Инфекционный эндокардит протезирование клапана положена ли группа
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
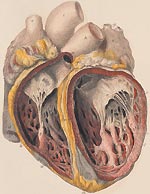
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
К инфекционному эндокардиту предрасполагают:
- протезированный клапан (10-20% случаев инфекционного эндокардита),
- тефлоновые или силиконовые катетеры.
В течение первого года после протезирования клапана инфекционный эндокардит развивается у 2% больных, каждый последующий год - еще у 0,5%. Протезированный аортальный клапан поражается чаще, чем митральный. Воспалительный процесс обычно развивается по линии швов.
Различают:
- ранний ИЭ протезированного клапана (в первые 60 дней после операции) - возникает вследствие обсеменения во время операции или послеоперационной бактериемии. Для него характерно молниеносное течение с острой клапанной недостаточностью
- поздний эндокардит – причиной может быть преходящая бактериемия.
Возбудители при ранних ИЭ:
- грамотрицательные бактерии у -15% больных
- грибы (в основном Candida spp.) – у 10%
Возбудители при поздних ИЭ
В связи с возрастающим употреблением наркотиков, частотой иммунодепрессивных состояний, в том числе вызванных длительным употреблением цитостатиков, возрастает значение полимикробной этиологии инфекционного эндокардита. В этих случаях заболевание отличается острым началом, многоклапанным поражением сердца, чистым вовлечением в патологический процесс миокарда и быстрым развитием сердечной недостаточности.
К сожалению, в реальной клинической практике далеко не всегда удается выделить возбудителя инфекционного эндокардита из крови, что связано, прежде всего, с назначением антибиотиков до исследования крови на стерильность и с использованием в лабораториях малочувствительных питательных сред. Потому примерно у 20-40% больных этиология заболевания остается неизвестной.
Патогенез
По современным представлениям инфекционный эндокардит развивается в результате сложного взаимодействия трех основных факторов:
• ослабления резистентности организма.
Бактериемия - это циркуляция тех или иных инфекционных агентов в кровяном русле. Источником бактериемии могут служить;
• разнообразные очаги хронической инфекции в организме (тонзиллиты, гаймориты,
кариозные зубы, отит, остеомиелит, фурункулез, проктит и др.);
• любые оперативные вмешательства на органах брюшной полости, мочеполовых ор
ганах, сердце, сосудах и даже экстракция зубов;
• инвазивные исследования внутренних органов, в том числе катетеризация мочево
го пузыря, бронхоскопия, гастродуоденоскопия, колоноскопия, любые манипуля
ции в ротовой полости, ирригоскопия и др.;
• несоблюдение стерильности при парентеральных инъекциях (например, у нарко
манов).
Следует помнить, что даже обычный ежедневный туалет полости рта может привести к кратковременной бактериемии. Таким образом, бактериемия - это довольно частое явление, которое встречается в жизни каждого человека. Однако для того, чтобы циркулирующие в крови инфекционные агенты привели к возникновению инфекционного эндокардита необходимо соблюдение двух других обязательных условий.
Повреждение эндотелия. При вторичном инфекционном эндокардите, развивающемся па фойе уже сформировавшегося приобретенного или врожденного порока сердца, пролапса митрального или трикуспидального клапана и других заболеваний клапанного аппарата, практически всегда имеет место более или менее выраженное повреждение эндотелия. При наличии клапанной патологии риск трансформации бактериемии в инфекционный эндокардит достигает 90%.
При наличии исходно неизмененных клапанов (первичный инфекционный эндокардит) существенное значение в повреждении эндотелия приобретают гемодинамические нарушения и метаболические расстройства, характерные, например, для больных АГ, ИБС, ГКМП и лиц пожилого и старческого возраста. Имеет значение, например, длительное воздействие на эндокард неизмененных клапанов высокоскоростных и турбулентных потоков крови. Недаром чаще всего инфекционный эндокардит развивается па створках аортального клапана, которые подвергаются воздействию высокоскоростных потоков крови.
Любое изменение поверхности эндокарда приводит к адгезии тромбоцитов, их агрегации и запускает процесс местной коагуляции и ведет к образованию па поверхности поврежденного эндотелия тромбоцитарпых пристеночных микротромбов. Развивается так называемый небактериальный эндокардит.
Если одновременно присутствует бактериемия, микроорганизмы из русла крови адгезируют и колонизируют образовавшиеся микротромбы. Сверху их прикрывают тромбоциты и фибрин, которые как бы защищают микроорганизмы от действия фагоцитов и других факторов защиты организма. В результате на поверхности формируются большие образования, похожие па полипы и состоящие из тромбоцитов, микробов и фибрина, которые получили название вегетации. Микроорганизмы в таких вегетациях получают идеальные условия для своего размножения и жизнедеятельности. Ослабление резистентности организма является вторым необходимым условием развития инфекционного очага в сердце на фоне бактериемии.
Существование очагов инфекции в сердце сопровождается несколькими важнейшими следствиями:
1. Деструкция створок клапана и подклапаппых структур, отрыв сухожильных нитей, прободение створок клапана, что закономерно приводит к развитию недостаточности клапана.
2. Иммунологические изменения в виде нарушений клеточного и гуморального иммунитета и неспецифической системы защиты.
3. Многочисленные иммунопатологические реакции во внутренних органах, связанные, с отложением иммуноглобулинов и ЦИК па базальных мембранах и развитием: гломерулонефрита; миокардита; артрита; васкулита и т.п.
4. Возникновение тромбоэмболии в артериальном сосудистом русле легких, головного
мозга, кишечника, селезенки и других органов.
Сочетание этих патологических изменений определяет клиническую картину инфекционного эндокардита.
Клиническая картина
Современное клиническое течение инфекционного эндокардита характеризуется:
- значительным преобладанием подострых форм эндокардита;
- возрастанием числа атипичных вариантов течения заболевания со стертой клинической симптоматикой;
- преобладанием иммунопатологических проявлений (васкулит, миокардит, гломе-
рулонефрит), иногда выступающих па первый план в клинической картине заболевания..
Большинство исследователей отрицают существование особой хронической (рецидивирующей) формы инфекционного эндокардита, поскольку рецидивы заболевания -это, как правило, лишь результат неадекватного лечения больных подострым инфекционным эндокардитом.
Клиническая картина инфекционного эндокардита отличается большим многообразием симптомов. Помимо типичных клинических проявлений, эндокардит может протекать атипично, под маской других заболеваний, обусловленных иммунопатологическим поражением органов или тромбоэмболическими осложнениями: гломерулонефрита, инфаркта почки, геморрагического васкулита, стенокардии или ИМ, инфаркта легкого, острого нарушения мозгового кровообращения, миокардита, сердечной недостаточности и т.д.
Лихорадка и интоксикация - это наиболее ранние и постоянные симптомы инфекционного эндокардита, которые наблюдается почти у всех больных. Характер повышения температуры тела может быть самым разнообразным. При подостром эндокардите болезнь чаще начинается как бы исподволь, с субфебрильной температуры, недомогания, головных болей, общей слабости, быстрой утомляемости, снижения аппетита, похудания. Субфебрильная температура сопровождается ознобом и потливостью. В этот период кардиальные жалобы, как правило, отсутствуют, за исключением стойкой синусовой тахикардии, которую часто неверно связывают с повышенной температурой тела. Сама лихорадка и сопутствующие ей симптомы интоксикации нередко расцениваются как проявление туберкулезной интоксикации, хронического тонзиллита, хронического бронхита, вирусной инфекции и т.п.
Через несколько недель (до 4-8) формируется более или менее типичная клиническая картина. Устанавливается неправильная лихорадка ремитирующего типа (реже гектическая или постоянная). Температура тела повышается обычно до 38-39° С и сопровождается выраженными ознобами. Иногда подъемы температуры сменяются короткими периодами ее снижения до субфебрильных или нормальных цифр. При этом выделяется обильный липкий пот с неприятным запахом.
Кардиальные симптомы обычно появляются позже, при формировании аортального или митрального порока сердца или/и развития миокардита. На фоне нарастающей интоксикации и повышения температуры тела могут появляться и постепенно прогрессировать следующие симптомы:
- одышка при небольшой физической нагрузке или в покое;
- боли в области сердца, чаще длительные, умеренной интенсивности; в более редких
случаях боли приобретают острый характер и напоминают приступ стенокардии;
- стойкая синусовая тахикардия, не зависящая от степени повышения температуры
тела.
Позже может появляться развернутая клиническая картина левожелудочковой недостаточности.
Следует помнить, что инфекционный эндокардит, являющийся полиорганным заболеванием, может манифестировать симптомами, обусловленными поражением не только сердца, но и других органов и систем. В связи с этим на первый план могут выступать следующие симптомы:
- отеки под глазами, кровь в моче, головные боли, боли в поясничной области, нарушения мочеиспускания (симптомы гломерулонефрита или инфаркта почки);
- интенсивные головные боли, головокружения, тошнота, рвота, общемозговые
и очаговые неврологические симптомы (тромбоэмболия мозговых сосудов с развитием ишемического инсульта);
- резкие боли в левом подреберье (инфаркт селезенки);
- высыпания на коже по типу геморрагического васкулита;
- клинические проявления инфарктной пневмонии;
- внезапная потеря зрения;
- боли в суставах и др.
Физикальное исследование
Осмотр
При типичном классическом течении инфекционного эндокардита общий осмотр позволяет выявить многочисленные неспецифические симптомы:
Похудание весьма характерно для больных инфекционным эндокардитом. Иногда
оно развивается очень быстро, в течение нескольких недель.
Периферические симптомы, обусловленные васкулитом или эмболией.
На коже могут появляться петехиальные геморрагические высыпания. Они имеют
небольшие размеры, не бледнеют при надавливании, безболезненны при пальпации. Нередко петехии локализуются па передней верхней поверхности грудной
клетки, на ногах. Со временем петехии приобретают коричневый оттенок и исчезают.
Иногда петехии локализуются на переходной складке конъюнктивы нижнего века - пятна Лукина или на слизистых оболочках полости рта. В центре мелких кровоизлияний в конъюнктиву и слизистые оболочки имеется характерная зона побледнения.
Пятна Рота - аналогичные пятнам Лукина мелкие кровоизлияния в сетчатку глаза, в центре также имеющие зону побледнения, которые выявляются при специальном исследовании глазного дна.
Узелки Ослера - болезненные красноватые образования размером
с горошину, располагающиеся в коже и подкожной клетчатке па ладонях, пальцах,
подошвах. Узелки Ослера представляют собой небольшие воспалительные ин
фильтраты, обусловленные тромбоваскулитом или эмболией в мелкие сосуды.
Появившись на коже или подкожной клетчатке, они достаточно быстро исчезают.
Положительная проба Румпеля-Кончаловского, которая свидетельствует
о повышенной ломкости микрососудов, что нередко может быть связано с вторичным повреждением сосудистой стенки при васкулитах и/или тромбоцитопатии
(снижении функции кровяных пластинок). Проба проводится следующим образом: манжета для измерения АД накладывается па плечо, в ней создается
постоянное давление, равное 100 мм рт. ст. Через 5 минут оценивают результаты
пробы. При отсутствии нарушений сосудисто-тромбоцитарного гемостаза ниже
манжеты появляется лишь небольшое количество петехиальных (мелкоточечных)
кровоизлияний (менее 10 петехий в зоне, ограниченной окружностью диаметром
5 см). При повышении проницаемости сосудов или тромбоцитепении число петехий в этой зоне превышает 10 (положительная проба).
Следует помнить, что все эти периферические симптомы инфекционного эндокардита в последние годы выявляются достаточно редко.
Признаки сердечной недостаточности, развивающейся вследствие формирования аортальной, митральной или трикуспидальной недостаточности и миокардита: положение ортопноэ, цианоз, влажные застойные хрипы в легких, отеки на ногах, набухание шейных вен, гепатомегалия и др.
Другие внешние проявления болезни, обусловленные иммунным поражением внутренних органов, тромбоэмболиями, а также развитием септических очагов во внутренних органах:
- нарушения сознания, параличи, парезы и другие общемозговые и очаговые неврологические симптомы, являющиеся признаками церебральных осложнений (инфаркта мозга, развивающегося вследствие тромбоэмболии мозговых сосудов, внутримозговых гематом, абсцесса мозга, менингита и т.п.);
- признаки тромбоэмболии легочной артерии (ТЭЛА), нередко выявляющиеся при
поражении трикуспидального клапана (особенно часто у наркоманов) - одышка,
удушье, боль за грудиной, цианоз и др.;
- признаки тромбоэмболии и септического поражения селезенки - спленомегалия,
болезненность в левом подреберье;
- объективные признаки острого асимметричного артрита мелких суставов кистей
рук, стоп.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
[youtube.player]Читайте также:


