Интерлейкин 6 при ревматоидном артрите
- КЛЮЧЕВЫЕ СЛОВА: артрит, ревматизм, метотрексат, этанерцепт, голимумаб
Роль ИЛ-6 в патогенезе ревматоидного артрита. Место ингибиторов ИЛ-6 в терапии заболевания
Прогресс в области биологии и медицины способствовал не только расшифровке новых звеньев и ключевых механизмов аутоиммунного воспаления, но и появлению в начале 2000-х гг. первых генно-инженерных биологических препаратов (ГИБП). Как отметил Эрнест ЧОЙ (E. CHOY), доктор медицины, профессор, руководитель отдела ревматологии и прикладных исследований Института инфекций и иммунитета, директор исследовательской группы по изучению артрита (Великобритания), на современном этапе для лечения пациентов с ревматоидным артритом (РА), не отвечающих на базисную противовоспалительную терапию, можно использовать 11 биологических препаратов. Среди одобренных в Европе ГИБП ингибиторы фактора некроза опухоли (ФНО) (этанерцепт, инфликсимаб, адалимумаб, цертолизумаб пэгол, голимумаб), блокатор костимуляции Т-лимфоцитов (абатацепт), анти-В-клеточный препарат (ритуксимаб) и ингибиторы интерлейкина 6 (ИЛ-6) (тоцилизумаб, сарилумаб).
Профессор Э. Чой сфокусировал свое выступление на патологических эффектах ИЛ-6 в развитии РА и возможностях ингибиторов ИЛ-6.
По своему строению ИЛ-6 похож на другие цитокины. Он представляет собой малый полипептид, имеющий четыре альфа-спирали, стабилизированные внутримолекулярными дисульфидными связями. Уникальность ИЛ-6 обусловлена механизмом активации клеток.
Передача сигнала через ИЛ-6 и его мембранный рецептор (mIL-6R) осуществляется с помощью субъединицы трансдукции сигнала – гликопротеина gp130. Этот способ активации известен как классический сигнальный путь 1 .
Ранее полагали, что клетки, не экспрессирующие мембранный рецептор mIL-6R, не способны отвечать на ИЛ-6. Однако существует и альтернативный сигнальный каскад, в котором задействованы растворимые рецепторы ИЛ-6 (sIL-6R), образующиеся при протеолитическом расщеплении mIL-6R в результате воздействия металлопротеаз или альтернативного сплайсинга. Растворимый комплекс sIL-6R/ИЛ-6 взаимодействует с молекулой gp130, представленной на многих типах клеток, и индуцирует сигнализацию. Этот уникальный механизм активации клеток известен как транс-сигнализация, или транс-сигнальный путь 1, 2 .
ИЛ-6 не случайно признан одним из основных провоспалительных цитокинов, индуктором системного воспаления. Именно его системные эффекты при РА приводят к развитию острофазового ответа, характеризующегося выработкой белков острой фазы, в частности С-реактивного белка (СРБ).
Рассматриваемый цитокин стимулирует рост гепатоцитов и продукцию гепсидина, играющего важную роль в развитии анемии. Гепсидин ингибирует высвобождение железа из макрофагов, а также угнетает абсорбцию алиментарного железа в кишечнике 3 . Поэтому у пациентов с РА высока частота анемий, которые практически не корригируются препаратами железа.
ИЛ-6 способен влиять на метаболизм костной ткани, поскольку сигнал, переданный через уникальную систему рецептора sIL-6R, приводит к дифференцировке и активации остеокластов. Повышенная сигнализация ИЛ-6 нарушает баланс формирования костной ткани, как следствие, усиливается костная резорбция. На животных моделях показано, что у трансгенных мышей с гиперэкспрессией ИЛ-6 увеличиваются количество остеокластов и их активность, за счет чего изменяется микроархитектоника губчатой костной ткани 4 .
Существует несколько способов подавления внутриклеточной сигнализации ИЛ-6. Мишенями терапии могут быть ИЛ-6 (сирукумаб), рецепторы ИЛ-6 (тоцилизумаб, сарилумаб) или янус-киназы (JAK) (тофацитиниб). Указанные препараты подавляют сигнальные пути ИЛ-6, однако есть принципиальное отличие ингибиторов JAK от ингибиторов ИЛ-6. Ингибиторы JAK снижают уровень ИЛ-6 в сыворотке крови, но не оказывают влияния на растворимую форму рецептора ИЛ-6, не обеспечивая полного подавления системных эффектов ИЛ-6.
Современные моноклональные антитела к человеческому рецептору ИЛ-6, одобренные для лечения РА, связываются как с мембранными, так и с растворимыми рецепторами цитокина. В результате блокируются и классический, и транс-сигнальный пути ИЛ-6.
Доказано, что по сравнению с анти-ФНО ингибиторы ИЛ-6 эффективнее снижают концентрацию гепсидина, способствуя более значимому повышению уровня гемоглобина.
Кроме того, в последнем систематическом обзоре, включившем 28 исследований, подтверждено, что терапия ингибиторами ИЛ-6 помимо повышения минеральной плотности костной ткани уменьшает локальную потерю костной ткани, чего не отмечено на фоне использования анти-ФНО 5 .
Одним из ярких представителей блокаторов рецепторов ИЛ-6 считается сарилумаб.
Сарилумаб – полностью человеческое моноклональное антитело, которое связывает мембранный и растворимый рецепторы ИЛ-6.
Характерной чертой сарилумаба считается отсутствие комплемент-опосредованной и антителозависимой цитотоксичности 6 .
Оценке эффективности терапии сарилумабом у больных РА, у которых эффект метотрексата оказался недостаточным, было посвящено 52-недельное мультицентровое рандомизированное двойное слепое плацебоконтролируемое исследование MOBILITY 7 . Участники исследования в дополнение к метотрексату получали сарилумаб 150 мг (n = 400), или сарилумаб 200 мг (n = 399), или плацебо (n = 398). Препарат вводился подкожно один раз в две недели.
Конечными точками исследования стали улучшение симптомов РА по критериям Американской коллегии ревматологов (American College of Rheumatology – ACR) 20, 50, 70, снижение индекса инвалидизации (Health Assessment Questionnaire – Disability Index – HAQ-DI), рентгенологического прогрессирования по модифицированной шкале Шарпа (mTSS).
На 24-й неделе наблюдения сарилумаб (150 и 200 мг) продемонстрировал статистически значимое (р 8 . Одним из обоснований этому служат результаты рандомизированных клинических сравнительных исследований, продемонстрировавших, что ингибиторы ИЛ-6 превосходят по эффективности ингибиторы ФНО в режиме монотерапии.
Установлено, что метотрексат подавляет Т- и В-клеточную активность. Используя его в комбинации с анти-ФНО, можно получить дополнительное биологическое подавление активности. ИЛ-6 может привести к активации Т- и В-клеток в дополнение к той роли, которую он играет в отношении нейтрофилов и макрофагов, равно как и в отношении миелоидной дендритной клетки. Поэтому при сочетании метотрексата и ингибитора ИЛ-6 наблюдается совпадение активности.
В исследованиях доказано, что ингибиторы ИЛ-6 менее зависимы от дополнительного эффекта метотрексата на иммунорегуляцию, чем ингибиторы ФНО 9 . Ингибиторы ИЛ-6 помимо врожденного способны блокировать адаптивный иммунный ответ. Потенциальными предикторами ответа на терапию ингибиторами ИЛ-6 служат положительный ревматоидный фактор (РФ) или положительные антитела к циклическому цитруллинированному пептиду (АЦЦП).
Необходимо отметить, что ингибиторы ФНО-альфа и ингибиторы ИЛ-6 влияют на разные внутриклеточные сигнальные пути цитокинов, что может приводить к различиям не только в эффектах 10 , но и в профиле безопасности, в том числе в отношении развития туберкулеза.
Вследствие особенностей иммунологического профиля у больных РА распространенность латентного туберкулеза среди них значительно выше, чем среди здоровых лиц.
Считается, что ингибиторы ФНО-альфа могут приводить к реактивации латентной туберкулезной инфекции. Так, на их фоне частота развития туберкулеза значимо выше, чем на фоне ингибиторов ИЛ-6.
Подводя итоги сказанному, профессор Э. Чой сформулировал следующие выводы:
- внутриклеточные сигнальные пути ФНО и ИЛ-6 независимы и приводят к разным биологическим эффектам;
- эффективность монотерапии ингибиторами ИЛ-6 превосходит таковую ингибиторов ФНО;
- ингибиторы ИЛ-6 в отличие от ингибиторов ФНО-альфа подавляют не только врожденный, но и адаптивный иммунный ответ, за счет чего снижается потребность в метотрексате;
- ИЛ-6 – ключевое звено ответа острой фазы: на фоне лечения ингибиторами ИЛ-6 нормализуется уровень СРБ, чаще отмечается повышение гемоглобина (по сравнению с терапией ингибиторами ФНО).
Применение принципов Treat to Target в реальной клинической практике
На протяжении последних лет современная стратегия терапии РА – Treat to Target (лечение до достижения цели) успешно внедряется в отечественную ревматологическую практику. По словам д.м.н., профессора Александра Михайловича ЛИЛЫ, врио директора Научно-исследовательского института ревматологии им. В.А. Насоновой, российские ревматологи активно внедряют в практику все нововведения, касающиеся оптимизации своей основной деятельности. Проведенное скрининговое исследование показало существенное улучшение качества обследования и лечения больных РА за прошедший двухлетний период.
Докладчик подчеркнул, что для достижения наилучших отдаленных результатов терапии особенно важно выявлять заболевание на ранней стадии. В основе диагностики РА лежит детальное изучение анамнеза заболевания, а также лабораторное и клиническое обследование, которое может быть дополнено ультразвуковым исследованием. У пациентов с недифференцированным артритом, которым не удается поставить диагноз при первичном осмотре, следует оценить факторы риска развития стойкого артрита 11 . Это необходимо, поскольку для каждой временной стадии можно формулировать подходы и подбирать наиболее оптимальную терапию.
Диагностические критерии РА, представленные еще в 2010 г., чрезвычайно просты и успешно применяются в клинической практике 12 . Помимо оценки вовлеченности суставов они предусматривают анализ серологических показателей, в частности наличие и уровень РФ и АЦЦП, которые признаны важными прогностическими факторами. Серопозитивность по РФ и АЦЦП коррелирует с агрессивным течением болезни, прогрессированием деструкции суставов, развитием экстраартикулярных проявлений. Поэтому внедрение в практику определения этих показателей имеет большое значение как для ранней диагностики РА, так и планирования долгосрочной базисной терапии заболевания.
В рекомендациях EULAR за 2016 г. в качестве препарата первой линии указан метотрексат, хотя не исключается комбинированная терапия. Необходимость использования целевых доз метотрексата обозначена и в рекомендациях Ассоциации ревматологов России (АРР) за 2016 г. При этом назначение метотрексата должно быть индивидуальным: при отсутствии риска развития нежелательных явлений (пожилой возраст, нарушение функции почек, печени и др.) лечение метотрексатом следует начинать с дозы 10–15 мг/нед с быстрым ее наращиванием до 25–30 мг/нед в зависимости от эффективности и переносимости препарата.
В то же время проведенное исследование с участием 132 ревматологов из 14 европейских стран продемонстрировало, что согласие с рекомендациями EULAR не означает безусловного следования им на практике, даже после проведенного обучения 13 , что требует оптимизации образовательных программ для врачей-ревматологов.
Согласно последним рекомендациям EULAR при недостаточной эффективности базисных средств необходимо назначить препарат второй линии. Это могут быть ингибиторы ФНО-альфа, абатацепт, ингибиторы ИЛ-6, анти-В-клеточная терапия, ингибиторы янус-киназ.
Согласно рекомендациям АРР за 2016 г. стратегия ведения пациентов с неудовлетворительным ответом на ингибиторы ФНО-альфа предусматривает как назначение другого препарата из этой группы, так и переход на ГИБП с другим механизмом действия, в частности на ингибиторы ИЛ-6.
Каков портрет пациента, которому может быть назначен ингибитор ИЛ-6?
По словам профессора А.М. Лилы, это пациенты с ранним РА, высокой клинической и лабораторной активностью заболевания (с высокими уровнями СРБ, РФ, АЦЦП), анемическим синдромом, а также с непереносимостью метотрексата 14 . Ингибитор ИЛ-6 может назначаться пациентам с внесуставными проявлениями РА (лихорадка, быстрая потеря мышечной массы и др.), высоким риском развития амилоидоза.
При правильном подборе терапии ингибитор ИЛ-6 будет способствовать быстрому снижению клинико-лабораторной активности РА и индукции клинической ремиссии.
Потенциальными претендентами на применение ингибиторов ИЛ-6 являются пациенты, длительно получающие глюкокортикостероиды в средних или высоких дозах, что позволит избежать стероидозависимости 15, 16 .
В заключение А.М. Лила напомнил о необходимости обследования всех пациентов с РА на туберкулез перед назначением ГИБП.
Эффективность генно-инженерной биологической терапии. Данные регистра пациентов с ревматоидным артритом Центра терапии генно-инженерными биологическими препаратами Санкт-Петербурга
Согласно рекомендациям Ассоциации ревматологов России, Европейской антиревматической лиги и Американской коллегии ревматологов после постановки диагноза РА как можно раньше должно быть назначено лечение бБМАРП. Как отметила к.м.н. Рузана Рамиловна САМИГУЛЛИНА, заведующая Центром терапии генно-инженерными биологическими препаратами клиники им. Э.Э. Эйхвальда Северо-Западного государственного медицинского университета им. И.И. Мечникова (Центр терапии ГИБП), золотым стандартом базисной противовоспалительной терапии является метотрексат. Однако при его применении должно осуществляться быстрое наращивание дозы. Это позволит ускорить снижение активности заболевания.
Если доза метотрексата превышает 15 мг, правильным решением будет использовать препарат не в форме таблеток, а в форме инъекций для подкожного введения. Сегодня для подкожного введения применяют метотрексат в дозах 10 и 50 мг/мл. Более высокая концентрация и подкожное введение препарата позволяют снизить объем вводимого вещества, сделать процедуру более удобной и менее болезненной, избежать развития нежелательных реакций, наблюдающихся при его пероральном приеме.
В отсутствие эффекта от терапии метотрексатом в схему лечения следует добавить один из биологических препаратов. Пул последних достаточно большой. По данным регистра Центра терапии ГИБП, в 2017 г. 1316 пациентов с ревматическими заболеваниями получали антицитокиновую терапию, 857 из них – больные РА. Анализ приема ГИБП пациентами с РА показал, что 73 из них использовали инфликсимаб, 512 – ритуксимаб, 35 – этанерцепт, 29 – адалимумаб, 59 – цертолизумаб пэгол, трое – голимумаб, 61 – абатацепт, 52 – тоцилизумаб, 33 – синтетический таргетный препарат тофацитиниб.
Эффективность проводимой терапии оценивалась каждые три месяца с помощью DAS-28 (Disease Activity Score 28), SDAI (Simplified Disease Activity Index), CDAI (Clinical Disease Activity Index).
Анализ динамики активности заболевания по DAS-28 у пациентов с РА, получавших разные препараты из группы ингибиторов ФНО-альфа в Центре терапии ГИБП, продемонстрировал сопоставимую эффективность всех ингибиторов ФНО-альфа, независимо от формы выпуска и частоты введения. Аналогичные данные получены при оценке качества жизни по индексу HAQ.
Однако в 25–30% случаев отмечается первичная или вторичная неэффективность биологической терапии 17 .
Первичная неэффективность, проявляющаяся отсутствием или недостаточным ответом на терапию, при использовании ингибиторов ФНО-альфа наблюдалась в 30–40% случаев. К возможным ее причинам можно отнести повышенную циркуляцию цитокинов других групп, снижение роли ФНО-альфа как пускового механизма при хроническом аутоиммунном процессе, переключение с Т-клеточного звена иммунитета на В-клеточный на ранних стадиях заболевания.
Под вторичной неэффективностью понимают ускользание ранее достигнутого ответа на фоне лечения ГИБП. Одна из причин вторичной неэффективности ингибиторов ФНО-альфа – образование нейтрализующих антител на вводимый ГИБП. Это приводит к снижению терапевтической концентрации препаратов.
По данным регистров иммуногенности различных ГИБП, более высокая частота обнаружения нейтрализующих антител наблюдалась у инфликсимаба. Это подтверждает и метаанализ 68 исследований: самая высокая частота образования антител к ингибиторам ФНО-альфа при лечении аутоиммунных заболеваний в группе инфликсимаба (25,3%), самая низкая – в группе этанерцепта (1,2%) 18 .
Согласно рекомендациям EULAR за 2016 г. при неэффективности предшествующей биологической терапии можно переходить на терапию другим ингибитором ФНО-альфа или препаратом с иным механизмом действия. В исследовании, проведенном J. Falcao и соавт. (2016), установлено, что лучшее удержание эффекта на терапии вторым ГИБП получено при назначении тоцилизумаба – ингибитора рецептора ИЛ-6, препарата с другим механизмом действия 19 .
В подтверждение этих данных Р.Р. Самигуллина представила данные Центра терапии ГИБП. В анализ вошли 46 больных РА, 20 из которых использовали ингибиторы ИЛ-6 в качестве терапии первой линии после применения синтетических базисных противовоспалительных препаратов, 17 – в качестве второй и третьей линии, а также девять детей, перешедших во взрослую группу.
У всех пациентов отмечена хорошая эффективность ингибиторов ИЛ-6 в отношении снижения активности РА. При этом у пациентов, принимавших указанные препараты в качестве первой и второй линии, динамика снижения активности РА была сопоставимой, что свидетельствует о высокой эффективности такой терапии вне зависимости от эффективности предшествующей терапии.
Эффект лечения сохранялся в течение двух лет применения препарата.
Аналогичные результаты получены в отношении значений HAQ. Все пациенты отмечали улучшение качества жизни. На данный момент влияние заболевания на качество жизни оценивается ими как низкое.
Подводя итог сказанному, Р.Р. Симигуллина отметила, что использование ингибитора рецептора ИЛ-6 как блокатора ключевого звена патогенеза РА эффективно как в первой линии терапии, так и во второй линии. Кроме того, такое лечение характеризуется стойкостью эффекта.
- 4970
- 4,1
- 0
- 5
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
![]()
Анна Огородник
![]()
Антон Чугунов![]()
Андрей Панов




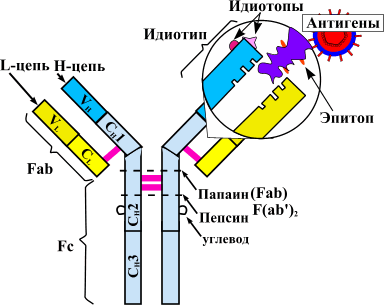
Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.
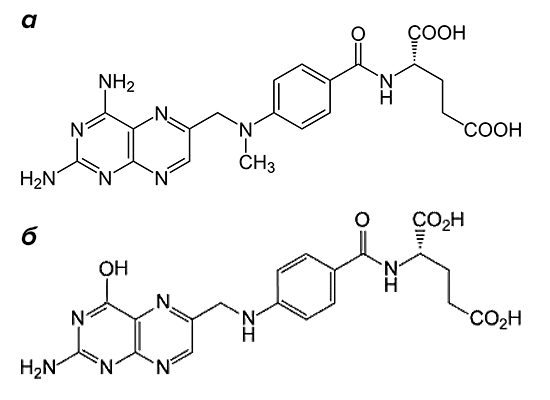
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
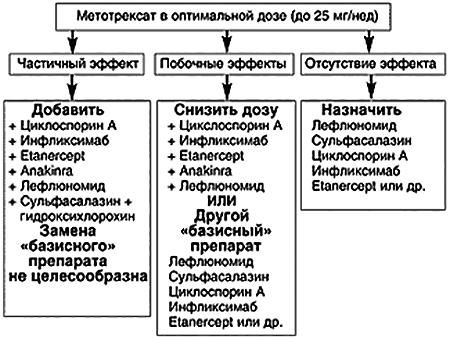
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
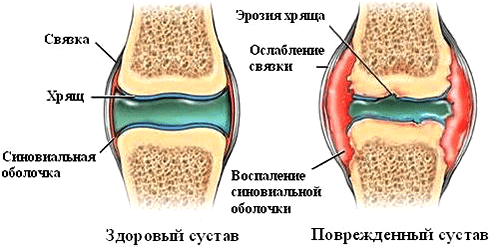
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
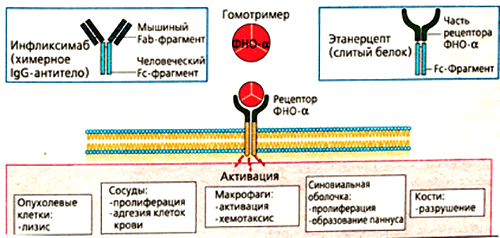
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
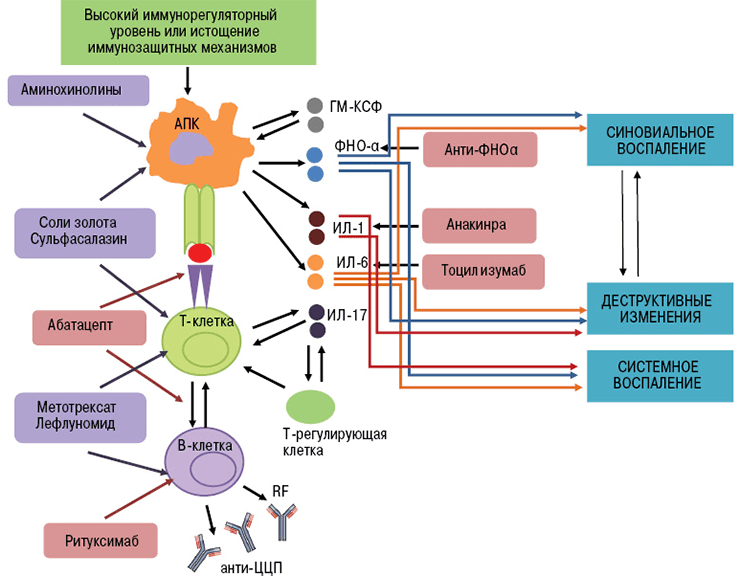
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
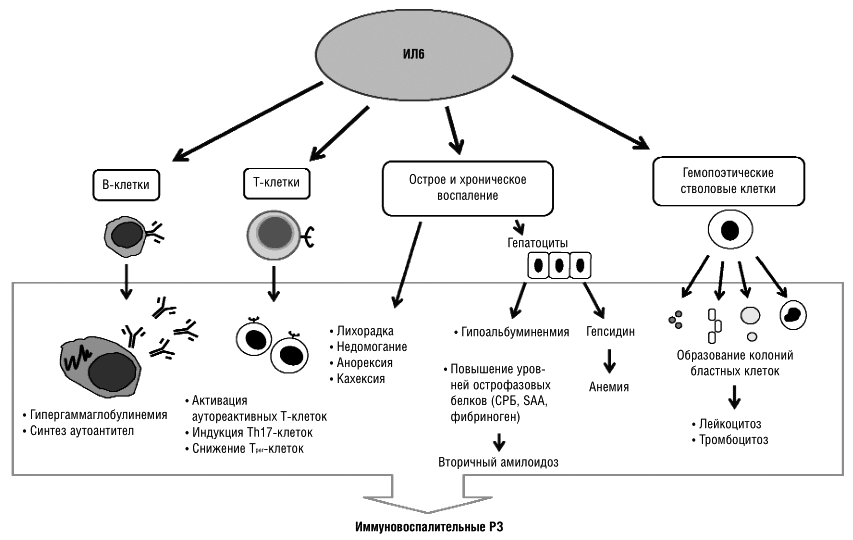
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
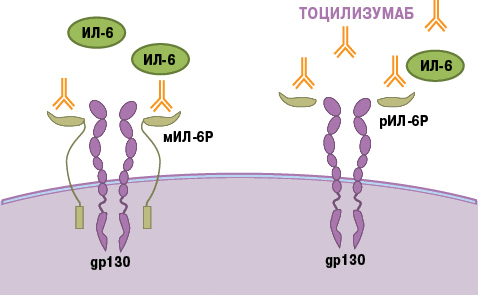
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
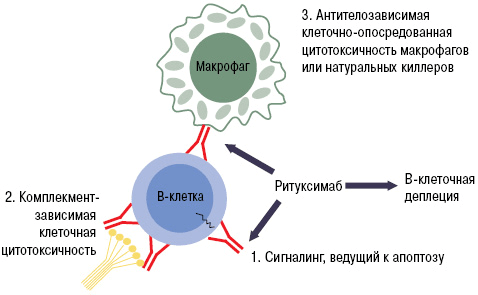
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
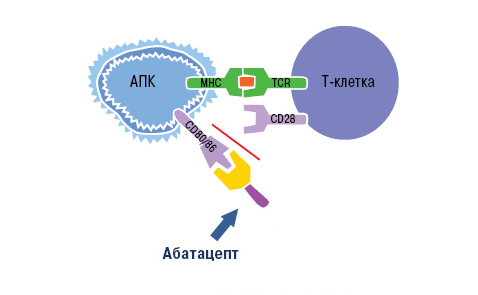
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Читайте также:





