История создания вакцины против клещевого энцефалита
Иммунопрофилактика
(общие понятия, виды вакцин и история иммунопрофилактики)
- Вакцинопрофилактика — это метод специфической профилактики инфекционных болезней с помощью вакцин.
Иммунная система человека обладает способностью к распознаванию чужеродных агентов, попадающих в организм, и формированию иммунологической памяти или активного иммунитета.
На сегодняшний день вакцинопрофилактика является наиболее эффективным способом предотвращения различных инфекционных заболеваний.
«В современных условиях охват прививками 95% детей означает вакцинацию тех, у кого имеется хроническая патология, ибо патологические состояния выявляются у 45-90% детей. Многолетняя вакцинация в рамках календаря прививок привела к существенному улучшению эпидемиологической ситуации по основным детским инфекциям. С 1997 г. на территории России не выявляется паралитический полиомиелит. В 2002 г. заболеваемость дифтерией, корью и коклюшем снизилась по сравнению с довакцинальным периодом в 430, 2300 и 100 раз соответственно.
Виды вакцин
- Живые вакцины. Они содержат ослабленный живой микроорганизм. Примером могут служить вакцины против полиомиелита, кори, свинки, краснухи или туберкулеза. Живые вакцины могут быть получены путем селекции (БЦЖ, гриппозная). Они способны размножаться в организме и вызывать вакцинальный процесс, формируя невосприимчивость. Утрата вирулентности у таких штаммов закреплена генетически, однако у лиц с иммунодефицитами могут возникнуть серьезные проблемы.
- Инактивированные (убитые) вакцины. Содержат убитый целый микроорганизм (например цельноклеточная вакцина против коклюша, инактивированная вакцина против бешенства, вакцина против вирусного гепатита А), их убивают физическими (температура, радиация, ультрафиолетовый свет) или химическими ( спирт, формальдегид) методами. Такие вакцины реактогенны, применяются мало (коклюшная, против гепатита А).
- Химические вакцины. Содержат компоненты клеточной стенки или других частей возбудителя, как например в ацеллюлярной вакцине против коклюша, коньюгированной вакцине против гемофильной инфекции или в вакцине против менингококковой инфекции.
- Анатоксины. Вакцины, содержащие инактивированный токсин (яд) продуцируемый бактериями. В результате такой обработки токсические свойства утрачиваются, но остаются иммуногенные. Примером могут служить вакцины против дифтерии и столбняка.
- Векторные (рекомбинантные) вакцины. Вакцины, полученные методами генной инженерии. Суть метода: гены вирулентного микроорганизма, отвечающий за синтез протективных антигенов, встраивают в геном какого-либо безвредного микроорганизма, который при культивировании продуцирует и накапливает соответствующий антиген. Примером может служить рекомбинантная вакцина против вирусного гепатита B, вакцина против ротавирусной инфекции.
- Синтетические вакцины. Представляют собой искусственно созданные антигенные детерминанты микроорганизмов.
- Ассоциированные вакцины. Вакцины различных типов, содержащие несколько компонентов (АКДС).
История вакцинопрофилактики
Основные даты истории вакцинации:
- 1769 – первая иммунизация против оспы, доктор Дженнер
- 1885 – первая иммунизация против бешенства, Луи Пастер
- 1891 – первая успешная серотерапия дифтерии, Эмиль фон Беринг
- 1913 – первая профилактическая вакцина против дифтерии, Эмиль фон Беринг
- 1921 – первая вакцинация против туберкулеза
- 1936 – первая вакцинация против столбняка
- 1936 – первая вакцинация против гриппа
- 1939 – первая вакцинация от клещевого энцефалита
- 1953 – первые испытания полиомиелитной инактивированной вакцины
- 1956 – полиомиелитная живая вакцина (пероральная вакцинация)
- 1980 – заявление ВОЗ о полной элиминации человеческой оспы
- 1984 – первая общедоступная вакцина для профилактики ветряной оспы.
- 1986 – первая общедоступная генно-инженерная вакцина против гепатита В
- 1987 – первая конъюгированная вакцина против Хиб
- 1992 – первая вакцина для профилактики гепатита А
- 1994 – первая комбинированная ацеллюлярная коклюшная вакцина для профилактики коклюша, дифтерии, столбняка
- 1996 – первая вакцина для профилактики гепатитов А и В
- 1998 – первая комбинированная ацеллюлярная коклюшная вакцина для профилактики коклюша, дифтерии, столбняка и полиомиелита
- 1999 – разработка новой конъюгированной вакцины против менингококковой инфекции С
- 2000 – первая конъюгированная вакцина для профилактики пневмонии.
Думаем, что большинство людей слышали и знают о прививках и прививается от инфекционных заболеваний.
Иммунопрофилактика — это метод специфической профилактики инфекционных болезней с помощью вакцин.
Оказалось, что эффект иммунологической памяти может быть достигнут при введении в организм так называемых ослабленных микробов, родственных микробов или их отдельных компонентов. Это явление нашло применение в медицине и получило название вакцинации. Препараты ослабленных микробов, родственных микробов или их отдельных компонентов называются вакцинами. На сегодняшний день вакцинопрофилактика является наиболее эффективным способом предотвращения различных инфекционных заболеваний. Многолетняя вакцинация в рамках календаря прививок привела к существенному улучшению эпидемиологической ситуации по основным детским инфекциям. Благодаря этому с 1997 г. на территории России не выявляется паралитический полиомиелит, в 2002 г. заболеваемость дифтерией, корью и коклюшем снизилась по сравнению с довакцинальным периодом в сотни раз. Отечественный и зарубежный опыт показывают,
что приспорадической заболеваемости и даже при отсутствии заболеваемости управляемыми инфекциями, вакцинопрофилактика должна продолжаться и охватывать не менее 95% детей. В противном случае произойдет возврат инфекций и возникнут тяжелые эпидемии, как было в России с дифтерией в 1993-1996 г.г. Ежегодно в период, предшествующий подъему заболеваемости острыми респираторными вирусными заболеваниями и гриппом, в стране проводится массовая вакцинопрофилактика против сезонного гриппа. Чем больше охват иммунизацией против гриппа населения региона, тем слабее будет наблюдаться эпидемический процесс заболевания, а возникшие заболевания будут протекать в более легкой форме, с быстрым выздоровлением и отсутствием тяжелых осложнений со стороны наиболее жизненно важных систем человеческого организма.
В Российской Федерации прививки против инфекций, указанных в национальном календаре профилактических прививок, включая грипп, проводятся на бесплатной основе в лечебно-профилактических учреждениях по месту жительства. Не пренебрегайте вакцинацией, ведь порой это может спасти жизнь и сохранить здоровье.
Холода, наконец, закончились, наступила полноценная весна. Все живое просыпается, в том числе и клещи. На днях Роспотребнадзор обнародовал предупреждение о том, что мы вступаем в очередной клещевой сезон. Укушенные граждане уже потянулись в травмпункты, надеясь своевременно отследить разнообразные клещевые инфекции — боррелиоз (болезнь Лайма), эрлихиоз и клещевой энцефалит. Прививку можно сделать только от клещевого энцефалита (КЭ), но при этом он остается одной из наиболее опасных клещевых инфекций. История ее открытия и изучения связана с судьбами многих наших соотечественников и буквально вплетена в непростую историю нашей страны. MedAboutMe рассказывает о том, что это за болезнь и кому из ученых мы обязаны знанием о ней.
Что такое клещевой энцефалит?

Клещевым энцефалитом (КЭ) называется вирусная инфекция, которая поражает серое и белое вещество мозга, а также его оболочки и другие отделы головного и спинного мозга. КЭ может развиваться в различных формах и в большинстве случаев заканчивается выздоровлением человека, но с осложнениями разной степени тяжести: судороги, параличи, парезы, слепота, глухота и др. При менингоэнцефалитической форме болезни погибает 25-30% пациентов.
Кроме человека, к вирусу также восприимчивы обезьяны, белые мыши, поросята и овцы. Инфекцию можно обнаружить у коз и коров — вирус при этом попадает в молоко, то есть можно заразиться, выпив его. А вот кролики к вирусу невосприимчивы, совсем, чем в свое время в немалой степени озадачили ученых. КЭ — сезонное заболевание. Пики его активности приходятся на май-июнь и август-сентябрь.
От места укуса или из желудочно-кишечного тракта (если источником инфекции стало инфицированное молоко) вирус распространяется по всему организму, используя нервные, кровеносные и лимфатические пути. Таким образом он попадает в мозг, который является главным центром нейроинфекции.

Инкубационный период (с момента укуса клеща до появления первых признаков болезни) составляет 8-23 дня, обычно 10-12 дней. На начальных этапах могут наблюдаться слабость, тошнота, головные боли, ощущение онемения кожи головы и шеи. Болезнь может начаться остро, со скачка температуры до 39-40°С, которая может сохраняться на протяжении 2-10 дней, в зависимости от формы заболевания. Развиваются боли — мышечные, головные, в конечностях, особенно сильные в тех мышцах, которые позднее будут поражены параличом или парезом. Возможно помрачнение сознания, вплоть до состояния комы.

Болезнь была определена как энцефалит только в 1935 году невропатологом А.Г. Пановым, но он счел ее вариантом японского энцефалита — болезни, которая вызывается флавивирусами, но распространяется комарами. Это вирусы из той же группы, что и возбудители лихорадки Западного Нила, денге и желтой лихорадки.
Через год советские власти собрали группу местных врачей, которые занялись изучением болезни, получившей новое название — летний энцефалит. На тот момент также высказывалось предположение, что она передается воздушно-капельным путем.
Следует понимать, что вирусология тогда была на начальном этапе своего развития. Ни современной аппаратуры для проведения диагностики, ни комфортных лабораторных условий для работы с вирусами не было.
Из Москвы на помощь дальневосточным ученым был прислан профессор Л.А. Зильбер. Человек крайне деятельный и настойчивый в достижении поставленных целей, Зильбер разработал сразу три плана по изучению новой инфекции:
- первый план подразумевал, что речь идет действительно о летнем варианте японского энцефалита;
- второй план предполагал, что это энцефалит, но какой-то другой;
- третий план следовало реализовать в случае, если речь идет вовсе не об энцефалите, а о какой-то другой болезни.
При этом Зильбер разделил свою команду докторов и ученых на две группы, каждая из которых занималась одними и теми же исследованиями — это позволяло на месте сверить полученные результаты и сократить продолжительность экспериментов.
Новый энцефалит

Уже через пару дней работы в очаге заболевания выяснилось, что практически все случаи болезни приходятся на весну и только после работы человека в тайге, причем пациенты между собой не контактировали. Был сделан вывод: воздушно-капельный путь передачи исключается, болезнь распространяется трансмиссивным путем, то есть должен быть переносчик инфекции, который передает ее от источника к жертве. Комаров на тот момент еще не было — на дворе стояла холодная весна. Тогда-то и была впервые высказана гипотеза о клещах, как о переносчиках инфекции.
Несколько сотрудников Зильбера в ходе экспериментов сами заразились клещевым энцефалитом. Сначала это списывалось на сложные условия работы и слабую защиту в лабораторных условиях. Однако люди заболевали при работе с вирусом даже в специализированных лабораториях в Москве. Исследователи пришли к выводу, что человеческий организм очень восприимчив к новому вирусу.
Всего за три месяца экспедиция завершила свою работу в тайге. Была доказана ключевая роль клещей в распространении болезни, ученые выделили 29 штаммов возбудителя инфекции, разработали иммунные сыворотки, позволявшие спасти жизнь и предотвратить особенно тяжелые осложнения болезни. Самое главное, было доказано, что клещевой энцефалит (он же весенний эпидемический энцефалит) — это самостоятельное новое заболевание.

Дальнейшая история Зильбера и его группы печальна. В августе 1937 года были завершены исследования, а уже в сентябре профессор и его сотрудники были арестованы. Причиной ареста послужил донос, согласно которому Зильбер планировал заразить москвичей вирусом энцефалита через городскую систему водоснабжения. В обвинительном заключении сообщалось, что ученые распространяли вирус японского энцефалита на территории советского Дальнего Востока. В основу обвинения легли перекрестные реакции между обоими вирусами. По другой версии, Зильбер собирался выпустить зараженных энцефалитом комаров около дачи Сталина.
Попав в лагеря, Зильбер продолжил научные изыскания и попутно разработал препарат для лечения пеллагры — болезни, развивающейся у заключенных на фоне дефицита витамина РР (никотиновой кислоты) и незаменимой аминокислоты триптофана.
В 1939 году Зильбера освободили, а в 1940 снова арестовали. В очередном заключении ученый сформулировал теорию вирусного происхождения злокачественных опухолей. В 1944 году был освобожден и награжден Сталинской премией.
Экспедиция Зильбера была невероятно эффективной. Всего за три месяца ученые и врачи получили основную информацию по возбудителю болезни и по ее лечению. Заболеваемость и смертность среди местных жителей и военнослужащих в тех краях в следующие пару лет снизилась в разы. Без преувеличения, можно говорить о тысячах спасенных жизней.
Оставьте свой email, чтобы всегда получать важную информацию и сервисы для сохранения вашего здоровья
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Билалова Г. П., Быстрицкий Л. Д., Воробьева М. С., Красильников И. В., Ильченко Т. Э.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Билалова Г. П., Быстрицкий Л. Д., Воробьева М. С., Красильников И. В., Ильченко Т. Э.
THE HISTORY OF VACCINES PRODUCTION FOR PROFILACTICS OF TICK-BORNE ENCEPHALITIS IN TOMSK: FROM BRAIN VACCINE TO ENCEVIR VACCINE
In the first time Tomsky Research Institute of Vaccines and Sera (since 1988 — SPC Virion) launched TBE vaccine production in 1954 using the Sofjin strain. The technology was modified and developed over time. In 1962 a technique on the base of a chicken embryo fibroblast (CEF) cell culture was adopted employing the Pan strain; in 1983 the company elaborated a cultivated vaccine with 205 far-eastern TBE virus strain. In 2001 SPC Virion set up the manufacturing of EnceVir® — a concentrated purified vaccine that meets modern international
УДК 612.017.1: 616.988.15-002.954.2
Г.П. Билалова, Л.Д. Быстрицкий, М.С. Воробьева, И.В. Красильников, Т.Э. Ильченко, Р.Г. Соляник, Н.Х. Ставицкая
ИСТОРИЯ ПРОИЗВОДСТВА ВАКЦИН
ДЛЯ ПРОФИЛАКТИКИ КЛЕЩЕВОГО ЭНЦЕФАЛИТА В Г. ТОМСКЕ: ОТ МОЗГОВОЙ ВАКЦИНЫ ДО ВАКЦИНЫ ЭНЦЕВИР
Ключевые слова: клещевой энцефалит, вакцина
Официальное признание Томской области очагом клещевого энцефалита (КЭ) датируется 1939 годом [1]. Однако ретроспективный анализ показывает, что заболевания, сходные по своей клинической картине с КЭ, на территории Томской области были описаны еще в конце XIX века. Первое сохранившееся описание случаев заболевания, датированное 1897 годом, принадлежит ординатору клиники нервных болезней Императорского Томского университета Л.М. Орлеанскому. По описанным симптомам речь шла о кожевни-ковской эпилепсии. Позднее, в 1918-1936 гг. профессор Томского университета Л.И. Омороков, всесторонне изучая случаи кожевниковской эпилепсии, обратил внимание на тот факт, что заболевание чаще возникает у жителей таежных районов, и сделал предположение о связи заболевания с обилием в этих местах таежного гнуса [2, 3].
Ведущее значение в борьбе с инфекционными природноочаговыми заболеваниями принадлежит вакцинопрофилактике [1]. Однако известно, что эффективность вакцинации зависит от ряда условий, в том числе от качественных характеристик профилактического препарата и способа его применения.
ционной хроматографии и гель-хроматографии на макропористых кремнеземах. Эффективность очистки контролировали по содержанию куриного белка, общего белка, остаточного формальдегида, антибиотика канамицина в конечном продукте.
В результате проведенных экспериментальных работ была разработана следующая схема изготовления вакцины:
1. Репродукция вируса в первично-трипсини-зированной суспензионной культуре клеток куриных эмбрионов по оригинальной технологии.
2. Инактивация вируса КЭ формальдегидом.
3. Очистка инактивированного вирусного сбора. Эта стадия включает в себя:
— осаждение клеточного детрита в вирусном сборе протаминсульфатом;
— проточное центрифугирование с последующей микрофильтрацией;
— концентрирование полуфабриката методом ультрафильтрации;
— очистка концентрата от низкомолекулярных примесей методом гель-хроматографии на авторских модифицированных макропористых кремнеземах.
Разработанная технология приоритетна и защищена патентом № 2203089.
Описанные процедуры позволили достичь значительной чистоты полуфабриката вакцины: в одной дозе вакцины в соответствии с требованиями НОК содержание куриного белка не превышало 0,5 мкг, а содержание общего белка — 65 мкг. Для определения содержания примесных белков на стадиях производства и в очищенном полуфабрикате в технологии используется метод встречного иммуноэлектрофореза (ВИЭФ).
4. Приготовление вакцины. Эта стадия включает следующие операции:
— стандартизация вирусного полуфабриката по концентрации вирусного антигена;
— стабилизация вирусного антигена;
— стерилизующая фильтрация полуфабриката;
— сорбция на алюминия гидроксиде.
Все стадии технологического процесса контролировались в соответствии с проектом Регламента производства № 1147-01. Требования к готовому препарату были изложены в проекте ФСП 42-42-0135179001 [И].
Таким образом, разработанная технологическая схема новой вакцины позволила:
1. Максимально сохранить антигенную активность первичного вирусного сбора.
2. Производить эффективную очистку от гете-рологичного белка куриного эмбриона, что стало главным критерием оценки эффективности технологии очистки.
3. Получать качественный готовый продукт без внесения антибиотиков и консервантов на заключительных стадиях. Антибиотик канамицин, используемый на стадии получения первичного вирусного сбора, разрешен требованиями ВОЗ к вакцинам КЭ и удаляется на стадии очистки. Его отсутствие контролируется на стадии готовой лекарственной формы.
4. Гарантировать отсутствие инактиватора формальдегида в готовом препарате, что также подтверждается контрольным тестом.
5. Выпускать вакцину в виде жидкой лекарственной формы по 0,5 мл (одна доза) в ампуле. Эта форма выпуска дает ряд преимуществ: точность дозирования и защиту от программных ошибок, гарантию соблюдения правил асептики и сокращение манипуляций при вакцинации. Кроме того, эта дозировка является важным фактором экономической эффективности, поскольку при мультидозном варианте выпуска потери вакцины достигают 51% [12].
Все вышеперечисленные факторы дали возможность использовать препарат для вакцинации взрослых, подростков и детей.
Согласно разработанной технологии в конце 2000 г. были получены экспериментально-производственные серии очищенной вакцины. Новый препарат получил коммерческое название ЭнцеВир® — вакцина клещевого энцефалита культуральная очищенная концентрированная инактивированная сорбированная жидкая [4].
Разработанная технология обеспечила высокую безопасность препарата, поскольку резко уменьшилась вероятность побочных реакций на его введение. Более высокая степень очистки полученного препарата, а также отсутствие в нем остаточного формальдегида позволяют вводить его внутримышечно (в дельтовидную мышцу). Такой метод введения обеспечивает большую биодоступность препарата и этим увеличивает имму-ногенность вакцины по сравнению с подкожным способом введения. Более высокая концентрация антигена вируса КЭ в вакцине ЭнцеВир позволила снизить объем вводимого препарата до 0,5 мл и перейти от громоздкой 3-кратной схемы вакцинации к 2-кратной: основной 0-5 мес. и экстренной 0-2 мес. с однократной ревакцинацией через год и затем отдаленными ревакцинациями через каждые три года [4].
По результатам доклинического испытания препарата в ГНИИСК им Л.А. Тарасевича было дано разрешение на проведение государственных клинических испытаний с целью определения реактогенности, безвредности и иммунологической эффективности вакцины. Испытания проводились по Программе, разработанной ГНИИСК
им Л.А. Тарасевича и утвержденной комитете МИБП в несколько этапов: первый этап — на о раниченной группе лиц; второй — на расшире] ном контингенте лиц в возрасте от 18 до 60 ле третий — при вакцинации подростков и детей возрасте от 18 до 3 лет. К клиническим испыт ниям были привлечены 745 волонтерлов. И пытания проводили с соблюдением требованг Хельсинкской декларации. В качестве препара-сравнения был применен препарат, назначеннь: комитетом МИБП — вакцина клещевого энцеф лита культуральная очищенная концентрирова) ная инактивированная сухая производства Ин титута полиомиелита и вирусных энцефалите им. М.П. Чумакова (Москва).
В ходе клинических испытаний была доказа! иммунологическая эффективность и слабая р> актогенность новой вакцины ЭнцеВир, что яв] лось основанием для разрешения использованг ее в качестве иммунобиологического препарат Технологические стандарты производства ва! цины ЭнцеВир, ее качественные характеристик: назначение и предложенные схемы вакцинаци позволяют осуществлять взаимозаменяемость Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Аналитические данные, полученные, за пят лет производства вакцины ЭнцеВир, позволяю говорить о стандартности получаемого препарг
та. Содержание и иммунологическая сохранность вирусных белков и полипептидов, ответственных за выработку протективных антител, определяемая методом титрования в ИФА, имеет среднее значение 1:256 при нормативном 1:128. Анализ результатов контроля специфической активности и подлинности вакцины, определяемой в тесте протективной активности на мышах, по 50% предельному разведению вакцины и показателю МИД, показал, что среднее значение минимальной иммунизирующей дозы равно 0,005 мл при нормативном показателе 0,0125 мл [11].
Динамическое наблюдение за лицами, привитыми вакциной ЭнцеВир, проводимое в разных регионах, подтверждает результаты клинических испытаний и позволяет говорить о безопасности, низкой реактогенности и высокой иммунологической активности вакцины. За весь период наблюдения не было зарегистрировано случаев поствакцинальных осложнений. Полный цикл вакцинации, состоящий из трех инъекций, вызывает сероконверсию у 99,3+0,4% привитых. Более чем у 80% привитых лиц антитела определяются в интервале 1:1600 — 1:3200, при защитном титре 1:100 [14].
В 2006 г. нами была проведена работа по выявлению отдаленных последствий вакцинации и определению сохранности специфического иммунитета при применении вакцины ЭнцеВир. К исследованию были привлечены волонтеры, принимавшие участие в клинических испытаниях вакцины в 2001 г. Результаты опроса волонтеров и анализа их сопутствующей заболеваемости за период времени, прошедшего после проведения первичного курса вакцинации, показал, что вакцинация не оказала отрицательного влияния на уровень их здоровья и качество жизни. Уровень антител к вирусу КЭ определялся в сыворотках крови в ИФА до введения бустерной дозы вакцины и через 30 дней после ее введения. Было отмечено, что перед введением бустерной дозы вакцины уровень антител снизился на одно-два разведения, относительно достигнутого первичным циклом вакцинации. Введение бустерной дозы приводит к выработке антител до прежнего уровня, либо превышает его. Специфичность вырабатываемых на введение вакцины ЭнцеВир антител подтверждается результатами исследований в реакции биологической нейтрализации (РБН) сывороток крови вакцинированных.
Вакцина успешно применяется для иммунизации доноров с целью получения иммунной плазмы, используемой для производства специфического иммуноглобулина [4]. Это подтверждено наблюдением за донорами, вакцинированными как только вакциной ЭнцеВир (550 человек), так
и донорами, ранее вакцинированными неконцентрированной вакциной (80 человек).
Кроме того, выявленная длительность сохранения иммунитета при вакцинации взрослых вакциной ЭнцеВир служит предпосылкой для пересмотра существующих схем вакцинации. В настоящее время, в условиях новых экономических отношений как никогда ощутимо, что здоровье это не только социальная, но и экономическая категория. Профилактика с помощью вакцинации — реальный способ планирования как собственного здоровья, так и здоровья нации. Фармако-экономические аспекты вакцинации наглядно и однозначно говорят о преимуществах этой процедуры [15]. Сегодня охват населения вакцинацией в некоторых регионах, признанных природными очагами КЭ, не превышает 5-15%. При этом доказано, что достижение 50% уровня вакцинации населения вакциной ЭнцеВир способно обеспечить снижение заболеваемости КЭ в природных очагах практически в два раза, а увеличение уровня вакцинации до 80% — снизить заболеваемость в 4-5 раз и практически исключить смертность. Такой подход к профилактике КЭ можно отнести к стратегии, при которой дополнительные затраты оправданы дополнительными клиническими преимуществами, что приобретает особую социальную значимость.
THE HISTORY OF VACCINES PRODUCTION FOR PROFILACTICS OF TICK-BORNE ENCEPHALITIS IN TOMSK: FROM BRAIN VACCINE TO ENCEVIR VACCINE
G.P. Bilalova, L.D. Bistritskij, M.S. Vorobiova, I.V. Krasilnikov, Т.Е. Ilchenko, R.G. Soliynik, N.Ch. Stavitskaya
In the first time Tomsky Research Institute of Vaccines and Sera (since 1988 — SPC Virion) launched TBE vaccine production in 1954 using the Sofjin strain. The technology was modified and developed over time. In 1962 a technique on the base of a chicken embryo fibroblast (CEF) cell culture was adopted employing the Pan strain; in 1983 the company elaborated a cultivated vaccine with 205 far-eastern TBE virus strain. In 2001 SPC Virion set up the manufacturing of EnceVir® — a concentrated purified vaccine that meets modern international
Standards. Since EnceVir® Vaccine has been suc-cessfully used on the territory of the Russian Federa-tion.
1. Жукова, Н.Г. Клещевой энецефалит в Томской области / Н.Г. Жукова, Н. И. Команденко, Л.Е. Подоп-лекина. — Томск, 2002.
2. Карпова, М.Р. История изучения клещевого энцефалита в г. Томске / М.Р. Карпова, Н.Г. Жукова, H.H. Команденко // Бюл. сиб. мед. — 2006. — Т. 5. — Приложение 1. — С. 6-15.
3. Мендрина, Г.И. Томская школа микробиологов / Г.И. Мендрина. — Томск, 1986.
4. Билалова, Г.П. Вакцина клещевого энцефалита ЭнцеВир: иммунобиологические и клинические испытания: Автореф. дис. канд. мед. наук / Г.П. Билалова.
- Уфа, 2003. - 150 с.
5. Быстрицкий, Л.Д. Бактериологический институт: Опыт столетия / Л.Д. Быстрицкий, М.А. Гаврилова.
- Томск, 2004. - 253 с.
6. Леонова, Г.Н. Вакцинопрофилактика клещевого энцефалита / Г.Н. Леонова, Е.В. Павленко, Н.В. Крылова. — Владивосток, 2006. — 100 с.
7. А. с. 669742 СССР. Штамм № 205 для приготовления вакцины против клещевого энцефалита / М.Н. Левина, М.С. Воробьева, Р.Н. Воробьева; кл. С 12 К 5/00, 1977.
8. Злобин, В.И. Клещевой энцефалит. Этиология, эпидемиология и специфическая профилактика / В.И. Злобин, О.З. Горин. — Новосибирск, 1996. — 177 с.
лев, Р.Г. Соляник // Сиб. мед. журн. — 2001. — 1 -С. 105-108.
10. Красильников, И.В. Разработка и внедрение; нологии очищенной вакцины клещевого энцефа. / И.В. Красильников, И.А. Мищенко, О.И. Ulapoi Актуальные вопросы разработки, производства и менения иммунобиологических и фармацевтиче Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
14. Прохорова, О.Г. Сравнительная характери ка иммунологической активности вакцин клеще энцефалита, используемых в ходе компании ма вой вакцинации населения Свердловской облас-О.Г. Прохорова, В.В. Романенко, В.И. Злобин // i демиол. и вакцинопрофилакт. — 2006. — № 4 (29 С. 33-36.
Среди переносчиков инфекционных заболеваний человека клещи занимают второе место после комаров: на сегодня выявлено не менее трех вирусных, 22 бактериальные и несколько протозойных инфекций, которые переносятся иксодовыми клещами. Ситуация зачастую осложняется тем, что при укусах клещи способны передавать человеку одновременно разные виды бактерий, вирусов и простейших, вызывая смешанные инфекции, часто протекающие в более тяжелых формах. Дополнительный риск заражения возникает из-за возможной циркуляции патогенов в сельскохозяйственных и домашних животных (например, инфекционные агенты могут сохраняться в молочных продуктах), а также при переливаниях крови и трансплантации органов. Наиболее опасными среди инфекций, переносимых клещами, считаются клещевой энцефалит, иксодовый клещевой боррелиоз, эрлихиоз, риккетсиоз и бабезиоз. Для России наиболее социально значимыми инфекционными агентами являются боррелии и конечно же вирус клещевого энцефалита, о котором пойдет речь ниже.
Таежная инфекция
В 30-х гг. XX в. шло интенсивное освоение Дальнего Востока: строились дороги, вырубались леса, из-за напряженных отношений с Японией в тайге дислоцировались крупные военные части. Врачи, работавшие в то время в Приморском крае, стали регулярно сообщать о неизвестной тяжелой болезни, поражающей как местных жителей, так и военных. Заболевание, считавшееся новой разновидностью тяжелого гриппа, сопровождалось резким повышением температуры и часто приводило к параличам и даже гибели заболевших.
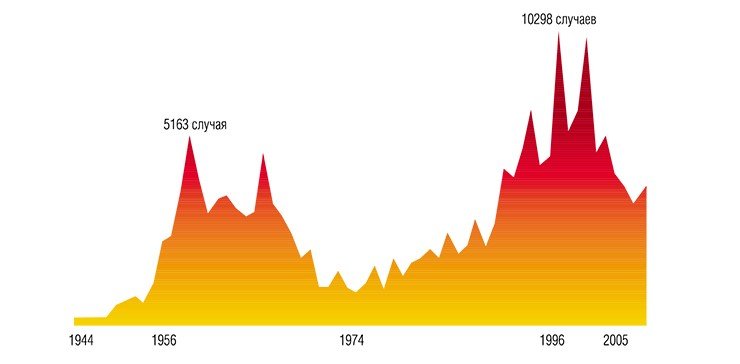
Правильно диагностировать неизвестную болезнь удалось лишь в 1935 г. местному врачу А. Г. Панову. Заболевание оказалось воспалением мозга, т. е. энцефалитом, похожим по симптомам на описанный ранее японский энцефалит. В 1936 г. врачи дальневосточной пастеровской станции пытались выделить возбудителя заболевания, вводя мышам в мозг эмульсию мозга людей, погибших от энцефалита. Но, несмотря на то, что у мышей появлялись признаки заболевания, исследования не увенчались успехом.
В январе 1937 г. военные медики обратились в Наркомздрав СССР, где и было принято решение об организации на Дальний Восток научной экспедиции под руководством Л. А. Зильбера. В тяжелых полевых условиях была развернута настоящая вирусологическая лаборатория. Ученые свою задачу выполнили: патоген, вызывающий тяжелые заболевания центральной нервной системы, был успешно выделен и описан. Кроме того, была четко установлена определяющая роль иксодовых клещей в передаче инфекционного агента. Выяснилось, что источником заражения клещей служили дикие позвоночные животные, на основе чего были разработаны рекомендации по необходимым профилактическим мерам.
К сожалению, это поистине блестящее открытие, ставшее важной вехой в истории вирусологии, не обошлось без жертв среди самих участников научной экспедиции. Так, М. П. Чумаков – будущий академик и создатель Института по изучению полиомиелита – перенес тяжелейшую форму инфекции, перешедшую у него в хроническую пожизненную форму; последствием заболевания у В. Д. Соловьева стала шестимесячная слепота.
Опасный сосед
Что на сегодня известно о вирусе клещевого энцефалита (ВКЭ)? Вирус относится к достаточно старому в эволюционном плане семейству флавивирусов (Flaviviridae), включающему более 70 вирусов животных и человека, в том числе такие опасные, как вирус желтой лихорадки, японского энцефалита, вирус лихорадки Денге и вирус гепатита C.

Лев Александрович ЗИЛЬБЕР (1894—1966) – один из основоположников медицинской науки в СССР. С его именем связаны фундаментальные исследования изменчивости у бактерий и природы иммунитета, организация первых в стране вирусологических центров, создание и экспериментальная разработка вирусо-генетической теории происхождения опухолей, а также совершенно нового направления – иммунологии рака.
За работу по выявлению возбудителя и переносчика весенне-летнего энцефалита в 1937 г. был награжден премией Наркомздрава СССР, но в том же году арестован по ложному обвинению, что экспедиция, которую возглавлял Зильбер, тайно распространяла японский энцефалит на Дальнем Востоке, и освобожден лишь через полтора года. В короткий промежуток времени между освобождением и новым арестом работал над монографией об эпидемических энцефалитах, подготовил несколько статей.
Основным природным резервуаром ВКЭ служат мелкие млекопитающие (полевки, мыши, насекомоядные). Вирус способен заражать животных и размножаться в их организме, однако заболевание протекает у них зачастую без видимого вреда для здоровья. Переносчиками вируса являются клещи, питающиеся кровью лесных зверьков, – европейский лесной клещ, таежный, луговой клещи, а также ряд других, более редко встречающихся видов. ВКЭ может размножаться и в их организме. Точно не известно, был ли вирус первоначально связан только с клещами, или только с позвоночными животными, но в процессе эволюции он приспособился к существованию в организмах как тех, так и других.
В настоящее время вирус клещевого энцефалита встречается в лесных регионах по всей территории Евразии от Атлантического океана до Тихого, причем в целом область его распространения совпадает с ареалами европейского лесного и таежного клещей. В последние десятилетия ареал ВКЭ неуклонно расширяется, что связано с усилением хозяйственной деятельности человека. Так, заброшенные лесные вырубки зарастают мелкими кустарниками и заболачиваются, что создает идеальные условия для обитания мелких млекопитающих и связанных с ними клещей.
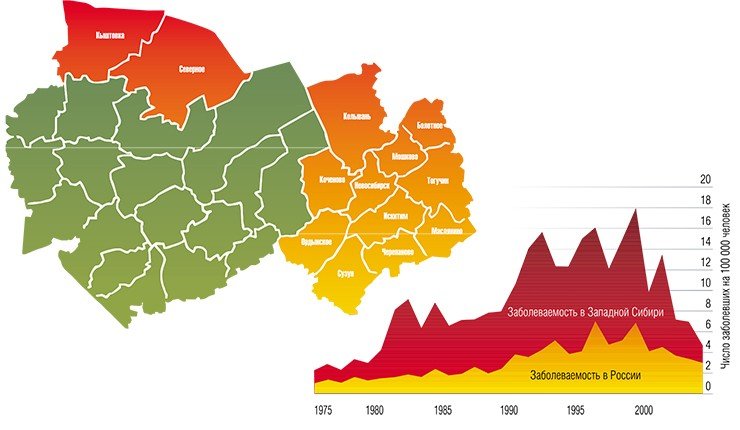
Кроме того, все большее число людей предпочитает проводить свободное время на природе, отдыхая или работая на приусадебных участках. В той же Новосибирской области около 75% населения проживает на территории, условия которой благоприятны для жизни клещей, здесь же сосредоточена и основная масса летних оздоровительных учреждений, зон массового отдыха, садово-дачных участков.
В Институте химической биологии и фундаментальной медицины были исследованы 95 штаммов вируса клещевого энцефалита из коллекции Института систематики и экологии животных СО РАН, выделенных от взрослых особей таежного клеща, собранных с растительности в восточной части Новосибирской области в 1980—2001 гг.
Анализ нуклеотидных последовательностей фрагмента гена Е, кодирующего белок оболочки вируса, показал, что все штаммы соответствуют сибирскому генетическому типу.
С другой стороны, в крови людей, госпитализированных с подозрением на клещевые инфекции, в совместных исследованиях с новосибирскими медиками были обнаружены изоляты ВКЭ, относящиеся к дальневосточному генетическому типу.
Ранее считалось, что этот тип вызывает только тяжелые формы заболевания, тогда как сибирский – преимущественно хронические. Наши исследования, подтвержденные данными других авторов, показали, что вирус дальневосточного генетического типа способен вызывать различные формы клещевого энцефалита, начиная от самых тяжелых и заканчивая стертыми, никак не проявляющимися.
Геном вируса клещевого энцефалита был расшифрован в 1989—1990 гг. практически одновременно в нашей стране (в том числе и в Институте химической биологии и фундаментальной медицины СО РАН (Pletnev et al., 1990)) и за рубежом (Mandl et al., 1989). На сегодня выделено три генетических типа вируса, различающихся по своим свойствам: дальневосточный, сибирский и западноевропейский. Такая привязка генетического типа к географическому местоположению достаточно условна, поскольку в одном регионе могут встречаться штаммы, относящиеся к разным типам.
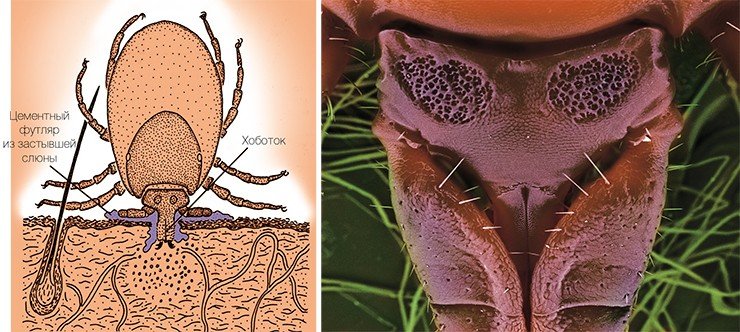
Для вируса клещевого энцефалита, как и для большинства других вирусных инфекций, не существует высокоспецифических методов лечения – в этом заключается его опасность. Лечение всех вирусных заболеваний направлено в основном на стимуляцию иммунитета и устранение внешних симптомов заболевания, а дальше организм должен сам справляться с инфекцией. ВКЭ опасен еще и тем, что способен вызывать хронические формы заболевания, а его последствиями могут быть параличи и инвалидность. Поэтому важнейшим делом в исследовании этого инфекционного агента является разработка методов диагностики и профилактики заболевания.
Диагностика и профилактика
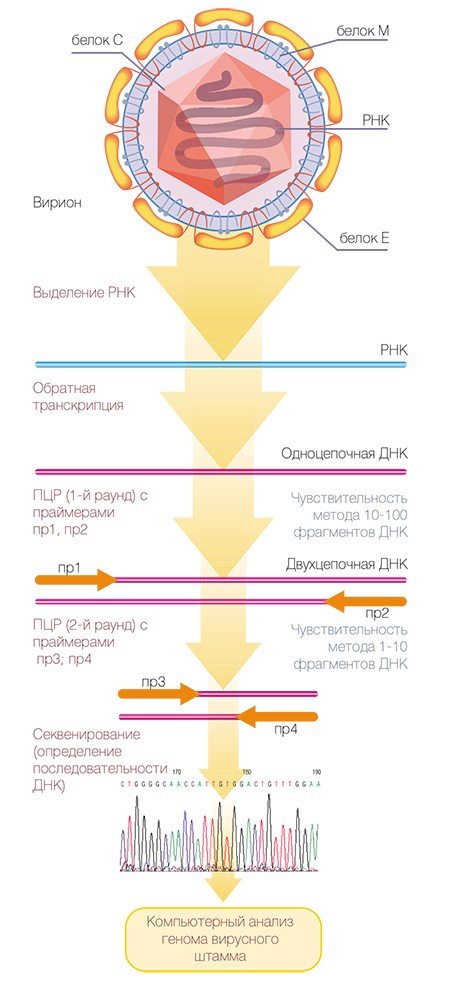
В клинической диагностике вируса клещевого энцефалита наиболее распространены серологические методы, с помощью которых в крови пациента определяют наличие антител, специфических защитных белков, или наличие самого агента. Однако чувствительность этих методов не слишком высока, к тому же существует вероятность ошибки из-за возможных перекрестных реакций с другими патогенами. Кроме того, с их помощью невозможно получить подробную характеристику самого возбудителя (например, определить его генетический тип).
Молекулярно-генетические методы, направленные на специфическое распознавание генетического материала вируса, обладают более высокой чувствительностью. Особенно это относится к методу полимеразной цепной реакции** (ПЦР), благодаря которой можно размножить, а потом идентифицировать ничтожное количество наследственного материала вируса, что позволяет провести диагностику в течение первых дней после заражения. Однако при некоторых обстоятельствах достоинства могут переходить в недостатки: генодиагностика ВКЭ молекулярно-генетическими методами благодаря высокой чувствительности может также приводить к ошибкам, обусловленным многочисленными новыми мутациями вирусных геномов, а кроме того, предъявляет высокие требования к чистоте экспериментов.

Живые вакцины
Живые вакцины – способ стимуляции иммунитета введением в организм ослабленных вирусов, открытый еще в 1796 г. английским врачом Э. Дженнером. С тех пор была получена живая вакцина против вируса желтой лихорадки, отличающаяся от высокопатогенных штаммов многочисленными заменами нуклеотидов в геноме; продолжаются поиски ослабленных штаммов флавивирусов Денге, Западного Нила и Лангат для разработки на их основе живых вакцин.
Были предприняты попытки создания живой вакцины и против вируса клещевого энцефалита. В 1957 г. в качестве такой живой вакцины было решено использовать ослабленный штамм флавивируса Лангат, вызывающий в организме выработку антител, подобных антителам к ВКЭ. Однако выяснилось, что при внутримозговом введении этот штамм сам становится патогенным и вызывает энцефалиты и атрофию участков мозга без внешних клинических проявлений. В дальнейшем были обнаружены ослабленные штаммы самого ВКЭ, но, к сожалению, все они оказались генетически нестабильными.
Вот трагический пример использования живых вакцин против ВКЭ. В 1969 г. от больного, у которого после укуса клеща в течение 4 лет не было клинических проявлений заболевания, но в крови сохранялись высокие титры антител, был выделен ослабленный штамм вируса клещевого энцефалита. Лабораторные исследования выявили его низкую нейровирулентность, после чего были проведены клинические испытания на добровольцах, давшие положительные результаты. В конечном счете ослабленным штаммом ВКЭ было иммунизировано около 650 тыс. человек. Однако 35 вакцинированных получили тяжелые осложнения в виде менингитов и менингоэнцефалитов, причем у 22 из них тяжелые последствия заболевания остались на всю жизнь, а один человек умер. Использование этого штамма в качестве живой вакцины было прекращено (Timofeev, Karganova, 2003).
ДНК-копии
С помощью подобных манипуляций были созданы живые химерные вакцины, содержащие, например, часть генов вируса желтой лихорадки и часть генов других флавивирусов. При этом в функционально важные участки их геномов были введены точечные мутации, вызывающие ослабление патогенности (Pletnev et al., 2006).
Тем не менее в настоящее время применение ослабленных живых вакцин, в том числе и против ВКЭ, ограничено, поскольку существует вероятность превращения ослабленных штаммов в высокопатогенные штаммы дикого типа. Это происходит потому, что в клетке-хозяине отсутствуют системы коррекции мутаций, которые могут возникнуть в вирусной РНК. Гарантией безопасности таких вакцин могла бы служить утрата больших фрагментов вирусных геномов, однако это приводит к значительному снижению жизнеспособности самих вирусов-мутантов.
Нужно отметить, что исследования флавивирусов, как и многих других патогенов, осложняются их высокой инфекционностью, следствием которой являются строгие требования безопасности, а также дороговизной самих вирусных препаратов. И в этом смысле использование неинфекционных ДНК-копий генома ВКЭ является очень перспективным направлением.
В ИХБФМ был получен ряд генно-инженерных ДНК, содержащих в том числе и полноразмерную ДНК-копию генома вируса клещевого энцефалита (Dobrikova et al., 1996). Конструирование подобных стабильных ДНК-копий вирусных геномов открывает широкие возможности для исследования хода размножения вируса в клетках, изучения функций отдельных вирусных белков и их комплексов.
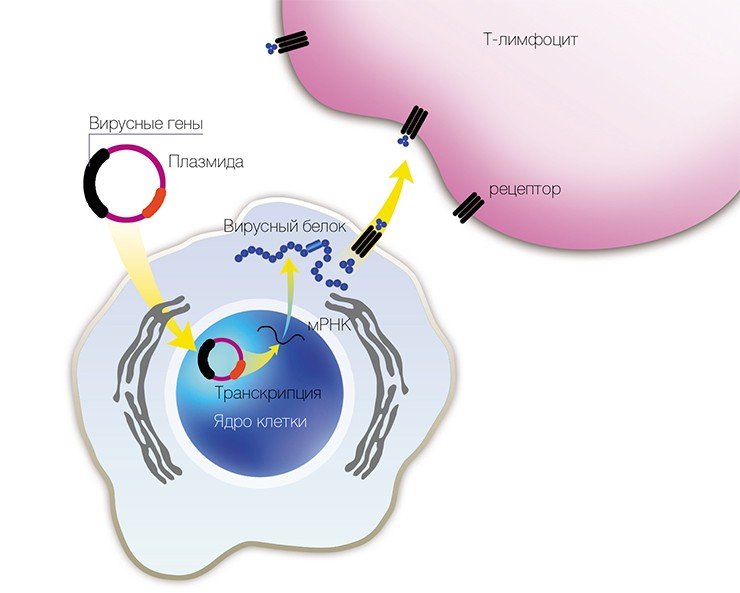
Иммунизация генами
В 1993 г. появился новый подход к профилактике инфекционных заболеваний – генная иммунизация, основанная на прямом введении в организм генно-инженерной ДНК, рекомбинантных плазмид (векторов-переносчиков), содержащих не весь геном, но отдельные гены возбудителя заболевания.
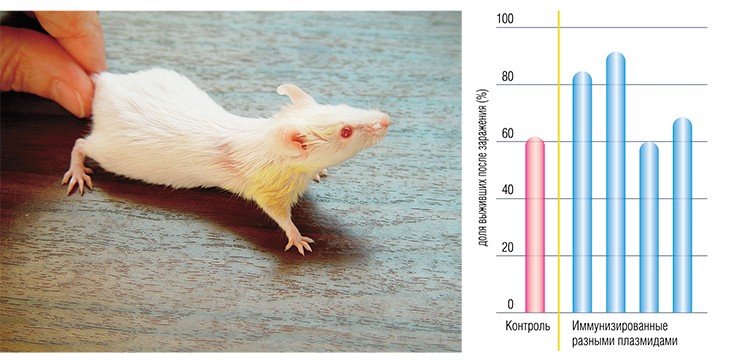
Учеными из ИХБФМ были сконструированы четыре таких плазмиды, содержащие различные гены одного из штаммов вируса клещевого энцефалита. Для оценки эффекта генной иммунизации привитых мышей заражали летальными дозами того же штамма ВКЭ. В результате оказалось, что некоторые плазмиды обладают определенным защитным эффектом.
В качестве вакцин против вирусных заболеваний ученые предполагают использовать генно-инженерные плазмиды, в которые встроены отдельные гены вирусов
Чтобы изучить возможные нежелательные эффекты этих вакцин, плазмиды вводили в различные клеточные культуры. В результате выяснилось, что при увеличении времени культивирования клеток до нескольких месяцев наблюдалась существенная модификация плазмид и встраивание их в хозяйский геном.
Таким образом, несмотря на положительные результаты генной вакцинации, вопрос о применении ДНК-вакцин в настоящее время остается открытым, поскольку препятствием к их использованию также является проблема безопасности. Возможно, преодолеть это препятствие удастся созданием РНК-вакцин с аналогичным принципом действия, для которых не существует риска интеграции в ДНК-геном хозяйской клетки. Но это уже задачи будущих исследований.
Возможно ли полностью избавиться от ВКЭ, например, уничтожив его основных переносчиков, иксодовых клещей? В свое время такая попытка была сделана с использованием печально известного ДДТ, но последствия массовой обработки лесов сильнейшим ядом были поистине ужасающими.
Читайте также:


