Кардиоваскулярные риски при ревматоидном артрите
Сравнить влияние терапии инфликсимабом и ритуксимабом на сердечно-сосудистый риск у больных ревматоидным артритом.
Материалы и методы
В исследование были включены 95 пациентов (средний возраст 42,74±7,23) с достоверным диагнозом РА развернутая стадия (6,1±2,9 лет) активного течения (DAS28 6,09±1,14) без сопутствующих заболеваний. Всем пациентам проводилась терапия инфликсимабом (n=32) или ритуксимабом (n=63). Исходно и через 1 год после начала лечения определяли структурно-функциональные параметры общих сонных артерий и сердца с помощью ультразвукового метода. Через 5 лет у 39 пациентов, продолжавших лечение генно-инженерных биологическими препаратами (ГИБП), оценивали частоту сердечно-сосудистых событий.
Исходно диастолическую дисфункцию левого желудочка 1 типа (замедленную релаксацию) наблюдали у 75 (78,9%) пациентов. В течение 1 года улучшение по крайней мере одного признака диастолической дисфункции наблюдалось у 10 (31,2%) пациентов группы инфликсимаба и 19 (30,2%) больных группы ритуксимаба. Исходно толщина комплекса интима-медиа (КИМ) общей сонной артерии была увеличена у 75 (78,9%) пациентов, а индекс жесткости – у 17 (17,9%). Терапия инфликсимабом в течение года не привела к статистически значимым изменениям этих показателей, в то время как при лечении ритуксимабом толщина КИМ правой общей сонной артерии снизилась на 8,9% (p Заключение
Терапия инфликсимабом и в большей степени ритуксимабом оказывает положительное влияние на сердечно-сосудистый риск.
Ревматоидный артрит (РА) является самым рас пространенным аутоиммунным заболеванием человека, характеризуется непрерывным прогрессированием, сопровождается существенным экономическим ущербом и социальными последствиями, а также высокой преждевременной смертностью 2. По данным популяционных исследований, частота развития сердечно-сосудистых осложнений у больных РА в 2-4 раза выше, чем в общей популяции, что нельзя объяснить наличием только традиционных факторов риска сердечно-сосудистых заболеваний 8. Наличие и длительность системного воспаления при РА сказываются на состоянии сердечно-сосудистой системы в целом и на ее отдельных структурно-функциональных показателях [9]. Исследования в этом направлении интересны и с позиции возможной обратимости начальных признаков сосудистого ремоделирования и изменений внутрисердечной гемодинамики под действием патогенетической терапии РА, в том числе генно-инженерными биологическими препаратами (ГИБП). Управление риском сердечно-сосудистых событий может способствовать снижению сердечнососудистой заболеваемости и смертности.
Целью исследования было сравнение влияния терапии инфликсимабом или ритуксимабом на сердечнососудистый риск у больных РА.
Материал и методы
В рандомизированное открытое исследование в параллельных группах включали пациентов с достоверным диагнозом активного РА, установленным в соответствии с критериями ACR, 1987 г. и ACR/EULAR, 2010 г., у которых была неэффективной терапия базисными противовоспалительными препаратами, включая метотрексат, в адекватных дозах в течение более 3 мес [10,11]. Критериями исключения были сердечно-сосудистые заболевания, в том числе артериальная гипертония, ишемическая болезнь сердца, сердечная недостаточность, нарушения мозгового кровообращения и др., а также сахарный диабет, заболевания почек (уровень креатинина в крови выше 110 мкмоль/л) и печени (уровни АСТ, АЛТ, билирубина, в 3 и более раза превышающие нормальные значения), ожирение (индекс массы тела более 30 кг/м2), инфекции, беременность, злокачественные новообразования, применение глюкокортикоидов в дозах более 7,5 мг/сут в пересчете на преднизолон. Всем пациентам проводили терапию оригинальными ГИБП, в том числе ингибитором фактора некроза опухоли-α (ФНОα) инфликсимабом или моноклональными антителами к В-лимфоцитам ритуксимабом в стандартных дозах. Рандо мизация проводилась стратификационным методом с учетом данных ультразвуковой допплерографии общих сонных артерий и эхокардиографии, включая отклонения толщины комплекса интима-медиа (КИМ) и индекса жесткости общей сонной артерии, показателей диастолической функции левого желудочка и морфологических параметров сердца от референсных значений.
Исходно и через 1 год проводили ультразвуковую допплерографию общих сонных артерий и эхокардиографию. Через 5 лет у пациентов, оставшихся под наблюдением, оценивали частоту сердечно-сосудистых событий.
Ультразвуковую допплерографию сонных артерий проводили с помощью аппарата Acuson Х/10, оснащенного линейным датчиком 7,5 МГц, в М- и В-режимах. В М-режиме измеряли диаметр просвета общей сонной артерии в систолу и диастолу, а в В-режиме – толщину КИМ общей сонной артерии в соответствии со стандартным протоколом, предложенным экспертами ВНОК для оценки субклинического атеросклероза сонных артерий. Крите рием утолщения КИМ считали значения более 0,9 и менее 1,3 мм. Локальное утолщение КИМ до 1,3 мм и более расценивали как атеросклеротическую бляшку. Для оценки локальной ригидности сосудистой стенки рассчитывали индекс жесткости общей сонной артерии по формуле: индекс жесткости (ИЖ) = log(САД/ДАД)/(ΔД/Д) (усл. ед.), где Д – диаметр общей сонной артерии в диастолу; ΔД – разница диаметров общей сонной артерии в систолу и диастолу; САД – систолическое АД; ДАД – диастолическое АД. В качестве референсных значений были взяты верхние допустимые значения по рекомендациям программы Ангио Скан-01.
Эхокардиографию проводили по стандартной методике на приборе GE Logic 400 (США) в М- и В- режимах. Диастолическое наполнение левого желудочка изучали с помощью допплерэхографии в импульсном режиме из верхушечной четырехкамерной позиции. Массу миокарда левого желудочка определяли по формуле R. Devereux.
Статистическая обработка данных проводилась с использованием статистического пакета программы “STATISTIСA” (версия 6.0). Различия между всеми исследуемыми показателями и переменными считали статистически значимы при р
Результаты
В рандомизированное открытое исследование в параллельных группах были включены 95 пациентов в возрасте от 21 до 50 лет (42,74±7,23, медиана 44,50) с достоверным диагнозом РА активного течения (среднее значение DAS28 6,09±1,14). Среди обследованных преобладали женщины – 77,9% (74/95). Длительность РА составила 6,1±2,9 лет. Степень активности по DAS28 была высокой у 79 (83,2%) пациентов и умеренной у 16 (16,8%). Ревматоидный фактор выявили у 74 (77,9%) больных, антитела к цитруллинированному пептиду – у 72 (75,8%). Лечение инфликсимабом проводили у 32 больных, ритуксимабом – у 63.
Через 1 год инфликсимаб и ритуксимаб по эффективности достоверно не отличались (р>0,05). Через 1 год хороший и удовлетворительный ответ на лечение инфликсимабом был достигнут у 28 (88%) пациентов, ремиссия РА (DAS28 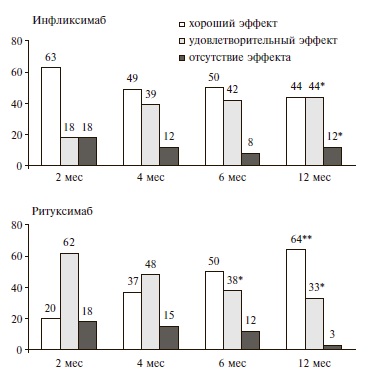
Рис. 1. Эффективность (%) инфликсимаба и ритуксимаба у больных РА в различные сроки после начала лечения. * p
Увеличение толщины межжелудочковой перегородки и/или задней стенки левого желудочка (>0,9 см для женщин и >1,0 см для мужчин) при эхокардиографии исходно выявили у 36 (37,8%) из 95 пациентов, а повышение индекса массы миокарда левого желудочка (>95 г/см2 для женщин и >115 г/см2 для мужчин) – у 28 (29,4%). Через 1 год после начала терапии инфликсимабом или ритуксимабом эти показатели, как и фракция выброса левого желудочка, достоверно не изменились.
На разных сроках наблюдения 56 (58%) из 95 пациентов прекратили терапию ГИБП. Причинами отмены инфликсимаба и ритуксимаба были вторичная неэффективность у 18 и 3 пациентов, соответственно, нежелательные явления у 6 и 2. Двадцать семь пациентов из группы ритуксимаба были исключены из исследования по причине значимого нарушения схемы лечения по немедицинским или не установленным причинам. Через 5 лет лечение инфликсимабом продолжали 8 пациентов, ритуксимабом – 31. Сердечнососудистые события (ишемическая болезнь сердца, артериальная гипертония, хроническая сердечная недостаточность) в двух группах были зарегистрированы у 2 (25%) и 4 (13%) пациентов, соответственно (отношение шансов 2,25). Разница оказалась недостоверной из-за недостаточной выборки.
Обсуждение
Сравнительный анализ результатов терапии через 1 и 5 лет показал наличие определенных различий между инфликсимабом и ритуксимабом в скорости наступления и стойкости противовоспалительного эффекта, а также влиянии на отдельные параметры сердечно-сосудистой системы. Точные механизмы действия ингибиторов ФНО-α и моноклональных антител к В-лимфоцитам на структурно-функциональные параметры артерий и сердца в настоящее время не установлены. Известные аспекты фармакокинетики и фармакодинамики данных препаратов не дают основания говорить о прямом воздействии инфликсимаба и ритуксимаба на сердечно-сосудистую систему. В качестве теоретического обоснования кардиопротективного эффекта ГИБП может быть воспалительная модель атерогенеза, которая поддерживается большинством исследователей. Оба препарата снижают степень активности воспалительной реакции при РА. При этом инфликсимаб оказывает селективное действие только на один цитокин – ФНО-α. Хотя препарат быстро связывается с ФНО-α, образует с ним устойчивое соединение, подавляет функциональную активность и предотвращает дальнейшие иммунологические реакции, потенцируемые ФНО-α, основные продуценты данного цитокина – моноциты и макрофаги остаются активными, что приводит к дальнейшему росту продукции различных молекул воспалительной реакции, в первую очередь ФНО-α, при снижении концентрации инфликсимаба в крови.
В то же время, ритуксимаб, специфически связываясь с CD20, оказывает прямое угнетающее действие на пул зрелых В-лимфоцитарных клеток и в конечном итоге блокирует В-лимфоцитарный синтез всех провоспалительных цитокинов. В нашем исследовании оба препарата вызывали улучшение диастолической функции левого желудочка у больных РА, однако ритуксимаб по сравнению с инфликсимабом оказывал более выраженное действие на состояние сосудов, в частности в большей степени снижал толщину КИМ и индекс жесткости общей сонной артерии. Через 5 лет была также выявлена тенденция к снижению частоты неблагоприятных сердечно-сосудистых исходов в группе ритуксимаба по сравнению с инфликсимабом. Полу ченные данные обосновывают продолжение исследований с целью изучения механизмов влияния раз личных ГИБП на сосудистую стенку и риск сердечно-сосудистых исходов [12,13].
Заключение
Терапия инфликсимабом и ритуксимабом, оказывая положительное влияние на воспалительный процесс у больных РА с доклиническими структурно-функциональными изменениями сердечно-сосудистой системы, дает опосредованный кардиопротективный эффект в виде снижения признаков диастолической дисфункции левого желудочка и улучшения состояния сосудистой стенки. Более выраженным действием на сердечнососудистую систему обладает ритуксимаб.
Изучение клинико-электрокардиографических изменений у больных ревматоидным артритом и их отличительных особенностей в зависимости от степени активности, стадий и клинических форм заболевания в сочетании с артериальной гипертонией и аутоиммунитетом.
| Рубрика | Медицина |
| Вид | автореферат |
| Язык | русский |
| Дата добавления | 29.12.2017 |
| Размер файла | 7,2 M |
- посмотреть текст работы
- скачать работу можно здесь
- полная информация о работе
- весь список подобных работ
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
- 1
- 2
- 3
Кардиоваскулярная патология при ревматоидном артрите
14.01.04 - внутренние болезни
диссертации на соискание ученой степени
доктора медицинских наук
САИДОВ ЁР УМАРОВИЧ
Работа выполнена на кафедре пропедевтики внутренних болезней Таджикского государственного медицинского университета им. Абуали ибни Сино
Научный консультант: доктор медицинских наук, профессор Шарипова Хурсанд Ёдгоровна
Официальные оппоненты: доктор медицинских наук, профессор, член-корр АН РТ Хамидов Набиджон Хамидович
доктор медицинских наук, профессор Ёров Нарзы Курбанович доктор медицинских наук Авезов Сайфулло Абдуллоевич
Ведущая организация: Государственное учреждение Институт ревматологии Российской академии медицинских наук
С диссертации можно ознакомиться в библиотеке Таджикского государственного медицинского университета им. Абуали ибни Сино
кандидат медицинских наук, доцент Бабаева Л.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. В современной медицине наиболее распространенной причиной смерти во всем мире считается кардиоваскулярная патология (КВП), а взаимосвязь атеросклероза (АС) и КВП с аутоиммунными заболеваниями, такими как ревматоидный артрит (РА) и системная красная волчанка (СКВ) с частым возникновением осложнений со стороны сердечно-сосудистой системы представляется особенно актуальной, и по-прежнему остается малоизученной и дискутабельной (Насонов Е.Л., 2004; Ивлева А.Я.,2007; Беленков Ю.Н. и соавт., 2007; Попкова Т.В. и соавт., 2008)
По мнению В.А.Насоновой (2003), в свете воспалительной теории атеросклероза (Насонов Е.Л. и соавт., 2003;; Libby P et al., 2003; Sattar N. et al., 2003; Кухарчук В.В., 2009), одной из важнейших задач XXI века является дальнейшее исследование взаимоотношения системных аутоиммунных заболеваний и АС, что позволит оценить динамику нарушений липидного обмена, способствующих поражению сосудистой стенки. Более того, именно системные ревматические заболевания являются сосредоточением таких основных теоретических проблем медицины, как иммунитет, острое и хроническое воспаление, иммуногенетика и РА считается своеобразной моделью для изучения взаимосвязи аутоиммунитета, АС и артериальной гипертонии (АГ) (Сигидин Я.А. и соавт, 2004; Ильина А.Е., 2006; Metsios G.S. et al., 2007; Шилкина Н.П. и соавт., 2008). И не случайно, что успехи в изучении РА, особенно его терапии, оказывают существенное влияние на развитие не только ревматологии, но и медицины в целом (Сигидин Я.А. и соавт., 2004).
Одной из основных причин летальности при РА являются сердечно-сосудистые катастрофы (инфаркт миокарда - ИМ, инсульт, внезапная коронарная смерть), обусловленные ранним развитием и быстрым прогрессированием атеросклеротического поражения сосудов (Демина А.Б., 2005; Naz S.M. et al., 2007). В недавних исследованиях установлено, что увеличение риска кардиоваскулярных осложнений (КВО) у больных РА связано не только с традиционными факторами риска (ФР), но и с особенностями иммуновоспалительных механизмов, лежащими в основе патогенеза РА и АС (Насонов Е.Л., 2004; Шилкина Н.П. и соавт., 2008; Попкова Т.В. и соавт., 2009). В этой связи само заболевание и его лечение ныне признаны вероятными ФР кардиоваскулярного поражения (Насонов Е.Л., 2004).
В последние десятилетия заметно возрос интерес к роли воспаления в развитии и прогрессировании АС и связанных с ним осложнений (Дмитриев В.А. и соавт., 2006; Кухарчук В.В., 2009; Цурко В.В. и соавт., 2009). Полагают, что системный воспалительный процесс при РА, характеризующийся активацией и пролиферацией эндотелиальных и гладкомышечных клеток, прокоагулянтного звена гемостаза с одновременным угнетением фибринолитической активности, образованием цитокинов и факторов роста способствует отложению липидов в сосудистой стенки, имеет существенное патогенетическое значение в прогрессирование АС, в дестабилизации атеросклеротической бляшки и, соответственно, в развитии КВО (Стрюк Р.И. и соавт., 2008; Шилкина Н.П. и соавт., 2008; Новикова Д.С. и соавт., 2009;).
Традиционные ФР кардиоваскулярных заболеваний (КВЗ) при РА подобны таковым в основной популяции: дислипидемия, сахарный диабет (СД), курение, АГ, возраст, отягощенная наследственность по КВЗ и др. (Никитина Н.М. и соавт., 2009). В последние годы (Бокарев И.Н., 2004; Кошурникова М.А., 2006) к ним добавились гиперфибриногенемия и тревожно-депрессивные расстройства (ТДР). В ряде работ (Козлова Л.К., 2003; Попкова Т.В., 2009) ускоренное развитие АС и КВП при РА связывают с активностью и длительностью заболевания, наличием системных проявлений, кумулятивной дозой ГК и отсутствием базисных противовоспалителных препаратов (БПВП) в комплексной терапии больных.
В этой связи клиническое значение показателей активации иммунитета и дисфункция эндотелия, белки острой фазы воспаления являются предметом наиболее интенсивного изучения в современной кардиологии. Среди воспалительных маркёров АС и КВЗ в последние годы особое значение придают С-реактивному белку (СРБ) (Ребров А.П., 2004; Александрова Е.Н. и соавт., 2007; Цурко В.В. и соавт., 2009). По современным представлениям, небольшое увеличение концентрации СРБ, определяемого с помощью высокочувствительных методов, отражает хроническое, субклинически текущее воспаление сосудистой стенки и рассматривается в качестве маркера и независимого проспективного ФР кардиоваскулярных осложнений у здоровых лиц и пациентов с КВЗ (Александрова Е.Н. и соавт., 2007; Цурко В.В. и соавт., 2009; Кухарчук В.В., 2009).
В целом, чрезвычайная гетерогенность РА, наличие многочисленных ФР, как традиционных, так и специфических и неоднородность патогенетических аспектов поражения КВС объясняют развитие широкого спектра кардиоваскулярного континуума у больных РА (Козлова Л.К., 2003; Колотова Г.Б. и соавт., 2007; Попкова Т.В. и соавт., 2008).
Однако, несмотря на чрезвычайную важность проблемы как с теоретической, так и с практической точек зрения и наличие большого количества исследований, посвященных проблеме развития АС и КВП при РА, сведения о распространенности КВЗ, ФР и механизмах атерогенеза и поражения КВП остаются во многом противоречивыми. Имеющиеся сообщения в литературе носят весьма фрагментарный характер, не лишены субъективизма и гипотетичности.
Данные о комплексном исследования клинико-электрокардиографических (ЭКГ) и ЭхоКГ-изменений, состоянии клеточного и гуморального иммунитета, свертывающей системы крови, липидного обмена и микроциркуяции (МЦ) у больных РА, как на ранних, так и поздних стадиях заболевания в доступной нам литературе мы не встретили. Другой важной, но малоизученной проблемой является дисфункция психоэмоцмонального статуса у больных РА, особенно при сочетании с КВП. Исследования ТДР у пациентов с РА появились в самые последние годы, и данная проблема еще далека от разрешения (Уланова Е.А., 2005; Балабанова Р.М. и соавт., 2005; Насонов Е.Л. и соавт., 2008).
С другой стороны, наличие КВП у больных РА с учетом кардиотоксичности большинства противовоспалительных препаратов во многом осложняет без того трудную задачу лечения основного заболевания и требует оптимизации терапии в целом и применение препаратов с целью коррекции артериального давления (АД) и других гемодинамических нарушений у больных данной коморбидности.
Целью настоящего исследования явились комплексные клинико-лабораторные, инструментальные и морфологические оценки состояния КВС у больных РА, как на ранних, так и поздних стадиях развития заболевания, а также обоснование целесообразности применения ИАПФ у пациентов с коморбидностью РА и КВП, оптимизация и интенсификация терапевтической стратегии в целом.
1. Изучить клинико-ЭКГ изменения у больных РА и их отличительные особенности в зависимости от степени активности, стадии и клинических форм заболевания.
2. Оценить морфо-функциональные особенности левых отделов сердца у больных РА в зависимости от клинических форм заболевания и наличия АГ.
3. Изучить вопросы, связанные с ассоциативную взаимосвязь АГ и ИБС с особенностями иммунопатологических нарушений, характерных для РА и, отчасти, со способами его терапии.
4. Сравнительно оценить роль традиционных и специфических (болезньсвязанных) ФР в раннем развитии АС и изучить ассоциацию маркеров воспаления (СРБ) с клиническими и субклиническими проявлениями АС.
5. Изучить общие закономерности изменений состояния свертывающей системы крови, липидного обмена, микроциркуляции (МЦ), качества жизни (КЖ), функциональных нарушений и уровень тревожности у больных РА в целом и их отличительных особенностей в зависимости от наличия КВП.
6. Изучить вопросы диагностики, клинико-иммунологические особенности и комплексной оценки состояния КВС при раннем РА.
7. Выяснить реальную возможность развития ревматоидного васкулита, изучить особенности его течения, клинической, лабораторной и морфологической диагностики и определить основные показания к переводу терапии в интенсивный режим с учетом оценки характера течения РА.
Научная новизна. Впервые дана комплексная и дифференцированная оценка состояния КВС, свертывающей системы крови, липидного обмена и МЦ, а также функциональных нарушений, КЖ и уровня тревожности у больных РА в зависимости от активности, клинических форм заболевания и характера проводимой терапии, как на ранних, так и на поздних стадиях РА, показана роль и значимость полученных сдвигов в механизмах прогрессирования и генерализации ревматоидного воспаления.
Установлено, что у больных РА на поздних стадиях заболевания с высокой частотой и в широком диапазоне, встречаются как субклинические, так и клинические симптомы поражения КВС, чаще всего субклинические симптомы АС, повышение АД, гипертрофия и диастолическая дисфункция левого желудочка (ГЛЖ, ДДЛЖ), нарушения ритма и проводимости сердца.
Впервые установлено, что развитие и прогрессирование КВП у больных РА в определенной степени взаимосвязаны с особенностями иммунопатологических нарушений, характерных для РА, и отчасти с его терапией. При этом выявлено, что наиболее отличительными особенностями ИБС при коморбидности с РА являлись безболевое и/или малосимптомное течение, ярко выраженные гиперкогуляционные сдвиги в крови, высокий уровень тревожности и хронологическая взаимосвязь с суставным синдромом.
Впервые установлено, что уровень СРБ является наиболее чувствительным лабораторным параметром как для оценки активности (особенно в дебюте), так и эффективности терапии РА, ассоциируется с напряженностью свертывающей системы крови и липидного обмена, и, дополняя традиционных ФР, одновременно является и прогностическим маркером в отношении риска развития КВЗ и их осложнений у больных РА.
Установлено, что длительное применение эналаприла в комбинации с МТ, у больных РА с КВП приводит к нормализации АД, вызывает регрессию ГЛЖ, улучшает МЦ и гемокоагуляционые показатели, и положительно влияет на липидный обмен .
Практическая значимость работы. Выявленный широкий спектр кардиоваскулярных симптомов при комплексной оценке состояния КВС у больных РА, несмотря на скудность субъективной симптоматики, диктует необходимость их своевременной диагностики.
Ускоренное развитие атеросклеротического поражения сосудов у больных РА диктует необходимость своевременного выявления и коррекции модифицируемых ФР.
С целью ранней диагностики АС и КВП необходимо динамическое обследование всех пациентов с РА с использованием УЗИ сонных артерий, ЭКГ, ЭхоКГ.
У больных РА целесообразно определение концентрации СРБ в динамике для оценки не только активности заболевания и эффективности терапии, но и с целью оценки кардиоваскулярного риска.
Оценка характера МЦ нарушений, состояния свертывающей системы крови и липидного обмена у больных РА может помочь в своевременной диагностике степени изменений изучаемых параметров на фоне высокой степени активности воспалительного процесса, АГ, АС и КВП.
Оценка степени функциональных нарушений, КЖ и уровня тревожности при коморбидности РА с КВП показывает, что хроническое прогрессирующее течение заболевания оказывает выраженное отрицательное влияние на функциональное состояние, КЖ и на систему психологических защитных механизмов личности больных, обусловливая высокий уровень тревожности.
Опыт сочетанного использования МТ и эналаприла у больных РА в сочетании с КВП с учетом иммунологических сдвигов, регрессии большинства кардиоваскулярных симптомов и значительное улучшении МЦ и гемокоагуляционных показателей, а также липидного обмена является патогенетически обоснованным, что позволяет рекомендовать их для широкого практического использования.
Основные положения диссертации, выносимые на защиту:
1. Общая характеристика пациентов в основной группе и их отличительные особенности. Обзор клинико - ЭКГ оценок состояния КВС у больных РА.
2. Вопросы коморбидности РА с АГ: особенности развития АГ, взаимосвязанность петогенетических механизмов, зависимость показателей гемодинамики от активности РА и наличия АГ.
3. О роли традиционных и специфических ФР, а также СРБ в раннем развитии АС при РА.
4. Оценка морфо-функциональных особенностей левых отделов сердца при РА.
5. Связь изменений в свертывающей системе, МЦ кровотока и липидного обмена с иммунологическими нарушениями, происходившими при РА в сочетании с КВП.
6. Ранний РА: клинико-иммунологическая характеристика, диагностика и вопросы терапии.
7. Оценка эффективности применения МТ и эналаприла у больных РА в сочетании с КВП, оптимизация терапии в целом и принципы интенсификации лечения при быстро прогрессирующей РА с постоянно высокой активностью.
Апробация работы. Основные положения диссертации опубликованы в печати (38 печатных работ, из которых 10 в журналах, включенных в перечень ВАК, 2 методические разработки и 2 рационализаторские предложении). Результаты исследований доложены и обсуждены на 52, 55, 56-х годичных научных конфренциях ТГМУ им. Абуали ибни Сино (Душанбе, 2004, 2007, 2008), республиканской научно-практической конференции с международным участием (Турсунзаде, 2007), ХIII Российской гастроэнтерологической недели (Москва, 2007), II съезде кардиохирургов Центральной Азии (Душанбе, 2008), V съезде терапевтов Узбекистана (Ташкент, 2008), III республиканской конференции кардиологов (Душанбе, 2008), на Российском национальном конгрессе кардиологов (Москва, 2008). ревматоидный артрит артериальный гипертония
Структура и объем диссертации. Диссертация изложена на 255 страницах компьютерного текста и состоит из введения, обзора литературы, материалов и методов исследования, четырех глав результатов собственных исследований, обсуждения, выводов, практических рекомендаций и указателя литературы. Диссертация иллюстрирована 48 таблицами, 22 рисунками и 4 клиническими наблюдениями. В списке литературы приведены 426 источников, из них 297 на русском языке и 129 - на иностранных языках.
Материал и методы исследования В исследование были включены 2 группы больных основная группа, и группа больных с ранним РА, которым верификация диагноза проводилась на ранних этапах (12 мес) болезни.
Основную группу составили 119 пациентов с достоверным по критериям АКР (1987г.), в группу раннего РА вошли 27 больных, которым при первом поступлении в стационар в период с 2005 по 2009 гг. был верифицирован диагноз РА при продолжительности заболевания не более 12 месяцев с момента появления симптомов воспалительного поражения суставов. Контрольную группу составили 40 человек (28 женщины и 12 мужчин) без ревматических и кардиоваскулярных заболеваний, сопоставимых по полу и возрасту с обследованными больными.
Все больные обследовались в клинике пропедевтики внутренних болезней ТГМУ им. Абуали ибн Сино (на базе ревматологического отделения ГКБ №5, г. Душанбе) в период с 2005 по 2010 г. и осматривались лично автором в качестве либо лечащего врача, либо ассистента кафедры. Обследование в стационаре проводилось при включение пациента в исследование и далее на этапах наблюдения в сроки 6, 12 месяцев и далее, каждые полгода в зависимости от эффективности проводимой терапии.
Подавляющее большинство больных (84,1%) составляли женщины и лица трудоспособного возраста (табл.1). Возраст пациентов к началу исследования колебался от 17 до 70 лет, средний возраст составил 45,3±3,4 года, что в целом соответствует общей тенденции при РА (Каратеев Д.Е., 2003). Из общего числа больных основной группы, большинство пациентов (76,5%) были взяты под наблюдением в поздние сроки наблюдения. Пациенты поступали в клинику в среднем через 3,5±1,4 гола от начала заболевания. Из общего числа больных с поздней стадией РА длительность болезни от 2 до 5 лет была у 44 (36,6%) и более 5 лет - у 52 (43,7%).
Таблица 1. Клиническая характеристика больных РА в основной группе
Клиническая характеристика на момент начала наблюдения

Ревматоидный артрит (РА) является одним из часто встречающихся аутоиммунных заболеваний как в российской, так и в мировой популяции, причем в последние годы отмечается рост числа пациентов во всех возрастно-половых группах [3, 7]. Неблагоприятный прогноз у пациентов с РА может быть связан с поражением почек [10]. Частота поражения почек при РА, по данным разных авторов, составляет от 57 до 73 % [1, 2]. Boers М. по данным аутопсий установлено, что различные варианты поражения почек встречаются у 19,7 % пациентов с РА [5].
Формирование нефропатии при РА носит сложный многофакторный характер и проявляется различными клинико-морфологическими вариантами. Так, известны различные клинические формы поражения почек при РА (амилоидоз, гломерулонефрит, реже ревматоидный гранулематоз и ревматоидный васкулит почек), а также ятрогенные, обусловленные проводимым лечением (лекарственный тубулоинтерстициальный нефрит, мембранозная нефропатия, мезангиопролиферативный гломерулонефрит). В то же время в реальной клинической практике нозологический диагноз заболевания почек при РА, как правило, устанавливается при появлении клинико-лабораторных критериев, важнейшим из которых является протеинурия [15], в то же время в последнее время установлено, что при малосимптомном течении нарушение функции почек может развиваться и без наличия протеинурии [9]. Примечательно, что не всегда специалистами-ревматологами обращается внимание на ранние проявления функциональных почечных нарушений, особенно при умеренной выраженности протеинурии, хотя темпы падения функции почек при РА могут быть достаточно быстрыми, особенно в пожилом возрасте и при ассоциации с сердечно-сосудистой патологией [15].
Весьма важно, что по современным представлениям функциональные почечные нарушения, длящиеся более трех месяцев (т.н. хроническая болезнь почек), в т.ч. без определенного нозологического диагноза, рассматриваются как важнейший прогностический фактор, требующий коррекции лечебной тактики как в общей популяции, так и, возможно, при РА [10, 11]. По данным некоторых исследователей, развитие хронической болезни почек при РА может быть ассоциировано с сердечно-сосудистой патологией, в то время как и сама почечная патология является фактором риска поражения сердечно-сосудистой системы [15]. В то же время крупномасштабных эпидемиологических исследований по распространенности хронической болезни почек при РА и ассоциированных с ее развитием факторов риска не проводилось, а имеющиеся данные разрозненны и противоречивы [4, 12]. Таким образом, оценка функциональных почечных нарушений и ассоциированных факторов при РА является актуальной для клинической медицинской практики, недостаточно разработаны подходы к раннему выявлению почечной патологии и оценке риска ее прогрессирования при РА.
Цель исследования – оценка тяжести функциональных почечных нарушений при РА с анализом основных факторов риска.
Материалы и методы исследования
В настоящее исследование было включено 117 пациентов с ревматоидным артритом (20 мужчин, 97 женщин), находившихся на стационарном лечении в ревматологическом отделении Краевой клинической больницы № 1 им. проф. С.В. Очаповского (г. Краснодар) в период с 2009 по 2011 гг., средний возраст в общей когорте составил 52,1 ± 16,4 лет. Демографическая и клиническая характеристика пациентов приведена в табл. 1.
Диагноз РА устанавливался на основании диагностических критериев Американской коллегии ревматологов (1987). Для оценки функционального состояния почек у всех пациентов определялся креатинин сыворотки крови, выполнялся общий анализ мочи, суточная протеинурия. Скорость клубочковой фильтрации (СКФ) рассчитывалась по формуле MDRD (Modification of Diet in Renal Disease Study). Для оценки активности РА рассчитывался индекс активности DAS28 (Disease Activity Score). Определялась клиническая и рентгенологическая стадия по Steinbrocker, учитывалось наличие системных проявлений.
Пациенты из исследования исключались при наличии данных, подтверждающих наличие инфекционных, онкологических заболеваний, алкогольного поражения печени, острой коронарной патологии, аллергических реакций, сахарного диабета 1 типа, сердечной недостаточности III-IV функциональных классов по классификации NYHA.
Статистический анализ данных проведен с помощью программы Statistica 6.0. В зависимости от типа распределения данные представлены в виде m ± SD или в виде медиана (25; 75 процентиль). Для сравнения групп использованы параметрический критерий Стьюдента, двухсторонний t-критерий или непараметрические критерии Манна–Уитни и Вилкоксона. Корреляционный анализ проведен методом ранговой корреляции Спирмена.
Демографические характеристики и активность ревматоидного артрита у пациентов, включенных в исследование (n = 117)
Читайте также:


