Клинические рекомендации по клостридиальной инфекции
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Р ациональная антибиотикотерапия является одной из важнейших составляющих в лечении детей с различными инфекционно–воспалительными заболеваниями. Однако широкое и не всегда обоснованное применение антибиотиков в педиатрической практике нередко приводит к развитию разнообразных осложнений (аллергические и токсические реакции, дисбактериозы и др.) [8,12]. Особое место среди антибиотико–индуцированных осложнений занимают дисбактериозы кишечника, которые могут сопровождаться суперинфекцией и клинически значимой активацией условно–патогенных энтеробактерий с развитием колитов и энтероколитов. При этом В.Ф. Учайкин и А.А. Новокшенов (1999) подчеркивают, что до 20% всех антибиотико–ассоциированных диарей и 90–100% псевдомембранозных колитов обусловлено Clostridium difficile–инфекцией [9].
Clostridium difficile–инфекция (клостридиоз диффициле) – острая, антропонозная, анаэробная инфекция с энтеральным путем заражения, характеризующаяся различной степенью выраженности клинических проявлений – от бессимптомного бактерионосительства и легких диарей до тяжелых форм заболевания в виде псевдомембранозного колита.
Этиология. Возбудитель клостридиоза диффициле – Clostridium difficile – строго анаэробная, спорообразующая, грамположительная бацилла [7]. Вегетативные формы Clostridium difficile обладают способностью продуцировать экзотоксины, среди которых идентифицированы повреждающие кишечную стенку энтеротоксин (токсин А) и цитотоксин (токсин В) [7,11,16]. Установлено, что токсин А, стимулируя гуанилатциклазу, повышает секрецию жидкости в просвет кишечника и способствует развитию диареи. Токсин В обладает выраженным цитопатогенным действием. Предполагают, что ингибируя процессы синтеза белка в энтеро– и колоноцитах, токсин В нарушает функции их клеточных мембран. Это приводит к потере калия и развитию электролитных нарушений. Споры Clostridium difficile проявляют высокую устойчивость к факторам внешней среды и стандартным дезсредствам, а вегетативные формы резистентны к большинству антибиотиков (природные и полусинтетические пенициллины, ингибитор–защищенные пенициллины, цефалоспорины, линкозамиды и др.) [5,7,11,14].
Эпидемиология. Clostridium difficile часто обнаруживаются в окружающей среде и могут быть изолированы из почвы [7,9,12]. Основной механизм передачи инфекции – фекально–оральный. Источником инфекции является человек (чаще – пациенты, получающие антибиотики широкого спектра действия, и дети). Установлено, что частота контаминации кишечника Clostridium difficile у здоровых новорожденных и младенцев может составлять более 50%, тогда как у детей старше 2 лет, а также у здоровых взрослых уровень инфицированности не превышает 5% [3,9,12]. В то же время у взрослых, находящихся на лечении в различных стационарах, частота носительства Clostridium difficile значительно выше и может достигать 10–20% [4,5]. При этом отмечено, что трансмиссия вегетативных форм Clostridium difficile от инфицированных (дети, медицинский персонал, лица, осуществляющие уход за больными и сами пациенты) к здоровым лицам осуществляется через такие факторы передачи, как руки и предметы ухода. Кроме этого, установлена возможность широкого контаминирования Clostridium difficile различных внутригоспитальных объектов (постельные принадлежности, мебель, душевые, туалеты и др.) [3–6]. Бытовая передача Clostridium difficile с участием различных факторов создает серьезный риск развития внутрибольничной инфекции, особенно у пациентов, получающих массивную антибактериальную терапию. Контингентами риска по развитию тяжелых форм нозокомиальной Clostridium difficile–инфекции являются и дети раннего возраста (ослабленные), а также пациенты, длительно находящиеся в стационаре [3,9,12].
Установлено, что основным фактором риска по развитию тяжелых форм заболевания является антибиотикотерапия. При этом В.А. Малов и соавт. (1999) подчеркивают, что даже однократный прием антибиотика широкого спектра действия, независимо от дозы и способа введения, может привести к развитию диареи и псевдомембранозного колита, обусловленных Clostridium difficile [6]. К факторам риска также относят повторные очистительные клизмы, длительное использование назогастрального зонда, оперативные вмешательства на органах желудочно–кишечного тракта и продолжительное пребывание пациентов в стационаре [2–6,12]. В то же время установлено, что диарея и колит, обусловленные Clostridium difficile, могут развиваться не только в стационаре, но и в амбулаторных условиях при использовании антибиотиков широкого спектра действия, особенно у ослабленных пациентов и детей раннего возраста [15].
Патогенез и патоморфология. В основе патогенеза клинически манифестных форм Clostridium difficile–инфекции – антибиотико–ассоциированной диареи и псевдомембранозного колита – лежит снижение колонизационной резистентности кишечника. Под действием антибиотиков и других повреждающих факторов нарушается интестинальный микробный пейзаж. Значительное угнетение при этом анаэробной части нормальной микрофлоры кишечника сопровождается возникновением благоприятных условий для размножения Clostridium difficile и перехода её в токсинобразующую форму. При этом основными факторами патогенности Clostridium difficile являются токсины А и В, приводящие к повреждению стенки кишечника, в то время как непосредственно сам возбудитель не обладает инвазивными свойствами и не оказывает цитотоксического воздействия на слизистые кишечника [5,7,11,16].
При легких вариантах Clostridium difficile–ассоциированной диареи морфологическая картина характеризуется умеренной гиперемией и незначительным отеком слизистой кишечника, тогда как при тяжелых – отмечаются выраженные воспалительные изменения. При развитии наиболее тяжелой формы заболевания (псевдомембранозный колит) на фоне резко выраженных воспалительно–геморрагических изменений слизистой кишечника обнаруживают небольшие по размеру (чаще – до 2–5 мм, реже – до 20 мм и более в диаметре) возвышающиеся желтоватые бляшки, плотно связанные с подлежащими тканями. Бляшки образованы скоплением фибрина, муцина и клеток, участвующих в воспалении. Сливаясь, бляшки образуют псевдомембраны. В отдельных случаях слизистая может быть покрыта толстым слоем фибринозно–пленчатых наложений на значительном протяжении кишечника. Пленки, при расплавлении, могут отторгаться, обнажая изъязвленную поверхность кишечной стенки [1,2,9,17].
Значительное распространение (более 50%) асимптоматического бактерионосительства Clostridium difficile у новорожденных детей и младенцев и крайне низкая частота развития у них манифестных форм инфекции объясняется, по–видимому, особенностями строения клеточной мембраны кишечного эпителия. Предполагается, что у детей раннего возраста эпителиальные клетки слизистых оболочек кишечника не имеют рецепторов к токсинам Clostridium difficile. Вероятно, что в формировании транзиторной резистентности к данной инфекции имеет значение и наличие у детей первого полугодия жизни материнских антиклостридиальных антител, полученных трансплацентарно [5,6,9].
Clostridium difficile–ассоциированная диарея у детей часто характеризуется клиническими симптомами нетяжелого колита или энтероколита и обычно протекает без лихорадки и интоксикации. При этом возможно появление болей в животе, но чаще болезненность со стороны кишечника выявляется лишь при его пальпации. Отмечается легкое или умеренное учащение дефекации, как правило, не приводящее к выраженным водно–электролитным нарушениям [9,12].
Клинические проявления псевдомембранозного колита у детей обычно развиваются остро и характеризуются отказом от еды, лихорадкой, интоксикацией, диареей, срыгиванием, вздутием и болями в животе спастического характера (абдоминальные колики), болезненной пальпацией живота по ходу толстого кишечника [9,12]. Стул частый, в каловых массах – примесь слизи и крови (реже). Иногда бoльшая часть испражнений представлена густой белесоватой слизью и обрывками фибринозных наложений. В случаях резко выраженного учащения стула развивается эксикоз с нарушениями кровообращения, значительно реже отмечается коллапс без предшествующей диареи. Течение псевдомембранозного колита может осложниться кишечным кровотечением, перфорацией и развитием перитонита [6,9,12]. Поэтому для своевременного выявления этих грозных осложнений за пациентами с тяжелыми формами клостридиоза диффициле должно проводиться совместное наблюдение педиатра и хирурга.
Крайне тяжелые и летальные случаи Clostridium difficile–инфекции в большинстве случаев отмечаются у детей с выраженной нейтропенией на фоне лейкемии, у младенцев с болезнью Гиршпрунга и у пациентов с хроническими воспалительными заболеваниями кишечника (болезнь Крона, неспецифический язвенный колит) [12].
Описаны случаи рецидивирующего течения манифестных форм клостридиоза диффициле, при которых отмена этиотропной терапии или использование антибиотиков в последующие периоды жизни ребенка вновь сопровождались развитием колита. Причинами рецидивов при этом считают такие факторы, как неполная элиминация кишечника от Clostridium difficile и реинфекция [5,12].
Следует еще раз подчеркнуть, что хотя наиболее часто Clostridium difficile–ассоциированная диарея и псевдомембранозный колит возникают у детей, находящихся в стационаре и получающих антибиотики, но могут встречаться и у лиц, уже выписанных из больницы, или развиться спустя 1–2 недели после отмены антибактериальной терапии.
Нельзя забывать и о том, что в редких случаях клостридиоз диффициле возникает без предшествующей госпитализации, а использование антибиотиков в амбулаторных условиях также может сопровождаться развитием заболевания [12,15].
Следует отметить, что для этиологической расшифровки диареи у новорожденных и детей первых месяцев жизни выявление токсинов А и В не имеет диагностического значения. Это связано с транзиторной резистентностью детей данного возраста к токсинам Clostridium difficile, что и определяет минимальный риск развития у них манифестных форм заболевания [9].
При бактерионосительстве Clostridium difficile и легких вариантах антибиотико–ассоциированной диареи гемограмма, как правило, характеризуется нормальными показателями. При манифестных формах инфекции изменения в клиническом анализе крови носят неспецифический характер и характеризуются нейтрофильным лейкоцитозом, сдвигом лейкоцитарной формулы влево, а также ускорением СОЭ [6,9].
Лечение. Асимптоматическое бактерионосительство Clostridium difficile у здоровых детей не требует проведения терапевтических мероприятий.
При развитии манифестных форм инфекции, независимо от степени выраженности клинических проявлений, принципиальным положением является незамедлительная отмена используемых антибиотиков (табл. 1).
Вопрос о необходимости назначения этиотропной терапии в каждом конкретном случае должен решаться индивидуально с учетом возраста ребенка, тяжести заболевания и фоновых состояний. Так, при легких вариантах Clostridium difficile–ассоциированных диарей, развившихся у детей с благополучным преморбидным фоном, назначение этиотропного лечения не требуется. В то же время у детей раннего возраста, ослабленных, у пациентов с нейтропенией, тяжелыми хроническими заболеваниями и пороками развития (особенно ЖКТ) даже при легких формах инфекции назначение антиклостридиальных препаратов считается обоснованным. Абсолютными показаниями для этиотропной терапии являются тяжелые формы заболевания, продолжающаяся после отмены антибиотиков диарея, а также рецидив инфекции на фоне повторного приема антибиотиков (табл. 1).
Метронидазол для лечения Clostridium difficile–инфекции применяется в суточной дозе 30 мг/кг. Суточная доза вводится ребенку в 3–4 приема [12]. При этом метронидазол, в отличие от ванкомицина, может вводиться как перорально, так и парентерально – путем внутривенной инфузии. В тех случаях, когда у ребенка с клостридиозом диффициле выражены тошнота, срыгивания или рвота, стартовая этиотропная терапия должна начинаться с парентерального введения метронидазола. При купировании указанных симптомов и улучшении общего состояния целесообразно заменить внутривенное введение метронидазола на оральный его прием. При приеме внутрь препарат быстро и хорошо всасывается (биодоступность – 80–100%). Связывание с белками крови составляет 20%. При внутривенном введении достигаются высокие концентрации метронидазола во всех тканях организма [18]. Метаболизируясь в печени путем окисления и глюкуронизации, метронидазол экскретируется почками (до 80%) и кишечником (до 15%). Метронидазол замедляет метаболизм непрямых антикоагулянтов, что приводит к усилению их эффекта и может способствовать развитию геморрагических осложнений. Терапевтический эффект метронидазола могут уменьшить индукторы печеночного метаболизма (барбитураты, противосудорожные препараты, рифампицин). В то же время препараты, ингибирующие микросомальные ферменты гепатоцитов (циметидин), снижают метаболизм метронидазола, что может привести к повышению его содержания в организме [18].
Особое внимание необходимо обратить на то, что при пероральном введении этиотропных лекарственных средств недопустимо одновременно применять энтеросорбенты (холестирамин, активированный уголь и др.). Это объясняется возможным уменьшением терапевтического эффекта антибиотиков из–за их связывания с энтеросорбентами в просвете кишечника [6,12]. В целом использование энтеросорбентов может быть оправдано лишь при легких вариантах Clostridium difficile–ассоциированной диареи, когда нет показаний для назначения этиотропных лекарственных средств или в тех случаях тяжело протекающего заболевания, когда метронидазол вводится парентерально.
По показаниям при тяжелых формах клостридиоза диффициле проводится также по–синдромная терапия, направленная на нормализацию выявленных изменений гомеостаза (водно–электролитный дисбаланс, токсикоз, гемодинамические нарушения, геморрагический синдром и др.) [9]. При тяжелых вариантах инфекции обсуждается также возможность применения внутривенных иммуноглобулинов [6]. Обоснованием для этого явилось обнаружение антитоксинов А и В (антитела к экзотоксинам Clostridium difficile) в препаратах нормального человеческого иммуноглобулина для внутривенного введения. При этом В.А. Малов и соавт. (1999) подчеркивают, что включение внутривенных иммуноглобулинов в комплексную терапию тяжелых форм клостридиоза диффициле сопровождалось быстрым прекращением диареи, купированием болей в животе и нормализацией температуры тела.
Особо следует отметить, что при тяжелых формах Clostridium difficile–ассоциированной диареи и псевдомембранозном колите нельзя использовать препараты, уменьшающие моторику кишечника [12, 18].
После отмены антимикробных препаратов детям, перенесшим Clostridium difficile–инфекцию, для полной санации кишечника от спор возбудителя целесообразно провести курсовое лечение пробиотиками (бифидимбактерин и др.) [2,6,9].
Профилактика клостридиоза диффициле заключается в строгом соблюдении правил личной гигиены, а также в неукоснительном выполнении всех требований по соблюдению санитарно–противоэпидемического режима лечебных учреждений. Нельзя также недооценивать и такой фактор в профилактике Clostridium difficile–инфекции, как уменьшение частоты бесконтрольного и необоснованного использования антибиотиков. Таким образом, основными резервами снижения заболеваемости у детей клостридиозом диффициле являются улучшение санитарной культуры населения в целом и повышение профессионализма медицинских работников.
1. Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. – М.: Триада–Х, 1998.
3. Клостридиозы. // Профилактика внутрибольничных инфекций. Руководство для врачей под ред. проф. Е.П.Ковалевой, проф. Н.А.Семиной. – М.: Рарогъ, 1993. – С. 55–59.
4. Ковалева Е.П., Семина Н.А., Семененко Т.А., Галкин В.В. Справочник госпитального эпидемиолога. – М.: Хризостом, 1999. – С. 136–139.
5. Малов В.А., Бондаренко В.М., Пак С.Г. Роль Clostridium difficile в патологии человека.//Журн.микробиол.–1996.–№1.–С.91–96.
6. Малов В. А., Пак С. Г., Беликов Д. В.// Лечащий врач. 1999. – 2–3.
7. Медицинская микробиология./ Под ред. В.И.Покровского, О.К.Поздеева. – М: ГЭОТАР МЕДИЦИНА, 1999.
8. Планельес Х.Х., Харитонова А.М. Побочные явления при антибиотикотерапии бактериальных инфекций. – М.: Медицина, 1976. – 430.
9. Учайкин В.Ф. Руководство по инфекционным заболеваниям у детей. – М.: Гэотар Медицина, 1998. – С. 492–494.
10. Фэкети Р. (Fekety R.), Дюпон Х.Л. (DuPont H.L.), Куперсток М. (Cooperstok M.) и др. Лечение колита, связанного с приемом антибиотиков. // Европейское руководство по клинической оценке противоинфекционных лекарственных средств/ Под ред. Т.Р.Бим (T.R.Beam) – Пер. с англ. под ред. академика РАМН А.Г.Чучалина и проф. Л.С.Страчунского. – Смоленск: Амипресс, 1996. – С. 302–306.
11. Bartlett J.G. Antibiotic–associated pseudomembranous colitis due to toxin producing clostridia. //N. Engl.J.Med. – 1978. – Vol.298. – P.531.
12. Clostridium difficile. // In Red Book: 2000. Report of the Committee on Infection Diseases. 25rd: American Academy of Pediatrics, 2000, P. 214–216.
13. Larson H.E., Prise A.B., Honour P. et al. Pseudomembranous colitis: present of clostridial toxin. // Lancet. – 1977. – P. 1312–1314.
14. Larson H.E., Prise A.B., Honour P. et al. Clostridium difficile and etiology pseudomembranous colitis. // Lancet. – 1978. – №1. – P. 1063–1066.
15. Mitchell D.K., Van R., Mason E.H. at al. Prospective study of toxigenic Clostridium difficilе children given amoxicillin/clavulanate for otitis media. // Pediatr. Inf. Dis. J. – 1996. – 15. – P. 514–519.
16. Mitchell T.J., Ketley J.M., Haslam S.C. et al. Effect of toxin A and B of Clostridium difficile on rabbit ileum and collon. // Gut. – 1986. – 27. – P. 78–85.
17. Prise A.B., Davies D.R.D. Pseudomembranous colitis. // J. Clin. Pathol. – 1977. –30. – P. 1–12.
18. The Pharmacological Basis of Therapeutics – Goodman &. Gilman’s. – 8th Ed.
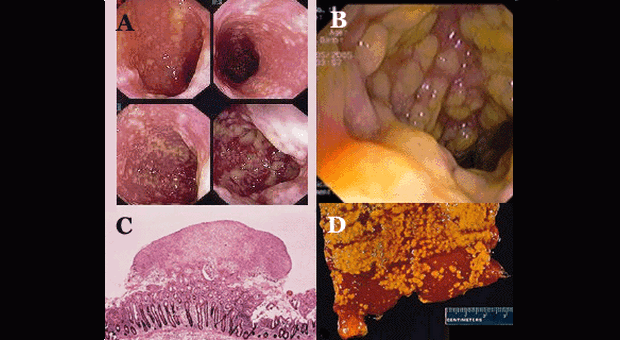
Этиология и патогенез
Clostridium difficile это спорообразующий, анаэробный микроорганизм впервые описанный в 1935 году [7]. Однако роль токсинов Clostridium difficile в развитии псевдомембранозного колита была установлена только к 1978 году [6]. Микроорганизм далеко не всегда вызывает развитие заболевания (т.к. существуют штаммы, не продуцирующие токсины), а его тяжесть может варьировать от легкой диареи, без признаков колита, до угрожающих жизни состояний.
Патогенез заболевания включает следующие этапы:
- нарушение нормальной микрофлоры толстой кишки (в норме стул содержит более 500 различных бактерий в концентрации 10 в 12 степени в одном грамме);
- колонизация толстой кишки продуцирующими токсин штаммами Clostridium difficile;
- выработка токсинов (А и В);
- воспаление и повреждение слизистой оболочки толстой кишки (до некроза эпителия и образования мембран в тяжелых случаях).
Чаще всего к развитию заболевания приводит применение клиндамицина, линкамицина, цефалоспоринов и защищенных пенициллинов [3]. Кроме недавнего (обычно не позднее 2 месяцев) применения антибиотиков риск развития инфекции повышен у лиц старше 60 лет, стационарных больных, пациентов с ослабленным иммунитетом, почечной недостаточностью, онкологическими заболеваниями и у лиц получающих антисекреторную терапию.
Симптомы и клинические рекомендации
К типичным симптомам данной патологии относятся диарея (стул водянистый, небольшого объема, от 4 до 20 раз в сутки, без примесей крови), схваткообразная боль в животе, а также слабость, анорексия и тошнота. Не специфическими, хотя и весьма характерными для инфекции Clostridium difficile признаками являются лейкоцитоз (до 15х109/л, а иногда и выше), гипоальбуминемия и лейкоциты в кале.
При заболевании легкой степени развивается водянистая диарея, не сопровождающаяся системными симптомами и явлениями колита при эндоскопическом обследовании.
При средней степени тяжести кроме диареи беспокоят схваткообразные боли в животе, вздутие живота, наблюдается умеренная дегидратация, тахикардия до 100 ударов в минуту, умеренный лейкоцитоз с нейтрофильным сдвигом, умеренное снижение артериального давления. При эндоскопии можно часто наблюдать характерную для псевдомембранозного колита картину.
При тяжелом течении на первое место выходят системные проявления – спутанное сознание, лихорадка, тахикардия больше 100 ударов в минуту, падение давления ниже 100 мм рт. ст., вентиляционные нарушения, высокий лейкоцитоз (до лейкемойдной реакции), развиваться токсическая делатация толстой кишки, ее перфорация, перитонит. У пациентов с таким вариантом заболевания диарея можем отсутствовать, в результате токсической дилатации толстой кишки [10].
Существует иммуноферментный метод определения токсина А и/или В в стуле. Результат исследования становиться известным в течение нескольких часов, но его чувствительность (65-85 %) и специфичность (95-100 %) ниже [2, 16]. Данный тест требует присутствия большего количества токсина для получения положительного результата (100-1000 pg) [3]. Несмотря на это, данную методику рассматривают как диагностический тест выбора у лиц с частотой стула более 6 раз в день [8]. У 5-20 % больных необходимо не однократное исследование стула для выявления токсина [14].
Получение культуры Clostridium difficile в анаэробных условиях для диагностики используется редко, во первых потому, что это занимает несколько дней, а во вторых не позволяет различить патогенные и не патогенные штаммы. Получение культуры с оценкой ее токсигенности позволяет избежать этой проблемы, но методика весьма трудоемка и занимает несколько суток.
Другие диагностические тесты включают реакцию латексной аглютенации (на клостридиальный белок глутамат дегидрогеназу, но она имеет относительно низкую чувствительность и специфичность) и определение токсинов путем полимеразной цепной реакции (находиться в процессе стандартизации).
Как проводится лечение псевдомембранозного колита
Одним из важнейших этапов лечения является отмена антибиотика вызвавшего заболевание (если это возможно). При легкой степени инфекции этого бывает достаточно для выздоровления [5]. При необходимости продолжения антибиотикотерапии лучше использовать препараты реже вызывающие развитие клостридиальной инфекции: аминогликозиды, сульфаниламиды, макролиды, тетрациклин и фторхинолоны.
В случае более тяжелого течения данной патологии необходимо назначение препаратов направленных на подавления Clostridium difficile. В качестве лечения выбора рассматривается Метронидазол 250 мг 4 раза в сутки или 500 мг 3 раза [15]. Ванкомицин (125 мг 4 раза в сутки) применяется при непереносимости метронидазола или его неэффективности [13]. Эффективность обеих препаратов сходна [17,18]. В обоих случаях длительность терапии 10-14 дней (улучшение состояние должно наступить в течение 72 часов). Если пациент продолжает лечение другими антибиотиками то метронидазол (ванкомицин) должен применяться весь период лечения и неделю после его прекращения [13]. Ванкомицин практически не всасывается и, следовательно, дает меньше побочных эффектов, но значительно дороже метронидазола.
Антиперистальтические агенты категорически противопоказаны. В качестве адсорбента рекомендуется холестирамин [12], но т.к. в России он отсутствует, мы с успехом вместо него используем смекту (в стандартных дозах). У пациентов с тяжелым колитом, которые не могут принимать препараты перорально, применяется метронидазол внутривенно, он выделяется в желчь и достигает достаточно высокой концентрации в просвете ЖКТ, но не ванкомицин т.к. при парентеральном введении последний в просвет ЖКТ практически не экскретируется. Впрочем, можно вводить ванкомицин (парентеральная форма) через назогастральный зонд или непосредственно в толстую кишку [13]. Не следует забывать о полноценной регидратации (пероральной или инфузионной) и коррекции электролитных нарушений.
В 10-20 % случаев при прекращении лечения возникает рецидив заболевания [19]. Он проявляется повторным возникновением симптомов через 3-21 день после прекращения применения метронидазола или ванкомицина. В таких случаях показана повторная терапия метронидазолом или ванкомицином, разумным является добавления лактобактерий и пробиотиков (хотя их эффективность не доказана).
У 0.4 %- 3,6 % пациентов требуется хирургическое лечение [13]. Наиболее частыми показаниями к операции является перитонит и токсическая дилатация толстой кишки с высоким риском перфорации. Операцией выбора является субтотальная колэктомия, но уровень летальности при ее выполнении достигает 57 % [4].
В заключение приведем схему лечения применяемую нами:
- Отмена антибиотиков (если возможно) или замена их на относительно безопасные (аминогликозиды, макролиды, фторхинолоны).
- Отмена всех антиперистальтических агентов и опиойдных анальгетиков.
- Смекта (стандартная дозировка).
- Линекс или хилак-форте (стандартная дозировка).
- Метронидазол 250 мг 4 раза в день (при системных проявлениях, частоте стула более 4 в сутки или необходимости продолжать антибиотикотерапию).
- Ванкомицин 125 мг 4 раза в сутки (при непереносимости, неэффективности метронидазола или при тяжелой инфекции).
- Метронидазол внутривенно (ванкомицин через назогастральный зонд) при невозможности самостоятельного приема препаратов.
- Коррекция водно-электролитных нарушений.
Полный текст:
1. Рациональная фармакотерапия заболеваний органов пищеварения / Под ред. В.Т. Ивашкина. М.: Литтерра, 2011; 522-6
2. Корнеева О.Н., Ивашкин В.Т. Антибиотикоассоциированный колит: патоморфология, клиника, лечение. Рос журн гастроэнтерол гепатол колопроктол 2007; 17(3):65-70
3. Goudarzi M., Seyedjavadi S.S., Goudarzi H., Mehdizadeh Aghdam E., Nazeri S. Clostridium difficile infection: Epidemiology, pathogenesis, risk factors, and therapeutic options. Scientifica 2014; 2014:916826.
4. Culligan E.P., Sleator R.D. Advances in the microbiome: Applications to Clostridium difficile infection. Article ID 916826. J Clin Med 2016; 5(9).
5. Ивашкин В.Т., Шифрин О.С., Тертычный А.С., Полуэктова Е.А., Лапина Т.Л., Ляшенко О.С., Ивашкин К.В. Clostridium difficile-ассоциированная болезнь Рос журн гастроэнтерол гепатол колопроктол 2015; 25(6):5-17.
6. Шептулин А.А. Рефрактерные и рецидивирующие формы колита, ассоциированного с Clostridium difficile. Рос журн гастроэнтерол гепатол колопроктол 2011; 21(2):50-3
7. Lessa F.C., Gould C.V., McDonald L.C. Current status of Clostridium difficile infection epidemiology. Clin Infect Dis 2012; 55:65-70.
8. DePestel D., Aronoff D.M. Epidemiology of Clostridium difficile infection. J Pharm Pract 2013; 26(5):464-75.
9. Redelings M.D., Sorvillo F., Mascola L. Increase in Clostridium difficile-related mortality rates, United States 1999-2004. Emerg Infect Dis 2007; 13:1417-9.
10. Lessa F.C., Mu Y., Bamberg W.M., Beldavs Z.G., Dumyati G.K., Dunn J.R., Farley M.M., Holzbauer S.M., Meek J.I., Phipps E.C., et al. Burden of Clostridium difficile infection in the united states. N Engl J Med 2015; 372:825-34.
11. Davies K.A., Longshaw C.M., Davis G.L., Bouza E., et al. Underdiagnosis of Clostridium difficile across Europe: the European, multicentre, prospective, biannual, pointprevalence study of Clostridium difficile infection in hospitalised patients with diarrhoea (EUCLID). Lancet Infect Dis 2014; 14(12):1208-19.
12. Gupta A., Khanna S. Community-acquired Clostridium difficile infection: an increasing public health threat. Infect Drug Resist 2014; 7:63-72.
13. Захарова Н.В., Филь Т.С. Микробиологические и клинические особенности инфекции Clostridium difficile. Инфекционные болезни 2015; 13(3):81-6.
14. Furuya-Kanamori L., Marquess J., Yakob L., et al. Asymptomatic Clostridium difficile colonization: epidemiology and clinical implications BMC Infect Dis 2015; 15:516.
15. Surawicz С.M., Brandt L.J., Binion D.G., Ananthakrishnan A.N., Curry S.R., Gilligan P.H., McFarland L.V., Mellow M., Zuckerbraun B.S. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections Am J Gastroenterol 2013; 108(4):478-98.
16. Paredes-Sabja D., Shen A., Sorg J.A. Clostridium difficile spore biology: sporulation, germination, and spore structural proteins. Trends Microbiol 2014; 22:406-416.
17. Britton R.A., Young V.B. Role of the intestinal microbiota in resistance to colonization by Clostridium difficile. Gastroenterology 2014; 146:1547-53.
18. Sarker M.R., Paredes-Sabja D. Molecular basis of early stages of Clostridium difficile infection: germination and colonization. Future Microbiol 2002; 7:933-43.
19. Sun X., Savidge T., Feng H. The enterotoxicity of Clostridium difficile toxins. Toxins (Basel) 2010; 2(7):1848-80.
20. Warny M., Pepin J., Fang A., Killgore G., Thompson A., Brazier J., Frost E., McDonald L.C. Toxin production by an emerging strain of Clostridium difficile associated with outbreaks of severe disease in North America and Europe. Lancet 2005; 366(9491):1079-84.
21. McDonald L.C., Killgore G.E., Thompson A., Owens R.C.Jr., Kazakova S.V., Sambol S.P., Johnson S., Gerding D.N. An epidemic, toxin gene-variant strain of Clostridium difficile. N Engl J Med 2005; 353(23):243341.
22. Geric B., Rupnik M., Gerding D.N., Grabnar M., Johnson S. Distribution of Clostridium difficile variant toxinotypes and strains with binary toxin genes among clinical isolates in an American hospital. J Med Microbiol 2004; 53(Pt 9):887-94.
23. Sartelli M., Malangoni M.A., Abu-Zidan F.M., Griffiths E.A., di Bella S., et al. WSES guidelines for management of Clostridium difficile infection in surgical patients World J Emerg Surg 2015; 10:38.
25. Hensgens M.P., Goorhuis A., Dekkers O.M., Kuijper E.J. Time interval of increased risk for Clostridium difficile infection after exposure to antibiotics. J Antimicrob Chemother 2012; 67:742-8.
26. Spigaglia P. Recent advances in the understanding of antibiotic resistance in Clostridium difficile infection Ther Adv Infect Dis 2016; 3(1):23-42.
27. Keller J.M., Surawicz C.M. Clostridium difficile infection in eldery. Clin Geriatr Med 2014; 30:79-93.
28. Vecchio A.L., Zacur G.M. Clostridium difficile infection: an update on epidemiology, risk factors, and therapeutic options. Curr Opin Gastroenterol 2012; 28:1-9.
29. Furuya-Kanamori L., Stone J.C., Clark J., McKenzie S.J., Yakob L., Paterson D.L., et al. Comorbidities, exposure to medications, and the risk of community-acquired Clostridium difficile infection: A systematic review and meta-analysis. Infect Control Hosp Epidemiol 2015; 36(2):132-41.
30. Haines C.F., Moore R.D., Bartlett J.G., Sears C.L., Cosgrove S.E., Carroll K., et al. Clostridium difficile in a HIV-infected cohort: incidence, risk factors, and clinical outcomes. AIDS2013; 27(17):2799-807.
31. Rodemann J.F., Dubberke E.R., Reske K.A., et al. Incidence of Clostridium difficile infection in inflammatory bowel disease. Clin Gastroenterol Hepatol 2007; 5:339-44.
32. Ивашкин В.Т., Шелыгин Ю.А., Абдулганиева Д.И., Абдулхак Р.А., Алексеева О.П., Ачкасов С.И., Барановский А.Ю., Белоусова Е.А., Головенко О.В., Григорьев Е.Г., Костенко Н.В., Лапина Т.Л., Маев И.В., Москалев А.И., Низов А.И., Николаева Н.Н., Осипенко М.Ф., Павленко В.В., Парфенов А.И., Полуэктова Е.А., Румянцев В.Г., Тимербулатов В.М., Тертычный А.С., Ткачев А.В., Трухманов А.С., Халиф И.Л., Хубезов Д.А., Чашкова Е.Ю., Шифрин О.С., Щукина О.Б. Рекомендации Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению взрослых больных язвенным колитом. Рос журн гастроэнтерол гепатол колопроктол 2015; 25(1):48-65.
34. Thibault R., Graf S., Clerc A., Delieuvin N., Heidegger C.P., Pichard C. Diarrhoea in the ICU: respective contribution of feeding and antibiotics. Crit Care 2013; 17(4):153.
35. Bavishi C., DuPont H.L. Systematic review: the use of proton pump inhibitors and increased susceptibility to enteric infection. Aliment Pharmacol Ther 2011; 34:1269-81.
36. Deshpande A., Pant C., Pasupuleti V., et al. Association between proton pump inhibitor therapy and Clostridium difficile infection in a meta-analysis. Clin Gastroenterol Hepatol 2012; 10:225-33.
37. Stevens V., Dumyati G., Brown J., Wijngaarden E. Differential risk of Clostridium difficile infection with proton pump inhibitor use by level of antibiotic exposure. Pharmacoepidemiol Drug Saf 2011; 20:1035-42.
38. Tleyjeh I.M., Bin Abdulhak A.A., Riaz M., et al. Association between proton pump inhibitor therapy and Clostridium difficile infection: a contemporary systematic review and meta-analysis. PLoS ONE2012; 7(12):e50836.
39. Albright J.B., Bonatti H., Mendez J., Kramer D., Stauffer J., Hinder R., et al. Early and late onset Clostridium difficile-associated colitis following liver transplantation. Transpl Int 2007; 20(10):856-66.
40. Chopra T., Alangaden G.J., Chandrasekar P. Clostridium difficile infection in cancer patients and hematopoietic stem cell transplant recipients. Expert Rev Anti Infect Ther 2010; 8(10):1113-9.
41. Rodríguez Garzotto A., Mérida García A., Muñoz Unceta N., Galera Lopez M.M., Orellana-Miguel M.A., Díaz-García C.V., et al. Risk factors associated with Clostridium difficile infection in adult oncology patients. Support Care Cancer 2015; 23(6):1569-77.
42. Debast S.B., Bauer M.P., Kuijper E.J. on behalf of the Committee. European society of clinical microbiology and infectious diseases: Update of the treatment guidance document for Clostridium difficile infection. Clin Microbiol Infect 2014; 20 (Suppl. 2):1-26.
43. Abou Chakra C.N., Pepin J., Valiquette L. Prediction tools for unfavourable outcomes in Clostridium difficile infection: a systematic review. PLoS ONE2012; 7:e30258.
44. Kociolek L.K., Gerding D.N. Clinical utility of laboratory detection of Clostridium difficile strain BI/ NAP1/027. J Clin Microbiol 2016; 54(1):19-24.
45. Vardakas K.Z., Konstantelias A.A., Loizidis G., Rafailidis P.I., Falagas M.E. Risk factors for development of Clostridium difficile infection due to BI/NAP1/027 strain: a meta-analysis. Int J Infect Dis 2012; 16(11):768-73.
46. Eyre D.W., Walker A.S., Wyllie D., Dingle K.E., Griffiths D., Finney J., et al. Predictors of first recurrence of Clostridium difficile infection: Implications for initial management. Clin Infect Dis 2012; 55(Suppl. 2):77-87.
47. Hu M.Y., Katchar K., Kyne L., Maroo S., Tummala S., Dreisbach V., et al. Prospective derivation and validation of a clinical prediction rule for recurrent Clostiridium difficle infection. Gastroenterology 2009; 136:1206-14.
48. Kelly J.P. Can we identify patients at high risk of recurrent Clostridium difficile infection? Clin Microbiol Infect 2012; 18(Suppl. 6):21-7.
49. Fekety R., McFarland L.V., Surawicz C.M., Greenberg R.N., Elmer G.W., Mulligan M.E. Recurrent Clostridium difficile diarrhea: Characteristics of and the risk factors for patients enrolled in a prospective, randomized, double-blinded trial. Clin Infect Dis 1997; 24(3):324-33.
50. Samie A.A., Traub M., Bachmann K., Kopischke K., Theilmann L. Risk factors for recurrence of Clostridium difficile-associated diarrhea. Hepatogastroenterology. 2013; 60(126):1351-4.
51. Planche T., Aghaizu A., Holliman R., et al. Diagnosis of Clostridium difficile infection by toxin detection kits: A systematic review. Lancet Infect Dis 2008; 8:777-84.
52. Crobach M.J.T., Planche T., Eckert C., Barbut F., et al.
53. European society of clinical microbiology and infectious diseases: Update of the diagnostic guidance document for Clostridium difficile infection. Clin Microbiol Infect 2016; 22:63-81.
54. Luo R.F., Banaei N. Is repeat PCR needed for diagnosis of Clostridium difficile infection? J Clin Microbiol 2010; 48:3738-41.
55. Cerilli L.A., Greenson J.K. The differential diagnosis of colitis in endoscopic biopsy specimens: a review article. Arch Pathol Lab Med 2012; 136:854-64.
56. Cohen S.H., Gerding D.N., Johnson S., Kelly C.P., Loo V.G., McDonald L.C., et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the society for healthcare epidemiology of America (SHEA) and the infectious diseases society of America (IDSA). Infect Control Hosp Epidemiol 2010; 31(5):431-55.
57. Dinh A., Bouchand F., le Monnier A. Current treatment and epidemiology of Clostridium difficile infections. Rev Med Interne 2015; 36(9):596-602.
58. Hempel S., Newberry S.J., Maher A.R., et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA 2012; 307:1959-69.
59. Johnston B.C., Ma S.S.Y., Goldenberg J.Z., et al. Probiotics for the prevention of Clostridium difficile associated diarrhea. Ann Intern Med 2012; 157:878-88.
60. Шрайнер Е.В., Курилович С.А., Осипенко М.Ф., Власов В.В. Трансплантация кишечной микробиоты: терапевтический потенциал при болезнях органов пищеварения Рос журн гастроэнтерол гепатол колопроктол 2014;24(5):63-8.
61. Chapman B.C., Moore H.B., Overbey D.M., Morton A.P. Fecal microbiota transplant in patients with Clostridium difficile infection: A systematic review. J Trauma Acute Care Surg 2016; 81(4):756-64.
62. Lofmark S., Edlund C., Nord C.E. Metronidazole is still the drug of choice for treatment of anaerobic infections. Clin Infect Dis 2010; 50 (suppl 1):16-23.
63. Aradhyula S., Manian F.A., Hafidh S.A.S., Bhutto S.S., Alpert M.A. Significant absorption of oral vancomycin in a patient with Clostridium difficile colitis and normal renal function. South Med J 2006; 99:518-20.
64. Martirosian G., Rouyan G., Zalewski T., MeiselMikołajczyk F. Dioctahedral smectite neutralization activity of Clostridium difficile and Bacteroides fragilis toxins in vitro. Acta Microbiol Pol 1998; 47(2):177-83.
65. McFarland L.V., Elmer G.W., Surawicz C.M. Breaking the cycle: treatment strategies for 163 cases of recurrent Clostridium difficile disease. Am J Gastroenterol 2002; 97:1769-75.

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 License.
Читайте также:


