Лазерная остеоперфорация в лечении остеомиелита
Остеомиелит – инфекционно-воспалительный процесс поражающий участок костного мозга, а затем элементы костной ткани одной или нескольких костей. Это грозное заболевание развивается часто после открытых переломов трубчатых костей, оперативного лечения закрытых переломов костей, огнестрельных переломов.
Наиболее часто встречающимися формами остеомиелита являются – гематогенный и посттравматический.
Гематогенный остеомиелит развивается чаще в длинных костях (бедренная, берцовые, плечевая). Возбудители инфекции оседают в мелких ветвях артерий костей, где кровоток несколько замедлен. Иногда этому может способствовать незначительная травма и связанный с этим отек. По течению болезни различают острый и хронический (развившийся из острого) остеомиелит.
Посттравматический остеомиелит развивается после открытых переломов. Основной причиной заболевания являются обширные разрушения мягких тканей и нарушение кровоснабжения кости с развитием очагов некроза и нагноения.
По данным Всемирной Организации Здравоохранения (1999) остеомиелит составляет до 7% в общей структуре заболеваний органов опоры и движения. В 10% случаев перенесенный острый гематогенный остеомиелит приводит к нарушению функции суставов, поражению всех анатомических образований сустава, нередко с общей интоксикации организма с развитием сепсиса.
У 25% пациентов, перенесших острый гематогенный остеомиелит, процесс переходит в хроническое течение, часто приводящее к инвалидизации, нарушению обмена веществ, функции печени, почек. До сих пор остается высокой (до 9%) летальность.
Лечение остеомиелита представляет трудную задачу. Традиционными методами лечения являются:
- хирургическое (удаление нежизнеспособных участков кости);
- механическая остеоперфорация (в очаге поражения производится разрез мягких тканей и наносятся дрелью 5-7 отверстий в кости для декомпрессии костномозгового канала с последующим приточно-вакуумным дренированием параоссальных пространств);
- введение в костномозговой канал антибиотиков широкого спектра действия;
- чрескостное промывание остеомиелитического очага растворами антисептиков.
Существенными недостатками этих методов являются:
- высокая частота перехода заболевания в хронические формы;
- высокая травматичность;
- высокая частота повторного инфицирования кости;
- появление грубых косметических и функциональных дефектов.
Сотрудниками Центра разработан и внедрен в клиническую практику новый малотравматичный метод лечения различных форм остеомиелита с применением высокоинтенсивного лазера. Метод отличается от известных на сегодняшний день малой травматичностью, хорошей переносимостью больными, способностью в короткие сроки купировать воспалительный процесс в тканях.
Метод лазерной остеоперфорации является наиболее щадящим методом, не требующий серьезного хирургического вмешательства. С помощью излучения лазера высокой оптической мощности, транспортируемого через тонкий кварцевый световод со специальным термостойким покрытием, в костной ткани в зоне воспаления перфорируется несколько отверстий. Не вынимая световода, производится термотерапия костномозгового канала на пониженной мощности. Никаких дополнительных разрезов, дренирования мягких тканей и костно-мозгового канала не производится.
При используемых режимах лазерного излучения не происходит глубоких термических поражений мягких тканей и костей.
Схема лазерной остеоперфорации при остеомиелите
Динамические бактериологические исследования показали быструю санацию гнойного очага и снижение числа высеваемых микроорганизмов ниже критического уровня. У всех больных в результате проведенного лечения отмечен быстрый и стойкий положительный эффект. При остром гематогенном остеомиелите достигнуто полное выздоровление и отсутствие перехода в хроническую стадию; при хроническом остеомиелите более чем в 90% случаев получена стойкая ремиссия, больные в сроки до 2.5-4 лет чувствуют себя хорошо, не отмечено ни рецидивов заболеваний, ни обострения процесса. Гнойные свищи почти у всех пациентов закрылись самостоятельно. У двух больных, имеющих крупные секвестры и обширное поражение костей, не удалось ликвидировать гнойный процесс, но предпринятое лечение значительно улучшило их состояние, снизило интоксикацию, что позволило подготовиться к операции и успешно удалить костные секвестры. Необходимо отметить, что лечение остеомиелита методом лазерной остеоперфорации не требует применения антибиотиков.
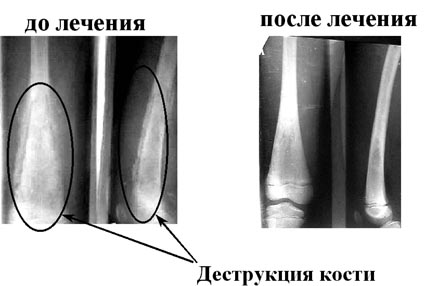
Результаты лечения острого гематогенного остеомиелита
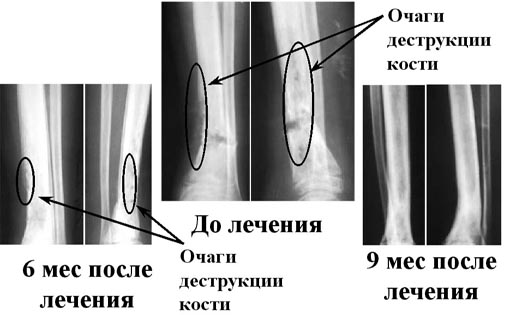
Результаты лечения хронического гематогенного остеомиелита
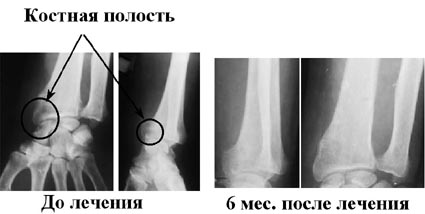
Результаты лечения хронического посттравматического остеомиелита
Применение антибиотиков значительно улучшило исходы консервативного лечения острого остеомиелита и уменьшило потребность в операциях.
При остром остеомиелите проводят консервативные и оперативные мероприятия. Из консервативных методов на первом месте находятся антибактериальная терапия и создание покоя для конечности (иммобилизация с помощью гипсовой лонгеты или вытяжения).
Из антибиотиков используют линкомицин, цефалоспорины, фторхинолоны, что обычно приводит к резкому улучшению состояния больного, понижению температуры, уменьшению интоксикации и быстрому выздоровлению. Если лечение антибиотиками начато рано, воспалительный процесс в костном мозге удается ликвидировать; нарушенная при воспалении структура кости постепенно восстанавливается.
При скоплении гноя под надкостницей производят пункцию и удаляют гной. Бактериологическое исследование гноя позволяет провести коррекцию антибиотикотерапии. Непосредственно в костный очаге помощью иглы капельно вводят линкомицин, полусинтетические пенициллины на 300-500 мл 0,25 % раствора новокаина.
Операция показана при запущенных процессах с развитием флегмоны и при неэффективности консервативного лечения. При лечении острого остеомиелита применяют вскрытие параоссальных флегмон, субпериостальных абсцессов, остеоперфорации, закрытые микроостеоперфорации.
Параоссальные флегмоны, субпериостальные абсцессы вскрывают по общим правилам с учетом локализации процесса, анатомических особенностей органа, фасциально-клетчаточных пространств.
Показаниями к декомпрессионной остеоперфорации при остром гематогенном остеомиелите служат отсутствие заметного улучшения при консервативном лечении в течение 48—72 ч; нарастание отека мягких тканей, присоединение и прогрессирование артрита, усиление локальной болезненности. Операцию выполняют под общим обезболиванием, местной инфильтрационной или внутривенной анестезией. Раствор анестетика вводят в комбинации с антибиотиками.
Разрез производят в месте наибольшей болезненности или в области инфильтрата. Рассекают кожу, подкожную клетчатку, фасцию, по межмышечному фасциальному промежутку или через мышцу, расслаивая ее волокна, проникают до кости. Электродрелью делают несколько отверстий диаметром 2-3 мм на расстоянии 1,5-2 см друг от друга. Перфорировать кость можно костным трепаном, толстой костной иглой с мандреном, шилом. Удобна игла Кассирского для пункции костей. Полученный пунктат направляют на бактериологическое исследование, костномозговой канал промывают раствором антисептика. В перфорационные отверстия можно вставить тонкие дренажные трубки для введения антисептиков.
При воспалительной инфильтрации тканей или параоссальной субпериостальной флегмоне рану оставляют открытой, вводят тампоны, смоченные растворами протеолитических ферментов. Если операция произведена в ранние сроки, когда воспалительный процесс не распространился за пределы костномозгового канала, то к месту остеоперфорационных отверстий подводят дренажную трубку и рану ушивают до места выхода дренажа.
В начальном периоде острого гематогенного остеомиелита у детей декомпрессии костномозгового канала можно достигнуть при помощи закрытой микроостеоперфорации с использованием костных игл с мандреном и рукояткой. Можно применять иглы с резьбой. Иглы должны иметь несколько боковых отверстий. Хорошая фиксация иглы в кости достигается ее проведением через костномозговой канал к противоположной кортикальной пластинке и фиксацией конца иглы в ней. Вводят несколько таких игл в местах наибольшей болезненности кости.
Хороший результат получают и тогда, когда иглы вводят в костномозговой канал вне очага воспаления костного мозга, что можно объяснить созданием декомпрессии, предупреждающей некроз костного мозга. Через введенные иглы берут кровь или гной для бактериологического исследования, а в послеоперационном периоде в костномозговой канал вводят антисептики с учетом чувствительности микробной флоры.
Эффективна активная аспирация гнойного отделяемого из костномозговой полости. Через дренажные трубки можно проводить и длительное капельное промывание гнойной полости раствором антисептиков (хлоргексидина, диоксидина, фурагина калия). Местную антибактериальную терапию сочетают с общей антибиотикотерапией, которую корригируют по антибиотикограмме.
Нельзя сводить лечение хронического остеомиелита к секвестрэктомии и пластике костной полости. Нельзя забывать, что хронический остеомиелит — это один из видов гнойной хирургической инфекции со сложными взаимодействиями макроорганизма с патогенной микрофлорой. Локальные гнойно-некротические процессы в кости происходят на фоне общих изменений с проявлениями гнойного воспаления и интоксикации, угнетением иммунобиологических защитных сил и др.
Патогенетически обоснованное лечение хронического остеомиелита должно обеспечить ликвидацию очага гнойно-деструктивного процесса в костной ткани. Для достижения этой цели необходимо сочетание радикального хирургического вмешательства с рациональной, целенаправленной антимикробной и иммунной терапией.
Показания к радикальному хирургическому вмешательству при хроническом остеомиелите: секвестр, остеомиелитическая костная полость, свищ, язва; повторяющиеся рецидивы заболевания с болевым синдромом и нарушением функции опорно-двигательного аппарата; патологические изменения в паренхиматозных органах, вызванные хронической гнойной интоксикацией, малигнизация тканей и др.
При определении показаний к хирургическому лечению больных хроническим остеомиелитом необходимо выбрать оптимальный вариант санации остеомиелитического очага и метод пластического замещения дефекта кости и мягких тканей; определить отношение к металлоконструкции при травматическом остеомиелите, наметить мероприятия по предупреждению послеоперационных осложнений.
Противопоказаниями к радикальному оперативному лечению хронического остеомиелита служат преимущественно декомпенсация функции почек, сердечно-сосудистой и дыхательной систем. До настоящего времени радикальная операция остается одним из основных лечебных мероприятий при хроническом остеомиелите. Только выполнив радикальное хирургическое вмешательство, можно рассчитывать на излечение или длительную ремиссию.
Лечение травматического остеомиелита осуществляется так же, как и гематогенного. В большинстве случаев показано хирургическое вмешательство, при котором удаляют секвестры, некротизированные костные осколки, гнойные грануляции, иссекают свищи. Поспешное удаление металлических конструкций при осложнении перелома остеомиелитом не всегда приводит к улучшению состояния больного, а иногда даже вызывает ухудшение. Удаление металлоконструкции необходимо тогда, когда она не обеспечивает иммобилизации (при интрамедуллярном остеосинтезе) или кость поражается на большом протяжении по ходу конструкции.
Изучение ближайших и отдаленных результатов подтверждает преимущества радикального хирургического пособия перед консервативным лечением остеомиелита, так как никакая антимикробная терапия даже с применением новейших и эффективных антибиотиков не способна ликвидировать гнойный очаг в кости, пока в ней остаются лишенные кровоснабжения инфицированные секвестры и полости с гнойным детритом. Антибиотикотерапия в лучшем случае может привести к стиханию перифокального воспаления, т.е. к очередной нестойкой и обычно непродолжительной ремиссии.
Хирургическое лечение хронического остеомиелита предусматривает:
• подготовку к операции;
• адекватный хирургический доступ;
• некрэктомию с использованием механических, химических и физических средств;
• адекватную интраоперационную санацию костной полости и мягких тканей;
• заполнение костного дефекта, пролонгированную санацию костной полости в послеоперационном периоде;
• пластическое закрытие дефекта мягких тканей;
• целенаправленную антибактериальную терапию после операции.
Предоперационная подготовка
Целью предоперационной подготовки больных хроническим остеомиелитом является предупреждение возможных осложнений во время и после операции. Она рассчитана на 11-12 дней и включает воздействие на местный очаг инфекции, активацию специфической и неспецифической иммунной реактивности организма, инфузионную терапию, физиотерапевтическое лечение.
Предоперационная подготовка больных хроническим остеомиелитом включает ряд лечебных мероприятий, направленных на уменьшение воспалительных изменений в зоне остеомиелитического поражения (промывание свища, полостей антисептическими растворами, протеолитическими ферментами, физиотерапия и др.), на санацию кожных покровов в области предстоящего операционного поля, на активацию иммунных реакций организма специфическими и неспецифическими методами, на санацию обнаруженных других гнойных очагов и дезинтоксикацию организма, на улучшение функционирования жизненно важных органов и систем.
Санацию гнойных очагов при хроническом остеомиелите (свищи, гнойные затеки, внутрикостные полости) проводят в комплексе предоперационной подготовки. Свищи промывают растворами протеолитических ферментов, химических антисептиков (хлоргексидин, гипохлорит натрия, диоксидин и др.). Общая антибактериальная терапия (использование антибиотиков) не имеет оснований, так как выраженные склеротические изменения в кости, рубцовые изменения мягких тканей ограничивают проникновение антибиотиков в гнойные очаги. Использование растворов протеолитических ферментов для промывания свищей, костной полости при подготовке больных к операции имеет особое значение.
Лизируя некротизированные ткани, гной, фибрин, ферменты способствуют санации гнойных очагов, эффективность санации повышает последующее промывание свищей растворами антисептиков. Промывание гнойных свищей проводят в течение нескольких дней (до 1 нед и более), пока промывная жидкость не становится прозрачной. Бактериальная обсемененность внутри-костного очага более чем в половине случаев превышает 10 6 бактерий в 1 г ткани или 1 мл экссудата. Санация гнойных очагов до операции с помощью средств биологической и химической антисептики позволяет уменьшить бактериальную обсемененность до 1 х 10 2 — 1 х 10 3 , что ниже критического уровня (1 х 10 5 ).
Объем оперативного вмешательства и успех хирургического лечения больных хроническим остеомиелитом во многом зависят от результатов предоперационного обследования. Оно включает в себя рентгенографию и КТ; фистулографию, которую производят всем больным со свищевой формой остеомиелита (предварительное промывание свищей растворами антисептиков и протеолитических ферментов помогает повысить информативность исследования); сканирование скелета с применением стронция ( 85 Sr) и пирофосфата, меченного технецием ( 99м Тс). Таким образом можно определить активность воспаления в кости, а также выявить другие остеомиелитическое очаги при множественной локализации процесса. КТ в сочетании с фистулографией дает объективную информацию о состоянии кости и прилежащих мягких тканей, позволяет выбрать оптимальный оперативный доступ и определить объем предполагаемой операции.
Радикальная операция у больных хроническим остеомиелитом из-за длительного, часто рецидивирующего заболевания, повторных операций, значительной распространенности патологического процесса в костях и окружающих мягких тканях и трудностей гемостаза сопровождается значительной кровопотерей. Это вызывает необходимость гемотрансфузии во время операции и в послеоперационном периоде. Гомологичная кровь, оказывая хорошее заместительное, гемостатическое действие, имеет ряд существенных недостатков, которые в значительной мере повышают риск операции. Накопленный опыт аутогемотрансфузии при различных оперативных вмешательствах в торакальной, абдоминальной, челюстно-лицевой, ортопедической, нейрохирургической и урологической практике убеждает в преимуществах данного метода возмещения операционной кровопотери по сравнению с использованием для этой цели гомологичной крови.
Изменения в различных звеньях системы гомеостаза (гиповолемия, диспротеинемия, гемоконцентрация, вторичный иммунодефицит и др.) у больных хроническим гематогенным остеомиелитом не являются препятствием к гемоэксфузии при условии применения в предоперационном периоде современных методов инфузионной терапии, детоксикации и иммунокоррекции.
Показания к аутогемотрансфузии для восполнения операционной кровопотери: предполагаемая кровопотеря более 10 % ОЦК; осложненный гемотрансфузионный анамнез, наличие многократных операций с переливанием донорской крови в анамнезе; обнаружение антител к антигенам гомологичной крови.
Преимущества аутогемотрансфузии перед гомогемотрансфузией: более быстрое восстановление показателей эритрона в послеоперационном периоде, более щадящее действие на функцию почек, выраженное стимулирующее влияние на иммунную систему.
Если невозможно возмещение операционной кровопотери только аутокровью, целесообразно и эффективно сочетанное применение ауто- и гомокрови в комплексной инфузионной программе.
Лечение больных с остеомиелитом остается социальной проблемой, что подтверждается частотой его встречаемости у пациентов с заболеваниями опорно-двигательного аппарата у 78 % лиц трудоспособного возраста [14]. Гнойно-воспалительные поражения костей являются тяжелыми и долго протекающими заболеваниями, приводящими к инвалидизации около 55 % пациентов [13, 22].
Высокая частота осложнений, вызванная нагноением опорно-двигательного аппарата при механической травме, развивается у 5,3–75,4 % пострадавших, что обусловлено увеличением случаев тяжелой механической травмы, ятрогенными факторами, изменением спектра микроорганизмов, способных вызвать нагноение, а также нарушениями деятельности иммунной системы организма, изначальным риском развития раневой инфекции и тяжестью клинического течения [6, 8,18, 23,29]. Сочетание остеомиелита с различными видами несращений, ложных суставов и дефектов мягких тканей, значительно усугубляет течение процесса, удлиняет сроки и ухудшает результаты лечения [13]. Остеомиелит выявляется в 3–25 % наблюдений после открытых переломов и в 1–8 % после оперативного лечения закрытых переломов. При этом у больных рецидивы остеомиелита наступают у 20–35 %, что приводит к радикальным методам лечения, таким как ампутации [4, 27, 37].
В этиологии остеомиелита ведущая роль отводится аэробным и грамположительным бактериям, таким как стафилококки 60–80 %, стрептококки – у 5–30 %, пневмококки – у 10–15 % [4,19, 21, 25, 31,32].
Ни одна из существующих теорий возникновения остеомиелита не может в полной мере объяснить его патогенез [19].
Большинство авторов считают, что в развитии остеомиелита имеют значение снижение реактивности организма больного (в результате травмы, переохлаждения, сенсибилизации) и нарушение кровоснабжения поражаемого отдела кости [4, 19, 21].
При развитии остеомиелита преобладают деструктивные изменения в костной ткани. Они характеризуются образованием различных по величине и форме дефектов, патологическими грануляциями, которые с течением времени сливаются в более крупные очаги костной деструкции, содержащие секвестры. Образование секвестров является результатом нарушения кровоснабжения кости, а не следствием действия бактериальных токсинов. Изменения в надкостнице характеризуются ее утолщением, разрастанием соединительной ткани и образованием серозного экссудата. В экстрамедуллярную фазу надкостница отслаивается гноем, проникшим из костномозгового пространства с образованием субпериостальных абсцессов. При разрыве надкостницы гной проникает в параоссальное пространство, что сопровождается развитием воспалительно-некротических изменений в мягких тканях конечности [19].
На сегодняшний день имеется достаточное количество исследований и разработок, направленных на диагностику остеомиелита.
До настоящего времени рентгенография является основой диагностики, однако имеет ряд недостатков: отображает состояние только минеральной составляющей костной ткани, первые признаки деструкции кости рентгенологически проявляются при потере от 20 % до 50 % костного вещества и не ранее 10 суток после начала заболевания [2, 6, 30]. Учитывая вышеперечисленные недостатки рентгенографии, так же применяют такие методы современной диагностики, как: компьютерная и магнитно-резонансная томография, сцинтиграфия, инфракрасная термография, фистулография. Для оценки периферического кровотока используют реографию, допплерографию; ультразвуковое сканирование применяется с целью контроля репарации костной ткани в патологическом очаге. Это позволяет проследить динамику состояния кортикальных слоев кости в процессе лечения без увеличения лучевой нагрузки [16].
Из лабораторных тестов в диагностике патологических сдвигов при остеомиелите наряду с общеклиническими исследованиями применяют определение иммунного статуса, а также исследование цитокинового профиля [9, 12, 16]. Обязательной является биопсия тканей для гистологического и бактериологического исследований.
Анализ отечественной и зарубежной литературы показал, что многие вопросы лечения остеомиелита остаются нерешенными и должны основываться на глубоком понимании этиологии и патогенеза заболевания.
Комплексное лечение больных с остеомиелитом основано на применении хирургического лечения и адекватной антибактериальной терапии, и включает консервативные и оперативные методы [1, 2, 5, 9].
Консервативные методы лечения в большинстве случаев стандартизированы и включают антибиотикотерапию, с определением микробного возбудителя и чувствительности микроорганизмов к антибактериальным препаратам, противоспалительную терапию. Большое значение имеет проведение иммуномодулирующей терапии, в том числе с использованием методов квантовой гемотерапии (реинфузия обработанной ауто- и донорской крови и др.), а в отдельных случаях гормонотерапии [1, 24]. В последние десятилетия установлено, что при хронических воспалительных процессах развиваются различные метаболические изменения, влияющие на активность окислительно-восстановительных ферментов. В связи с этим многие авторы считают целесообразным в схему лечения больных с остеомиелитом включать и метаболиты, такие как тиаминпирофосфат, рибофлавин, пантотенат кальция, липоевую кислоту, панангин и др. [1, 2, 3, 5, 6, 22]. Некоторые авторы предлагают использовать региональную интенсивную терапию при наиболее тяжелых повреждениях конечностей, грозящих ампутацией, путем внутриартериальной перфузии поврежденной конечности и создания, таким образом, максимальных концентраций вводимых препаратов (антибактериальных, сосудистых, антигистаминных) в зоне повреждения [15, 19, 41].
В большинстве случаев хирургическое лечение остеомиелита направлено, прежде всего, на ликвидацию очага гнойно-некротического поражения, замещение остаточных полостей или образовавшихся дефектов с использованием спонгиозной аутокости и установлением системы аспирационно-промывного дренирования [10, 11]. При лечении остеомиелита в основном используется тактика одноэтапного лечения, но в последнее время все большее распространение получают двухэтапные вмешательства. [2, 17, 18]. При наличии краевых дефектов для предотвращения широкой резекции концов отломков и значительного укорочения конечности выполняют аутоспонгиопластику трансплантатами, взятыми из гребня подвздошной кости, что обеспечивает полноценное замещение остаточных полостей и способствует восстановлению структуры кости. Авторами было также доказано, что одним из основополагающих условий достижения положительного лечебного эффекта является стабилизация костных отломков средствами внеочагового остеосинтеза. Способы и средства внеочагового остеосинтеза, по мнению большинства специалистов, на сегодняшний день являются методом выбора как средство лечебной иммобилизации при наиболее тяжелых открытых повреждениях костей и суставов [2, 26]. Эти подходы легли в основу органосохраняющей тактики лечения тяжелых открытых переломов.
Также в последние годы широко разрабатываются методы закрытия костной полости, такие как мышечная или кожно-мышечная пластика [5, 8, 18]. Необходимо отметить, что проблема замещения костного дефекта довольно сложна и связана в первую очередь с тем, что замещается инфицированная костная полость. В этих условиях наиболее предпочтительными и перспективными являются биодеградируемые материалы, такие как аутокость или деминерализованные аутотрансплантанты. Некоторые исследователи для улучшения результатов лечения и профилактики рецидивов заболевания предлагают использовать пластику остаточной полости аутогенной костной тканью перифокальной области воспаления [13, 17, 18, 21, 26, 28, 31, 33]. Однако вопрос о костной пластике при радикальном оперативном лечении, как при острых, так и при хронических формах остеомиелита, должен решаться в каждом случае индивидуально.
Как правило, неудовлетворительные результаты лечения связаны с отсутствием полноценной хирургической обработки – в 84 % и неадекватным дренированием – 88,7 % [5].
В основе профилактики рецидивов остеомиелита в настоящее время лежит полноценная хирургическая обработка, адекватное дренирование и антибиотикопрофилактика [20]. Основным профилактическим фактором заболевания является соблюдение канонов организации оказания медицинской помощи пострадавшим на догоспитальном этапе. Соблюдение принципов хирургической профилактики, включающих ряд неотложных мероприятий на догоспитальном и раннем госпитальном этапах, и хирургического лечения открытых повреждений ран или переломов костей. Профилактические меры, которые позволяют снизить риск развития остеомиелита. Опыт второй мировой войны, малые локальные войны, катастрофы, дорожно-транспортные травмы свидетельствуют об эффективности именно системного подхода к организации помощи при риске посттравматических инфекционных гнойно-некротических осложнений [2].
Несмотря на активное внедрение высокотехнологичных методик диагностики остеомиелита, а также различных современных методов его лечения, хронический остеомиелит остается тяжело протекающим заболеванием с трудно прогнозируемым исходом. В связи с этим актуальным является поиск принципиально новых методов диагностики и профилактики этого грозного заболевания.
Принципы комплексного лечения острого гематогенного остеомиелита у детей были разработаны Т.П. Краснобаевым еще в 1925 г., однако до настоящего времени не утратили своего практического значения. Лечебные мероприятия состоят из трех компонентов: 1) местное лечение -- хирургическая санация всех очагов воспаления; 2) антибактериальная терапия с учетом вида патогенного возбудителя и его чувствительности к химиопрепаратам; 3) воздействие на макроорганизм -- коррекция нарушенных параметров гомеостаза.
Так же имеются схемы алгоритма лечения, составленные зарубежными коллегами. (рис. 3)

Рис.3 Алгоритм рентгенологического обследования и лечения при подозрении на острый гематогенный остеомиелит. (Petlola H., 2014)
Местное лечение:
Местное лечение предусматривает раннюю санацию остеомиелитического очага и декомпрессию. Несмотря на отсутствие единства взглядов относительно характера и объема оперативного вмешательства, основным хирургическим методом лечения остается фрезевая остеоперфорация.
Основная цель остеоперфорации -- ликвидация повышенного внутрикостного давления. У новорожденных и грудных детей с метаэпифизарным остеомиелитом используют пункционный метод местного лечения гнойного артрита с эвакуацией экссудата и промыванием полости сустава раствором антибиотика. Однозначного мнения о необходимости вскрытия внутрикостного очага (остеоперфорации) при метафизарной локализации процесса у детей до 5 лет нет. Тем не менее остеоперфорация в ранние сроки заболевания (до 3 недель) у детей старше года возможна и эффективна. Операция должна быть выполнена максимально щадящим образом и в наименьшей степени разрушать структуру сустава и кости. Необходимость остеоперфораци при очаге в диафизе, не вызывает сомнений промедление с адекватной декомпрессией, как правило, ведет к быстрому усугублению деструкции и практически тотальному поражению кости.
Техника остеоперфорации:
Перед операцией в палате определяется и отмечается область наибольшей болезненности путем пальпации и легкой перкуссии. При отсутствии изменений в мягких тканях (визуально или после их пункции) остеоперфорацию производят чрескожно. При наличии флегмоны ее вскрывают широким разрезом (до здоровых тканей) с контрапертурами при гнойных затеках.
Первую перфорацию производят в центре измененного участка кости, который обычно лишен надкостницы. Отверстия просверливают с помощью электродрели сверлами диаметром от 2 до 5 мм в зависимости от вида кости и возраста ребенка, в количестве от 2 до 6--8 и более. В верхнее и нижнее отверстия вводят двухпросветные силиконовые или пластиковые трубки, через которые производят промывание гнойной полости антибиотиками или антисептиками и вводят проводник для лазеротерапии. Промывание кости производят с помощью шприца (после отсасывания гноя из полости) до чистых вод, не создавая большого давления. Заканчивается промывание введением антибиотиков. В качестве промывных сред применяют растворы антисептиков (диоксидин, хлоргексидин, гипохлорид натрия, эктерицид и др.) или антибиотиков (в зависимости от чувствительности микрофлоры). Дренажи из костномозгового канала удаляют после прекращения отделяемого, в среднем на 5--10-е сутки после операции.
В последних публикациях авторы отказываются от использования проточно промывного дренирования, мотивируя это тем, что оно приводит к разрушению биологического барьера, формирующегося гнойного очага или препятствует его образованию, способствуя обсеменению костномозгового канала (Никитин Г.Д., 2000) (Котельников Г. П., 2009)
При хронизации гематогенного остеомиелита показано хирургическое вмешательство с целью удаления не только нежизнеспособных, подвергшихся демаркации тканей с экссудатом, но и воспаленной, инфицированной внутренней оболочки капсулы очага, а также -- частично или полностью -- фиброзной оболочки (debridmetn-некросеквестрэктомия) Послеоперационная регенерация тканей кости, заключающаяся в пролиферации молодой грануляционной ткани, созревании и трансформации ее в фиброзную, а затем костную, должна протекать в условиях применения энергичного, целенаправленного и достаточно длительного антибактериального воздействия общего и местного характера, по некоторым данным минимум 4 недели. (Griesmaier, 2013)
При выполнении некросеквестрэктомии при наличии четких границ очага, кость трепанируется не долотом, а фрезой, секвестральная коробка вскрывается, обрабатывается, удаляются секвестры и производится остеоперфорация выше и ниже полости в кости с введением микроирригатов; на рану накладываются швы;
Иммобилизация является важной составной частью комплексного лечения острого гематогенного остеомиелита, особенно у детей младшего возраста. Однако применение строгой иммобилизации при благоприятном течении болезни должно быть кратковременным (4-8 недель), чтобы избежать нарушения кровообращения, атрофии мышц, явлений остеопороза, снижения репаративных процессов.
Антибактериальная терапия
Касаясь принципов антибактериальной терапии, следует отметить, что выбор антибактериального препарата определяется чувствительностью микрофлоры, тропностью, совместимостью с другими препаратами и токсичностью для организма ребенка. До идентификации возбудителя рекомендуется прибегать к эмпирической терапии антибиотикам цефалоспоринового ряда третьего или четвертого поколения в сочетании с препаратами нитазола. В
На данный момент в большинстве литературных источников рекомендуется ступенчатая терапия, так при наличии снижения показателей СОЭ и СРБ через неделю лечения внутривенным введением антибиотиков, рекомендуется переход на пероральные формы препаратов
У детей препаратами первой линии являются клиндамицин и первое поколение цефалоспоринов. Большинство MRSA штамов сохранили чувствительность к клиндамицину, но он (как и Ванкомцин) не используется при выявлении K. kingae.
Бета лактамы- это антибиотики выбора при остеомиелите вызванном K. kingae, так же как и в случаях с S. pyogenes or S. pneumoniae.
В случае вления возбудителя H. Influenze используется ампициллин или амоксициллин либо цефалоспорины 3го поколения.
У пациентов в нестабильном состоянии и при наличии резистентности к клиндамицину рекомендуется применения Ванкомицина, как препарата 1й линии, препаратом резерва в этом случае является Линезолид.
Американская Ассоциация инфекционных болезней рекомендует продолжительность курса антибиотикотерапии для MRSA штаммов 4-6 недель, а также для лечения заболевания в тех районах, где остеомиелита из-за сальмонеллы является распространенным явлением. Отмена антибиотиков при достижении порговых значенй СРБ 20 мг/л, СОЭ 20мм/час Так же длительный курс рекомендован для пациентов, когда ОГО осложнился септическим артритом, т.к. данная форма склонна к хронизации и длительному удерживанию высоких цифр СРБ. По поводу укорочения курса для новорожденных данных нет. (Petlola H., 2014). По тем же рекомендациям составлен алгоритм лечения. (Рис 4)
Воздействие на макроорганизм:
Коррекция гомеостаза включает восстановление системной гемодинамики и перфузии тканей (инотропная и волемическая поддержка для увеличения сердечного выброса и доставки кислорода); респираторную поддержку; нутритивную поддержку; коррекцию иммунологического состояния; интенсивную дезинтоксикационную терапию.
В комплексе детоксикационных мероприятий применяется широкий спектр активных методов интенсивной экстракорпоральной терапии. Предпочтение различных методов гравитационной хирургии обусловлено многими причинами, основные из них -- доступность и техническая оснащенность лечебного учреждения. Значение имеют сложившиеся традиции в научных медицинских школах: использование обменных (цитоферез, плазмаферез) либо мембранных технологий (гемодиализ, ультрафильтрация, гемодиафильтрация и др.), физических и химических методов интракорпоральной и экстракорпоральной деструктуризации токсических веществ, начиная от фотомодификации крови и биологических жидкостей вплоть до непрямого электрохимического окисления крови.
Комплекс лечебных мероприятий может быть дополнен физиотерапией и дифференцированной иммунокоррекцией, направленной на различные звенья системы антиинфекционной резистентности, что сокращает фазу экссудации, стимулирует пролиферацию, активирует Т-систему лимфоцитов, нормализует калликреин-кининовую систему. В качестве целенаправленной коррекции активации процессов свободнорадикального окисления и антиоксидантной системы в комплекс лечебных мероприятий включают витамины Е, С, унитиол и мембраностабилизаторы (жировые эмульсии, эссенциале и др.).
Рис.4 Алгоритм антибактериальной терапии и оперативного лечения (Dartnell J, 2012)
Читайте также:


