Лечение болевого синдрома при остеоартрозе
Рассмотрены патофизиология болевого синдрома при остеоартрозе и подходы к терапии с применением нестероидных противовоспалительных препаратов (НПВП). Описаны клиническая эффективность и безопасность применения нимесулида для лечения боли при остеоартрозе.
Pathophysiology of pain syndrome in osteoarthrosis and approaches to the therapy using non-steroidal anti-inflammatory preparations (NAIP) were considered. Clinical efficiency and safety of nemisulide application for relief of pain in osteoarthrosis were described.
Остеоартроз (ОА) — одно из самых распространенных заболеваний опорно-двигательного аппарата, основная причина постоянного болевого синдрома [1] и инвалидизации [2].
Болевой синдром при ОА представляется важной клинической проблемой. Манифестация боли возможна на разных стадиях процесса и не имеет четкой корреляции с рентгенологической картиной: рентгенологические проявления ОА отмечаются примерно у 30% взрослого населения, а болевой синдром развивается у 10–12% [3].
Боль может сохраняться даже после хирургического лечения. Примерно 15% больных, которым проведено эндопротезирование коленного сустава в связи с выраженным ОА, продолжают испытывать боль, несмотря на отсутствие хирургических осложнений и нормальную рентгенологическую картину [4].
В основе успешного управления симптомами ОА лежит понимание патофизиологии и тщательная клиническая оценка болевого синдрома.
Любой сустав, вне зависимости от его размеров, — это сложный орган, в состав которого входят синовиальная мембрана, синовиальная жидкость, хрящ, кость и мягкие ткани. При этом сустав — это еще и орган с едиными нейротрофическими, метаболическими, иммунными и функциональными составляющими, играющими важную роль как в патогенезе самого ОА, так и болевого синдрома при нем.
Известно, что прогредиентно протекающие дегенеративные процессы при ОА отмечаются во всех суставных структурах и объединяют потерю матрикса гиалинового хряща, ремоделирование подлежащей кости, поражение костного мозга, вовлечение связок, растяжение капсулы сустава, ослабление прилегающих к суставу мышц [5]. По мере прогрессирования ОА существенно меняется биомеханика сустава.
При ОА в процесс активно вовлекается периост из-за обнажения костной суставной поверхности [6]. Поверхность костной ткани внутри сустава, лишенная амортизирующих свойств из-за деструкции хряща, испытывает избыточную и неравномерную механическую нагрузку. В субхондральной кости появляются зоны динамической перегрузки, в которых развиваются изменения микроциркуляции. Это способствует возникновению субхондрального остеосклероза, кистовидной перестройки, изменению кривизны суставных поверхностей и образованию остеофитов. Повышение внутримедуллярного давления в субхондральной кости — это еще один источник боли при ОА.
Изменения также затрагивают связки, сухожилия, с развитием лигаментитов, теносиновитов, а также бурситов околосуставных сумок [7]. Прилегающие к суставу мышечные структуры страдают как от реактивного воспаления, развивающегося в суставах, так и от нарушения биомеханики больного сустава. В итоге повышенная механическая нагрузка на мышечный аппарат приводит к гипертонусу мышц, что также способствует нарастанию боли.
Значимая роль в патогенезе ОА отводится синовиту, деструктивно воздействующему на суставные структуры за счет активации фагоцитарных, воспалительных и иммунных реакций, способствующих высвобождению значительного числа медиаторов (цитокинов, простагландинов, матриксных металлопротеиназ, супероксидных радикалов, оксида азота и др.), играющих ключевую роль как в моделировании воспаления, так и восприятии боли [8, 9]. Воспаление синовиальной оболочки вносит существенный вклад в развитие боли, поскольку в ней достаточно широко представлены нервные окончания.
К настоящему времени накоплены данные о роли субстанции Р — нейропептида, способствующего возникновению и поддержанию боли за счет усиления продукции медиаторов воспаления в области суставов [10, 11]. По данным исследований при ОА субстанция Р обнаруживается в синовиальной жидкости и синовиальной оболочке [12, 13], периосте, подхрящевых участках костей, суставных капсулах, где синтезируется в немиелинизированных чувствительных нейронах [14], то есть в тех суставных структурах, из которых чаще и больше происходит болевых импульсов [15]. В хрящевой ткани сустава субстанция Р не обнаружена.
Еще одним проявлением ОА, усиливающим боль, является синовиальный выпот, способствующий растяжению богатой нервными окончаниями капсулы сустава [16, 17].
Кроме того, в качестве весьма специфического для суставов фактора, способствующего развитию болевого синдрома при ОА, рассматривается ангиогенез, при котором помимо роста сосудов отмечается значительный рост новых немиелинизированных чувствительных нервных окончаний [18]. При ОА процесс ангиогенеза наблюдается в синовиальной оболочке, некальцифицированных участках внутрисуставных хрящей и в остеофитах. Интересно, что в периваскулярных немиелинизированных нервных волокнах также обнаруживается субстанция Р и пептид, связанный с геном кальцитонина (CGRP), которые в совокупности способствуют медиации устойчивой жгучей боли, как ее описывают больные ОА [19].
Поскольку внутрисуставной гиалиновый хрящ не имеет ноцицепторов, он, несмотря на существенные дегенеративные процессы в нем, не может служить источником болевой импульсации. Очевидно, что боль при ОА полиэтиологична и происходит из всех выполняющих сустав структур, за исключением хряща [10, 11].
Болевой синдром при ОА может быть острым и хроническим: с периодическими обострениями и их уменьшением. Острая боль является следствием раздражения болевых рецепторов, расположенных в коже, связках, сухожилиях, сумках, костях, синовиальной оболочке, мышцах. Механизмы трансформации острой боли в хронический болевой синдром при ОА изучены недостаточно полно. Предполагается, что хронизации боли при ОА может способствовать длительное раздражение периферической ноцицептивной системы с постоянным вовлечением задних рогов спинного мозга [20]. При этом включаются принципиально иные механизмы формирования болевых импульсов. Ключевой вопрос касается связи между периферическим повреждением и воспалением структур суставов и стимуляцией выработки ЦОГ-2 в центральной нервной системе (ЦНС), где могут иметь значение как нервные, так и гуморальные механизмы. В частности, показано, что довольно продолжительная активность небольших сенсорных нейронов, обусловленная периферическим воспалением, сопровождается высвобождением глутамата/аспартата и субстанции Р в спинном мозге с последующей активацией рецепторов NMDA (N-метил-D-аспартата) в нейронах задних рогов спинного мозга [21]. Доказательством этого является повышенное содержание субстанции Р в спинномозговой жидкости больных ОА [22]. Стимуляция этих рецепторов может вызвать повышение экспрессии ряда ферментов, включая ЦОГ-2, в спинном мозге, что в итоге ведет к усилению болевого синдрома. Гуморальный же механизм воспалительной реакции, связанной с повреждением периферических суставных структур, приводит к высвобождению провоспалительных цитокинов (ФНО-α, ИЛ-1β), которые в свою очередь усиливают экспрессию ЦОГ-2.
Исходя из представлений о патогенезе ОА и болевого синдрома при нем, становится очевидным, что подавление воспаления и предотвращение деструкции суставных структур, с целью снижения синтеза провоспалительных цитокинов, простагландинов (в особенности ПГE2), ферментов синовиальной оболочки, металлопротеиназ, деградации коллагеновых волокон, протеолитической активности и т. п., является одним из приоритетных направлений в терапии ОА. Несомненно, назначение противовоспалительных препаратов не просто желательно, но и показано больным с ОА, испытывающим боль, особенно в тех случаях, когда развитие болевого синдрома тесно связано с тканевым воспалением, а простой анальгетик не оказывает должного эффекта. Подобный терапевтический подход соответствует ведущим рекомендациям национальных и международных руководств по купированию болевых синдромов у пациентов с ОА, где подчеркивается, что терапевтическим методом в таких случаях является использование парацетамола. При этом важно подчеркнуть, что парацетамол не оказывает действия на периферические ЦОГ, а посему не обладает противовоспалительным эффектом. И, кроме того, чтобы реализовать свою функцию, парацетамол должен достичь достаточного уровня концентрации в ликворе, поскольку оказывает комплексное воздействие на ЦНС, усиливая нисходящие от периферии к ЦНС процессы торможения. А это требует применения достаточной дозировки и обязательного соблюдения временного интервала между приемами (1 г трижды в день), чтобы полностью использовать потенциал препарата [27]. Эти аспекты оправдывают применение таких лекарственных препаратов, как НПВП, с учетом соотношения пользы и риска.
Нестероидные противовоспалительные препараты (НПВП) — наиболее назначаемый класс лекарственных средств, предназначенных для лечения болевых синдромов. Общими фармакологическими свойствами НПВП являются подавление биосинтеза простагландинов (ведущих факторов активации болевых рецепторов) за счет блокады изоферментов циклооксигеназы, в частности ЦОГ-2, и нормализация сниженного болевого порога. При назначении НПВП подавление синтеза простагландинов имеет место как на периферическом, непосредственно в месте повреждения и воспаления, так и на центральном уровнях, свидетельствуя о том, что и периферические и центральные механизмы принимают участие в антиноцицептивном действии этих препаратов. Центральный эффект НПВП связан с угнетением синтеза простагландинов, которые образуются в ЦНС и способствуют усилению болевого сигнала. Таким образом, ЦНС является дополнительным местом проявления антиноцицептивных эффектов НПВП.
Одним из наиболее популярных средств среди НПВП является нимесулид. Многочисленные исследования и более чем 30-летний клинический опыт применения показали, что нимесулид (Найз) обладает высокой эффективностью и хорошей переносимостью [28].
В контексте данной статьи хотелось бы прежде остановиться на бесспорных достоинствах нимесулида как препарата выбора для лечения болевых синдромов при ОА, принимая во внимание данные об их механизмах, рассмотренные ранее.
Интересны, прежде всего, ЦОГ-зависимые механизмы действия, обусловливающие эффективность и безопасность нимесулида. Поскольку нимесулид оказывает преимущественное действие на ЦОГ-2, то его эффекты очевидны как на периферии, в суставных структурах, затронутых деструктивным процессом и связанным с ним воспалением, так и в ЦНС [29, 30]. Причем исключительной особенностью нимесулида является способность не только подавлять активность ЦОГ-2, но и блокировать ее образование [31].
Хотя нимесулид и обладает преимущественным эффектом в отношении ЦОГ-2, он оказывает сбалансированное влияние на обе изоформы ЦОГ. В терапевтических концентрациях нимесулид ингибирует 88% активности ЦОГ-2 и 45% активности ЦОГ-1. При этом если воздействие на ЦОГ-1 прекращается через 24 часа после введения, то воздействие на ЦОГ-2 продолжается намного дольше [32], и это различие сохраняется при длительном применении [33, 34].
Неоспоримым преимуществом нимесулида является способность молекулы уменьшать высвобождение ФНО-α, ИЛ-6 и субстанции Р [35–37].
Примечательны ЦОГ-независимые эффекты нимесулида. В частности, в терапевтических концентрациях нимесулид влияет на продукцию токсичных окислительных радикалов и других компонентов нейтрофильной активации [38], ß-глюкуронидазы [39], что может усилить противовоспалительный и анальгетический эффект и потенциально уменьшать вероятность гастроинтестинальной ульцерогенности.
Наконец, трудно переоценить протективное действие нимесулида на суставной хрящ. Известно, что неселективные в отношении ЦОГ НПВП усугубляют тяжесть ОА при длительном применении. В наибольшей степени отрицательно влияют на хрящ производные индолуксусной кислоты (индометацин), чуть меньше — производные пропионовой кислоты (ибупрофен, напроксен и др.), что подтверждается данными рентгенографии. При этом доказано, что селективные ингибиторы ЦОГ-2, в частности нимесулид, не оказывают отрицательного влияния на синтез протеогликанов хрящевой тканью, даже при применении высоких доз [40, 41]. Напротив, нимесулид обнаруживает способность снижать в синовиальной жидкости, полученной из воспаленного сустава, уровень коллагеназы, вызывающей деградацию коллагена и протеогликанов [42].
С клинической точки зрения, многоплановость механизмов действия нимесулида, связанных или не связанных с ЦОГ, выражается в эффективности и быстром модулировании сложного воспалительного процесса и сопряженной с ним боли.
Клиническая эффективность нимесулида показана в многочисленных исследованиях. Известно, что препарат превосходит или как минимум столь же эффективен, как и классические НПВП, в отношении купирования значительного числа болевых синдромов, включая ревматоидный артрит, скелетномышечные боли в спине, послеоперационную и зубную боль, дисменорею. Преимущества нимесулида показаны и при лечении ОА. Так, использование нимесулида позволило добиться значимого уменьшения боли и улучшения самочувствия у подавляющего большинства пациентов с ОА, включенных в двойное слепое сравнительное исследование эффективности и безопасности нимесулида и диклофенака при гонартрозе и коксартрозе [43]. Этот результат представляется более значимым еще и потому, что примерно половина больных до назначения нимесулида получали другие НПВП и не отмечали при этом существенного улучшения своего состояния.
М. И. Шупина* , 1 , кандидат медицинских наук
Г. И. Нечаева*, доктор медицинских наук, профессор
Е. Н. Логинова*, кандидат медицинских наук
Т. В. Кропотина**, кандидат медицинских наук
Ю. В. Арбузова**
* ГБОУ ВПО ОмГМУ МЗ РФ, Омск
** БУЗОО ОКБ, Омск
Заболевание остеоартроз (код в МКБ 10 от М15 до М19) относится к дегенеративно-дистрофическим болезням суставов. Характеризуется первичной дегенерацией суставного хряща с последующими изменениями суставных поверхностей и развитием краевых остеофитов (костных наростов), что приводит к деформации суставов. Проявления незначительного реактивного синовита являются вторичными по отношению к дегенеративным изменениям хряща. В Юсуповской больнице врачи диагностируют заболевание с помощью новейшей аппаратуры ведущих европейских и американских производителей.
Ведущие специалисты в области ортопедии, ревматологии, медицинской реабилитации коллегиально определяют тактику ведения пациента. Врачи применяют немедикаментозные методы терапии и лекарственные препараты, которые обладают высокой эффективностью и минимальным спектром побочных эффектов. Мультидисциплинарный подход позволяет быстро достичь положительных результатов.
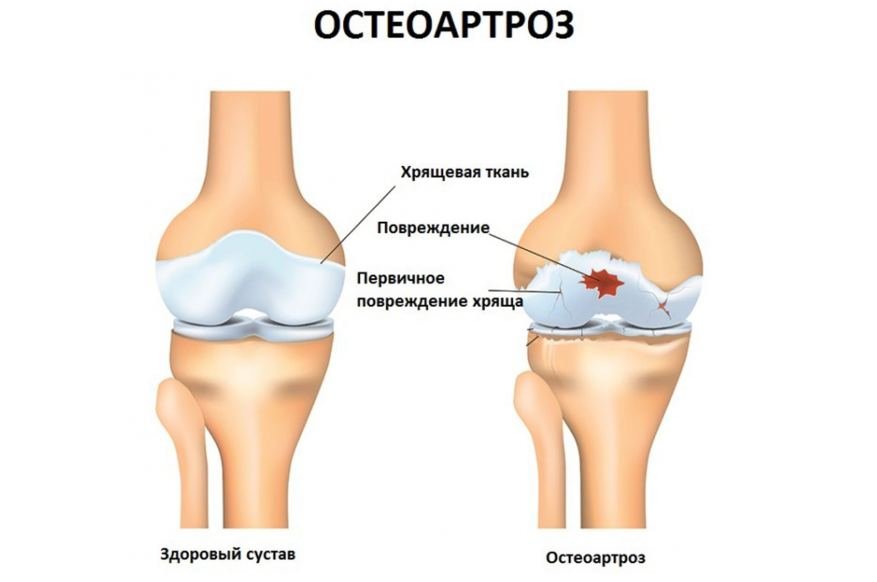
Остеоартроз является наиболее распространённой формой патологии суставов. На долю этой болезни приходится от 60 до 70 % всех ревматических заболеваний. Полная инвалидность у больных остеоартрозами наступает редко, кроме пациентов, страдающих остеоартрозом тазобедренного сустава. Заболевание часто служит причиной временной нетрудоспособности. Первичный генерализованный остеоартроз имеет код в МКБ 10 № М15.
Остеоартроз выявляют одинаково часто у мужчин и женщин, за исключением заболевания дистальных межфаланговых суставов, которое встречается у женщин в10 раз чаще. Клинические проявления артроза начинаются преимущественно в возрасте 40-50 лет, у женщин в период менопаузы. Рентгенологические признаки поражения суставов выявляют значительно раньше.
Причины остеоартроза
Дегенерация суставного хряща при остеоартрозе происходит вследствие чрезмерной перегрузки здорового хряща, которая превышает физиологическую, и снижения устойчивости суставного хряща к обычной физиологической нагрузке. Механические (первичные) остеоартрозы обусловлены следующими причинами:
- Профессиональной, бытовой, спортивной перегрузкой;
- Дисплазиями;
- Нарушениями статики.
В основе структурных артрозов лежат изменения структуры и трофики суставного хряща, в результате чего он не справляется с обычной физиологической нагрузкой. Это вторичные остеоартрозы, поскольку происходит дегенерация предварительно изменённого хряща.
Остеоартроз развивается вследствие несоответствия между механической нагрузкой, падающей на суставную поверхность хряща, и его возможностями сопротивляться этой нагрузке. Подобная ситуация создаётся при выраженном ожирении, тяжёлой физической работе с часто повторяющимися стереотипными движениями, которые нагружают одни и те же суставы (остеоартроз лучезапястного сустава у маляра, плеча у кузнеца, суставов позвоночника у грузчика), или чрезмерных занятиях спортом (артроз коленных суставов у футболистов, хоккеистов, бегунов).
К перегрузке хряща ведёт нарушение нормального соотношения суставных поверхностей здорового хряща. В результате нагрузка неравномерно распределяется по всей поверхности хряща, причём основная нагрузка падает на небольшую площадь в месте наибольшего сближения суставных поверхностей. По этой причине хрящ в этом месте быстро дегенерирует.
Иногда нагрузка остаётся нормальной, но значительно изменяются физико-химические свойства хряща. Это делает его менее устойчивым к обычной нагрузке. Причиной этого являются следующие факторы:
- Нарушение субхондрального кровообращения;
- Изменения, которые возникают со стороны синовиальной оболочки;
- Инфекционные и неинфекционные артриты;
- Кровоизлияние в сустав;
- Нарушения обмена веществ (подагра, гемохроматоз, пирофосфатная артропатия;
- Заболевания эндокринной и нервной систем (сахарный диабет, акромегалия);
- Отягощённая наследственность.
К факторам, которые вызывают развитие остеоартроза, относят дисплазии, чрезмерную подвижность, функциональную перегрузку, травму сустава.
Симптомы остеоартроза
При артрозе главным образом поражаются наиболее нагруженные суставы нижних конечностей – тазобедренный, коленный и первый плюснефаланговый сустав. На верхних конечностях наиболее часто поражаются межфаланговые суставы. Остальные суставы включаются в патологический процесс реже. При остеоартрозе патологический процесс локализуется в одном суставе, затем развивается вторичный или первичный генерализованный остеоартроз.
На 1 стадии остеохондроза симптомы неотчётливые. Незаметно появляются хруст в суставах при движении и небольшие периодические боли после значительной физической нагрузки, которые быстро проходят в покое. Постепенно интенсивность болей увеличивается. Они появляются после любой нагрузки, становятся продолжительными, иногда появляются ночью.
Болевой синдром при артрозах главным образом возникает при нагрузке на больной сустав, наступании на ногу, ходьбе и отсутствует в покое. Боли тупые, их интенсивность достигает максимума по вечерам, после дневной нагрузки. Чаще всего причинами болей при остеоартрозе является периартрит, реактивный синовит и спазм близлежащих мышц.
При остеохондрозе 2 степени, наличии реактивного синовита наблюдаются стартовые боли, которые возникают при первых шагах пациента. Они затем быстро исчезают и возобновляются после физической нагрузки. Синовит иногда сопровождается тендобурситом. Тогда болевой синдром возникает при определённых движениях, связанных с сокращением поражённого сухожилия. Вследствие рефлекторного спазма близлежащих мышц появляются боли при любом движении в суставе.
При прогрессирующем фиброзе капсулы сустава происходит сдавление нервных окончаний. Его результатом являются боли, связанные с растяжением капсулы при движении в суставе. Венозная гиперемия и застой в субхондральной кости вызывают тупые, непрерывные ночные боли, которые исчезают при ходьбе. Если остеоартроз локализуется в тазобедренном суставе, боль отдаёт в коленные суставы.
В начальной стадии остеоартроза отмечаются следующие симптомы:
- Небольшая крепитация при движениях в суставе, которая с развитием болезни переходит в грубый хруст;
- Быстрая утомляемость регионарных мышц;
- Кратковременная тугоподвижность сустава при переходе из состояния покоя к активной деятельности.
При дальнейшем развитии болезни наряду с усилением болей может появиться небольшое ограничение движений, которое со временем нарастает. Постепенно возникает и прогрессирует деформация сустава. Периодически возникает небольшая припухлость в области сустава с болезненностью при пальпации, особенно по ходу суставной щели и повышением кожной температуры. Иногда в полости сустава можно определить определяется небольшой выпот. В поздней стадии остеоартроза при выраженном обезображивании суставов подвижность пациента может быть ограничена, однако полного отсутствия движения в суставах не происходит.
Диагностика остеоартроза
Основным методом, который позволяет выявить остеоартроз на доклинической стадии заболевания, является рентгенография суставов. В ранней стадии патологического процесса на рентгенограммах появляется неравномерное и неотчётливое сужение суставной щели, расширение и уплотнение замыкающей костной пластинки эпифизов. Одновременно с этим определяется лёгкое заострение краев суставных поверхностей. Эти изменения возникают в первую очередь в области суставных впадин.
Со временем сужение суставной щели и признаки остеосклероза становится более выраженными, отчётливыми. Суставные поверхности уплотняются. На рентгенограммах видны субхондральные округлые кистевидные просветления, которые окружены уплотнённой костной тканью, имеющей чёткие контуры. Некоторые кисты вскрываются в сторону суставной полости, обусловливают частичное разрушение замыкающей костной пластинки. Суставные поверхности меняют форму и не соответствуют друг другу. Наблюдаются значительные краевые костные разрастания и подвывих. На рентгенограммах в поздней стадии иногда определяются участки окостенения суставной капсулы, внутрисуставные свободные тела.
В анализах крови и мочи отсутствуют отклонения от нормы. При наличии реактивного синовита скорость оседания эритроцитов до 20-25 мм/ч. Синовиальная жидкость имеет нормальную вязкость, количество клеток нормальное или незначительно увеличено.
Лечение остеоартроза
Как вылечить остеоартроз? Сегодня препаратов, которыми пациент мог бы излечиться от остеоартроза, не существуют. Врачи Юсуповской больницы, придерживаясь клинических рекомендаций по лечению остеоартроза, индивидуально подходят к выбору метода терапии каждого пациента. Залогом успешного лечения заболевания является одновременное воздействие на все факторы, которые вызвали изменения в суставах у данного пациента.
Для улучшения кровообращения и обменных процессов врачи Юсуповской больницы широко используют как медикаментозные средства, так и методы физиотерапии и бальнеотерапии. Это особенно относится к пациентам, у которых ишемический тип артроза или сосудистый тип болевого синдрома. В этих случаях обязательно назначают сосудостимулирующие медикаментозные средства – бутадион, но-шпа, никошпан.
Учитывая, что главной причиной развития дегенеративных процессов является перегрузка суставного хряща, основным фактором базисной терапии остеоартроза является разгрузка поражённого сустава. Пациентам рекомендуют не осуществлять длительных пеших прогулок, не стоять долго на ногах. Реабилитолог вместе с пациентом вырабатывает дозированную нагрузку, которая не приводит к частым обострениям реактивного синовита. Если есть признаки воспаления синовиальной оболочки, пациентам рекомендуют ходить с палкой, костылями.
Большое значение в лечении имеет также снижение веса тела, так как при ожирении не только повышается нагрузка, но и ослабевают мышцы и связки вследствие малоподвижности этих больных. Питание при остеоартрозе должно быть сбалансированным. Пациентов предупреждают, что при наступлении улучшения и отсутствии болей они не должен расширять режим подвижности, поскольку увеличение нагрузки на сустав повлечёт за собой прогрессирование болезни.
В ранний период болезни пациентам для снятия стартовых болей периодически назначают небольшие дозы противовоспалительных лекарственных средств, которые ингибируют ферменты и уменьшают проницаемость сосудов. При прогрессировании заболевания противовоспалительные препараты вводят внутримышечно и внутрисуставно. С целью обезболивания применяют различные медикаментозные средства и местные физиотерапевтические процедуры. При наличии выраженных рефлекторных болей проводят иглоукалывание.
При длительном течении остеоартроза, когда возникают боли при стоянии, ходьбе вследствие снижения способности к нагрузке субхондральной кости, лечение направлено на усиление опорной функции кости (разгрузка, применение анаболических стероидов). Если у пациента появляются тупые, ночные боли, связанные с венозным стазом в субхондральной кости, применяют средства, которые улучшают внутрикостное кровообращение, теоникол, физиотерапевтические процедуры. При наличии признаков поражения суставов звоните по телефону контакт центра Юсуповской больницы и записывайтесь на приём к врачу в удобное вам время.
Кафедра травматологии и ортопедии Уральской медицинской академии, г.Екатеринбург.
В последнее десятилетие по распространенности и длительности нетрудоспособности боль в суставах и позвоночнике обошла даже различные сезонные ОРВИ. Оглянитесь вокруг – мало кто может похвастаться, что за всю жизнь ни разу не испытывал боль или дискомфорт в позвоночнике.

Более того: около 70% взрослых людей постоянно или эпизодически жалуются на боли в спине, по этому поводу выдаются больничные листы сотрудникам до 25% рабочих организаций, а 5% россиян в настоящее время проходят лечение. Кроме того, большая часть больных с проблемами с позвоночником неофициально обращаются к частным врачам, остеопатам, знахарям или лечатся самостоятельно.
При этом лечение боли в позвоночнике оставляет желать лучшего: стандартной медикаментозной терапии эффективна лишь в 20-40% случаев, а результаты физиотерапии и мануальной терапии обычно сомнительны и недолговечны. К счастью, в последние годы появились принципиально новые медицинские технологии, к которым относится метод внутритканевой электростимуляции.
Представления о механизмах боли.
Заболевание, как в позвонках, так и в суставах, развивается следующим образом. Сначала возникают патологические локальные изменения в костной ткани в виде остеопороза и разрушения костных балок, застоя крови, повышения внутрикостного давления. В результате происходит раздражение костных рецепторов и возникновение боли. Чем хуже кровообращение в кости, тем больше интенсивность боли. Затем в патологический процесс вовлекается надкостница, и возникают болевые ощущения. Со временем, при прогрессировании процесса могут вовлекаться мышцы, что приводит к их напряжению и развитию мышечно-тонического синдрома. Постепенно патологический процесс затрагивает нервы, выходящие из позвоночника, что может обусловливать боль в конечностях.
Нарушение кровообращения влияет не только на позвоночник, но и на суставы. Недостаточное кровоснабжение костной ткани нарушает диффузное питание хрящевой ткани, вызывая ее распад, а продукты распада хряща – отек, боль и другие клинические проявления, характерные для остеохондроза и остеоартроза.
Кроме того, обменные процессы в костях зависят от интенсивности боли в позвонке. Структурные изменения прогрессируют в местах прикрепления мышц, капсулы суставов. При хронической боли на рентгеновских снимках уже становятся видны характерные изменения.
Лечение болевых синдромов.
Невысокая эффективность стандартной медикаментозной терапии вызвана затрудненным поступлением лекарственных веществ внутрь кости с током крови. Внутрикостное введение различных препаратов улучшает эффект от лечения лишь частично. Физиотерапевтическое лечение также малоэффективно, так как кожа является барьером для прохождения разных видов энергии внутрь организма. Например, электрический ток ослабляется кожным покровом в 200-500 раз и практически не доходит до кости.
Специалисты из Уральском государственном медицинском университете доказали, что электрический ток улучшает кровообращение в костях и благоприятно влияет на костные рецепторы. Чтобы улучшить доступ к позвонкам и суставам, используют металлический проводник в виде тонкой иглы-электрода, который подводят к пораженному позвонку и подают физиологический электрический ток, соответствующий естественным биотокам организма. Это низкочастотный сложномодулированный импульсный ток. Существующие физиотерапевтические аппараты, к сожалению, не удовлетворяют нужным требованиям, так как высокочастотные составляющие импульсов оказывают повреждающее действие на нерв и его оболочку. Разработанный аппарат и методы лечения разрешены МЗ РФ. Новый метод лечения называется внутритканевая электростимуляция по А.А. Герасимову. Аппарат допускает одновременное лечение двух пациентов. Процедура безболезненна и комфортна, применяется у взрослых и детей. Отсутствие осложнений позволяет использовать метод в амбулаторной практике, то есть без необходимости госпитализации.
Методика лечения.
Специальную одноразовую иглу-электрод вводят на глубину кожи до контакта с остистым отростком пораженного позвонка и проводят по ней ток в течение 10-20 минут. Возможно последовательное лечение двух позвонков. Обычно курс лечения включает 4-6 процедур.
Полное устранение болей в позвоночнике у стационарных больных достигается в 85-90%, у амбулаторных больных – в 95% случаев. Эффект проявляется быстро. Хорошо изучены отдаленные последствия лечения. Длительность ремиссии (периода без рецидива боли) более чем в 3 раза превышает этот срок при традиционном комплексном лечении. Сроки лечения при использовании внутритканевой электростимуляции сокращаются в 2-4 раза.
С применением внутритканевой электростимуляции снижаются сроки временной утраты трудоспособности почти в два раза. Больные выписывались к труду без каких-либо клинических проявлений и нормализацией показателей при функциональных ислледованиях. Рецидивы в течение 2 лет после внутритканевой электростимуляции наблюдались всего в 5% случаев,
Особенно эффективна внутритканевая электростимуляция при некоторых синдромах, трудноподдающихся лечению традиционными методами, особенно с вегетативными нарушениями, например, при синдроме вертебральной артерии, синдроме плечелопаточного периартроза, эпикондилеза. Кроме того, метод оказался эффективен не только для устранения нейропатической боли, но и восстановления периферических нервов. Хороший эффект наблюдается у всех больных с грыжей диска, которая под воздействием электротока быстро покрывается плотной капсулой, прекращает увеличиваться и постепенно рассасывается.
Хорошо изучены основные механизмы лечебного действия внутритканевой стимуляции. 1. Общерефлекторный механизм заключается в воздействии на головной и спинной мозг и выработку естественных обезболивающих веществ. При этом восстанавливаются компенсаторные и адаптационные процессы в тканях пораженных позвонков, уменьшаются вегетативные дисфункции во всем организме. Происходит постепенная нормализация артериального давления, пульса, показателей общего анализа крови и других.
2. Местное действие заключается в воздействии тока на костную ткань. Различными инструментальными методами доказано, что воздействие тока приводит к локальному восстановлению кровообращения в пораженном позвонке. Следовательно, ликвидируется основная причина боли – раздражение болевых рецепторов в костных сосудах. Это улучшает питание и восстановление тканей.
3. При этом методе происходит возбуждение нервных клеток, восстановление нарушенной работы нервов, ускорение роста поврежденных нервов и восстановление их функций. Одна из причин болезни заключается в нарушении проводимости по нервам, ослаблении их трофической функции. Это вызывает не только неврологические нарушения, но нарушает обмен веществ и кровообращение конечности и костей. Электрический ток распространяется внутри организма по сосудам и нервам, оказывая благоприятный эффект.
Кроме того, при внутритканевой стимуляции происходит стимуляция внутренних органов, что положительно сказывается на их состоянии. Созданы эффективные методики лечения гастропатологии, бронхиальной астмы, патологии мочеполовой системы и других.
Метод лечения больных с остеоартрозами.
При остеоартрозе болевой синдром имеет похожие механизмы возникновения и развития, которые были указаны выше. В основе заболевания лежит нарушение кровообращения суставных концов костей. Оно приводит к недостатку питания гиалинового хряща, который со временем распадается. После лечения даже истонченный слой хряща может выполнять свою функцию еще многие годы при восстановлении адекватного кровообращения прилежащих участков кости.
При внутритканевой электростимуляции хорошие результаты наблюдаем на всех суставах, но особенно у больных с коксартрозом (остеоартрозом тазобедренного сустава). Бытует мнение, что при поздних стадиях артроза тазобедренного сустава консервативное лечение является бесполезным занятием и пустой тратой денег. Только оперативное лечение с заменой сустава на эндопротез является эффективным. Однако исследования показали, что внутритканевая электростимуляция дает хорошие результаты при лечении этого заболевания. Эффективность полного устранения боли методом внутритканевой стимуляции среди всех стадий составляет 88-92%. Периодическое лечение раз в 2-6 лет помогает жить без боли до конца жизни.
Отличные результаты получены и при лечении больных с головной болью, мигренью, функциональными нарушениями мозгового кровообращения и последствиями черепно-мозговой травмы. Эффект проявляется уже на 1 процедуре. Кроме того, улучшается память, сон, уменьшается депрессия.
Существует большое количество методик электростимуляции, которые воздействуют на кости, головной и спинной мозг, нервы. Все методики объединены одним принципом – внутритканевым воздействием. Метод электростимуляции можно использовать как основной и единственный, можно в комплексе с другими.
Таким образом, специально разработанный метод внутритканевой электростимуляции эффективно воздействует на костный рецепторный аппарат и устраняет болевой синдром. Эффективность устранения рефлекторных болей составляет свыше 90% с длительной и стойкой ремиссией. После лечение происходит не только устранение боли, но и расслабление мышц и восстановление нервов, а также сокращаются сроки лечения и не развиваются осложнения, что проверено тридцатилетней практикой. Методы электростимуляции уже внедрены и работают уже многие годы в большинстве областей страны и зарубежья.
Видео информацию о данном методе лечения можно посмотреть здесь .
Читайте также:


