Лечение герпесвирусных инфекций с помощью дендритных клеток
Коллектив авторов: Березина Л. К., Косякова Н. П., Веткова Л. Г., Степанова Т. Н., Савойская С. Л., Зубашев И. К., Клицунова Н. В., Ольшанская А. А., Рахманина М. М., Элизбарашвили Э. И., Мезенцева М. В., Куриц Т., Пронин А. В., Санин А. В., Наровлянский А. Н.; ГУ НИИЭМ им. Н. Ф. Гамалеи РАМН, НИИ вирусологии им. Д. И. Ивановского РАМН, ВГНКИ ветеринарных препаратов, г. Москва, РФ; Окриджская национальная лаборатория, Окридж, США.

Вирусы группы герпеса вызывают у домашних животных целый ряд заболеваний — болезнь Ауески, респираторные и глазные заболевания, герпесвирусный энцефалит, инфекционный ринотрахеит кошек и др. Возбудители относятся к семейству герпесвирусов — эти вирусы характеризуются наличием липопротеиновой оболочки и содержат 2-цепочечную ДНК. На основании фенотипических и генетических данных семейство герпесвирусов подразделяют на 3 подсемейства: α-, β-, и γ-герпесвирусов. Ранее, при лечении кошек, больных инфекционным ринотрахеитом (возбудитель — FHV-1, герпесвирус кошек типа 1, относящийся к подсемейству α-герпесвирусов), была установлена высокая терапевтическая эффективность таких противовирусных средств как фоспренил и максидин (1). При лечении других вирусных инфекций фоспренилом было показано, что в ряде случаев противовирусный эффект препарата может быть результатом активации некоторых звеньев врожденного иммунитета (синтез интерферона и ряда других цитокинов, активация макрофагов и естественных киллерных клеток), обеспечивающих повышение неспецифической резистентности организма (2). В настоящей работе изучали противовирусную эффективность аналога фоспренила — МПФ, фосфорилированного полипренола, выделенного из древесной листвы и отличающегося от фоспренила не только происхождением (полипренолы для фоспренила выделяют из хвои), но и длиной полипренольной цепи. Оценку эффективности МПФ проводили при экспериментальной герпетической инфекции у мышей, при экспериментальном генитальном герпесе у морских свинок, при летальной инфекции кроликов, вызванных вирусом болезни Ауески, а также при инфекционном ринотрахеите кошек.
1. Экспериментальная герпетическая инфекция у мышей
Модель экспериментальной герпетической инфекции у мышей воспроизводили на белых беспородных мышах массой 10 – 12 г . Для заражения использовали вирус простого герпеса 1 типа (ВПГ-1) штамм Л2 (коллекция вирусов НИИ вирусологии им. Д. И. Ивановского) в титре 7 lg ЛД50/0,03 мл. Мышей заражали внутрибрюшинно (в/б) вируссодержащей 10%-ной суспензией мозга мышей (доза — 100 ЛД50). МПФ вводили в дозе 400 мкг/мышь/0,2 мл в/б по 2-м схемам: профилактической (за 24 часа до заражения ВПГ-1) и лечебно-профилактической (одновременно с ВПГ-1). В качестве референс-препарата использовали коммерческий препарат ридостин, который вводили в дозе 100 мкг/мышь за 24 часа до заражения ВПГ-1. В каждой группе было по 10 мышей, срок наблюдения составил 15 дней. Противовирусную активность определяли по увеличению процента выживаемости животных, увеличению средней продолжительности жизни (СПЖ). Наибольший эффект был обнаружен у МПФ при лечебно-профилактической схеме введения (0 час) — выживаемость составила 90%, защита — 50%, а СПЖ — 14,1±0,85. Аналогичным эффектом обладал и эталонный противовирусный препарат ридостин (защита составила 50%, а СПЖ — 14,3±0,66. В контроле выживаемость была 40%, а СПЖ — 10,0±1,31.
Для доказательства противовирусной активности препаратов были проведены опыты биологического титрования вируса из мозга мышей на клетках VERO. Титр ВПГ-1 в ткани мозга опытных и контрольных мышей, взятой на 6-й день после заражения, определяли в результате обработки культуры клеток 10-кратными разведениями суспензии мозга мышей. Наблюдение и учет ЦПД осуществляли на 3 – 4 день после контакта клеток с инфекционным материалом. Титр ВПГ-1, полученного из мозга контрольных мышей составил 5 lg ТЦД50/мл. Титры ВПГ-1 из мозга мышей, которым вводили МПФ, составляли 2,0 (-24 ч) и 1,5 (0 ч) lg ТЦД50/мл, соответственно. Таким образом, МПФ существенно снижал титр вируса (на 3,5 – 2,0 lg), что было сопоставимо с противовирусным действием ридостина, который снижал титр вируса на 3,5 (-24 ч) lg ТЦД50/мл.
2. Генитальный герпес морских свинок
При воспроизведении модели экспериментального генитального герпеса у самцов морских свинок использовали ВПГ 2 типа (штамм ЕС, титр 6 lg ТЦД50/мл). Степень выраженности инфекционного процесса оценивали по 4-балльной шкале, учитывая 4 основных признака: гиперемию, отечность, специфические элементы (везикулы, пустулы, изъязвления), орхит. МПФ вводили в/б в дозе 4мг, 4-кратно: за 24 часа до инфицирования, в момент заражения, через 24 и 48 часов после инфицирования. Показано, что МПФ оказывал выраженный статистически достоверный (р
3. Болезнь Ауески кроликов
4. Инфекционный ринотрахеит кошек
Исследование влияния МПФ на течение инфекции, вызванной вирусом ринотрахеита (ВРТ), проводили на 9 беспородных разнополых котятах в возрасте от 1,5 до 3,5 месяцев. До заражения смывы носоглоточные и конъюнктивы глаз, а также кал исследовали на наличие герпес-, парво- и калицивирусов методом ПЦР. После заражения ВРТ кал котят также исследовали методом электронной микроскопии. Сыворотку крови котят, полученную до заражения, исследовали на наличие вируснейтрализующих антител к ВРТ в реакции нейтрализации на культуре клеток.
В опытную группу были взяты 5 котят, а в контрольную — 4 котенка. Заражение каждого котенка проводили внутримышечно (в/м) по 1,0 мл, перорально (п/о) и интраназально по 0,5мл вируса (активность вируса равна 6,0 ТЦД50/мл). При обнаружении клинических признаков заболевания проводили лечение 0,4% раствором МПФ перорально в дозе 0,3 – 0,7мл. Наблюдение за состоянием котят вели с момента заражения до выздоровления в опыте в течение 3 – 5 недель.
Обследование котят до заражения, проведенное с помощью ПЦР, показало, что у двоих котят был обнаружен калицивирус, а у одного из них также и ВРТ. Титр нейтрализующих антител к вирусу герпеса у всех обследованных котят варьировал от 4,0 до 9,0 lоg.
По результатам электронной микроскопии были обнаружены единичные вирионы герпеса и калицивирусов у двух котят, а единичные вирионы калицивируса и парвовируса — у четырех.
Таким образом, заражение животных ВРТ в некоторых случаях производилось на фоне смешанной инфекции.

Лечение с помощью МПФ начинали с момента появления клинических признаков заболевания (депрессия, тусклая шерсть, обезвоживание, понос, рвота, отказ от еды, язвы в ротовой полости). МПФ вводили п/о в дозе 0,3 мл первые 2 дня, а затем по 0,5мл, а также орошали слизистую ротовой полости дважды в день. В качестве вспомогательной терапии использовали кламоксил, гамавит и пиобактериофаг, а для снятия обезвоживания — физиологический раствор и глюкозу 5%.
По предварительным результатам, клиническое выздоровление наступило у двух котят на 6 – 8-е сутки (исчезновение язв, снижение обезвоживания, повышение активности, улучшение состояния шерсти), а у трех котят лечение МПФ в дозе 0,7 мл дважды в день в сочетании с орошением ротовой полости привело к выздоровлению на 3 – 4-е сутки. Исчезновение признаков заболевания в контрольной группе животных наступало на 22 – 30-е сутки.
Таким образом, МПФ — препарат, во многом аналогичный фоспренилу, обладает высокой эффективностью при лечении инфекций, вызванных вирусами группы герпеса у различных животных. Возможные механизмы терапевтической активности МПФ служат предметом дальнейшего изучения.
Библиография
2. Pronin A. V., Grigorieva E. A., Sanin A. V., Narovlyansky A. N., Ozherelkov S. V., Deyeva A. V., Danilov L. L., Maltsev S. D., Najid A. Polyprenols as possible factors that determine the instructive role of innate immunity in the acquired immune response. Russian J. Immunol. 2002, v. 7, № 2, p. 135 – 142.
Summary
NOVEL APPROACH TO TREATMENT OF ANIMAL HERPES VIRUS INFECTIONS
Berezina L. K., Kosyakova N. P., Vetkova L. G., Stepanova T. N., Savoyskaya S. L., Zubashev I. K., Klitsunova N. V., Olshanskaya A. A., Rakhmanina M. M., Elizbarashvilli E. I., Mezentseva M. V., Kuritz T., Pronin A. V., Sanin A. V., Narovliansky A. N. N. F.Gamaleya Research Inst. for Epidemiology and Microbiology, Moscow, D. I. Ivanovsky Research Inst. for Virology, Moscow, All-Russian State Research Institute for Control, Standardization and Certification of Veterinary Preparations, Moscow, National Oak Ridge Lab., Oak Ridge, USA.
A novel approach has been attempted to treat herpes virus infections in animals using MPP, a new medicine derived from plant polyprenols. MPP was shown to possess a very high therapeutic efficiency during treatment of some herpes virus infections: experimental mouse herpes virus infection, guinea pig genital herpes infection, Aueski disease of rabbits and feline viral rhinotracheitis.
По материалам Ветеринарного Конгресса, 2005 г .
[youtube.player]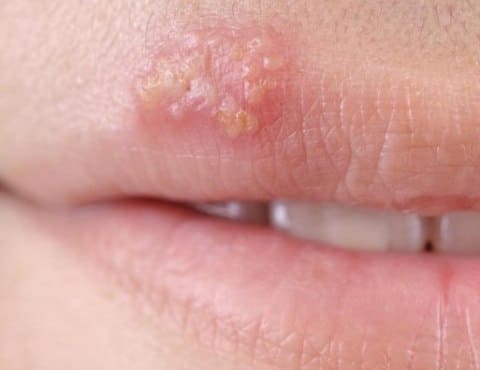
Проявления простого герпеса
Разработанные схемы терапии герпетической инфекции включают противовирусную (ацикловир, валацикловир, фамцикловир и другие) и иммуномодулирующую (интерфероны, индукторы эндогенного интерферона, иммунопрепараты других групп) терапию, что достаточно эффективно на определенном этапе течения заболевания. Большинство схем терапии направлены на стихание самого обострения болезни, но не направлены на долгосрочный эффект. Такой терапии не всегда оказывается достаточно для достижения желаемого результата – сокращения рецидивов до минимума. Определенной проблемой является и развитие резистентности (устойчивости) вирусов к противовирусным препаратам, особенно применяемым бесконтрольно и без назначения врача. В связи с этим научные разработки пошли дальше. Разработаны препараты и схемы вакцинотерапии хронической герпетической инфекции. Но и у этих методов оказалась недостаточная максимальная активность. Дошла очередь до новейших научных основе лечения с помощью специфических дентритных клеток.
Целью данного метода является создание дендритно-клеточных вакцин нового поколения, способных решить одну простую задачу – снижение клинических проявлений герпетической инфекции и сокращение частоты рецидивов до минимума с помощью экономически выгодного способа иммунотерапии хронической рецидивирующей герпетической инфекции. Достижение поставленной задачи достигается путем генерации из моноцитов периферической крови пациента аутологичных интерферон-альфа индуцированных дендритных клеток, нагруженных рекомбинантным антигеном вируса простого герпеса в культуре invitro, которые больной получает 2мя курсами в сочетании с препаратом рекомбинантного интерлейкина-2 в качестве адъюванта (препарата, усиливающего иммунный ответ). Именно за счет интерлейкина-2 идет активация Т-клеток, предупреждаются процессы апоптоза (клеточной гибели) лимфоцитов, синтеза долго живущих цитотоксических Т-лимфоцитов.
Ожидаемым результатом терапии является выработка цельного антиген-специфического иммунного ответа высокого уровня на длительный период времени.
Показания к лечению
Показанием для ДК-вакцинации является хроническая герпетическая инфекция, часто рецидивирующая форма при частоте рецидивов более 6 раз в год, причем с момента последнего рецидива должно пройти не менее 2х недель (то есть в период ремиссии).
Как проводится лечение дендритными клетками
Техническое выполнение метода состоит в следующем: пациент госпитализируется в стационар, где проводится генерация дендроклеток из периферической крови больного. В утренние часы отбирается 200 мл крови во флакон с гепарином (1000 Ед), к которой добавляется раствор желатиноля (40 мл) и проводится инкубация при 370 в течение 45 минут. Образуется лейкоцитарная взвесь, которую центрифугируют в течение 20 минут при 1000 об/мин. Осажденные клетки омывают фосфат-забуферным физиологическим раствором (PBS), наслаивают на градиент плотности фиккола-верографина и опять же центрифугируют 20 минут, но уже при 3000 об/мин. Собранные мононуклеарные клетки (МНК) подвергаются дополнительной обработке (дважды омываются, ресуспендируются) до выделения МНК в концентрации 3*106/мл, которые инкубируют при 370 в течение 2х часов (это незрелыедендроклетки). В последующем клетки проходят вновь дополнительную обработку, нагрузку интерфероном-альфа 1000 Ед/мл (Роферон-А, Roche, Швецария), повторную культивацию в течение 3х часов. Затем в присутствии препарата полиоксидоний (НПО ПетроваксФарм, Россия) в дозе 2 нг/мл и происходит окончательное созревание дентритных клеток.
Полученный препарат (специфические ИФН-ДК) в концентрации 6,0 * 106/мл криоконсервируют для последующего использования. Весь процесс изготовления длится 4 суток.
Методика ДК-вакцинации
Методика ДК-вакцинации с применением данного препарата состоит их 2х курсов вакцинотерапии:
Контроль эффективности ДК-вакцинации проводят путем определения уровня пролиферативного ответа МНК на стимуляцию вакцинальным антигеном вируса герпеса (HSV 1gD) и митогеном (конканавалином А). У пациента забирается 10 мл венозной крови, которая подвергается обработке и в течение 72 часов оценивается уровень пролиферации и другие составляющие исследования. Результат предоставляется в виде среднего счета (имп/мин) их трех идентичных культур. Контроль проводится 4 раза: до лечения, после 1 курса, после 2 курса и через 6 месяцев после окончания терапии (последнее исследование через 15 месяцев после начала лечения).
Пргноз лечения
Использование данного метода ДК-вакцинации с применением ИФН-ДК вакцин выявил 75%ную эффективность у пациентов с часто рецидивирующей формой герпетической инфекции. Так, частота рецидивов у пациентов снижалась в 3 раза, причем сокращалась и общая площадь поражений при обострении, длительность ремиссии (межрецидивных периодов) удлиннялась до 3х и более месяцев. Также отмечалось улучшение показателей специфического антиген-индуцированного иммунного ответа как после второго курса вакцинации, так и через 6 месяцев после окончания лечения.
Таким образом, можно говорить о появлении нового эффективного метода ДК-вакцинации, способного стимулировать выработку антиген-специфического иммунного ответа не только в период вакцинотерапии, но и через 6 месяцев после завершения лечения, что безусловно повлияет на частоту рецидивов при данной болезни и качество жизни пациентов с хронической часто рецидивирующей герпетической инфекцией.
[youtube.player]*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Герпесвирусы широко распространены в человеческой популяции. После первичного инфицирования вирусы герпесгруппы переходят в латентное состояние и пожизненно персистируют в организме. При неблагоприятных условиях и снижении местного или системного иммунитета может происходить реактивация инфекции, что обусловливает развитие воспаления чаще всего на местном уровне. Разнообразие клинических форм герпесвирусных инфекций постоянно поддерживает научный интерес как в области изучения их патофизиологии, так и в области поиска эффективной противовирусной терапии. Особенно актуально это для β- и γ-герпесвирусов, т. к. группа α-герпесвирусов изучена достаточно хорошо.
Цель исследования: определить эффективность валацикловира в отношении репликации вируса Эпштейна – Барр (ВЭБ), вируса герпеса человека 6 типа (ВГЧ-6), цитомегаловируса (ЦМВ) в ротоглотке у часто болеющих взрослых с хроническими воспалительными заболеваниями верхних дыхательных путей (ВДП).
Материал и методы: нами амбулаторно обследованы 80 пациентов с частыми рецидивами хронических воспалительных заболеваний ВДП. Всем пациентам проводились микробиологическое исследование мазков из ротоглотки и оценка вирусной нагрузки в смешанной слюне и цельной крови вне периода обострения. Пациенты получали терапию валацикловиром по схеме 500 мг 3 р./сут в течение 14 дней. Контроль вирусной нагрузки в биоматериале проводился после окончания лечения.
Результаты и обсуждение: микробный пейзаж ротоглотки часто болеющих взрослых вне периода обострения представлен преимущественно нормальной или условно-патогенной микрофлорой. В смешанной слюне обнаруживалась ДНК ВЭБ, ВГЧ-6, но не ЦМВ. При этом в образцах крови указанных пациентов ДНК вирусов герпесгруппы не выявлялась. Применение валацикловира в дозе 500 мг 3 р./сут достоверно снижает репликацию ВЭБ в ротоглотке у часто болеющих взрослых.
Выводы: целесообразно провести дальнейшие исследования по определению режима дозирования и оценке клинической эффективности ациклических нуклеозидов в лечении ВЭБ-инфекции.
Ключевые слова: герпесвирусы, вирус Эпштейна – Барр, вирус герпеса человека, цитомегаловирус, часто болеющие взрослые, вирусная нагрузка, валацикловир.
Для цитирования: Щубелко Р.В., Зуйкова И.Н., Шульженко А.Е. Герпесвирусные инфекции человека: клинические особенности и возможности терапии. РМЖ. 2018;8(I):39-45.
Human herpesviruses infections: clinical features and opportunities of therapy
R.V. Shubelko 1 , I.N. Zuykova 2 , A.E. Shulzhenko 2
1 JSC "K+31", Moscow
2 “National Research Center — Institute of Immunology” Federal Medical-Biological Agency of Russia, Moscow
Herpesviruses are widely spread among the human population. After the primary infection, the herpesviruses become latent and persistent in the human body for life. Adverse conditions and a low local or systemic immunity may reactivate the infection, which causes the inflammation, usually at the local level. The variety of clinical forms of herpesviruses infections constantly supports scientific interest both in the field of studying their pathophysiology and in the search for effective antiviral therapy. This is especially important for β- and γ-herpesviruses, since the α-herpesvirus group has been studied rather well.
Aim: to determine the efficacy of valacyclovir for replication of the Epstein-Barr virus (EBV), human herpesvirus type 6 (HHV-6), cytomegalovirus (CMV) in the oropharynx in frequently ill adults with chronic inflammatory diseases of the upper respiratory tract.
Patients and Methods: 80 patients with frequent recurrences of chronic inflammatory diseases of the upper respiratory tract were examined outpatiently. All patients underwent microbiological examination of swabs from the oropharynx and the viral load in mixed saliva and whole blood not in exacerbation period was assessed. Patients received valacyclovir therapy according to the scheme 500 mg x 3 times a day for 14 days. Control of viral load in the biomaterial was carried out after the end of treatment.
Results and Discussion: out of the period of exacerbation the oropharynx microflora in frequently ill adults is represented mainly by a normal or conditionally pathogenic microflora. EBV DNA, HHV-6, but not CMV DNA, were detected in the mixed saliva. The DNA of the herpesvirus was not detected in the blood samples of these patients. The use of valacyclovir in a dose
of 500 mg 3 times a day significantly reduces the replication of EBV in the oropharynx in frequently ill adults.
Conclusions: it is advisable to conduct further studies to determine the dosage regimen and evaluate the clinical efficacy of acyclic nucleosides in the treatment of EBV infection.
Key words: herpes viruses, Epstein-Barr virus, human herpes virus, cytomegalovirus, frequently ill adults, viral load, valacyclovir.
For citation: Shubelko R.V., Zuykova I.N., Shulzhenko A.E. Human herpesviruses infections: clinical features and opportunities of therapy // RMJ. 2018. № 8(I). P. 39–45.
В статье рассмотрены клинические особенности и возможности терапии герпесвирусных инфекции человека. Определена эффективность валацикловира в отношении репликации вируса Эпштейна – Барр, вируса герпеса человека 6 типа, цитомегаловируса.
Только для зарегистрированных пользователей
[youtube.player]Полный текст:
д.м.н., ведущий научный сотрудник, лаборатория клеточной иммунотерапии,
630099, г. Новосибирск, ул. Ядринцевская, 14,
к.м.н., заслуженный врач РФ, заведующая отделением иммунологии клиники иммунопатологии,
врач-иммунолог отделения иммунологии клиники иммунопатологии,
к.м.н., врач-иммунолог отделения иммунологии клиники иммунопатологии,
аспирант, лаборатория клеточной иммунотерапии,
к.м.н., научный сотрудник лаборатории клеточной иммунотерапии,
д.м.н., профессор, главный научный сотрудник лаборатории клеточной иммунотерапии,
д.м.н., профессор, член-корр. РАН, заведующая лабораторией клеточной иммунотерапии,
1. Веретенникова М. Современная фармакотерапия герпеса с использованием различных лекарственных форм // Фундаментальные исследования, 2014. № 8. С. 1630-1634. [Veretennikova M.A. Current treatment of herpes with using different pharmaceutical forms. Fundamental`nye issledovaniya = Fundamental Research, 2014, no. 8, pp. 1630-1634. (In Russ.)]
2. Желтова О.И., Старостина Н.М., Тихонова М.А., Леплина О.Ю., Черных Е.Р., Останин А.А. Особенности иммунитета больных с хроническими рецидивирующими инфекциями // Иммунология, 2011. № 4. С. 205-209. [Zheltova O.I., Starostina N.M., Tikhonova M.A., Leplina O.Yu., Chernykh E.R., Ostanin A.A. Immunity features of patients with chronic recurrent infections. Immunologiya = Immunology, 2011, no. 4, pp. 205-209. (In Russ.)]
3. Леплина О.Ю, Желтова О.И., Борисова А.Е.. Старостина Н.М, Останин А.А., Черных Е.Р. Вакцины на основе дендритных клеток в лечении герпетической инфекции // Вестник Уральской медицинской академической науки, 2011. №2/2 (35). С. 38-39. [Leplina O.Yu., Zheltova O.I., Borisova A.E., Starostina N.M., Ostanin A.A., Chernykh E.R. Dendritic cells vaccines in the treatment of herpetic infection. Vestnik Ural`skoy meditsinskoy akademicheskoy nauki = Bulletin of the Ural Medical Academic Science, 2011, no. 2/2 (35), pp. 38-39. (In Russ.)]
4. Черных Е.Р., Леплина О.Ю., Тихонова М.А., Курганова Е.В., Стрельцова Е.И., Останин А.А., Козлов В.А. Феномен Т-клеточной анергии при хирургическом сепсисе // Медицинская иммунология, 2003. Т. 5, № 5/6. С. 529-538. [Chernykh E.R., Leplina O.Yu., Tikhonova M.A., Kurganova E.V., Streltsova E.I., Ostanin A.A., Kozlov V.A. T cell anergy in surgical sepsis. Meditsinskaya immunologiya = Medical Immunology (Russia), 2003, Vol. 5, no. 5-6, pp. 529-538. (In Russ.)]
5. Шульженко А.Е., Зуйкова И.Н. Подходы к иммунотерапии рецидивирующего простого герпеса // Эффективная фармакотерапия в акушерстве и гинекологии, 2010. №3. C. 44-49. [Shulzhenko A.E., Zuikova I.N. Approaches to the immunotherapy of recurrent herpes simplex. Effektivnaya farmakoterapiya v akusherstve i ginekologii = Effective Pharmacotherapy, 2010, no. 3, pp. 44-49. (In Russ.)]
6. Aurelian L. Herpes simplex virus type 2 vaccines: new ground for optimism? Clin. Diagn. Lab. Immunol., 2004, Vol. 11, no. 3, pp. 437-445.
7. Bedoui S., Gebhardt T. Interaction between dendritic cells and T cells during peripheral virus infections: a role for antigen presentation beyond lymphoid organs. Curr. Opin. Immunol., 2011, Vol. 23, no. 1, pp. 124-130.
8. Bedoui S., Greyer M. The role of dendritic cells in immunity against primary herpes simplex virus infections. Front Microbiol., 2014, no. 5, p. 533.
9. BenMohamed L., Bertrand G., McNamara C.D., Gras-Masse H., Hammer J., Wechsler S.L., Nesburn A.B. Identification of novel immunodominant CD4+ Th1-type T-cell peptide epitopes from herpes simplex virus glycoprotein D that confer protective immunity. J. Virol., 2003, Vol. 77, no. 17, pp. 9463-9473.
10. Bettahi I., Zhang X., Afifi R.E., BenMohamed L. Protective immunity to genital herpes simplex virus type 1 and type 2 provided by self-adjuvanting lipopeptides that drive dendritic cell maturation and elicit a polarized Th1 immune response. Viral. Immunol., 2006, Vol. 19, no. 2, pp. 220-236.
11. Bitan M., Weiss L., Reibstein I., Zeira M., Fellig Y., Slavin S., Zcharia E., Nagler A., Vlodavsky I. Heparanase upregulates Th2 cytokines, ameliorating experimental autoimmune encephalitis. Mol. Immunol., 2010, Vol. 47, no. 10, pp. 1890-1898.
12. Bourne N., Bravo F.J., Francotte M., Bernstein D.I., Myers M.G., Slaoui M., Stanberry L.R. Herpes simplex virus (HSV) type 2 glycoprotein D subunit vaccines and protection against genital HSV-1 or HSV-2 disease in guinea pigs. J Infect Dis., 2003, Vol. 187, no. 4, pp. 542-549.
13. Chi C.C., Wang S.H., Delamere F.M., Wojnarowska F., Peters M.C., Kanjirath P.P. Interventions for prevention of herpes simplex labialis (cold sores on the lips). Cochrane Database Syst Rev., 2015, no. 8, CD010095.
14. Cunninghama A., Griffithsb P., Leonec P., Mindeld A., Patele R., Stanberryf L., Whitleyg R. Current management and recommendations for access to antiviral therapy of herpes labialis. J. Clin. Virol., 2012, Vol. 53, no. 1, pp. 6-11.
15. Della Bella S., Nicola S., Riva A., Biasin M., Clerici M., Villa M.L. Functional repertoire of dendritic cells generated in granulocyte macrophage-colony stimulating factor and interferon-α. J. Leukoc. Biol., 2004, Vol. 75, no. 1, pp. 106-116.
16. Dhodapkar M.V., Steinman R.M., Sapp M., Desai H., Fossella C., Krasovsky J., Donahoe S.M., Dunbar P.R., Cerundolo V., Nixon D.F., Bhardwaj N. Rapid generation of broad T-cell immunity in humans after a single injection of mature dendritic cells. J. Clin. Invest., 1999, Vol. 104, no. 2, pp. 173-180.
17. Dyakonova V.A., Dambaeva S.V., Pinegin B.V., Khaitov R.M. Study of interaction between the polyoxidonium immunomodulator and the human immune system cells. Int. Immunopharmacol., 2004, Vol. 4, no. 13, pp. 1615-1623.
18. García F., Plana M., Climent N., Leon A., Gatell J.M., Gallart T. Dendritic cell based vaccines for HIV infection: the way ahead. Hum. Vaccin. Immunother., 2013, Vol. 9, no. 11, pp. 2445-2452.
19. Ghasemi M., Erturk M., Buruk K., Sonmez M. Induction of potent protection against acute and latent herpes simplex virus infection in mice vaccinated with dendritic cells. Cytotherapy, 2013, Vol. 15, no. 3, pp. 352-361.
20. Kabanov V.A. From synthetic polyelectrolytes to polymer-subunit vaccines. Pure Appl. Chem., 2004, Vol. 76, no. 9, pp. 1659-1677.
21. Kobelt D., Lechmann M., Steinkasserer A. The interaction between dendritic cells and herpes simplex virus-1. Curr. Top. Microbiol. Immunol., 2003, Vol. 276, pp. 145-161.
22. Korthals M., Safaian N., Kronenwett R., Maihofer D., Schott M., Papewalis C., Diaz Blanco E., Winter M., Czibere A., Haas R., Kobbe G., Fenk R. Monocyte derived dendritic cells generated by IFN-alpha acquire mature dendritic and natural killer cell properties as shown by gene expression analysis. J. Transl. Med., 2007, Vol. 5, pp. 46-57.
23. Le Cleach L., Trinquart L., Do G., Maruani A., Lebrun-Vignes B., Ravaud P., Chosidow O. Oral antiviral therapy for prevention of genital herpes outbreaks in immunocompetent and nonpregnant patients. Cochrane Database Syst Rev., 2014, no. 8, CD009036.
24. Lebrun-Vignes B., Bouzamondo A., Dupuy A., Guillaume J.C., Lechat P., Chosidow O. A meta-analysis to assess the efficacy of oral antiviral treatment to prevent genital herpes outbreaks. J. Am. Acad. Dermatol., 2007, Vol. 57, no. 2, pp. 238-246.
25. Lee H.K., Zamora M., Linehan M.M., Iijima N., Gonzalez D., Haberman A., Iwasaki A. Differential roles of migratory and resident DCs in T cell priming after mucosal or skin HSV-1 infection. J. Exp. Med., 2009, Vol. 206, no. 2, pp. 359-370.
26. Luo J., Li J., Chen R.L., Nie L., Huang J., Liu Z.W., Luo L., Yan X.J. Autologus dendritic cell vaccine for chronic hepatitis B carriers: A pilot, open label, clinical trial in human volunteers. Vaccine, 2010, Vol. 28, no. 13, pp. 2497-2504.
27. McKenna D.B., Neill W.A., Norval M. Herpes simplex virus specific immune responses in subjects with frequent and infrequent orofacial recrudescences. Br. J. Dermatol., 2001, Vol. 144, no. 3, pp. 459-464.
28. Mysliwska J., Trzonkowski P., Bryl E., Lukaszuk K., Myśliwski A. Lower interleukin-2 and higher serum tumor necrosis factor levels are associated with perimenstrual, recurrent, facial herpes simplex infection in young women. Eur. Cytokine Netw., 2000, Vol. 11, no. 3, pp. 397-406.
29. Pollara G., Speidel K., Samady L., Rajpopat M., McGrath Y., Ledermann J., Coffin R.S., Katz D.R., Chain B. Herpes simplex virus infection of dendritic cells: balance among activation, inhibition, and immunity. J. Infect. Dis., 2003, Vol. 187, no. 2, pp. 165-178.
30. Powell B.S., Andrianov A.K., Fusco P.C. Polyionic vaccine adjuvants: another look at aluminum salts and polyelectrolytes. Clin. Exp. Vaccine Res., 2015, Vol. 4, no. 1, pp. 23-45.
31. Rooney J.F., Straus S.E., Mannix M.L., Wohlenberg C.R., Alling D.W., Dumois J.A. Notkins A.L. Oral acyclovir to suppress frequently recurring herpes labialis. A double-blind, placebo-controlled trial. Ann. Intern. Med., 1993, Vol. 118, no. 4, pp. 268-272.
32. Sancho-Shimizu V., Perez De Diego R., Jouanguy E., Zhang S.Y., and Casanova, J. L. Inborn errors of anti-viral interferon immunity in humans. Curr. Opin. Virol., 2011, Vol. 1, no. 6, pp. 487-496.
33. Santini S., Pucchini T., Lapenta C., Parlato S., Logozzi M., Belardelli F. A new type 1 IFN-mediated pathway for the rapid differentiation of monocytes into highly active dendritic cells. Stem. Сells, 2003, Vol. 21, no. 3, pp. 357-362.
34. Schon E., Harandi A.M., Nordstrom I., Holmgren J., Eriksson K. Dendritic cell vaccination protects mice against lethality caused by genital herpes simplex virus type-2 infection. J. Reprod. Immunol., 2001, Vol. 50, no. 2, pp. 87-104.
35. Shin H., Iwasaki A. Generating protective immunity against genital herpes. Trends Immunol., 2013, Vol. 34, no. 10, pp. 487-494.
36. Singh R., Kumar A., Creery W.D., Ruben M., Giulivi A., Diaz-Mitoma F. Dysregulated expression of IFN-gamma and IL-10 and impaired IFN-gamma-mediated responses at different disease stages in patients with genital herpes simplex virus-2 infection. Clin. Exp. Immunol., 2003, Vol. 133, no. 1, pp. 97-107.
37. Stanberry L.R., Cunningham A.L., Mindel A., Scott L.L., Spruance S.L., Aoki F.Y., Lacey C.J. Prospects for control of herpes simplex virus disease through immunization. Clin. Infect. Dis., 2000, Vol. 30, no. 3, pp. 549-566.
38. Stanberry L.R., Spruance S.L., Cunningham A.L., Bernstein D.I., Mindel A., Sacks S., Tyring S., Aoki F.Y., Slaoui M., Denis M., Vandepapeliere P., Dubin G. GlaxoSmithKline Herpes Vaccine Efficacy Study Group. Glycoprotein-D-adjuvant vaccine to prevent genital herpes. N. Engl. J. Med., 2002, Vol. 347, no. 21, pp. 1652-1661.
39. Straus S.E., Takiff H.E., Seidlin M., Bachrach S., Lininger L., Di Giovanna J.J., Western K.A., Smith H.A., Lehrman S.N., Creagh-Kirk T. Suppression of frequently recurring genital herpes. A placebo-controlled double-blind trial of oral acyclovir. N. Engl. J. Med., 1984, Vol. 310, no. 24, pp. 1545-1550.
40. Thurner B., Roder C., Dieckmann D., Heuer M., Kruse M., Glaser A., Keikavoussi P., Kampgen E., Bender A., Schuler G. Generation of large numbers of fully mature and stable dendritic cells from leukapheresis products for clinical applications. J. Immunol. Meth., 1999, Vol. 223, no. 1, pp. 1-15.
41. Van Lint A., Ayers M., Brooks A.G., Coles R.M., Heath W.R., Carbone F.R. Herpes simplex virus-specific CD8+ T cells can clear established lytic infections from skin and nerves and can partially limit the early spread of virus after cutaneous inoculation. J. Immunol., 2004, Vol. 172, no. 1, pp. 392-397.
42. Zabaleta A., D’Avola D., Echeverria I., Llopiz D., Silva L., Villanueva L., Riezu-Boj J., Larrea E., Pereboev A., Lasarte J., Rodriguez-Lago I., Inarrairaegui M., Sangro B., Prieto J., Sarobe P. Clinical testing of a dendritic cell targeted therapeutic vaccine in patients with chronic hepatitis C virus infection. Mol. Ther. Methods Clin. Dev., 2015, Vol. 2, p. 15006.
43. Zhu J., Peng T., Johnston C., Phasouk K., Kask A.S., Klock A. Immune surveillance by CD8-α + skin-resident T cells in human herpes virus infection. Nature, 2013, Vol. 497, pp. 494-497.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:



