Лечение инфекционного эндокардита протезированного клапана
Инфекционный эндокардит протезированных клапанов
К инфекционному эндокардиту предрасполагают любые внутрисосудистые инородные тела: протезированный клапан (10-20% случаев инфекционного эндокардита), сосудистые швы, электроды кардиостимулятора, тефлоновые или силиконовые катетеры. При этом не только повышен риск, но и затруднено лечение инфекционного эндокардита.
Среди больных с эндокардитом протезированных клапанов преобладают мужчины старше 60 лет. В течение первого года после протезирования клапана инфекционный эндокардит развивается у 1-2% больных, каждый последующий год — еще у 0,5%. Протезированный аортальный клапан поражается чаще, чем митральный. Воспалительный процесс обычно развивается по линии швов.
Ранний (в первые 60 дней после операции) эндокардит возникает вследствие обсеменения протезированного клапана во время операции или послеоперационной бактериемии. При позднем эндокардите (особенно в первый год после операции) механизм инфицирования клапана часто тот же, но инкубационный период дольше. Причиной позднего эндокардита может быть и преходящая бактериемия.
Возбудителями 50% ранних и 30% поздних эндокардитов бывают стафилококки. причем Staphylococcus epidermidis чаще, чем Staphylococcus aureus. Грамотрицательные бактерии обнаруживаются у 15% больных, грибы (в основном Candida spp. ) — у 10% (при позднем эндокардите — реже). При обильных вегетациях (часто грибковой этиологии) может нарушаться функция протезированного клапана. Поздние эндокардиты у 40% больных бывают вызваны стрептококками. При ранних эндокардитах они обнаруживаются редко.
Для раннего эндокардита характерно молниеносное течение с острой околоклапанной недостаточностью (из-за отрыва пришивного кольца). Поздний эндокардит иногда тоже бывает молниеносным, но в большинстве случаев, особенно при стрептококковой этиологии, от инфекционного эндокардита естественных клапанов не отличается.
Мы предполагаем, что вам понравилась эта презентация. Чтобы скачать ее, порекомендуйте, пожалуйста, эту презентацию своим друзьям в любой соц. сети.
Итак, чтобы скачать:
Шаг 1. Посмотрите, ниже находятся кнопочки всех популярных соцсетей. Наверняка Вы гдето зарегистрированы. Воспользуйтесь одной из кнопок, чтобы порекомендовать своим друзьям презентацию.
Спасибо за посильную помощь нашему порталу!
Особенности эндокардита искусственных клапанов
Инфекционный эндокардит возникает у 0,7-3,8% больных с протезами клапанов сердца. Он может возникать у пациентов после коррекции неинфицированных пороков сердца и как рецидив инфекционного эндокардита, развившийся после операции.
Инфекционный эндокардит (ИЭ) искусственных клапанов подразделяется по срокам возникновения после операции на ранний (в течение 2 мес) и поздний (> 2 мес после операции).
Возбудители раннего эндокардита искусственных клапанов сердца: коагулазаотрицательные стафилококки, S. aureus. S. epidermicis , энтеробактерии, грамотрицательные палочки, дифтероиды, Candida spp. Aspergillus spp .
Возбудители позднего эндокардита ИКС: зеленящий стрептококк, Enterococcus spp. S. aureus. S. epidermidis , стафилококки.
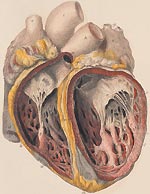
При инфекционном эндокардите искусственный клапан сердца на манжете механических протезов, на створках биопротезов могут образовываться вегетации, возможно формирование парапротезных фистул и частичный отрыв протеза. При инфекции биопротеза, кроме кольца, поражаются и створки с возможной их перфорацией и развитием недостаточности клапана.
При наличии вегетации могут возникнуть следующие осложнения:
• эмболия сосудов большого круга кровообращения — при локализации вегетации на митральном или аортальном клапане, и эмболии легочной артерии — при локализации их на трикуспидальном клапане;
• вегетации могут препятствовать нормальному движению запирателыюго элемента; вследствие чего развивается клапанная регургитация;
• при наличии массивных вегетации возможна обструкция протеза (это осложнение встречается достаточно редко).
При инфекционном эндокардите инфекция может распространяться на околоклапанные структуры, что приводит к образованию абсцессов клапанного кольца с возможным развитием в дальнейшем абсцессов корня аорты и миокарда, АВ-блокады. Абсцессы сердца при инфекционном эндокардите могут образовываться вследствие эмболии мелких ветвей коронарных артерий бактериальными тромбами.
Диагностика инфекционного эндокардита ИКС основывается на данных анамнеза, клинических данных, лабораторных показателях, ЭхоКГ (в том числе чреспищеводная ЭхоКГ), результатах посевов крови; в последние годы применяется метод молекулярной диагностики, направленный на выявление в крови ДНК возбудителя инфекции — полимеразная цепная реакция.
Инфекционный эндокардит искусственных клапанов сердца плохо поддается антибактериальной терапии — вследствие внедрения инфекции в ткань манжеты клапана и шовный материал и труднодоступности ее для непосредственного воздействия антибиотиков.
Необходима ранняя массивная и длительная (не менее 4—6 нед) антибиотикотерапия с учетом индивидуальной чувствительности выделенного возбудителя. Показано применение антибиотиков, оказывающих бактерицидное действие.
На необходимость хирургического лечения эндокардита искусственных клапанов сердца указывают отсутствие эффекта от антибактериальной терапии, наличие паравальвулярных фистул с выраженными нарушениями гемодинамики и развитием сердечной недостаточности, выявление при ЭхоКГ вегетации значительного размера с риском развития эмболии; формирование абсцессов сердца.
[youtube.player]Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Заболевание встречается в 1-5% случаев. Общепринятым считается выделение раннего ИЭПК, развившегося в сроки до 2 мес после операции протезирования клапана, и позднего, возникающего в более поздние сроки. Ранний ИЭПК, развившийся после операции по поводу ИЭ, считается по существу ранним рецидивом эндокардита. В настоящее время частота поражения механических и биологических клапанов одинакова. Ранний ИЭПК устанавливается в 7-11% случаев.
Развитие ИЭПК через год после операции - это повторное развитие эндокардита у пациента с изменённым клапаном (протезом), а не рецидив заболевания. От предыдущего случая болезни он был излечен. Поздний ИЭПК развивается по тем же законам, что и ИЭ естественных клапанов. В пользу этого свидетельствует совпадающая структура возбудителей позднего ИЭПК и ИЭ естественных клапанов, отличная от таковой при раннем ИЭПК.
Ранний ИЭПК в 41,3% случаев вызывается коагулазонегативным стафилококком, тогда как в возникновении ИЭ естественных клапанов и позднего ИЭПК большую роль играет стрептококк. Для раннего ЭИПК характерна высокая частота встречаемости грамотрицательных возбудителей и грибов.
К основным причинам развития раннего ИЭПК относятся недостаточно эффективная санация камер сердца во время операции по поводу ИЭ, невозможность выполнить резекцию клапана в пределах здоровых тканей вследствие распространения вегетаций за пределы клапана, внесение возбудителя с клапаном, шовным материалом, через аппарат искусственного кровообращения или из воздуха операционной. Большей частью это экзогенная инфекция во время операции. В послеоперационном периоде источниками бактериемии являются внутривенные и внутриартериальные катетеры, уретральные катетеры, электроды кардиостимулятора. В 50% случаев источником развития бактериемии и раннего эндокардита является послеоперационная рана. Пациенты, оперированные в активную фазу эндокардита, в последующем подвержены большему риску развития ИЭПК, чем оперированные в неактивную фазу. Искусственный клапан в аортальной позиции инфицируется чаще. Многоклапанное протезирование также учащает случаи развития ИЭПК.
Клиническая картина при ИЭПК определяется сроком его возникновения после первичной операции, видом возбудителя, возрастом пациента, предшествующим проведением антибактериальной терапии.
Ранний ИЭПКотличается яркими клиническими признаками собственно сепсиса, быстро наступающей декомпенсацией кровообращения в результате тяжёлого поражения миокарда, а также развитием тромбоэмболических осложнений, нарушением функции печени и почек на фоне септической инфекции. Лихорадка различного типа регистрируется у всех больных. Главным клиническим признаком раннего ИЭПК считается изменение аускультативной картины со стороны сердца – повторное возникновение шума над областью сердца (исключить шум трения перикарда вследствие послеоперационного перикардит). Имеет значение формирование фистул с левоправым сбросом крови (дефект межжелудочковой перегородки, аортоправопредсердная и аортолёгочная фистулы), а также парапротезных фистул. Появление протодиастолического шума при имплантации протеза в аортальной позиции или систолического шума при наличии протеза в митральной позиции должно насторожить лечащего врача в плане развития парапротезной фистулы.
Поздний ИЭПК протекает более доброкачественно, имеет стёртый характер клинических проявлений, что затрудняет клиническую диагностику. Симптомы сепсиса выражены слабо. Спленомегалия имеется у 60% больных. Иммунные проявления, такие как гломерулонефрит, с протеинурией и гематурией (у 40%), васкулит (у 16%), выявляются чаще, чем при раннем ИЭПК. Клиническая картина позднего ИЭПК близка к сиптоматике ИЭ естественных клапанов, что отражает общность патогенетических механизмов развития этих двух форм эндокардита.
Диагностика ИЭПК трудна, несмотря на то, что внимание врачей привлечено к факту имплантации искусственного клапана. Эхокардиографическими критериями диагностики ИЭПК являются визуализация вегетаций, обнаружение абсцесса клапанного кольца и доказательство частичного отрыва протеза. Для выявления вегетаций на механическом протезе трансторакальная ЭхоКГ малоинформативна из-за значительного акустического сопротивления, создаваемого металлическими частями, которое доминирует над сопротивлением соседних структур. Трансторакальная ЭхоКГ позволяет выявить вегетации у 20-50% больных ИЭПК, абсцессы клапанного кольца – у 6%. Чреспищеводная ЭхоКГ – более чувствительный метод для выявления признаков ИЭ: вегетации визуализируются в 67-87% случаев, абсцессы клапанного кольца – в 33-38%.
Диагностика ИЭПК, особенно раннего, является показанием к повторной операции протезирования клапана. Высокая летальность при терапевтическом лечении ИЭПК, достигающая 56-65% и значительно превышающая летальность при оперативном лечении является основанием для проведения повторного оперативного вмешательства. Септический процесс с инфицированием биопротезов протекает обычно более благоприятно, чем в случае механического клапана, чаще удаётся достичь стойкой нормализации температуры и стерилизации крови при консервативной терапии.
Общая летальность при ИЭПК высока и достигает 23-48%, а при эндокардите, вызванном золотистым стафилококком, ещё выше – 28-82%. Золотистый стафилококк является независимым предиктором риска смерти. Другим предиктором неблагоприятного исхода является развитие осложнений со стороны сердца: появление нового или усиление имевшегося шума вследствие дисфункции протеза клапана, впервые возникшая или прогрессирующая по этой же причине застойная сердечная недостаточность, длительная (более 10 дней) лихорадка во время соответствующей антибактериальной терапии и возникновение или прогрессирование нарушения проводимости сердца. Комбинированное медикаментозное и хирургическое лечение позволяет добиться лучших результатов. Операционная летальность при раннем ИЭПК высокая и достигает 43,8%, при позднем – 26,3%.
Инфекционный эндокардит у лиц с имплантированным электрокардиостимулятором.
ИЭ может развиться в разные сроки после имплантации электрокардиостимулятора: и через сутки, и 10 лет спустя. Входными воротами инфекции чаще всего являются местные факторы: эрозия кожи в месте нахождения электрода и инфицирование ложа генератора. Основной этиологический фактор – стафилококки, преимущественно коагулазонегативные, выделяемые в 75- 93,5% случаев. Чаще встречаются метициллинрезистентные стафилококки. Основным симптомом является лихорадка. У трети больных выявлены инфильтраты в лёгких вследствие септических эмболий оторвавшимися частицами вегетаций с трикуспидального клапана или зонда-электрода. Диагностика данной формы эндокардита считается трудной. Важную роль в диагностике заболевания играет эхокардиография. Чреспищеводная ЭхоКГ позволяет выявить вегетации у 80,8% больных. Чаще (76%) вегетации располагаются на зонде-электроде изолированно или в сочетании с поражением трикуспидального клапана. Особенностями терапии данной формы заболевания являются обязательное удаление электрокардиостимулятора, перевод больного на эпикардиальную стимуляцию с последующей антибактериальной терапией в течение 6 недель.
[youtube.player]Читайте также:


