Легочная инфекция вызванная mycobacterium
Насыщенная липидами клеточная стенка микобактерии обусловливает их кислотоустойчивость. Существует более пятидесяти видов микобактерии, большинство из которых присутствует в окружающей среде и не представляет опасности для человека.
Основной путь передачи туберкулёза — воздушно-капельный. Лёгкие являются первым органом, поражаемом при туберкулёзе. В месте проникновения возбудителя формируется воспалительный очаг (первичный комплекс), из которого инфекция может распространиться по всему организму (милиарное распространение). Заболевание может неожиданно разрешиться либо перейти в локализованный процесс (например, менингит).
Устойчивость к туберкулёзу обеспечивает Т-клеточное звено иммунитета. При его нарушении болезнь может рецидивировать (предполагаемый риск составляет 10%). Яркую клиническую картину заболевания чаще обнаруживают у пациентов со сниженным иммунитетом (например, у больных с ВИЧ-инфекцией).
Mycobacterium tuberculosis фагоцитируются макрофагами, но не инактивируются фаголизосомами, а размножаются в цитоплазме клеток. Выраженный иммунный ответ приводит к локальному разрушению тканей (образование полостей в лёгких — каверн) и возникновению симптомов, обусловленных цитокин-индуцированной системной воспалительной реакцией (лихорадка, потеря массы тела).
В качестве факторов вирулентности выступает большое количество антигенов, в том числе липоарабиноманнан (стимулятор цитокинов) и супероксиддисмутаза (обеспечивает выживаемость внутри макрофагов).
Возбудитель может поражать любой орган: он имитирует как воспалительные заболевания, так и злокачественные новообразования. Симптомы туберкулёза лёгких — хронический кашель, кровохаркание, лихорадка, потеря массы тела, рецидивирующая бактериальная пневмония. При отсутствии лечения болезнь переходит в хроническую форму, характеризующуюся постепенным ухудшением состояния.
При туберкулёзном менингите отмечают повышение температуры, помутнение сознания, при поражении почек — лихорадку, потерю массы тела, а также признаки локальной инфекции, осложнённой фиброзом мочеточников и гидронефрозом. Прогрессирование туберкулёза костей, обычно поражающего пояснично-крестцовый отдел позвоночника, характеризуется признаками вертебрального коллапса и сдавления нервов.
Кроме того, гной из очага инфекции может проникать под оболочку поясничной мышцы, в результате чего возникает паховый абсцесс. Поражение крупных суставов приводит к артриту и разрушению суставной ткани. При абдоминальной инфекции наблюдают брыжеечную лимфаденопатию, хронический перитонит, а также лихорадку, потерю массы тела, асцит, признаки нарушения всасывания в кишечнике. Диссеминированная (милиарная) инфекция может протекать без симптомов поражения лёгких.
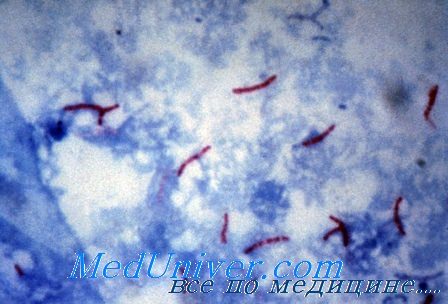
Микобактерии туберкулеза
• Культивирование на средах, обогащенных липидами (яичные среды), или с добавлением малахитового зелёного (среда Левенштейна—Йенсена) для подавления роста других бактерий. Препарат окрашивают по методу Циля—Нильсена.
• Определение чувствительности штаммов на скошенной питательной среде Левенштейна—Йенсена.
• Молекулярно-генетические методы (помогает уточнить наличие гена ргоВ, идентифицировать туберкулёзный антигенный комплекс и определить устойчивость к рифампицину).
• Типирование Mycobacterium tuberculosis с помощью анализа полиморфизма длины рестрикционных фрагментов.
• Измерение уровня цитокинов периферической крови, продуцируемых моноцитами (для диагностики остроты процесса).
Для лечения туберкулёза лёгких применяют этамбутол в комплексе с пиразинамидом (в первые 2 мес) и рифампицин и изониазид (на протяжении 6 мес). При поражении других органов используют такую же схему лечения, основанную на способности лекарственного препарата проникать в различные ткани (например, в спинномозговую жидкость). В последнее время всё чаще выделяют мультирезистентные штаммы возбудителя туберкулёза.
Вероятность их обнаружения зависит от числа случаев неполного излечения, уровня жизни и др. В этом случае для лечения используют препараты второй линии: аминогликозиды, фторхинолоны, этионамид или циклосерин (после обязательного определения чувствительности возбудителя к антибиотикам).
Вакцинация аттенуированными (ослабленными) штаммами (вакцина для профилактики туберкулёза, синоним — вакцина Кальметт—Герена, БЦЖ) позволяет избежать милиарного распространения инфекции, но клинические исследования в некоторых странах не подтвердили её эффективности. Пациентам с высоким риском развития туберкулёза назначают профилактическое лечение рифампицином и изониазидом, а лицам с ВИЧ-инфекцией рекомендован приём рифабутина или кларитромицина в течение длительного времени.
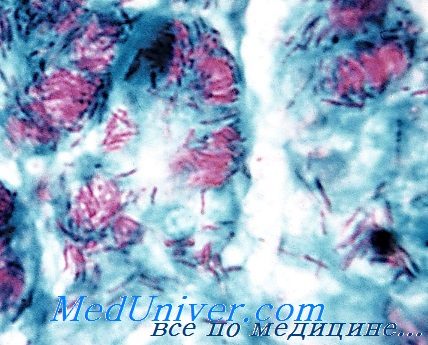
Микобактерии лепры
Возбудителя лепры (проказы) до настоящего времени не удалось культивировать на искусственных питательных средах.
Mycobacterium leprae вызывает поражение периферических нервов, сопровождаемое нарушением болевой чувствительности. Разрушение и деформация суставов и фаланг пальцев делают пациентов физически недееспособными. Итог заболевания индивидуален и зависит от иммунного ответа. В настоящее время выделяют три типа иммунного ответа при лепре:
• туберкулоидный (превалирует Thl-ответ);
• лепроматозный (преобладает Тh2-ответ);
• пограничный.
При туберкулоидном типе инфекции у пациентов развивается стойкий клеточный иммунитет, возникает большое количество гранулём, трофические поражения нервов. В тканях обнаруживают небольшое количество бактерий. Для лепроматозного типа характерен слабый клеточный иммунитет, отсутствие гранулём и генерализованная инфекция (леонтиаз, депигментация и нарушение чувствительности).
Диагноз основан на результатах микроскопического исследования препаратов поражённой кожи (окраска по Цилю-Нильсену) и биоптатов кожных покровов гистологического исследования. Для лечения применяют рифампицин, дапсон и клофазимин, эффективные на ранних стадиях заболевания, но неспособные препятствовать повреждению нервов и деформации конечностей, при возникновении которых необходимо хирургическое вмешательство.
Различные виды микобактерий могут вызывать локализованные или диссеминированные заболевания у лиц со сниженным иммунитетом. Некоторые из них могут инфицировать имплантируемые ткани.
Mycobacterium avium. В состав комплекса входят Mycobacterium avium, M. intracellular и М. scrofulaceum. Некоторые из них поражают птиц, других животных, являясь санрофитами окружающей среды. Их считают наиболее распространённой причиной микобактериального лимфаденита у детей, остеомиелита у пациентов со сниженным иммунитетом и пневмонии у лиц пожилого возраста. При прогрессирующей ВИЧ-инфекции эти микроорганизмы способны вызывать диссеминированные инфекции и бактериемию.
Возбудители из авиум-внутриклеточного комплекса устойчивы к действию большинства противотуберкулёзных препаратов, поэтому для лечения инфекций, вызванных ими, применяют методы комплексной терапии с использованием рифабутина, кларитромицина и этамбутола. При развитии лимфаденита иногда требуется хирургическое вмешательство.
Mycobacterium kansasi, M. Malmoense, M. Xenopi. Вызывают вялотекущую инфекцию лёгких, похожую на туберкулёз, у пациентов с хроническими заболеваниями лёгких (бронхоэктазией, силикозом, хронической обструктивной болезнью лёгких). Начальную терапию осуществляют с помощью стандартных препаратов после определения чувствительности микроорганизмов к антибиотикам.
Mycobacterium marinum, М. ulcerans. Mycobacterium marinum вызывают хронические гранулематозные инфекции кожи. Возбудитель обитает в реках, запущенных бассейнах и неухоженных садках для рыбы. Заболеванию свойственно возникновение множественных гнойничковых очагов, покрытых твёрдой коркой. Инфекции, вызванные М. ulcerans, распространены в сельскохозяйственных зонах Африки и Австралии. Бактерии обычно поражают нижние конечности, при этом обнаруживают папулёзные очаги, сопровождаемые изъязвлением и глубоким повреждением тканей (включая костную).
После открытия возбудителя туберкулеза - Mycobacterium tuberculosis - были открыты десятки других видов микобактерий. Большинство из них распространено в природе. Многие - сапрофиты, некоторые патогенны для рыб, земноводных или птиц, и лишь несколько видов вызывают заболевания у людей: Mycobacterium avium-intracellulare (наиболее часто), Mycobacterium kansasii, Mycobacterium marinum и быстрорастущие микобактерии, например Mycobacterium fortuitum и Mycobacterium chelonae. Все они менее вирулентны, чем Mycobacterium tuberculosis, и обычно вызывают оппортунистические инфекции.
Идентификация микобактерии основана на внешнем виде колоний, скорости роста и биохимических свойствах, но сложные биохимические методы постепенно вытесняются молекулярно-генетическими методами, которые позволяют быстро различить Mycobacterium avium-intracellulare и Mycobacterium tuberculosis.
Mycobacterium avium-intracellulare
Хроническая легочная инфекция. Заболевание обычно возникает в среднем возрасте, чаще у мужчин. Оно напоминает туберкулез легких, но имеет некоторые отличия. Симптомы поражения легких бывают часто, а общее состояние страдает редко.
Заболевание течет и прогрессирует медленно. При рентгенографии грудной клетки изменения обычно обнаруживают в паренхиме легких (тонкостенные полости, утолщение плевры над пораженным учатком), а плевральный выпот встречается лишь изредка. На ранних стадиях заболевание диагностируют редко. Как правило, поражается участок легкого, измененный хроническим бронхитом или бронхоэктазами, эмфиземой, зажившим очагом туберкулеза или силикозом.
Другая форма заболевания - поражение интерстициальной ткани и образование мелких узелковых бронхоэктазов в средних и нижних отделах легких - наблюдается у пожилых женщин без хронических заболеваний легких. Другие органы вовлекаются редко, хотя в отдельных случаях развивается инфекция костей и суставов. Поскольку выделение Mycobacterium avium-intracellulare еще не доказывает наличие инфекции, для постановки окончательного диагноза необходимо неоднократное выделение большого числа микобактерии одного и того же штамма в течение нескольких дней или недель в сочетании с типичными клиническими и рентгенологическими симптомами.
Из-за лекарственной устойчивости микобактерии лечение нередко бывает малоэффективным. При легком течении лучше всего ограничиться наблюдением. Развернутое заболевание, сопровождающееся образованием каверн в легких, часто требует назначения трех или более препаратов на длительный срок, вплоть до двух лет. При выборе препарата следует по возможности ориентироваться на чувствительность возбудителя. Начинать лечение рекомендуется с комбинации кларитромицина (либо азитромицина), рифабутина (либо рифампицина) и этамбутола; на раннем этапе можно добавить стрептомицин. Дополнительное хирургическое вмешательство целесообразно при очаговой инфекции и минимальном операционном риске.
Шейный лимфаденит. Заболевание встречается у детей в возрасте от 1 года до 5 лет и проявляется стойким безболезненным увеличением передних или задних шейных лимфоузлов. Заражение, вероятно, происходит алиментарным путем, когда ребенок берет что-нибудь в рот с пола или с земли. Инфекция, вызванная Mycobacterium avium-intracellulare, - гораздо более частая причина гранулематозного воспаления лимфоузлов, чем туберкулез. Диагноз ставят после выделения возбудителя из материала, полученного при пункции или биопсии увеличенных лимфоузлов. Антибиотики малоэффективны. Без лечения заболевание часто приводит к формированию свищей или обезображивающих рубцов.
Диссеминированная инфекция. Это тяжелое заболевание иногда наблюдается у онкологических больных и реципиентов внутренних органов на фоне иммуносупрессивной терапии, но наибольшую опасность оно представляет для больных СПИДом. Диссеминированная инфекция развивается, когда число лимфоцитов CD4 падает ниже 50 в мкл (а нередко - и ниже 10 в мкл), поражая 20-40% больных. Клинические проявления включают высокую лихорадку, слабость, понос и панцитопению (плохой прогностический признак).
Самые точные методы диагностики - посев крови или костного мозга. Посев кала тоже обычно положительный, но сам по себе он не имеет диагностического значения.
Без лечения 50% больных живут не более 4 мес. С помощью комбинированной антимикробной терапии, наподобие той, которую применяют при хронической легочной инфекции, выживаемость можно увеличить вдвое. В процессе лечения часто возникают особые осложнения, обусловленные взаимодействием рифампицина с антиретровирусными средствами. Больным СПИДом, у которых число лимфоцитов CD4 не превышает 100 в мкл, рекомендуется профилактика диссеминированной инфекции азитромицином.
Mycobacterium kansasii
В отличие от Mycobacterium avium-intracellulare, широко распространенной в почве и водоемах, Mycobacterium kansasii редко встречается в природе, но ее время от времени обнаруживают в водопроводной воде. Микроорганизм имеет форму четок или бус и крупнее других микобактерии, так что опытному врачу-лаборанту, чтобы поставить диагноз, достаточно мазка, окрашенного по Цилю-Нильсену. У Mycobacterium kansasii отмечено специфическое свойство - ее культура на свету приобретает желтую окраску (Mycobacterium kansasii относится к фотохромогенным микобактериям).
Патогенность Mycobacterium kansasii для человека невысока. Подобно Mycobacterium avium-intracellulare, этот микроорганизм может вызвать хроническую легочную инфекцию и диссеминированную инфекцию у больных СПИДом и изредка - инфекцию костей и суставов. Однако Mycobacterium kansasii отличается от Mycobacterium avium- intracellulare большей чувствительностью к антимикробным препаратам. Выраженный эффект дает рифампицин, и рекомендуемая в настоящее время схема лечения включает назначение рифампицина, изониазида и этамбутола по крайней мере на 9 мес.
Mycobacterium marinum
Заболевание, вызываемое Mycobacterium marinum, - гранулема купальщиков - характеризуется появлением на коже узлов и изъязвлений. Заражение происходит во время купания, разделки морской рыбы, чистки аквариума. Диагноз ставят после выделения Mycobacterium marinum из биоптата кожи.
Заболевание может пройти самостоятельно, но глубокие поражения (тендовагинит или артрит) необходимо лечить на протяжении как минимум 3 мес. Обычно возбудитель чувствителен к кларитромицину, триметоприму/сульфаметоксазолу, тетрациклину, рифампицину и этамбутолу. Можно назначить какой-либо один из этих препаратов или комбинацию рифампицина с этамбутолом.
Быстрорастущие микобактерии
Быстрорастущие микобактерии, прежде всего Mycobacterium fortuitum и Mycobacterium chelonae, вызывают раневую инфекцию и инфекцию эндопротезов, в особенности протезов молочных желез, туннельных катетеров, свиных клапанов и хирургического воска. Иногда наблюдается также глазная или кожная инфекция в сочетании с легочной инфекцией, похожей на ту, что вызывает Mycobacterium aviumintracellulare.
Диагностика обычно не представляет трудностей. Выращивать возбудителя несложно, колонии образуются через 3-7 сут.
Лечение, как правило, заключается в удалении эндопротеза и широком иссечении пораженных тканей. Антимикробная терапия не всегда эффективна; успех наиболее вероятен при использовании таких препаратов, как амикацин, тобрамицин, цефокситин, сульфаметоксазол, имипенем и ципрофлоксацин.
Введение. В 50-х годах было показано, что вызывать заболевание у человека могут не только микобактерии туберкулеза, но и другие представители рода Mycobacterium . Классификация этих микроорганизмов, основанная на морфологии колоний и ростовых характеристиках, была предложена Е. Раньоном . Эти бактерии широко распространены в природе как сапрофиты, главным образом в почве и воде. Животные заражаются и служат резервуаром инфекции для человека. Передача инфекции от человека человеку не зарегистрирована. Эпидемиологические исследования, проведенные с помощью туберкулинов из разных видов микобактерии, демонстрируют распространенность инфекции в Соединенных Штатах и в других странах, а также значительные различия в географическом распространении инфекции. Эти микроорганизмы относятся к атипичным или анонимным микобактеричм . Хотя эти микроорганизмы и не всегда анонимны, высокая частота распространения их в окружающей среде обусловливает необходимость повторного выделения их из очага поражения, прежде чем будет подтверждена их этиологическая роль. В связи с достигнутым в настоящее время усовершенствованием лабораторных методов исследования, включая радиометрическое культивирование методов исследования, видовая идентификация при изучении этих патогенов в настоящее время стала значительно проще (табл. 121-1). По мере повышения опыта медицинских работников и в связи с появлением новых заболеваний появляются новые синдромы, связанные с воздействием различных видов возбудителей, и повышается их значение в патологии.
M. ulcerans — этиологический агент язвы Бурули или Bairnsdale . Возбудитель растет только при температуре 30—33°С. Рост колоний появляется через 7 нед ; выделение возбудителя производится при заражении мышей в мякоть подошвы лапки. Это тропическая болезнь, распространенная в Австралии и Африке. Первым признаком инфекции, вызванной М. ulcerans , является маленький безболезненный узелок, превращающийся в обширное гранулематозное изъязвление, обычно располагающееся на разгибательной поверхности конечностей. Характерно наличие глубокой язвы с некротическим основанием и подрытыми краями. Излечение достигается при широком хирургическом иссечении пораженных тканей с пересадкой кожи. Точных данных относительно эффективности химиотерапии нет.
Это психрофильный фотохромогенный микроорганизм, обитающий в соленой и пресной воде и вызывающий болезни у рыб (прежнее название его М. balnei ). У человека инфекция обычно связана с какой-то деятельностью в воде, например работа с аквариумами, плавание. Микроорганизм внедряется через поврежденные кожные покровы и образует узелок; инфекция может распространяться вдоль лимфатических сосудов, вызывая подозрение на споротрихоз , формировать бородавчатые очаги или изъязвления (реже). Пора-
Таблица 121-1. Патогенные для человека микобактерии, не относящиеся к М. tuberculosis и М. leprae
Легкие, лимфатические узлы
Кожа (абсцессы), легкие
Почва, нечистоты, вода
Кожа (абсцессы), легкие
Почва, нечистоты, вода
Обозначения. Ф — фотохромогенные (желто-оранжевый пигмент развивается только при экспозиции на свету); Н — непигментированные; С— скотохро-могенПые (желто-оранжевый пигмент развивается в темноте); С*—скотохромо-генные при 37°С , фотохромогенные — при 25°С. жение проявляется в виде гранулематозного очага обычно без признаков казеоза — гранулема купальщиков, или аквариумная гранулема. Инфекция часто характеризуется положительной туберкулиновой реакцией, отражающей некоторое участие антигенов М. tuberculosis . В связи с тем, что данную болезнь необходимо отдифференцировать от споротрихоза и других микобактериальных инфекций, решающее значение имеет культуральное выделение соответствующего возбудителя путем инкубации при температуре 30—32°С. Описаны инфекции сухожильных влагалищ и синовиальных оболочек, развившиеся при наличии проникающих повреждений в области расположения названных структур. Изъязвления, аналогичные тем, которые вызваны М. ulcerans , а также диссеминированные кожные поражения описаны у больных с иммунодефицитом. Более мелкие очаги могут рассасываться спонтанно. Возбудитель in vitro чувствителен к рифампицину и этамбутолу , что позволяет использовать эти препараты для лечения. Эффективны также тетрациклин, миноциклин (Minocyclini ) и триметоприм — сульфаметоксазол .
М. kansasii — длинные, толстые кислотоустойчивые бактерии с выраженными поперечными перехватами, образующие пигмент при экспозиции на свету, культивируются при температуре 37°С. Наиболее широко распространены в центральных районах США, в Техасе, Англ ии и Уэ льсе. Причины таких географических вариаций неизвестны, но, по всей вероятности, связаны с какими-то экологическими особенностями этого микроорганизма. Передача инфекции от человека человеку не установлена. Известные сообщения указывают на предпочтительное поражение представителей европеоидной расы.
Поражение легких — наиболее распространенное заболевание, вызываемое этим микроорганизмом. Клиническая картина очень напоминает туберкулез легких, хотя признаки и симптомы заболевания выражены слабее. Пневмокониоз и хронические обструктивные заболевания легких считаются предрасполагающими состояниями. Характерно образование тонкостенных полостей с минимальными воспалительными изменениями. При отсутствии лечения процесс медленно прогрессирует.
Важным проявлением инфекции М. kansasii считается диссеминированное заболевание. Гематогенное распространение возбудителя связывается с панцитопенией , лейкозным ретикулоэндотелиозом , злокачественными заболеваниями, трансплантацией костного мозга и почек. Наблюдаются лихорадка, анемия, симптомы вовлечения в процесс различных органов и систем. Диагноз подтверждается результатами культурального исследования пораженных тканей. Возможны также поражения кожи и мягких тканей, аналогичные вызываемым М. marium , развитие теносиновитов , остеомиелитов, лимфаденитов, перикардитов и инфекций органов мочеполового тракта.
Заболевания, вызванные М. kansasii , хорошо поддаются лечению. Оказалось, что наиболее эффективным препаратом является рифампицин , который следует включать в состав всех лекарственных режимов для первоначального лечения. Применяют также изониазид и этамбутол . Эффективность лечения около 95%. При разработке режимов для повторного лечения следует руководствоваться данными определения лекарственной чувствительности возбудителя in vitro . Рифампицин применяется, если чувствительность к нему сохранена.
Этот скотохромогенный микроорганизм служит основной причиной лимфаденитов у детей. В процесс обычно вовлекаются шейные лимфатические узлы, но сопутствующие симптомы системных поражений наблюдаются редко. Для уточнения диагноза необходимо получить рост культуры возбудителя. Для успешного лечения требуется полное удаление лимфоузлов и свищевого хода, если он имеется. Имеется несколько сообщений о заболеваниях легких, костей и мягких тканей, вызванных М. scrofulaceum . Распространение патологического процесса связано с тяжелыми сопутствующими заболеваниями. Характер чувствительности возбудителя варьирует, в связи с чем применяются многокомпонентные лекарственные режимы.
При температуре 37°С этот микроорганизм проявляет свойство скотохромогенности , что позволяет спутать его с более распространенными микробными загрязнителями водопроводной воды. Первоначально он был описан как редкий возбудитель заболеваний легких; есть также сообщения о вызываемых этим микробом бурситах, лимфаденитах, теносиновитах . Большинство штаммов, выделенных от больных, чувствительны к рифампицину и этамбутолу .
M. xenopi — медленно растущий скотохромогенный микроорганизм, вызывающий у человека заболевания легких, подобные туберкулезу. Однако в настоящее время становятся все более частыми сообщения о диссеминированных формах болезни, связанных с синдромом приобретенного иммунодефицита (см. ниже). В противоположность ряду нетуберкулезных микобактерий этот вид чувствителен к большинству противотуберкулезных препаратов.
М. avium и М. intracellulare можно различить с помощью реакции сероагглютинации , тонкослойной хромотографии и иммуноферментного исследования, однако эта дифференциация затруднена, и поэтому эти микроорганизмы объединяют в один комплекс (MAI). Эти микроорганизмы наиболее широко распространены на юго-востоке США и, более того, являются наиболее часто выделяемыми микобактериями после М. tuberculosis . Распространены инфицирование и скрытые инфекции, вызываемые MAI; сведения о передаче инфекции ограничены. Наиболее часто в процесс вовлекаются легкие; клиническая картина аналогична легочному туберкулезу. Факторами риска являются сопутствующие заболевания легких, возможное генетическое предрасположение и возрастной фактор. Нередки единичные.о чаги в легких. Для вывода адекватной терапии необходимо установить этиологическую роль возбудителя, так как именно это определяет характер лечения.
Описаны поражения кожных покровов, мышечной ткани и костного скелета, включая остеомиелит позвоночника,- напоминающий болезнь Потта . У детей и у взрослых людей также описаны диссеминированные формы инфекции, развивающиеся на фоне тяжелых сопутствующих заболеваний. Наиболее важные симптомы подобных состояний — лихорадка, анемия, лейкоцитоз, гипергаммаглобулинемия и гепатоспленомегалия .
Эти микроорганизмы входят в число возбудителей оппортунистических инфекций, осложняющих синдром приобретенного иммунодефицита. Осложняя СПИД, они представляют одну из наиболее распространенных угрожающих жизни больных инфекций. Проявления болезни специфичны и в основном отражают симптоматику основного заболевания у больного с нарушенным клеточным иммунитетом. Выявляется бактериемия, и микобактерии в огромных количествах обнаруживаются во всех органах и секретах организма. Минимальная клеточная реакция макроорганизма проявляется слабой гранулематозной или какой-либо иной реакцией. Возможна тяжелая диарея с патологией кишечника, напоминающая болезнь Уипла , сопровождающаяся появлением большого количества макрофагов, заполненных MAI. В других органах эти макрофаги напоминают клетки лепры.
Лечение затруднено и не приносит удовлетворительных результатов. Возбудитель обычно устойчив к большинству антимикобактериальных агентов. Тем не менее можно рекомендовать лечение многокомпонентными комбинациями, в ряде случаев приводящее к улучшению состояния больного, что, вероятно, можно объяснить синергизмом этих лекарственных средств, который трудно доказать in vitro . Эти комбинации по возможности должны включать те лекарственные средства, к которым чувствителен возбудитель. Три из шести препаратов, применяемых одновременно, следует подбирать из следующего ряда: изониазид , этамбутол , рифампицин , этионамид , пиразинамид , циклосерин , стрептомицин, канамицин и капреомицин . Наиболее эффективны среди них этамбутол , этионамид и циклосерин . Хирургическое лечение рекомендуется при лимфаденитах и является обоснованной альтернативой при некоторых других локализованных инфекциях. Находящиеся на испытании препараты клофазимин (Clofazimine ) и рифабутин (Rifabutine ) были применены в сочетании с иммуномодуляторами у больных с MAI-инфекцией, осложнившей течение СПИДа (см. гл. 257).
Для этих микобактерии характерен чрезвычайно быстрый рост; первичное выделение занимает 1—5 нед , но при последующем субкультивировании для роста этих микобактерии требуется всего 5 дней. Микобактерии этих видов не требовательны к составу питательных сред и быстро размножаются на большинстве из них. Эти виды микроорганизмов ответственны практически за все известные инфекции, вызванные быстрорастущими микобактериями. М. fortuitum более часто ассоциируется с посттравматическими и послеоперационными инфекциями кожи и мягких тканей. М. chelonei -- более частая причина легочных инфекций и диссеминированных заболеваний. Для клинических целей определение видовой принадлежности возбудителя необязательно. Широко распространенные в окружающей природной-среде и в больничном окружении, а также высокоустойчивые к лекарственным препаратам, антисептикам и дезинфицирующим средствам, эти быстрорастущие микобактерии служат важной причиной внутрибольничных инфекций.
Большинство инфекций человека связано с нарушением целостности кожных покровов и повреждениями мягких тканей. Ингаляционные поражения легких осложняют течение сопутствующих легочных заболеваний. Хотя при этом могут развиваться и хронические гранулематозные реакции с признаками казеоза , отличительной чертой этих поражений являются нагноительные процессы с образованием микроабсцессов , в которых при окраске по Граму выявляют дифтероидоподобные микроорганизмы. Инфекции развиваются после кардяоторакальных операций, мамм о - и артропластических вмешательств, инъекций, операций на глазном яблоке, проведения диализа. Клинические проявления включают лимфаденит, кератит, остеомиелит, менингит и эндокардиты с вовлечением в процесс сердечных клапанов. Гематогенная диссеминация инфекции наблюдается редко и связана с нарушением защитных механизмов больного.
Адекватная очистка и дренирование раны с удалением инородных тел и омертвевших тканей показаны во всех возможных случаях. Многие штаммы возбудителя высокоустойчивы ко всем противомикробным препаратам, поэтому при определении адекватного терапевтического режима следует учитывать результаты определения лекарственной чувствительности микроорганизмов. Как правило, наибольшую активность проявляет амикацин , однако также доказана эффективность гентамицина , цефокситина , доксициклина , эритромицина , сульфаниламидов, рифампицина и этамбутола . Сульфаниламиды более эффективны в отношении М. fortuitum , а эритромицин подавляет некоторые штаммы М. chetonei . Наличие лекарственно-устойчивых микроорганизмов делает предпочтительным использование одновременно двух или трех препаратов.
М. haemophilurn проявляет себя как кожный патоген . Это психрофил , для своего развития требующий присутствия в питательных средах железа. Все известные случаи заболевания, вызванные этим микроорганизмом, наблюдались у больных с иммунодефицитом. Изъязвляющиеся кожные очаги с наличием в них кислотоустойчивых микобактерии, которые не выделяются при культивировании, описаны у людей, проживающих в штате Миннесота, а также в пограничных с Канадой районах. Болезнь самоизлечивается . Неклассифицнруемые виды микобактерии были выделены как этиологические агенты при воспалительных заболеваниях кишечника; они могли быть аналогичны М. paratuberculosis , возбудителю болезни Joune , болезни кишечника жвачных животных.
По мере совершенствования лабораторных и клинических методов список заболеваний, вызванных нетуберкулезными микобактериями, может пополниться.
Атипичная микобактериальная инфекция — комплекс гранулематозных поражений, вызываемых микобактериями, отличающимися от классических патогенов — возбудителей туберкулёза и лепры.
✎ Этиология. Возбудители — Mycobacterium ulcerans, Mycobacterium marinum (Mycobacterium balnei), Mycobacterium kansasii, Mycobacterium avium-intracellulare, Mycobacterium xenopi, Mycobacterium szulgai, Mycobacterium scrofulaceum, Mycobacterium fortuitum, Mycobacterium malmoense.
✎ Эпидемиология. Большинство возбудителей широко распространено в окружающей среде; некоторые обитают в воде и прибрежной зоне, вызывая заболевания у рыб, другие (например, Mycobacterium avium-intracellulare) — у птиц. Наиболее часто заражение происходит при вдыхании микобактерий, употреблении заражённых продуктов и проникновении возбудителя через микротравмы кожи и слизистых оболочек. Патогенез. Проникшие микобактерий фагоцитируются макрофагами и транспортируются в регионарные лимфатические узлы; фагоцитарные реакции незавершённые, и возбудитель персистирует в цитоплазме макрофагов. Воспалительная реакция незначительная, но в месте проникновения развивается первичный аффект. В динамике по ходу регионарных лимфатических путей и узлов формируется первичный комплекс, характеризующийся развитием гранулём. Микроскопия биоптатов выявляет в последних очаги неказеозного некроза, содержащие кислотоустойчивые бактерии.
❐ Клиническая картина
● Туберкулёзоподобные поражения. В патологический процесс вовлекаются лёгкие, почки, кожные покровы и костно-суставная система. Часто осложняют течение эмфизематозных процессов. У 40-50% больных с иммунодефицитными состояниями вызывают генерализованные поражения.
● Лимфадениты. Клинически чаще проявляются поражениями шейных лимфатических узлов (т.н. скрофулы); последние безболезненны, могут изъязвляться либо дренироваться наружу; системные проявления слабые или чаще отсутствуют.
● Кожные поражения. Типичным считают инфицирование ран конечностей, полученных при ударе о стенку бассейна или любой объект на дне и берегах водоёма. Чаще наблюдают образование изъязвляющейся гранулёмы, спонтанно ограничивающейся в течение нескольких недель, в более редких случаях формируется хроническая инфекция.
● Реже наблюдают хронические лёгочные поражения у лиц среднего возраста, зарегистрированные к настоящему времени повсеместно. Возможны бурситы локтевого сустава при повторных травмах и кожные поражения, цервикальные лимфадениты и синдром запястного канала у лиц с иммунодефицитами (наиболее часто после терапии гормональными препаратами).
❐ Методы исследования
● Выделение и идентификация возбудителя по скорости роста, образованию пигментов (на свету или в темноте) и патогенности для лабораторных животных
● AT к Mycobacterium kansasii перекрёстно реагируют с Аг Mycobacterium tuberculosis и у инфицированных лиц отмечают положительную реакцию Манту. Дифференциальный диагноз
❐ Лечение:
● При лёгочных поражениях.
● Рекомендовано сочетание изониазида 600 мг, рифампицина 300 мг, стрептомицина 1 г и этамбутола 15-25 мг/кг 1 р/сут.
● При поражении М. marinum — миноциклин по 100 мг каждые 12 ч в течение 6-8 нед.
● При поражении М. kansasii and M. xenopi эффективна стандартная противотуберкулёзная терапия с обязательным назначением рифампицина.
● Хирургическое вмешательство рекомендовано при локализованных поражениях у пациентов молодого возраста без патологии других органов и систем.
● При лимфадените — у детей от 1 до 5 лет показано хирургическое лечение.
● При кожных поражениях, вызванных М. marinum, — тетрациклин (1-2 r/сут) и сочетание рифампицина и этамбутола в течение 3-6 мес.
● При инфекциях, вызванных ранами или инородными телами.
● Хирургическая обработка раны и удаление инородного тела. .
● Лекарственная терапия: сульфатримоксазол (50 мг/кг сут), доксициклин (200-400 мг/сут), цефокситин (200 мг/кг/ сут), амикацин (10-15 мг/сут) в течение 3-6 мес.
● При диссеминированных поражениях — сочетание противотуберкулёзных средств (как при лёгочных поражениях) лишь уменьшает бактериемию и временно ослабляет симптомы.
✎ Течение и прогноз: Течение — прогрессирующее. Более чем у 20% пациентов отмечают рецидивы заболевания в течение 5 лет.
МКБ А31 Инфекции, вызванные другими микобактериями
Читайте также:


