Лимфоидная ткань при инфекции
Каждый день организм человека вынужден бороться с проникновением в тело различных чужеродных агентов. Патогенные микроорганизмы, вирусы, грибки и паразиты попадают в нас через поврежденные кожные покровы, пищеварительную систему, слизистые носа и глотки и вызывают различные заболевания. И только благодаря иммунитету (слово образовано от латинского immunitas и в дословном переводе означает "освобождать от чего-нибудь") мы защищаемся от такого масштабного вторжения. Огромное значение при этом играет ткань лимфоидная, которая распространена по всему организму и суммарно составляет 1 % от массы всего тела. Так что же это такое?
Определение
Одна из разновидностей соединительной ткани, в которой размещена система макрофагов и лимфоцитов, называется лимфоидной. Она может быть представлена в виде отдельных органов, а может просто являться функционирующей частью тела. Встречается ткань лимфоидная в таких органах, как костный мозг и селезенка, лимфатические узлы и вилочковая железа. В них она является функционирующей паренхимой.
В слизистой оболочке некоторых органов тоже встречаются скопления лимфоидной ткани — бронхи, мочевыводящие пути, почки, кишечник и другие.
Функции
Во всех без исключения защитных реакциях основное участие принимает лимфоидная ткань. Содержащиеся в ней лимфоциты, макрофаги и бласты, плазматические клетки, тучные клетки и лейкоциты защищают организм от вторжения инородных клеток и убирают поврежденные клетки самого организма. За формирование клеток иммунной системы отвечают лимфатические узлы, вилочковая железа и ткань (лимфоидная) кишечника.
Строение
Лимфоидная ткань чаще всего представляет собой поддерживаемые в сетке из ретикулярных волокон свободные клетки. Сеть может быть более густой по составу (образует плотную ткань) или рыхлой (с пространствами, где свободно могут перемещаться свободные клетки). Сами волокна образованы из III типа коллагена.
Места скопления
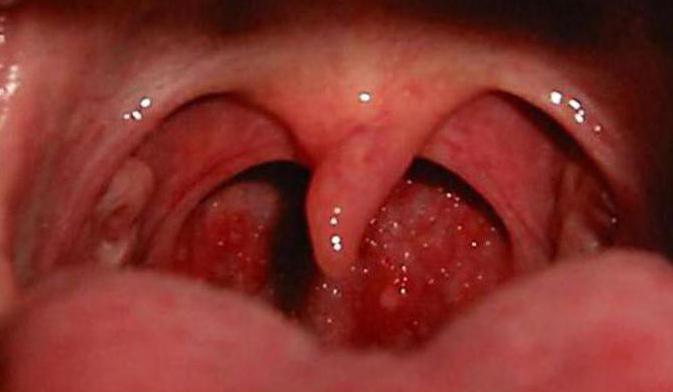
В местах наибольшей вероятности попадания чужеродных организмов размещаются большие скопления лимфоидной ткани. Знакомые всем миндалины — это лимфоидная ткань глотки, размещенная на границе с полостью рта. Они бывают глоточные, небные, трубные и гортанные. Совокупность всех миндалин и областей и есть лимфоидная ткань носоглотки.
Ее функция очень важна для нашего здоровья, ведь она обезвреживает попадающие через рот и нос микробы. А вместе с органами, содержащими лимфоидную ткань, обеспечивает образование нужного количества лимфоцитов для целого организма.
Кроме прочего, лимфоидная ткань в горле взаимодействует с эндокринными железами (надпочечниками, щитовидкой, тимусом, поджелудочной), образуя тесную связь "гипофиз - кора надпочечника - лимфатическая ткань" до полового созревания ребенка.
Что такое гипертрофия
У ребенка от трех до десяти лет может развиться гипертрофия лимфоидной ткани миндалин, при этом функционирование ее не нарушается. Только с началом пубертатного периода гипертрофированная ткань начинает уменьшаться.
Точно неизвестно, с чем связан этот процесс, но предположительные причины — воспаление глотки или инфекция, различные эндокринные нарушения. Гипертрофия может привести к частым воспалениям или патологическим изменениям в ушах, носу, гортани.
Если нарушается носовое дыхание, ослабляется вентиляция легких. Позже это приводит к изменению состава крови — гемоглобин и количество эритроцитов понижается, а лейкоциты увеличиваются в количестве. Далее начинают нарушаться функции ЖКТ, щитовидной железы, надпочечников. Нарушение всех процессов приводит к задержке в росте и половом развитии ребенка.
Что такое гиперплазия
Термин "гиперплазия" пришел к нам из греческого языка и обозначает сверхобразование. По своей сути это патология, при которой клетки начинают интенсивно размножаться, увеличивая объем ткани.
Но гиперплазия лимфоидной ткани — это не заболевание, а симптом. Ответная реакция организма на появление инфекции или воспалительного процесса в организме. Внешне это особенно заметно на лимфоузлах. Выделяют три типа гиперплазии лимфатических узлов:
- Инфекционная. Иммунный ответ на любую инфекцию приводит к выработке лимфоцитов и макрофагов в быстром режиме, это вызывает разрастание лимфоидной ткани.
- Реактивная. Бактерии и микробы попадают в лимфоузел, там скапливаются продукты их жизнедеятельности, выделяемые ими токсины, вызывая, в свою очередь, активное выделение клеток-макрофагов.
- Злокачественная. В этот патологический процесс могут быть вовлечены любые клетки лимфатического узла, что приводит к изменению его размера, формы и структуы.
Ткань лимфоидная — одна из важнейших составляющих иммунной системы нашего организма. Она помогает предотвратить многие болезни еще до попадания инфекции внутрь вместе с пищей и воздухом. Выполняет она и другие функции, механизм которых так до конца и не изучен.
Иногда лимфоидная ткань воспаляется, и появляются такие заболевания, как аппендицит, тонзиллит и многие другие (в зависимости от места локализации ткани лимфоидной). Очень часто в таких случаях врачи прибегают к хирургическим методам лечения, проще говоря, удаляют пораженный участок или орган. Так как все функции лимфоидных образований изучены не до конца, нельзя стопроцентно утверждать, что такое удаление не наносит вреда человеческому организму.
Многие вирусы не способны инфицировать лимфоидную ткань, т. е. селезенку, лимфатические узлы, тимус, лимфоидные клетки крови; обнаружение вируса в лимфатическом узле может быть просто результатом проникновения вируса по лимфатическим путям из периферического места размножения. Другие вирусы размножаются в лимфоцитах, ретикулярных клетках, макрофагах лимфоидной ткани, на что указывают данные окрашивания флуоресцирующими антителами и электронной микроскопии. До разработки надежных методов диагностики проводили подробное и тщательное исследование реакции лейкоцитов на вирусную инфекцию. Для некоторых вирусных болезней характерна лимфопения, для других — нейтропения; часто наблюдают лимфоцитоз при выздоровлении.
Состояние картины крови отражает ход воспалительных и иммунологических процессов в тканях, иногда — прямое действие вируса на лейкоциты и реакцию костного мозга. Сам костный мозг тоже может быть заражен, но инфекция костного мозга мало исследована. Сейчас уделяют меньше внимания изменениям поведения лейкоцитов крови; вместе с тем сами лейкоциты могут быть заражены, могут переносить вирус, вырабатывать интерферон, быть иммунологически активными и, вероятно, играют важную роль в патогенезе (Грессер и Ланг, 1966).
Лимфоидная ткань, имеющая множество разнообразных функций, может по-разному реагировать на разные вирусы: а) вирусы могут размножаться без цитопатического эффекта, как у мышей при врожденном заражении вирусами ЛХМ и лейкозов, когда развивается персистентная инфекция с иммунологической толерантностью; б) размножение вируса в лимфоидной ткани может происходить с цитопатическими эффектами, такими, как образование включений или гигантских клеток, например при цитомегаловирусной, герпесвирусной, коревой инфекции. Зараженные лейкоциты в конечном итоге гибнут, но успевают принять участие в распространении вирусов по организму. Вирус чумы рогатого скота вызывает более серьезные цитопатические поражения в лимфатических узлах (Тадзима и Усидзима, 1971).

Это сопровождается гиперпластической иммунной реакцией клеток, которая вносит свой вклад в изменение лимфоидной ткани; иммунные реакции могут играть роль в развитии патологических изменений; в) в типичном случае лимфатический узел дренирует пораженную зону и накапливает вирионы и вирусные антигены, являясь местом развития иммунного ответа. Взаимодействие иммунных клеток или антител с вирусным антигеном в лимфатическом узле может вести к отеку, а иногда и к некрозу даже в тех случаях, когда сам вирус не вызывает цитопатического эффекта, как вирус ЛХМ у взрослых мышей (Миме и Тозолини, 1969; Тозолини и Миме, 1971), или не вызывает существенного заражения лимфоидной ткани, как вирус коровьей оспы у мышей (Валнерова и Миме, 1971); г) поражения лимфоидной ткани могут быть результатом прямого деструктивного действия вируса.
При оспе мышей, сопровождающейся тяжелыми деструктивными поражениями, обусловленная этим слабость иммунного (клеточного) ответа приводит к бурному размножению вируса в печени и в конечном счете к гибели животного; у выздоравливающих животных неинфицированные клетки лимфоидного ряда обеспечивают сильный иммунный ответ (Миме, 1964). Вирус венесуэльского энцефалита (Виктор и др., 1956) и вирус некроза тимуса мышей (Роу и Кэпс, 1961) тоже, видимо, размножаются в лимфоидной ткани и разрушают ее. У мышей, зараженных вирусом гепатита мышей (коронавирусом), развивается некроз фолликулов селезенки с локальным размножением вируса (Биггарт и Рюбнер, 1970). Некроз можно предотвратить кортизоном, который либо стабилизирует мембраны, либо тормозит иммунологический механизм поражений; е) наконец, поражения лимфоедной ткани могут быть вызваны «ортикостероидными гормонами.
Тяжелая инфекция действует как стресс, а сравнимые по силе стрессы, вызванные иными факторами — холодом, голодом, травмой, — повышают секрецию кортикостероидных гормонов.
Эти гормоны оказывают глубокое воздействие на лимфоидную ткань, но их участие в патологических процессах редко отделяют от прямого вирусного и иммунологического воздействия на лимфоидную ткань (Валнерова и Миме, 1971). Многие вирусные инфекции обладают иммунодепрессивным действием, обычно связанным с размножением вируса в лимфоидной ткани; механизмы этого процесса еще неясны.
Кровь
Кровь состоит из жидкой части — плазмы и взвешенных в ней форменных элементов (эритроциты, лейкоциты, тромбоциты). В эритроцитах содержится гемоглобин. Оставшаяся после свертывания крови жидкая часть называется сывороткой. Плазма крови состоит на 80% из воды, 18% белков и 2% остальных растворенных веществ. Около половины этих веществ — соли, остальная часть органические вещества с молекулярным весом меньше, чем у белков. Концентрация каждого компонента крови регулируется организмом рыбы и поддерживается в нормальном состоянии на определенном уровне. Диапазоны нормального содержания того или иного компонента могут быть определены путем обследования большого количества клинически здоровых рыб. Они имеют огромное значение при диагностике заболеваний.
Количество крови у рыб относительно меньше, чем у всех остальных позвоночных животных (1,1 – 7,3% от массы тела, в том числе у карпа 2,0–4,7%, сома – до 5, щуки – 2, кеты – 1,6, тогда как у млекопитающих – 6,8% в среднем). Это связано с горизонтальным положением тела (нет необходимости проталкивать кровь вверх) и меньшими энергетическими тратами в связи с жизнью в водной среде. Вода является гипогравитационной средой, т. е. сила земного притяжения здесь почти не сказывается.
Клетки крови занимают от одной трети до половины объема крови рыб. Большая часть из них — эритроциты, которые выполняют дыхательную (перенос кислорода и углекислого газа), транспортную, защитную и др. функции. Общий объем эритроцитов относительно всей массы крови составляет у хрящевых рыб 20-25%, у костистых рыб 19—38%.
Эритроциты рыб — правильной элипсообразной формы, в отличие от млекопитающих и человека имеют расположенное в центре ядро. На окрашенных мазках ядро выглядит в виде плотной структуры красно-фиолетового цвета. Широкий слой цитоплазмы имеет оксифильную окраску. Эритроциты содержат гемоглобин и зависят от темпа роста, условий обитания, сезона года и физиологического состояния организма. Поперечный диаметр эритроцитов, например, для осетровых — 9,84-14,0мкм, продольный — 10,16-16,75 мкм. У костистых рыб продольный диаметр равен 9,90—18,3 мкм, поперечный — 5,2—11,0 мкм. Измеряя диаметры эритроцитов, можно определить интенсивность эритропоэза у рыб, наличие в крови кровепаразитов, разрушение эритроцитов при инфекциях и токсикозах.
Количество эритроцитов у рыб колеблется в широких пределах, прежде всего в зависимости от подвижности рыб: у карпа – 0,84–1,89 млн. /мм 3 крови, щуки – 2,08, пеламиды–4,12 млн. /мм 3 . Количество лейкоцитов составляет у карпа 20–80, у ерша – 178 тыс. /мм3. Клетки крови рыб отличаются большим разнообразием, чем у какой-либо другой группы позвоночных. У большинства видов рыб в крови имеются и зернистые (нейтрофилы, эозинофилы) и незернистые (лимфоциты, моноциты) формы лейкоцитов. Среди лейкоцитов преобладают лимфоциты, на долю которых приходится 80–95%, моноциты составляют 0,5–11%; среди зернистых форм преобладают нейтрофилы–13–31%; эозинофилы встречаются редко (у карповых, амурских растительноядных, некоторых окуневых).
Кровь окрашена гемоглобином в красный цвет, но есть рыбы и с бесцветной кровью. Так, у представителей семейства Chaenichthyidae (из подотряда нототениевых), обитающих в антарктических моряхв условиях низкой температуры (
Способность гемоглобина крови извлекать кислород из воды у разных рыб неодинакова. У быстро плавающих рыб – макрели, трески, форели – гемоглобина в крови много, и они очень требовательны к содержанию кислорода в окружающей воде. У многих морских придонных рыб, а также угря, карпа, карасей и некоторых других, наоборот, гемоглобина в крови мало, но он может связывать кислород из среды даже с незначительным количеством кислорода.
Например, судаку для насыщения крови кислородом (при 16°С) необходимо содержание в воде 2,1–2,3 О2 мг/л; при наличии в воде 0,56–0,6 О2 мг/л кровь начинает его отдавать, дыхание оказывается невозможным и рыба гибнет. Лещу при этой же температуре для полного насыщения гемоглобина крови кислородом достаточно присутствия в литре воды 1,0–1,06 мг кислорода.
Чувствительность рыб к изменениям температуры воды также связана со свойствами гемоглобина: при повышении температуры воды потребность организма в кислороде увеличивается, но способность гемоглобина связывать его падает.
Угнетает способность гемоглобина связывать кислород и углекислота: для того чтобы насыщенность кислородом крови угря достигла 50% при содержании в воде 1% СО2, необходимо давление кислорода в 666,6 Па, а в отсутствии СО2 для этого достаточно давления кислорода почти вдвое меньшего – 266,6– 399,9 Па.
Соотношение разных форм лейкоцитов в крови карпа зависит от возраста и условий выращивания.
Общее количество лейкоцитов в крови рыб сильно изменяется в течение года, у карпа оно повышается летом и понижается зимой при голодании в связи со снижением интенсивности обмена.
Количество лейкоцитов у рыб зависит от возраста и пола, у карпа, например, — 20—80 тыс. в 1 мм 3 , у красноперки оно достигает 120 тыс. в 1 мм 3 , у ерша — 178 тыс. в 1 мм 3 . Основная функция лейкоцитов — защитная, т. е. они представляют собой составную часть иммунной системы рыб. Поэтому при инфекционных заболеваниях количество лейкоцитов увеличивается, что является показателем усиления защитной реакции организма. Увеличение количества лейкоцитов называется лейкоцитозом, а уменьшение — лейкопенией. Лейкоциты костных рыб разделяются на клетки, содержащие специфическую зернистость — гранулоциты, в цитоплазме которых обязательно наличие зернышек, или гранул, и незернистые — агранулоциты в цитоплазме которых зерна отсутствуют. К зернистым лейкоцитам относят нейтрофилы, эозинофилы, базофилы, псевдобазофилы и псевдоэозинофилы. К незернистым — лимфоциты и моноциты. При рассматривании мазков крови, окрашенных специальными основными и кислыми красками все перечисленные формы лейкоцитов различаются по строению ядра и цитоплазмы у разных видов рыб. При этом ядро имеет красно-фиолетовый цвет, а цитоплазма — голубой, розовый или розовато-фиолетовый. Розовато-фиолетовый цвет свидетельствует о поглощении и той и другой краски.
Группы крови у рыб впервые были определены на байкальском омуле и хариусе в 30-х годах. К настоящему времени установлено, что групповая антигенная дифференцировка эритроцитов широко распространена; выявлено 14 систем групп крови, включающих более 40 эритроцитарных антигенов. При помощи иммуносерологических методов изучается изменчивость на разных уровнях; выявлены различия между видами и подвидами и даже между внутривидовыми группировками у лососевых (при изучении родства форелей), осетровых (при сравнении локальных стад) и других рыб.
Лимфоциты — округлые нередко амебоидной формы с занимающим большую часть объема клетки крупным красно-фиолетовым ядром. Цитоплазма резко базофильная, бесструктурная, расположенная в виде ободка вокруг ядра, имеет небольшие выросты по периферии клетки.
Тромбоциты представляют собой мелкие клетки элипсоидной, овальной, амебоидной, округлой формы с плотным красно-фиолетовым ядром и грязно-розовой цитоплазмой, принимают участие в механизме свертывания крови. Как правило, время свертывания крови обратно пропорционально количеству тромбоцитов. Предполагают, что тромбоциты участвуют также в дыхании.
Клетки крови у разных видов рыб имеют свои морфологические особенности.
Соотношение разных форм лейкоцитов, выраженное в процентах, называется лейкоцитарной формулой (лейкограмма). У здоровых рыб лейкоцитарная формула очень динамична, но более или менее постоянна. В норме у различных видов рыб она разная и изменяется в зависимости от физиологического состояния рыбы, характера питания, активности движения, солености воды, возраста и пола, но во всех случаях в крови рыбы преобладают лимфоциты. При заболеваниях процентное соотношение отдельных форм лейкоцитов изменяется. Например, при аэромонозе карпа значительно увеличивается содержание нейтрофилов, при черно-пятнистом заболевании отмечается увеличение количества моноцитов.
При голодании содержание основных компонентов крови также снижается. Так, скорость оседания эритроцитов (СОЭ) у карпа резко увеличивается после голодания в течение 7 недель при температуре 16—22 °С. При этом плазма крови теряет много белка, что приводит к уменьшению ее удельного веса и вязкости. Затем было обнаружено снижение гемоглобина с 11 до 7%. Голодание приводит к уменьшению молодых клеток крови и резкому снижению интенсивности процессов кроветворения.
Иоффи и Куртис (1970) объединили лимфоидную и кроветворную системы в единый лимфомиелоидный комплекс. Комплекс представляет собой систему органов и тканей, паренхима которых содержит клетки мезенхимального происхождения. В него входит красный костный мозг, тимус, селезенка, лимфатические узлы, лимфоидная ткань кишечника и соединительная ткань. Функциональные клетки лимфоидной системы представлены лимфоцитами, макрофагами и в некоторых тканях эпителиальными клетками. Все эти клетки функционируют в составе либо обособленных органов, либо диффузных образований.
Лимфоидные органы относят либо к первичным (центральным), и ибо ко вторичным органам. Первичные лимфоидные органы — это красный костный мозг и тимус.
Первичные лимфоидные органы служат основным местом развития лимфоцитов. Здесь лимфоциты дифференцируются из стволовых лимфоидных клеток, размножаются и созревают в функциональные клетки. В первичных органах формируется репертуар специфичностей лимфоцитарных антител распознающих рецепторов, и лимфоциты приобретают таким образом способность распознавать любые антигены, с которыми организм может столкнуться в течение жизни. После чего уже в периферических лимфоидных органах или образованиях распознают только чужеродные антигены.
Из первичных органов лимфоциты мигрируют для выполнения своих функций по кровеносному руслу в периферическую лимфоидную ткань — лимфатические узлы, селезенку и лимфоидную ткань слизистых оболочек (пейеровы бляшки, миндалины). Это движение лимфоцитов от центральных органов иммунной системы на периферию является главным миграционным путем. Кроме того, имеется путь рециркуляции. Лимфатические сосуды, дренирующие тело, собирают внеклеточную жидкость — лимфу — вместе с рассеянными по телу лимфоцитами и переносят ее в лимфатические узлы. После некоторого времени пребывания в лимфатических узлах лимфоциты собираются в выносящих эфферентных лимфатических сосудах. Из них лимфоциты попадают в основной лимфатический сосуд — грудной проток, откуда вновь возвращаются в кровоток.
Таким образом, лимфоциты относятся к той категории клеток, которые широко распространены в организме. Различные типы организации лимфоцитов обеспечивают наиболее эффективное проявление лимфоидной системы при встрече с чужеродным антигеном.
Иммунный ответ на антигены, поступающие в организм через слизистые оболочки, начинается с премирования лимфоцитов, главным образом в пейеровых бляшках.
Разные лимфоидные органы защищают различные системы организма: селезенка отвечает на антигены, циркулирующие в крови; лимфоузлы реагируют на антигены, поступающие по лимфатическим сосудам; лимфоидная ткань слизистых оболочек защищает слизистые оболочки.
Лимфоциты в большинстве не оседлые, а циркулирующие клетки; они постоянно мигрируют из кровотока в лимфоидные органы и вновь поступают в кровоток.
In vivo сложные клеточные взаимодействия, составляющие основу иммунной реакции, происходят в периферических, или вторичных, лимфоидных органах, к которым относятся лимфатические узлы, селезенка и скопления диффузной лимфоидной ткани в слизистых оболочках дыхательных, пищеварительных и мочеполовых путей.
Вторичные лимфоидные ткани заселены клетками ретикулярного происхождения, а также макрофагами и лимфоцитами, предшественниками которых служат стволовые клетки костного мозга. Стволовые клетки дифференцируются в иммунокомпетентные Т- и В-лимфоциты. При этом Т-лимфоциты дифференцируются в иммунокомпетентные клетки в тимусе, а В-лимфоциты в костном мозге. В дальнейшем лимфоциты заселяют лимфоидные ткани, где и происходит иммунный ответ. Лимфатические узлы отфильтровывают чужеродные материалы, попавшие в ткани организма, и при необходимости реагируют на них.
Селезенка осуществляет контроль за цитологическим составом крови, а лимфоидная ткань, диффузно распределенная в слизистых покровах организма, представляет собой самый первый барьер на пути инфекции, защитное действие которого основано на секреции иммуноглобулинов.
Взаимодействие между вторичными лимфоидными органами и остальными тканями организма осуществляется с помощью ретикулирующих лимфоцитов, которые переходят из крови в лимфатические узлы, селезенку и другие ткани и обратно в кровь по основным лимфатическим путям.
Вопросы для самоконтроля
1. Какие основные клетки лимфоидной ткани вы знаете?
2. Дайте общую характеристику лимфоидной ткани.
3. По каким признакам делятся ткани внутренней среды?
4. Какие основные функции у соединительных тканей?
5. Какие основные свойства соединительной ткани вы знаете?
6. Какие разновидности тканей внутренней среды вы знаете?
1.Калайда, М.Л. Общая гистология и эмбриология рыб / М.Л. Калайда, М.В. Нигметзянова, С.Д. Борисова // - Проспект науки. Санкт- Петербург. - 2011. - 142 с.
3. Константинов, В.М.Сравнительная анатомия позвоночных животных / В.М. Константинов, С.П. Шаталова //Издательство: "Академия", Москва. 2005. 304 с.
4. Павлов, Д.А. Морфологическая изменчивость в раннем онтогенезе костистых рыб / Д.А. Павлов // М.: ГЕОС, 2007. 262 с.
1. Афанасьев, Ю.И. Гистология / Ю.И. Афанасьев [и др.] // - М.. “Медицина”. 2001 г.
2.Быков, В.Л. Цитология и общая гистология / В.Л. Быков // - СПб.: “Сотис”. 2000 г.
3.Александровская, О.В. Цитология, гистология, эмбриология / О.В. Александровская [и др.] // - М. 1987 г.
Не нашли то, что искали? Воспользуйтесь поиском:
Злокачественное поражение лимфатической системы относится к сравнительно благоприятным видам новообразований. Болезнь Ходжкина при своевременной диагностике и правильном подходе к терапии можно вылечить. К важным прогностическим факторам относятся поражение внутренних органов и риск сопутствующих инфекций.
Увеличение лимфоузлов указывает на риск патологии
Болезнь Ходжкина
Лимфоидная ткань имеется в любом месте человеческого организма. Опухоль, связанная с этой системой вне костного мозга, называется лимфома (поражение лимфоидной системы костного мозга – это лейкоз). Самый частый вариант новообразования – болезнь Ходжкина, у которой имеются альтернативные названия:
- лимфогранулематоз;
- лимфома Ходжкина;
- злокачественная гранулема.
Началом заболевания является поражение опухолью лимфоузлов в любом месте организма. По мере прогрессирования онкопроцесса происходят изменения во внутренних органах (печень, селезенка, почки и легкие), что является прогностически неблагоприятным фактором. Стандартное время обнаружения опухоли – в возрасте 20-30 лет и после 55.
Причины патологии лимфоидной системы
Важнейшими причинами, запускающими болезнь Ходжкина, являются следующие факторы:
- наследственная предрасположенность (генетические мутации, полученные от родителей);
- инфицирование вирусом Эпштейна-Барр;
- наличие выраженного иммунодефицита любого происхождения (ВИЧ, прием иммунодепрессантов, лучевая терапия, терапия после трансплантации);
- действие химических канцерогенов.
В большинстве случаев крайне сложно подтвердить значимость какого-либо фактора: при наличии предрасположенности к опухоли все остальные факторы провоцируют или способствуют злокачественному росту.
Гистологические варианты
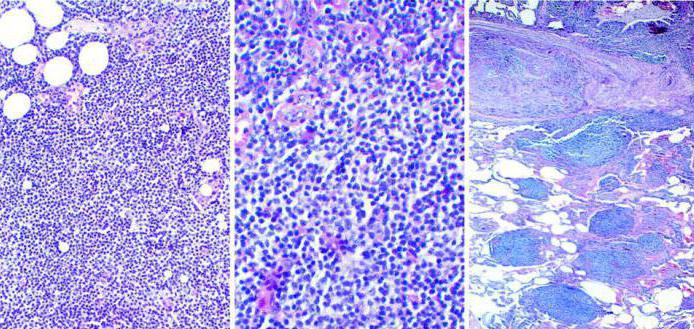
Объективным и доказательным методом обследования любой опухоли является микроскопия гистологического материала. Главный признак при болезни Ходжкина – наличие больших клеток Рида-Штернберга в биопсийном материале, взятом из лимфоузла больного человека. Дополнительно врач-гистолог заметит наличие следующих признаков в лимфоидной ткани:
- клетки Ходжкина;
- мелкие по размерам Т-лимфоциты;
- множество В-лимфоцитов.
В зависимости от соотношения клеточных структур и прогноза злокачественности выделяют 4 вида лимфом:
- Лимфогистиоцитарный;
- Узловой склероз;
- Смешанный;
- Истощение или полное подавление лимфоидной ткани.
Первые 3 варианта являются сравнительно благоприятными (шансы на выздоровление достаточно велики), при отсутствии в гистологическом материале нормальной лимфоидной ткани прогноз неблагоприятен.
Стадии опухолевого процесса
Распространение лимфогранулематоза по организму человека разделяется на 4 стадии:
- Изменения в одной локализованной группе лимфоузлов;
- Поражение лимфоидной системы с одной стороны от диафрагмы (верхняя часть тела или нижняя, разделяемые на уровне груди);
- Опухолевый рост по обе стороны диафрагмы;
- Патологические изменения во внутренних органах (печень, почки, легкие, селезенка, кишечник, костный мозг).
Оптимально выявить и лечить в 1-2 стадию, когда шансы на полное выздоровление наилучшие.
Симптомы заболевания
- шейные лимфатические узлы;
- подчелюстные;
- надключичные;
- подмышечные;
- паховые.
При поражении глубоко расположенных лимфоузлов в области груди и поясницы возникают следующие симптомы:
- необъяснимый кашель;
- одышка;
- боль в спине, неподдающаяся стандартным методам лечения;
- нарушения дефекации (понос);
- суставная боль.
Из общих симптомов, указывающих на риск опасной патологии, возможны следующие проявления:
- температурная реакция в виде необъяснимой лихорадки;
- выраженная потливость;
- снижение массы тела;
- рецидивирующая пневмония.
При любых проблемах со здоровьем важно не медлить – вовремя проведенные диагностические исследования помогут поставить точный диагноз и начать эффективную терапию.

Врач-гистолог в биоптате обнаружит специфические клетки, что будет подтверждением диагноза
Методы диагностики
Единственный точный вариант обследования – хирургическая или аспирационная биопсия увеличенного лимфатического узла. Болезнь Ходжкина – это наличие клеток Рида-Штернберга в биоптате. Необходимыми методами обследования являются:
- общеклинические анализы;
- рентген грудной клетки;
- ультразвуковое сканирование внутренних органов;
- компьютерная томография;
- лапароскопия (при необходимости).
Тактика лечения
Основа успешной терапии – комбинированное лечение с применением курсового лучевого воздействия и использованием химиотерапевтических препаратов с цитостатическим действием. Врач для каждого пациента подбирает индивидуальную схему терапии. Наблюдение в врача-онколога пожизненное.
Прогноз благоприятен при 1-2 стадии – полная ремиссия возможна у подавляющего большинства пациентов (до 96%). При осложнениях и 3-4 стадии шансов на выздоровление значительно меньше (до 50-55%). Лучшие результаты лечения бывают у молодых людей (до 30 лет) и при отсутствии серьезных проблем с иммунитетом.
Лимфоидная ткань (лат. lympha чистая вода, влага + греч. eidos вид; син. лимфатическая ткань) — морфофункциональный комплекс лимфоцитов и макрофагов, располагающийся в клеточно-волокнистой соединительнотканной основе и составляющий функционирующую паренхиму лимфоидных органов; Лимфоидная ткань неразрывно связана с гемопоэтической тканью.
К лимфоидным органам, являющимся органами иммуногенеза, относят вилочковую железу (см.), лимфатические узлы (см.), селезенку (см.), лимфоидные элементы костного мозга (см.) и скопления лимфоидной ткани по ходу желудочно-кишечного тракта. Лимфоидные органы в отношении функции иммуногенеза разделяют на первичные и вторичные. Так, вилочковую железу относят к центральным органам системы иммуногенеза (формирование клеточной системы иммунитета), а белую пульпу селезенки, лимфатические узлы и скопления Лимфоидной ткани в слизистой оболочке пищеварительного тракта — к вторичным, или периферическим, органам иммуногенеза.
Основные этапы эволюции Л. т. достаточно очерчены. У беспозвоночных Л. т. отсутствует. У круглоротых (миног) впервые обнаруживается предшественник вилочковой железы, имеющий вид небольших лимфоидных скоплений в эпителии окологлоточной бороздки. У этих животных установлена способность к иммунному ответу по типу реакции гиперчувствительности замедленного типа и реакции отторжения аллотрансплантата. У примитивных хрящевых рыб обнаруживается селезенка, Л. т. в кишечнике, почках, половых железах, в периваскулярной соединительной ткани. У осетровых рыб появляются плазматические клетки, т. е. способность к выработке специфических антител. Амфибии и рептилии отличаются появлением красного костного мозга, очагов лимфоидного кроветворения в печени. У птиц одновременно с концентрацией лимфоидных элементов в области клоакального органа — фабрициевой сумки — возникают зачаточные лимф, узлы (см. Лимфатическая система).
Все лимфоидные органы млекопитающих, в т. ч. и человека, состоят из соединительнотканной основы, представленной коллагеновыми и аргирофильными волокнами, в к-рых располагаются постоянные (стабильные) клеточные элементы Л. т. и непрерывно мигрируют другие клетки. Основными клеточными элементами Л. т. являются лимфоциты (см.), макрофаги (см.), плазматические клетки (см.), фибробласты, эндотелиальные и ретикулярные клетки. Лимфоциты и их производные, входящие в так наз. лимфоидную систему, и система макрофагов, лежащие в фиброретикулярной ткани, составляют основу Л. т. (так наз. макрофагально-фагоцитарная система). В 1970 г. Ван-Фюрт (R. van Furth) и соавт, предложили данную функциональную систему назвать лимфоретикулогистиоцитарной системой.
Ретикулярные клетки, образующие ретикулярные волокна, по морфологии (на уровне световой микроскопии) не отличаются от фибробластов соединительной ткани (см.). Совр, исследования по гистогенезу кроветворной ткани привели к необходимости пересмотра представлений о ретикулярной клетке. Различные авторы рассматривают ее по-разному. А. Я. Фриденштейн и К. С. Лалыкина (1973) полагают, что ретикулярные клетки стромы вторичных лимфоидных органов (механоциты) образуются из специальных стволовых клеток, отличающихся от стволовых клеток крови. Ретикулярные клетки разных органов, несмотря на морфол, сходство, различаются по направленности дифференцировки: ретикулярные клетки из культур костного мозга при обратной пересадке в организм образуют кость, а из культур селезенки— ретикулярные волокна. И. Н. Кокорин (1970) и соавт, считают, что ретикулярные клетки селезенки являются полипотентными клетками стромы этого органа. Можно предположить, что ретикулярные клетки объединяют несколько типов клеток: гистиоциты, соответствующие макрофагам, моноциты, фибробласты, а также так наз. дендритические и интердигитирующие клетки.
Еще в 1927 г. А. А. Максимов, критикуя концепцию ретикулоэндотелиальной системы (см.), указывал на различия в происхождении, морфологии и функции эндотелиальных клеток сосудов и ретикулярных клеток. Затем было установлено наличие разных предшественников этих клеток и подтверждены их функц, различия. Показано, что эндотелиоциты сосудов, фибробласты и ретикулярные клетки относятся к слабофагоцитирующим элементам: окрашивание их при введении витального красителя (особенно в больших дозах) происходит в основном в результате пиноцитоза (см.), а не фагоцитоза. Оказалось, что в клиренсе крови участвуют преимущественно макрофаги печени (купферовские клетки) и макрофаги красной пульпы селезенки, но не эндотелиоциты и не ретикулярные клетки.
Устойчивый уровень процесса физиологической регенерации в первичных лимфоидных органах человека устанавливается в конце эмбрионального периода, во вторичных — в раннем постнатальном периоде.
В процессе функционирования происходит распад и гибель лимфоидных клеток и элементов стромы, число их непрерывно возмещается пролиферацией, дифференцировкой и миграцией клеток.
Наиболее демонстративны возрастные изменения в вилочковой железе, максимальная масса к-рой (30—40 г) приходится на пубертатный период, затем она быстро подвергается инволюции; отмечается нарастание числа лаброцитов (тучных клеток), количество плазматических клеток сначала увеличивается, затем они исчезают, уменьшается количество эпителиоцитов; возникает жировое замещение паренхимы. Нередко после 30 лет лишь микроскопическое исследование позволяет обнаружить в области вилочковой железы небольшие скопления лимфоцитов и эпителиоцитов, заложенных в жировую или фиброзную основу.
Изменения в лимфоидных органах у пожилых людей служат отражением сниженной иммунной реактивности.
Факторы, регулирующие процессы физиол, и репаративной регенерации в первичных и вторичных лимфоидных органах, выяснены частично: соматотропный гормон, кальцитонин, вазопрессин и другие гормоны усиливают пролиферацию клеток первичных лимфоидных органов, гормоны коркового вещества надпочечников подавляют лимфоцитопоэз в селезенке и лимф, узлах; в эксперименте пассивное введение антител тормозит пролиферацию клеток при действии антигена. Установлен гуморальный фактор (тимозин), вырабатываемый вилочковой железой, способствующий пролиферации тимоцитов и образованию О-антигенов на поверхности стволовых клеток костного мозга, мигрирующих в вилочковую железу. Однако окончательно не выявлен фактор, влияющий на лимфоцитопоэз (см. Лейкопоэтины). Не ясны факторы, обусловливающие рост вилочковой железы в постнатальном периоде и инволюцию ее у взрослых организмов. Вместе с тем установлено, что для созревания тимоцитов необходим прямой контакт с чрезвычайно своеобразной ретикулоэпителиальной стромой вилочковой железы. А. Я. Фриденштейн (1973) высказал предположение, что различия в ответе на повреждающее воздействие первичных и вторичных лимфоидных органов могут быть связаны с разницей в характере и происхождении их стромы. Т. А. Рожнова (1971), Борам (К. Borum, 1969) экспериментально установили, что репаративная регенерация в вилочковой железе происходит лишь в тех случаях, когда повреждающее воздействие (облучение, кортизонотерапия, резекция и др.) существенно не нарушает целости стромы. При этом в вилочковую железу мигрируют лимфоидные клетки костного мозга, за счет пролиферации к-рых и происходит регенерация органа, однако его масса уже не достигает нормальной величины.
Репаративная регенерация вторичных лимфоидных органов (селезенки и лимф, узлов) обусловлена не только пролиферацией репопулирующих клеток из костного мозга и вилочковой железы, но и размножением сохранившихся клеток органов. Г. В. Харлова (1975) допускает, что скорость и полнота регенерации вторичного лимфоидного органа зависят от соотношения и созревания в нем Т- и В-лимфоцитов. Показано, что лимфоциты принимают участие в регенеративных процессах не только в лимфоидных органах, но и в печени, легких, коже, почках.
Функциональное значение Лимфоидной ткани определяется ее важнейшей ролью в иммунных реакциях. Процесс выработки антител осуществляется клетками Л. т. Высказывается вполне обоснованное предположение, что Т- и В-лимфоциты путем обратной связи могут контролировать иммунный ответ и деление стволовых клеток. Нек-рые исследователи полагают, что утрата способности Т-лимфоцитов к такому контролю может явиться причиной аутоиммунных заболеваний, а также является одним из возможных условий развития злокачественного новообразования.
Защитная реакция организма на воздействие чужеродных веществ (экзо- и эндогенных) в значительной мере определяется функц, состоянием Л. т., с к-рой связана специфическая (иммунологическая) резистентность (см. Иммунитет). Появляются доказательства большого значения Л. т. не только в иммунных реакциях, но и в неспецифической резистентности организма (см.). Как показали исследования П. Д. Горизонтова (1976), повышение резистентности организма при стрессе характеризуется усилением костномозгового кроветворения, увеличением миграции клеток Л. т. в костный мозг в первые часы после воздействия чрезвычайного раздражителя — так наз. лимфоидный пик. Появление при этом Т-лимфоцитов в костном мозге рассматривается исследователями как свидетельство роли вилочковой железы в неспецифической резистентности организма.
Предполагается, что при неблагоприятных воздействиях распад клеток Л. т. обеспечивает трофическую функцию, т. к. при этом продукты обмена (в частности, нуклеопротеиды) реутилизируются в зонах повреждения тканей, чем компенсируется неблагоприятное воздействие. Бернс (D. W. Bernes, 1962) и соавт, высказали мнение о том, что недостаточность Л. т. и уменьшение ее трофической функции играют важную патогенетическую роль при так наз. болезнях истощения, в т. ч. и при раневом истощении, описанном И. В. Давыдовским.
Заболевания, связанные с поражением Л. т., обычно диагностируются по данным биопсий лимф, узлов (за исключением лейкозов, дисгаммаглобулинемий и аутоиммунных процессов). К заболеваниям Л. т. относятся гипоплазия лимфатических узлов— редкое состояние, отражающее иммунную недостаточность; реактивная гиперплазия лимф, узлов, возникающая при воспалительных процессах и активации иммунных реакций как первичного, так и вторичного характера (см. Иммуноморфология, Иммунопатология). Решение вопроса о характере так наз. воспалительного компонента (появление эозинофилов, нейтрофилов, плазматических и эпителиоидных клеток) нередко представляет значительные трудности.
Особую группу патологических процессов Лимфоидной ткани составляют злокачественные новообразования (см. Гемобластозы, Гистиоцитозы, Лимфогранулематоз, Лимфома, Миеломная болезнь).
Библиогр.: Горизонтов П. Д. Лимфоидная ткань и неспецифическая резистентность организма, Арх. патол., т. 38, № 3, с. 3, 1976, библиогр.; Пестова И. М. Краткий очерк эволюции лимфоидной ткани и её иммуноклеточной реактивности у позвоночных, Арх. анат., гистол, и эмбриол., т. 70, № 3, с. 26, 1976, библиогр.; Структура и функция лимфоидной ткани в онто- и филогенезе, под ред. Е. А. Вагнера и др., Пермь, 1976; Харлова Г. В. Регенерация лимфоидных органов у млекопитающих, М., 1975, библиогр.; Carr J. The line structure of the mammalian lymphoreticular system, Int. Rev. Cytol., y. 27, p. 283, 1970, bibliogr.; он же, The macrophage — a review of ultrastructure and function, L.— N. Y., 1973; Goldstein A. L., Slater F. D. a. White A. Preparation, assay and partial purification of thymic lymphocytopoietic factor (thymosin), Proc, nat. Acad. Sci. (Wash.), v. 56, p. 1010, 1966; Kyriazis A. A. a. Esterly J. R. Fetal and neonatal development of lymphoid tissues, Arch. Path., v. 91, p. 444, 1971; Maximow A. Bindegewebe und blutbildene Gewebe, Handb, mikr. Anat. Menschen, hrsg. v. W. Mollendorff, Bd 2, T. 1, S. 232, B. 1927; Mononuclear phagocytes m immunity, infection and pathology, ed. by R. van Furth, Oxford, 1975.
Читайте также:


