Макролиды для лечения урогенитальных инфекций
Урогенитальный хламидиоз часто является причиной воспалительных заболеваний органов малого таза (ВЗОМТ), а впоследствии бесплодия и невынашивания беременности. Кроме того, скрыто протекающий урогенитальный хламидиоз подготавливает благоприятную почву для суперинфекции другими микроорганизмами. Хламидии чувствительны к тетрациклинам, макролидам и фторхинолонам (кроме ципрофлоксацина).
- Азитромицин внутрь 1 г однократно,
или по 0,25 1 раз/сут 3 дня,
или 0,5 в первый день лечения, а затем 4 дня по 0,25 однократно (за 1 ч до еды);
или эритромицин 0,5 внутрь 4 раза/сут,
или рокситромицин 0,3 внутрь в 1-2 приема,
или ровамицин 3 млн. МЕ внутрь 3 раза/сут,
или мидекамицин 0,4 внутрь 2 раза/сут,
или кларитромицин 0,25 внутрь 2 раза/сут в течение 7-14 дней. - Доксициклин внутрь 0,1 2 раза/сут 7-14 дней.
- Офлоксацин 0,4 внутрь 2 раза/сут, или левофлоксацин 0,5 внутрь в день, или моксифлоксацин 0,4 внутрь в день 7 дней.
- Комбинированная схема: доксициклин 0,1 внутрь 2 раза/сут 9 дней, затем азитромицин 0,5 в день 3 дня, затем офлоксацин 0,2 внутрь 2 раза/сут 9 дней.
В клинике показана также целесообразность назначения одновременно двух антихламидийных препаратов (например, препаратов группы макролидов и фторхинолонов) гинекологическим больным с урогенитальным хламидиозом, осложненным воспалительным процессом.
При осложненном хламидиозе апробирована и рекомендуется схема 1-7-14: по 1 г азитромицина в 1-й, 7-й и 14-й дни. Особо необходимо обратить внимание, что некоторыми антихламидийными схемами рекомендуется ципрофлоксацин, но он малоэффективен против хламидий, поэтому целесообразность его назначения в данном случае крайне сомнительна. Особенно эффективны против хламидий фторхинолоны последнего поколения (левофлоксацин, моксифлоксацин), поэтому предпочтительнее их использование при микст-инфекциях.
Поскольку при беременности противопоказаны доксициклин и фторхинолоны, можно использовать только макролиды:
- эритромицин (основание) 0,5 внутрь 4 раза/сут в течение 1014 дней;
- ровамицин (ровамицин) внутрь 3 млн. МЕ 3 раза/сут 10-14 дней;
- азитромицин внутрь 1 г однократно, или по 0,25 раз/сут 3 дня, или 0,5 в первый день лечения, а затем 4 дня по 0,25 однократно (за 1 ч до еды).
В некоторых руководствах приводятся схемы лечения хламидиоза у беременных клиндамицином (по 0,3 внутрь 4 раза/сут в течение 7 дней), однако имеющиеся данные о проникновении препарата через плаценту не позволяют рекомендовать его для широкого применения при наличии более безопасных для плода макролидов.
Микоплазмоз и уреаплазмоз. Микоплазмы резистентны к антибиотикам пенициллинового ряда, чувствительны к тетрациклинам, азитромицину. Тетрациклины одинаково эффективны против как M. hominis, так и уреаплазмы. M. hominis чувствительна к линкомицину, но устойчива к эритромицину. Уреаплазма, наоборот, чувствительна к эритромицину, но устойчива к линкомицину. Клиндамицин имеет высокую активность в отношении M. hominis и среднюю в отношении уреаплазмы. Некоторую активность в отношении микоплазм имеют аминогликозиды.
Вне беременности препаратами выбора являются антибиотики группы тетрациклинов и(или) макролидов. Лечение проводится пациенткам совместно с их половыми партнерами:
- доксициклин 0,1 внутрь 2 раза/сут в течение 7-10 дней, первый прием 0,3;
- метациклин по 0,3 внутрь 3 раза/сут 9 дней, первый прием 0,6;
- азитромицин по 0,25 г внутрь 1 раз/сут 5-6 дней;
- ровамицин 3 млн. ЕД внутрь 3 раза/сут 10-14 дней;
- рокситромицин внутрь (суточная доза 0,3 г, курс 3 г);
- мидекамицин внутрь (суточная доза 1,2 г, курс 12 г);
- эритромицин 0,5 внутрь 4 раза/сут 10 дней.
Согласно имеющимся в литературе рекомендациям, беременным в 18-20 недель можно провести лечение эритромицином (по 0,5 внутрь 4 раза/сут в течение 10 дней). Многолетнее и доказанно безопасное использование ровамицина при беременности, а также спектр его антимикробной активности позволяют рекомендовать его как препарат выбора для лечения урогенитальных инфекций у беременных (в том числе микоуреаплазмоза) - курсом по 3 млн. МЕ внутрь 3 раза/сут 10-14 дней, причем сразу при выявлении инфекции - в любом сроке беременности. Со II триместра возможно назначение азитромицина по 0,25 г внутрь раз в сутки 5-6 дней или по другим схемам, приведенным выше.
Негонококковые уретрит и цервицит чаще всего вызываются Chlamуdia trachomatis, Mycoplasma hominis, Ureaplasma urealyticum, E. coli.
- Азитромицин внутрь 1 г однократно или 0,5 1 раз/сут 3 дня, или ровамицин 3 млн ЕД внутрь 3 раза/сут, или рокситромицин 0,3 в 1-2 приема/сут внутрь, или мидекамицин 0,4 внутрь 2 раза/сут, или кларитромицин 0,25 внутрь 2 раза/сут, или эритромицин 0,5 внутрь 4 раза/сут.
- Доксициклин внутрь 0,1 2 раза/сут.
- Офлоксацин 0,2 г внутрь 2 раза/сут + орнидазол 0,5 г внутрь 2 раза/сут.
- Левофлоксацин 0,25 внутрь в день или моксифлоксацин 0,4 внутрь в день.
Терапия проводится в течение 7-14 дней. Российский национальный формуляр допускает применение всех макролидных антибиотиков (курс 7 дней).
Вопросы антибиотикотерапии урогенитальной микоплазменной инфекции активно дискутируются. Многочисленные исследования посвящены разработке рекомендаций по терапии микоплазменной инфекции. Но по-прежнему наиболее сложным и актуальным на сегодняшний день ост
В последние десятилетия наряду с ростом заболеваемости урогенитальной патологией отмечаются значительные изменения в ее структуре. По данным эпидемиологических исследований, более чем у 40% больных с воспалительными заболеваниями урогенитального тракта выявляется микоплазменная инфекция [1].
Урогенитальная микоплазменная инфекция довольно широко распространена в популяции. Человек является естественным хозяином, по крайней мере, одиннадцати видов микоплазм, из них три вида (Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma urealyticum) способны вызывать воспалительные заболевания урогенитального тракта. Носительство М. hominis и U. urealyticum среди населения варьирует от 10% до 50% [1].
В настоящее время все большее внимание в отечественной и зарубежной литературе уделяется виду U. urealyticum. Данный вид включает в себя два биовара: PARVO (серотипы 1, 3, 6 и 14) и T-960 (серотипы 2, 4, 5, 7, 8, 9, 10, 11, 12, 13). Оба биовара способны инициировать патологические проявления. Так, с биоваром PARVO связывают выраженную лейкоцитарную реакцию при микроскопии мазка, кольпит, пиелонефрит, дистрофические изменения плаценты, а также рождение детей с массой тела менее 3 кг.
Биовар Т-960 считается ответственным за проявления негонококкового уретрита у мужчин, патологические выделения из влагалища у женщин и, в редких случаях, внутриутробную гибель плода [3].
Отличительными особенностями микоплазм и уреаплазм являются отсутствие клеточной стенки и способность паразитировать на мембране клеток хозяина.
Учитывая высокую распространенность микоплазм, в особенности у беременных женщин, их клиническая роль зависит от степени колонизации ими урогенитального тракта [4]. Так, статистически выявлена значительная связь между уровнем колонизации U. urealyticum и M. hominis мочеполовых путей женщин и преждевременными родами, а также дородовым излитием околоплодных вод [4]. В литературе появляется все больше сообщений о внутриутробной микоплазменной инфекции, которая реализуется у новорожденных чаще всего в виде пневмоний, но может носить и генерализованный характер [4].
Основной путь передачи микоплазменной инфекции — половой. Чаще всего микоплазмы обнаруживаются у лиц с повышенной половой активностью. Для развития инфекционного процесса важное значение имеет не столько сам факт наличия или отсутствия микоплазм, сколько широта и массивность их диссеминации. К факторам, провоцирующим развитие инфекционного процесса, относятся: присоединившаяся инфекция другой природы, изменение гормонального фона, беременность и роды; нарушения иммунного и интерферонового статусов организма. Немаловажную роль в развитии инфекции играет и вирулентность конкретного штамма.
Кроме того, широко распространено бессимптомное носительство микоплазм. Во многих случаях они вызывают латентную инфекцию, которая под влиянием различных стрессовых факторов может перейти в хроническую рецидивирующую или острую форму.
Клиническая картина мико- и уреаплазменной инфекции неспецифична и, как правило, не отличается от клинических проявлений инфекций, вызванных другими возбудителями урогенитальных инфекций.
Таким образом, воспалительные заболевания мочеполовых органов, обусловленные патогенными и условно-патогенными микоплазмами, продолжают оставаться серьезной проблемой в связи с возможностью развития тяжелых осложнений, связанных с репродуктивной функцией. Несмотря на неоднозначность мнений исследователей в отношении патогенной роли мико- и уреаплазменной инфекции, в этиологической классификации Всемирной организации здравоохранения (ВОЗ) 2006 г. и синдромальной классификации CDC (Centers for Disease Control and Prevention, центры по контролю и профилактике заболеваний США) эти микроорганизмы выделены как возможные этиологические агенты неспецифических негоноккоковых уретритов, воспалительных заболеваний органов малого таза и бактериального вагиноза [2].
Одним из наиболее сложных на сегодняшний день остается вопрос эффективности терапии урогенитальных инфекций.
Многочисленные исследования посвящены разработке схем и методик применения тех или иных антимикробных препаратов. Оптимизируют антибактериальную терапию с помощью иммуномодуляторов, ферментных и других лекарственных средств. В целом, терапия инфекций, передаваемых половым путем, должна быть комплексной, а применяемые препараты — обладать широким спектром действия. К препаратам, используемым для лечения инфекций, передаваемых половым путем, ВОЗ выдвинуты следующие требования:
- эффективность не менее 95%;
- хорошая переносимость и малая токсичность;
- безопасность использования во время беременности;
- медленное развитие резистентности микроорганизмов к средствам терапии;
- доступная цена.
Основные принципы медикаментозной терапии:
- основные препараты (препараты выбора) — обеспечивают наилучшее соотношение между эффективностью лечения и доказанной безопасностью лечебного средства;
- альтернативные препараты — обеспечивают приемлемые результаты лечения при отсутствии возможности использования основных схем лечения (беременность, кормление грудью, индивидуальная непереносимость лекарственного средства, сопутствующие заболевания и т. д.).
Рациональный выбор антибиотиков для эмпирической терапии следует осуществлять с учетом следующих критериев:
- спектр активности, соответствующий предполагаемому возбудителю;
- фармакокинетика, определяющая проникновение антибиотика в очаг воспаления, кратность введения и длительность курса лечения;
- эффективность при урогенитальных инфекциях, доказанная в рандомизированных клинических исследованиях;
- противопоказания и частота побочных эффектов;
- удобство применения для пациента (повышает аккуратность соблюдения режима лечения);
- фармакоэкономические аспекты лечения.
Вопросы антибиотикотерапии урогенитальной микоплазменной и уреаплазменной инфекции также активно дискутируются. В то же время адекватная антибиотикотерапия должна проводиться лишь с учетом чувствительности конкретного штамма возбудителя [5–6].
С учетом вышеуказанных пунктов можно выделить следующие перспективные группы антибиотиков для лечения мико- и уреаплазменной инфекции: тетрациклины, макролиды, фторхинолоны, азалиды.
Критериями назначения этиотропной терапии при выявлении генитальных микоплазм, по мнению большинства исследователей, являются:
1) клинические и лабораторные признаки воспалительного процесса в органах мочеполовой системы;
2) результаты комплексного микробиологического обследования на наличие патогенных и условно-патогенных микроорганизмов с количественным обнаружением генитальных микоплазм более 104 КОЕ/мл;
3) предстоящие оперативные или другие инвазивные мероприятия на органах мочеполовой системы;
4) бесплодие;
5) беременность (оценка акушерско-гинекологического анамнеза).
Среди наиболее часто применяемых антибиотиков сохраняется стабильно высокая чувствительность мико- и уреплазменной инфекции к джозамицину (94,8% 5 лет назад и 94,4% в настоящее время) и отмечается увеличение числа штаммов, чувствительных к доксициклину, с 93,2% до 97,2%. Вместе с тем чувствительность к другому антибиотику этой же группы, тетрациклину, снизилась с 92,5% до 83,3%.
Препараты, указанные в альтернативных схемах, не имеют каких-либо преимуществ между собой и рассматриваются как равнозначные.
Рекомендованными препаратами в соответствии с Европейским руководством по ведению беременных женщин, инфицированных микоплазмами [7], являются: эритромицин по 500 мг 4 раза в день в течение 7 дней; или амоксициллин 500 мг внутрь 3 раза в день 7 дней; или джозамицин 500 мг 2 раза в день 7 дней.
Для лечения беременных [2] применяется следующая схема: джозамицин по 500 мг внутрь 3 раза в сутки в течение 10 дней (табл. 1 и 2).
Тетрациклины
Одним из основных препаратов для лечения инфекций, передаваемых половым путем, остается представитель группы тетрациклинов — доксициклин. При этом эталоном эффективности различных режимов терапии является пероральный прием доксициклина (100 мг 2 раза в день в течение 10 дней). Доксициклин отличается от тетрациклина лучшими фармакокинетическими свойствами и большей безопасностью. В основе механизма антибактериального действия доксициклина, как и других тетрациклинов, лежит подавление им биосинтеза белка микробной клетки на уровне рибосом [8]. Среди солей доксициклина предпочтение следует отдавать моногидрату, который, в отличие от гидрохлорида, не вызывает развития эзофагита и оказывает минимальное воздействие на микрофлору кишечника [4]. Наиболее удобной в применении является форма доксициклина моногидрата в виде таблеток диспергируемых, которая позволяет применять препарат как в форме таблеток, так и суспензии или раствора. Кроме того, лекарственная форма диспергируемой таблетки обеспечивает стабильное всасывание доксициклина и равномерное нарастание его концентрации в крови. При негонококковом уретрите, вызванном U. urealyticum, M. hominis или M. genitalium, доксициклин применяют в дозе 100 мг 2 раза в день в течение 7–14 дней [4]. Хорошие результаты были получены при применении доксициклина у женщин, инфицированных различными видами микоплазм и страдающих бесплодием или привычным невынашиванием беременности. В ряде случаев после применения доксициклина наступала беременность, которая заканчивалась нормальными родами в срок и без осложнений [4].
С клинической точки зрения наиболее актуальным представляется выбор тех препаратов, к которым U. urealyticum демонстрирует наивысшую чувствительность. Выделение устойчивых к действию доксициклина инфектов отмечается крайне редко. Рост числа штаммов, чувствительных к доксициклину, можно объяснить тем, что в последние годы этот препарат несколько потеснили макролиды (кларитромицин, рокситромицин, азитромицин), активно применяемые в терапии урогенитальной инфекции.
Сохранение высокой чувствительности возбудителя к доксициклину доказывает обоснованность его применения в лечении микоплазмозов. При его применении могут наблюдаться отдельные побочные эффекты, чаще со стороны желудочно-кишечного тракта (ЖКТ). К недостаткам доксициклина относится невозможность его назначения детям до 8 лет и беременным женщинам, а также женщинам в период лактации.
Макролиды
Другие группы антибиотиков, применяемые для лечения микоплазмозов, представлены, в частности, макролидами. Для макролидов в целом характерны более низкие минимальные подавляющие концентрации (МПК), чем для фторхинолонов. По мнению ряда исследователей, при мико- и уреаплазменной инфекции макролиды должны использоваться в качестве препаратов первого ряда [9].
Препарат группы макролидов эритромицин в течение длительного времени применялся в качестве альтернативы тетрациклинам, однако этот препарат часто плохо переносится больными. Согласно опубликованным результатам терапия эритромицином остается достаточно эффективной — 83–95%. Тем не менее многие авторы отмечают, что выраженные побочные эффекты со стороны ЖКТ, а также высокая курсовая доза и необходимость многократного приема (4 раза в день по 500 мг) снижают целесообразность выбора этого антибиотика.
В группе макролидов самые низкие МПК для уреаплазм имеют кларитромицин и джозамицин. Прием 250 мг кларитромицина 2 раза в день в течение 7 дней, как правило, приводит к исчезновению M. hominis, U. urealyticum из половых путей мужчин и женщин. Применение рокситромицина (300 мг 1 раз в день) не уступает по эффективности стандартному режиму приема доксициклина.
Джозамицин обладает широким спектром антибактериального действия, включающим не только все клинически значимые возбудители микоплазмоза (M. hominis, M. genitalium, U. urealyticum), но и другие частые этиологические агенты при урогенитальных инфекциях — хламидии и Neisseria gonorrhoeae.
Преимуществом 16-членных макролидов, к которым относится джозамицин, перед эритромицином и другими препаратами этой группы является более редкое развитие к ним устойчивости у ряда микроорганизмов, например S. pneumoniae [10]. Аналогичная тенденция прослеживается и в отношении внутриклеточных возбудителей. Несмотря на широкое применение джозамицина, клинические штаммы микоплазм и уреаплазм сохраняют высокую чувствительность к нему как за рубежом [11], так и в России [3]. Например, в период с 2001 по 2003 г. был отмечен рост количества устойчивых штаммов к рокситромицину, кларитромицину, левофлоксацину и клиндамицину, в то время как уровень антибиотикорезистентности к джозамицину за это время не изменился [7]. Аналогичные данные были получены и в исследовании, проведенном в Красноярске, где было показано сохранение стабильно высокой чувствительности U. urealyticum к джозамицину на протяжении последних 5 лет [12]. Более высокая активность джозамицина в отношении уреаплазм по сравнению с другими макролидами продемонстрирована и в других отечественных исследованиях [4].
В зарубежном сравнительном исследовании чувствительности к семи антибактериальным препаратам (джозамицин, доксициклин, миноциклин, спарфлоксацин, рокситромицин, офлоксацин и азитромицин) возбудителей смешанной инфекции U. urealyticum и M. hominis, выделенных у больных негонококковым уретритом, также была показана их высокая чувствительность к джозамицину, превышающая таковую к препаратам сравнения [13]. При подобных инфекциях уровень резистентности возбудителей особенно высок, в связи с чем выбор препаратов для их лечения должен проводиться наиболее тщательно. Например, резистентность к азитромицину в данном исследовании составила 90,48%.
Джозамицин накапливается в лимфатических узлах и половых органах, причем его концентрации в этих органах при воспалительных процессах повышаются, т. к. он способен проникать внутрь фагоцитарных клеток (макрофагов, фибробластов, полиморфноядерных гранулоцитов) и переноситься ими в очаг воспаления [14]. Концентрация препарата в полиморфноядерных лейкоцитах человека, моноцитах и альвеолярных макрофагах приблизительно в 20 раз выше, чем во внеклеточном пространстве [15].
В отличие от большинства других макролидов, джозамицин наряду с хорошим проникновением внутрь клеток создает и высокие концентрации в сыворотке крови, что имеет важное значение при системном проявлении инфекции [16]. Препарат не связывается с изоферментами цитохрома Р-450 и не влияет на НАДФ-цитохром-С-редуктазу, поэтому обладает значительно более низким риском лекарственных взаимодействий, чем эритромицин и кларитромицин, и не оказывает отрицательного влияния на функцию печени. Для джозамицина характерны выраженные иммуномодулирующие свойства, которые могут способствовать усилению терапевтического эффекта у больных с воспалительными заболеваниями [17].
После приема внутрь джозамицин быстро абсорбируется из ЖКТ. Сmax достигается через 1–2 ч после приема. Через 45 мин после приема дозы 1 г средняя концентрация джозамицина в плазме составляет 2,41 мг/л. Связывание с белками плазмы не превышает 15%. Прием препарата с интервалом в 12 ч обеспечивает сохранение эффективной концентрации джозамицина в тканях в течение суток. Равновесное состояние достигается через 2–4 дня регулярного приема.
Одним из преимуществ джозамицина является быстрое создание высокой концентрации препарата в клетках и тканях за счет его высокой липофильности. При пероральном применении концентрация препарата в лейкоцитах, моноцитах, фагоцитах, макрофагах и клетках эпителия приблизительно в 20 раз выше, чем в межклеточном пространстве.
Поскольку микоплазмы и уреаплазмы являются внутриклеточными паразитами, вышеуказанные свойства джозамицина делают его идеальным препаратом для лечения инфекций, вызванных этими патогенами.
Доказана также высокая клиническая эффективность джозамицина. По данным Института исследования инфекционных кожно-венерических заболеваний (Австрия), степень излечения микоуреаплазмоза при применении джозамицина составляет 97% (для сравнения: эффективность применения доксициклина при данной патологии составляет 50%, азитромицина — 55,5%) [1].
Достаточно широкий спектр антимикробного действия антибиотика делает его эффективным при лечении смешанных инфекций, включающих анаэробные, к которым женщины особенно восприимчивы. Для лечения урогенитального микоуреаплазмоза рекомендуемая доза препарата — по 500 мг 2 раза в сутки в течение 7–10 дней.
Азитромицин является полусинтетическим антибиотиком широкого спектра действия, первым представителем подкласса азалидов. Подобно другим макролидам, обладает в основном бактериостатическим эффектом, но благодаря способности создавать очень большие внутриклеточные концентрации может действовать бактерицидно. К достоинствам азитромицина следует отнести его хорошую переносимость. Результаты клинических исследований показали, что азитромицин и доксициклин обладают практически одинаковой эффективностью при уреа- и микоплазменной инфекциях (94,9% и 95,9% соответственно).
Фторхинолоны
Фторхинолоны в лечении микоплазмозов относятся к альтернативным препаратам. Среди них предпочтение стоит отдавать офлоксацину и его левовращающему изомеру — левофлоксацину.
Амоксициллин
Согласно рекомендациям американского Центра по профилактике и контролю за заболеваниями, к альтернативным препаратам, применяемым при урогенитальных инфекциях (табл. 1), относится амоксициллин. Однако несмотря на приводимые относительно высокие показатели излечения амоксициллином — 82–94%, нельзя забывать, что in vitro пенициллины оказывают неполный ингибирующий эффект по отношению к внутриклеточным возбудителям, в частности, M. hominis, U. urealyticum.
Резюмируя вышесказанное, необходимо отметить, что на сегодняшний день существует множество рекомендаций и схем лечения микоплазменной инфекции. Эффект лечения зависит от многих причин, поэтому обязательным условием успеха лечения является комплексное обследование пациента до назначения лекарственного препарата с обязательным определением чувствительности выявленного патогена к антибактериальным препаратам. Установление клинико-микробиологических критериев излеченности урогенитальных инфекций, вызванных микоплазмами, проводится через 1 месяц после окончания лечения. При отсутствии клинических проявлений заболевания и выявлении возбудителя в количестве менее 104 КОЕ/мл осуществляется динамическое наблюдение за больными, в больших количествах — повторное лечение с заменой антибиотика [18].
С учетом общих принципов лечения инфекционных больных, терапия микоплазменной инфекции должна быть комплексной, этиологически, патогенетически и симптоматически обоснованной и дифференцированной в соответствии с видом возбудителя, клинической формой и характером болезни, наличием осложнений и остаточных явлений.
Литература
В. Н. Кузьмин 1 , доктор медицинских наук, профессор
М. И. Гусейнзаде
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Abstract. The questions of antimicrobial therapy of urogenital mycoplasma infections are actively discussed. Numerous studies devoted to the development of recommendations for mycoplasma infections treatment. But one of the most difficult and up-to-date questions is the choice of effective therapy.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В настоящее время среди инфекций, передающихся половым путем (ИППП), на первый план выходят вызываемые негонококковыми возбудителями. Доказана роль этих инфекций в развитии неспецифических уретритов и воспалительных заболеваний органов малого таза (ВЗОМТ).
Работы ряда авторов говорят о значительном увеличении в последние годы заболеваемости ВЗОМТ, ассоциированных с Mycoplasma hominis и Ureaplasma spp. Чаще всего причиной негонококкового уретрита (НГУ) у мужчин становятся Chlamydia trachomatis (23–55%), Ureaplasma urealyticum (20–40%), Mycoplasma genitalium (12–25%), Trichomonas vaginalis (2–5%). Более того, у больных неспецифическими уретритами часто выявляют микст-инфекции.
При растущей роли внутриклеточных бактериальных патогенов в развитии ВЗОМТ у женщин и НГУ у мужчин возрастает роль макролидов в лечении данных видов инфекции. Наиболее распространенным препаратом данной группы является рокситромицин. За последние годы опубликованы результаты большого числа исследований, посвященных оценке клинической эффективности и безопасности рокситромицина в лечении НГУ у мужчин. Согласно результатам этих исследований данный препарат может эффективно и безопасно применяться в лечении НГУ и ВЗОМТ.
Ключевые слова: инфекции, передающиеся половым путем; урогенитальные инфекции, негонококковые уретриты, вагиниты, воспалительные заболевания органов малого таза, макролиды, рокситромицин.
Для цитирования: Кузьменко А.В., Кузьменко В.В., Гяургиев Т.А. Эффективность применения макролидов в лечении больных урогенитальными инфекциями. РМЖ. 2019;10:46-49.
The efficacy of macrolides for urogenital infections
A.V. Kuz’menko, V.V. Kuz’menko, T.A. Gyaurgiev
Burdenko Voronezh State Medical University
Currently, non-gonococcal microbes become the leading causative agents of sexually transmitted infections. It was demonstrated that these microbes provoke non-specific urethritis and pelvic inflammatory disorders.
and safety of roxithromycin for non-gonococcal urethritis in men were published Many authors report on the significant increase in the occurrence of inflammatory pelvic disorders associated with Mycoplasma hominis and Ureaplasma spp. in recent years. In men, the most common causative agents of non-gonococcal urethritis are Chlamydia trachomatis (23–55%), Ureaplasma urealyticum (20–40%), Mycoplasma genitalium (12–25%), Trichomonas vaginalis (2–5%). Moreover, mixed infections are commonly diagnosed in patients with non-specific urethritis.
Considering the growing role of intracellular bacterial pathogens in pelvic inflammatory disorders in women and non-gonococcal urethritis in men, macrolides gain significance in the treatment for these infections. Among macrolides, the most popular agent is roxithromycin. In recent years, a number of studies on the clinical efficacy. These studies have demonstrated that this drug is an effective and safe therapy for non-gonococcal urethritis and pelvic inflammatory disorders.
Keywords: sexually transmitted infections, urogenital infections, sexually transmitted infections, vaginitis, sexually transmitted infections, macrolides, roxithromycin.
For citation: Kuz’menko A.V., Kuz’menko V.V., Gyaurgiev T.A. The efficacy of macrolides for urogenital infections. RMJ. 2019;10:46–49.
В статье рассмотрены вопросы эффективности применения макролидов в лечении больных урогенитальными инфекциями
Актуальность и структура заболеваемости инфекциями, передающимися половым путем
Ежегодный рост заболеваемости инфекциями, передающимися половым путем (ИППП), и вызванными ими воспалительными заболеваниями органов мочеполового тракта остается одной из неразрешенных задач современной урологии [1–3]. Недостаточная профилактика венерических заболеваний, резкий рост числа случайных половых связей, снижение возможности получения качественной медицинской помощи при заражении привели к резкому росту инфекционно-воспалительных заболеваний органов репродуктивной системы как у мужчин, так и у женщин [1–6]. Около 15% пар в нашей стране страдают бесплодием [7, 8]. Даже эффективность применения вспомогательных репродуктивных технологий, включая экстракорпоральное оплодотворение, не превышает 30–35%, что подчеркивает актуальность данной проблемы [9–11].
В настоящее время ВЗОМТ выявляются у 50–65% женщин репродуктивного возраста и имеют тенденцию к распространению [13–16]. Treponema pallidum, Haemophilus ducreyi, Neisseria gonorrhoeae, Trichomonas vaginalis, Chlamydia trachomatis относятся к истинным патогенам [17]. Однако важная роль отводится и микроорганизмам, вызывающим заболевания лишь при определенных условиях [18, 19]. К ним относятся аэробные грамположительные бактерии, такие как Streptococcus, Staphylococcus, Enterococcus, Corynebacterium, и аэробные грамотрицательные палочки Enterobacteriaceae — Escherichia coli, Enterobacter spp., Proteus spp., Klebsiella spp., Pseudomonas spp., а также анаэробные грамотрицательные микроорганизмы, среди которых Bacteroides, Prevotella, Fusobacterium и грамположительные бактерии родов Clostridium, Peptostreptococcus, Peptococcus [20, 21].
Тем не менее работы ряда исследователей в последние годы свидетельствуют о значительном росте заболеваемости ВЗОМТ, вызванных Ureaplasma spp. и M. hominis [22, 23]. Кроме того, данные возбудители, наряду с M. genitalium, также могут вызывать негонококковые уретриты (НГУ), простатиты, а также вагиниты, эндометриты и некоторые другие воспалительные заболевания у женщин [24, 25]. Это подтверждено исследованиями Батурина и соавт., которые выделили различные виды уреаплазм у 80% женщин с клиническими проявлениями урогенитальных инфекций и у 51% женщин с репродуктивными нарушениями [26]. Необходимо также отметить, что микоплазмы и уреаплазмы в 88% случаев встречаются в составе микст-инфекций и лишь в трети случаев как моноинфекция [24]. Так, по данным О.И. Летяевой, их сочетание с Chl. trachomatis выявляется в 30% случаев, с кандидозной инфекцией — в 28%, с Gardnerella vaginalis — в 14%, а с ВПЧ — в 40% [27].
Существенная доля микст-инфекций в структуре ВЗОМТ приводит к широкому разнообразию клинических проявлений заболевания, которые зависят от состава возбудителей и особенностей их взаимодействия между собой. При этом частота рецидивов хронически протекающих заболеваний может увеличиваться в несколько раз [28, 29]. Кроме того, в сочетании с ростом частоты ВЗОМТ и случаев самолечения это приводит к повышению антибиотикорезистентности и ухудшению результатов лечения больных с микст-инфекциями, что продемонстрировано в ряде многоцентровых исследований [28, 30].
Уретрит является одним из самых распространенных заболеваний у мужчин [1–5]. Все уретриты можно разделить на две группы: гонококковые и негонококковые. В мире ежегодно регистрируется около 50 млн случаев заболеваний НГУ [31]. В США и Великобритании заболеваемость НГУ значительно превысила заболеваемость гонококковым уретритом, а в России, по официальным данным, ежегодно регистрируется около 350 тыс. новых случаев НГУ [32]. Однако точное число больных неспецифическим уретритом не поддается исследованию. C одной стороны, это связано с большим количеством частных клиник, не ведущих статистического учета, с другой стороны — с широкой распространенностью самолечения [32, 33].
Микробная структура заболеваемости негонококковым уретритом
Диагностика НГУ основывается на результатах оценки клинической симптоматики и наличии воспалительной реакции (более 5 полиморфноядерных лейкоцитов в поле зрения) при условии отсутствия грамотрицательных внутриклеточных диплококков [1, 2]. При этом НГУ является полиэтиологическим заболеванием и может вызываться различными возбудителями. Чаще всего его причиной у мужчин становятся Chl. trachomatis (23–55%), U. urealyticum (20–40%), M. genitalium (12–25%), T. vaginalis (2–5%). Более того, у больных неспецифическими уретритами часто выявляют микст-инфекции [31].
По результатам ряда исследований была установлена роль U. urealyticum в развитии НГУ. Кроме того, применение антибиотиков, активных в отношении U. urealyticum, было эффективно в лечении уретрита [34].
Длительное время, до 2009 г., в Российской Федерации не было каких-либо данных по распространенности и результатам лечения НГУ. В исследовании по изучению гонококковой и хламидийной инфекции у пациентов, получавших лечение по поводу ИППП в трех московских клиниках, были собраны образцы клинического материала из уретры, которые затем исследовались на M. genitalium [38]. Оценивая распространенность изучаемых микроорганизмов у пациентов с различными клиническими характеристиками, выявлено, что из 141 пациента с уретральными симптомами у 32 (23%) возбудителем была N. gonorrhoeae, у 51 (36%) — Chl. trachomatis, а у 35 (25%) — M. genitalium. Из 152 больных с клиническими признаками у 34 (22%) была выявлена N. gonorrhoeae, у 53 (35%) — Chl. trachomatis, а у 43 (28%) — M. genitalium. У мужчин с клиническими симптомами уретрита частота моноинфекции M. genitalium совпадала с частотой моноинфекции Chl. trachomatis, при этом выраженность симптомов также была одинаковой. Подтверждение роли M. genitalium в развитии НГУ стало одним из оснований для пересмотра подходов к лечению данного заболевания. Терапия тетрациклинами для лечения пациентов с НГУ была признана нерациональной и во многих случаях неэффективной, т. к. она не приводит к элиминации M. genitalium, что может способствовать хронизации заболевания [33].
Современные тенденции в лечении ИППП
С учетом растущей роли внутриклеточных микроорганизмов в развитии ВЗОМТ у женщин и НГУ у мужчин выбор антибактериального препарата во многом определяется способностью к внутриклеточному накоплению и минимальным количеством побочных явлений. В этих условиях возрастает роль макролидов в лечении данных видов инфекции.
Антибиотики группы макролидов впервые зарегистрированы более 50 лет назад [39]. Из 8 препаратов, зарегистрированных в России, одним из наиболее широко распространенных является рокситромицин [39–43].
Данный антибиотик обладает рядом особенностей, которые отличают его от других макролидов [42]. Связываясь с 50s-субъединицей рибосом, он уменьшает реакцию транслокации и транспептидации, подавляет процесс формирования пептидных связей между аминокислотами и пептидной цепью; угнетает синтез белка рибосомами, что в результате приводит к бактериостатическому действию на микроорганизмы. При этом он создает более высокие внутриклеточные концентрации [39, 44].
Рокситромицин обладает сходными с другими макролидами свойствами, но имеет ряд преимуществ. Изменения в лактонном кольце определяют кардинальные отличия данного препарата от эритромицина. К ним относятся: 1) расширение спектра действия преимущественно за счет грамотрицательной флоры, 2) более высокая кислотоустойчивость и улучшенная всасываемость в желудочно-кишечном тракте (ЖКТ), 3) способность создавать более высокие концентрации в клетках и увеличение продолжительности периода полувыведения препарата [41, 42].
Рокситромицин устойчив к соляной кислоте и хорошо всасывается в ЖКТ, за счет чего имеет высокую биодоступность. При этом, несмотря на то что пища может замедлять скорость абсорбции препарата, она не влияет на ее полноту [41–43]. Это одно из преимуществ рокситромицина перед другими макролидами, например азитромицином, степень адсорбции которого уменьшается в 2 раза при приеме с едой или после еды.
Важной отличительной особенностью рокситромицина от других макролидов является его способность достигать наиболее высоких концентраций в крови [44]. На российском рынке рокситромицин представлен несколькими торговыми наименованиями, например Эспарокси ® .
Высокая клиническая эффективность макролидов связана не только с их противомикробным действием. Антибиотики данной группы могут воздействовать на функциональную активность фагоцитов периферической крови и обладают противовоспалительным эффектом [45]. Это обусловлено наличием антиоксидантных свойств, снижающих процессы перекисного окисления в фагоцитах [46]. Кроме того, макролиды, имеющие 14-членное лактонное кольцо (рокситромицин, кларитромицин), могут влиять на иммунные процессы, изменяя синтез моноцитами и макрофагами важнейших медиаторов иммунного ответа (фактор некроза опухолей, интерлейкины, колониестимулирующий фактор и др.) [47]. Это свойство свидетельствует об их иммуностимулирующем действии на организм человека, что подтверждается клиническими наблюдениями, в ходе которых на фоне приема рокситромицина и кларитромицина у пациентов выявлено достоверное увеличение хемотаксиса нейтрофилов [45].
Одним из достоинств рокситромицина является его высокий профиль безопасности [46]. Рокситромицин обладает самой лучшей переносимостью в группе макролидных антибиотиков. Побочные эффекты развиваются в 3–4% случаев, при этом 80% из них — со стороны ЖКТ: боль, тошнота, диарея [39–45].
За последние годы были опубликованы результаты большого числа исследований (в т. ч. двойных слепых плацебо-контролируемых), посвященных оценке клинической эффективности и безопасности применения рокситромицина в лечении НГУ у мужчин [46–50]. Результатами данных исследований было подтверждено, что рокситромицин безопасен и имеет минимальное число побочных эффектов.
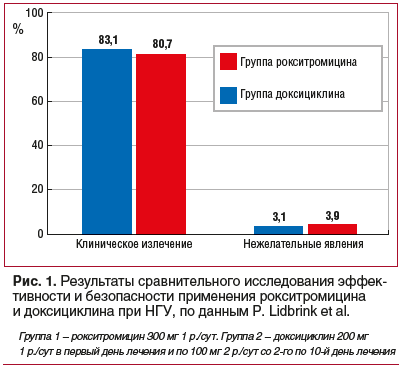
P. Lidbrink et al. [47] провели слепое рандомизированное исследование эффективности и безопасности применения данного антибиотика в сравнении с применением доксициклина. Из 113 пациентов, принимавших рокситромицин и доксициклин, у 83,1% и 80,7% соответственно наблюдалось полное клиническое излечение. Возможные и вероятные побочные эффекты после применения обоих препаратов были практически одинаковыми (рис. 1).
A.H. van der Willigen et al. [48] опубликовали работу, посвященную изучению двух режимов применения рокситромицина (300 мг 1 р./сут и 150 мг 2 р./сут). В группе, где пациенты разово принимали дозу в 300 мг, результаты превосходили показатели группы 2, где пациенты принимали препарат по 150 мг 2 р./сут, однако различия были недостоверны (р ≥ 0,01) (рис. 2).

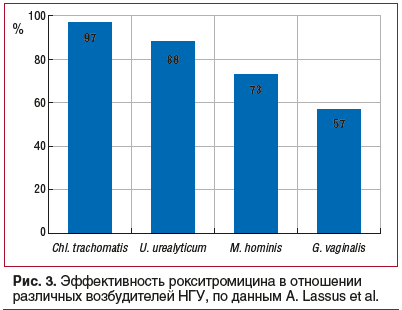
A. Lassus et al. [49] опубликовали результаты пяти исследований эффективности и безопасности применения рокситромицина в лечении негонококковых генитальных инфекций, в т. ч. результаты трех двойных слепых сравнительных исследований и двух открытых. Из 924 па-циентов, участвовавших в исследованиях, 637 получали по 150 мг рокситромицина 2 р./сут. Остальные пациенты получали доксициклин по 200 мг/сут, лимециклин по 300 мг 2 р./сут или рокситромицин по 150 мг 2 р./сут. По результатам исследования у 90% (576 из 637) пациентов, принимавших рокситромицин, наблюдалось полное излечение (эффективность действия на возбудителей показана на рисунке 3).
По результатам трех сравнительных исследований не было выявлено значительных различий между результатами применения рокситромицина и других препаратов.
Данные исследования свидетельствуют о высокой эффективности 10-дневного курса применения рокситромицина и доказывают, что он не менее эффективен в лечении НГУ, чем традиционно применяемые антибиотики группы тетрациклина.
Высокая эффективность рокситромицина при лечении урогенитальных инфекций также подтверждена результатами отечественных испытаний. По результатам рандомизированного клинического исследования, проведенного А.В. Веселовым, при урогенитальном хламидиозе и НГУ применение рокситромицина было сопоставимо с доксициклином по клинической и бактериологической эффективности. Однако количество нежелательных явлений в группе пациентов, принимавших рокситромицин, было почти в 2 раза меньше [43]. Это исследование подтвердило ранее полученные данные по применению рокситромицина в лечении НГУ [46–50].
Таким образом, согласно данным зарубежных и отечественных исследований макролиды, и в частности рокситромицин, могут эффективно и безопасно применяться в лечении ряда урогенитальных инфекционных заболеваний как у мужчин, так и у женщин, в т. ч. в терапии НГУ и ВЗОМТ.
Только для зарегистрированных пользователей
Читайте также:


