Мероприятия направленные на борьбу с контактной инфекцией
АСЕПТИКА И АНТИСЕПТИКА
Среди осложнений в хирургии наиболее часто встречаются инфекционные. Они могут привести к смертельному исходу, несмотря на блестяще выполненную операцию. Предупреждение таких осложнений - главный принцип хирургии, в основе которого лежат асептика и антисептика.
Асептика - комплекс мероприятий, направленных на предупреждение попадания возбудителей инфекции в рану или организм человека.
Антисептика - комплекс мероприятий, направленных на борьбу с инфекцией в организме человека, предупреждение или ликвидацию инфекционного воспалительного процесса.
Оба метода представляют собой единое целое в профилактике хирургической инфекции. Рассматривать их следует с точки зрения взаимоотношения источника инфекции, путей её передачи и восприимчивости организма.
Любая наука проходит определённые этапы развития. В хирургии коренной переворот наступил с внедрением антисептики и асептики, определивших грань между доантисептическим и антисептическим периодами. И это не случайно, так как летальность в доантисептический период даже после небольших разрезов или проколов достигала более 80%. В XIX веке даже у такого хирурга, как Бильрот, летальность после мастэктомии и струмэктомии составляла 50%. Больные умирали от нагноений ран, рожи, гангрены, сепсиса. Приоритет в разработке антисептического метода принадлежит английскому хирургу Джозефу Листеру (1829-1912). Его работы произвели переворот в хирургии и положили начало новому этапу в её развитии.
Приоритет в системном применении антисептики принадлежит венгерскому врачу-акушеру И. Земмельвайсу, применившему в 1847 г. для обеззараживания родовых путей родильниц, рук, инструментов и всех других предметов, соприкасающихся с родовыми путями, раствор хлорной извести. К этому методу И. Земмельвайс подошёл не случайно: он экспериментально доказал наличие загрязнённого начала в выделениях из матки женщин, больных родильной горячкой (сепсисом): кролики, в кровь которых вводили выделения, погибали. Исходя из этого, И. Земмельвайс считал, что перенос заразного начала от больной родильницы к здоровой, проникновение его через обширную раневую поверхность, которой является матка после родов, приводят к развитию сепсиса. Применение предложенного И. Земмельвайсом метода обработки привело к снижению летальности в его клинике на треть. Однако метод не получил распространения, так как большинство хирургов считали причиной заражения ран воздушную инфекцию.
И несмотря на то, что и раньше высказывались предположения о роли каких-то внешних факторов в развитии септических осложнений и предлагались те или иные средства для предупреждения осложнений, заслуга Дж. Листера в том, что он создал систему профилактики - антисептический метод. Основными компонентами этой системы были многослойная листеровская повязка, обработка рук, инструментов, стерилизация воздуха в операционной. Повязка состояла из следующих слоёв: к ране прилегала повязка из шёлка, пропитанного 5% раствором фенола, поверх неё накладывали 8 слоёв марли, пропитанной тем же раствором с добавлением канифоли, покрывали прорезиненной тканью или клеёнкой и фиксировали марлевыми бинтами, пропитанными фенолом. Руки хирурга, инструменты, перевязочный и шовный материал мыли 2-3% раствором фенола. Операционное поле обрабатывали тем же раствором. В операционной с помощью пульверизатора распыляли раствор фенола до и во время вмешательства для стерилизации воздуха.
Применение метода Листера привело к снижению частоты гнойных осложнений ран, но выявило и недостатки. Использование растворов фенола, кроме положительного, оказывало и отрицательное действие, вызывая общую интоксикацию больных, ожог тканей в области раны, поражение почек, заболевания хирургов (дерматит, ожоги, экзему рук). Предпринимались попытки заменить фенол другими веществами: раствором ртути дихлорида (сулемы), борной или салициловой кислоты, перманганата калия и др. Однако чем сильнее проявлялось антимикробное действие используемых средств, тем более выраженным было их токсическое влияние на организм.
В истории антисептики известны и драматические моменты. Так, высказанную Л. Пастером в 1880 г. мысль о том, что все гнойные воспаления имеют одного возбудителя, Э. Бергман подверг сомнению как недоказательную и поэтому сомнительную. Швейцарский хирург К. Гарре (1857-1928) для доказательства правоты Л. Пастера втёр себе в кожу левого предплечья микробную культуру стафилококка из колоний, полученных при посеве гноя больного остеомиелитом. На месте инфицирования развился большой карбункул, окружённый множественными мелкими фурункулами. При посеве гноя был выделен стафилококк. Врач выздоровел. Проведя эксперимент на себе, он опытным путём доказал, что стафилококки вызывают различные гнойные заболевания: абсцесс, фурункул, карбункул, остеомиелит.
Постепенно интерес к методу Листера и его модификациям утрачивался, и спустя 25 лет на смену ему пришёл асептический метод, который заключался в стерилизации всех предметов, соприкасающихся с раной. Основоположником асептики стал немецкий хирург Э. Бергман, работавший ранее в России. На конгрессе хирургов в Берлине в 1890 г. он доложил о новом методе борьбы с раневой инфекцией и продемонстрировал успешно прооперированных в асептических условиях больных. Председательствовавший на конгрессе Дж. Листер поздравил Э. Бергмана с успехом, назвав асептический метод блестящим завоеванием хирургии.
В основе предложенного асептического метода лежит принцип уничтожения микробной флоры на всех предметах, соприкасающихся с раной, воздействием высокой температуры (кипячением, действием горячего пара и др.). Начиная с 1892 г. метод асептики стал применяться во многих клиниках мира. Результаты были столь разительны, что появились призывы полностью отказаться от антисептического метода (борьба с инфекцией в организме человека) и даже исключить антисептические средства из хирургической практики. Однако обойтись без них в хирургии оказалось невозможным: обработка рук хирурга и операционного поля, санация гнойных полостей и многие другие мероприятия невыполнимы без антибактериальных препаратов, тем более что со временем появились новые малотоксичные антисептические средства, а методы антисептики пополнились не только химическими, но и физическими средствами (лазер, ультразвук и др.).
Основные требования, предъявляемые к антисептическим средствам, следующие: бактерицидное или бактериостатическое действие на микроорганизм; отсутствие раздражающего токсического влияния на ткани при местном применении; сохранение свойств при соприкосновении с биологическими жидкостями (кровью, экссудатом, гноем) и воздухом (они не должны быть летучими); кроме того, их производство должно быть дешёвым.
[youtube.player]• операционный блок и перевязочный материал;
• обработка рук хирургов;
• подготовка операционного ноля.
Стерилизация (лат sterilis - бесплодный) - полное освобождение предметов от микробов путем воздействия на них физическими или химическими факторами.
Дезинфекция (des - приставка, означающая удаление, избавление от чего-либо, + infeetum -- заражать; син. обеззараживание) — это уничтожение потенциально патогенных для человека микробов на объектах внешней среды с целью разрыва путей передачи возбудителей инфекционных заболевании и осложнении.
Стерилизация является основой асептики, самым эффективным и надежным методом профилактики контактной контаминации. Средства, применяемые для стерилизации, должны оцениваться возможностью обеспложивать спороносные бактерии, быть безопасными для больных и медперсонала и не ухудшать рабочие свойства инструментов, а также предметов, подвергающихся стерилизации.
В современной асептике применяются физические и химические методы стерилизации.
К химическим методам стерилизации относят стерилизацию окисью ггнлена, обработку надуксуснон кислотой, а также разработанными в Республике Беларусь в 2000 г. новыми высокоэффективными дезинфек-таитами (полидез, триацнд, комбинированный дезинфектант инструментария)
ГЛАВА IV. АСЕПТИКА И А1Ш1СЕПТИКА
1.2.1. СТЕРИЛИЗАЦИЯ ХИРУРГИЧЕСКОГО ИНСТРУМЕНТАРИЯ
Стерилизация хирургического инструментария просолится к дна этапа
Первый этап -- предстерилизационная обработка, второй - непосредственная стерилизация. Последовательность предстернлизационной подготовки зависит от степени бактериальной загрязненности инструментов.
Предстерилизационная подготовка включает: обеззараживание, мытье и высушивание. В связи с высокой опасностью распространения СПИД и выполнения операций у больных, перенесших гепатит, правила предстери-лизационной подготовки изменены и приравнены к способам обработки инструментов, предусматривающим гарантию уничтожения вируса иммунодефицита человека. Инструменты после гнойных операций при анаэробной инфекции, больных, перенесших в течение 5 последних лет гепатит, а также при риске СПИД обрабатывают отдельно от других
Тши. I. Этапы и режимы иредстерилизационной очистки инструментарии, сонмещепион с дезинфекцией ннкрасептом 10А
| Структура изделия | Концентрация раствора, % | Режим, мин | Мойка в растворе, мин | Ополаскивание в проточной воде, мин | Ополаскивание в дистиллированной воде, мин |
| Металл | |||||
| Стекло | |||||
| Керамика | з |
| Мишиных компонентов моющего средства, крови и жира, глошршпо пи i-ежат не менее 1% от партии инструментов, одновременно подвергшихся бработке. Кроме того, контроль качества иредстерилизационной обработ-11 проводится центром гигиены и эпидемиологии один раз в квартал. При |
Качество иредстерилизационной обработки проверяется путем постановки азопирамовой, фенолфталеиновой и бепзидпновой проб на наличие
остаточных компонентов моющего средства, крови и жира. Контролю по i-
ки проводится центром
ГИ \Б V IV. АСЕПТИКА II АНТИСЕПТИКА
Следующий mm- высушивание инструментов в сухожаровом шкафу при температуре SO °C в течение 20 мин.
Выбор метола стерилизации зависит от вида хирургических инструментов, подлежащих стерилизации.
Вес обще\ир>ргические инструменты условно разделяют на три
• металлические - режущие (скальпеля, ножницы, иглы шовные, ампутационные ножи и др.), нережущие (шприцы, инъекционные иглы, зажимы, пинцеты, крючки, зонды и т.д.);
• резиновые и пластмассовые (катетеры, зонды, дренажи и т.д.);
• оптические - лапароскопы, гастроскопы, холедохоскопы, цистоскопы, колоноскопы, бронхоскопы и т.д.
Стерилизация хирургических металлических инструментов и изделий из стекла производится следующими способами.
• Стерилизация сухим горячим воздухом (аэростерилизация) осуще
ствляется в сухожаровык шкафах. Инструменты и шприцы в разо
бранном виде помещают в специальные металлические сетки пли
упаковывают в крафт-бумагу и стерилизуют при температуре
180-200 °С в течение 1 ч. Изделия, простерилизованные в краф[-бу
маге, сохраняются стерильными 3 суток, а в открытых сетках долж
ны использоваться непосредствен
но после стерилизации.
| io TJiii |
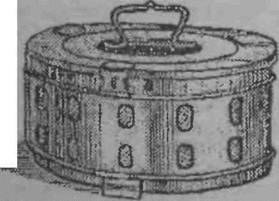
• Для стерилизации паром инстру
менты помещают в биксы (рис. 2)
Шнммельбуша, загружают в авто
клавы и стерилизуют при давлении
1,1 атм - 60 мин, 1,5 атм -- 4S мин,
2 атм - 30 мин. Сроки хранения в
биксах с фильтром - 3 суток, бе*
фильтра- 24 ч.
| Рис 2 Ьнм. Шинпи-льбуны |
• Инструменты одноразового поль
зования стерилизуют в герметич
ных пакетах ионизирующим излу
чением (у-лучи), ультрафиолетовы
ми лучами и ультразвуком. В настоящее время предпочтение отдают
стерилизации у-лучамп. Для этих целен применяют изотопы ""Со и
Стерилизация должна производиться с соблюдением мер безопасности в заводских условиях. При сохранении герметичности упа-
ковок в которых производилась стерилизация у-лучами, стерильность сохраняется 5 лет.
• Кипячение как метод стерилизации в настоящее время не применяет
ся н относится к дезинфекции. Дезинфекция инструментов кипяче
нием проводится в электрических стерилизаторах, различных но
конструкции и емкости, на сетках, погружаемых в дистиллирован
ную воду, с добавлением 2% раствора натрия гпдрокарбопата в тече
ние 30 мин.
Стерилизация режущих и колющих инструментов осуществляется в заводских условиях у-лучами, газовым способом и холодным химическим способом с применением антисептиков. В перевязочных режущие и колющие инструменты стерилизуются в сухожаровых шкафах.
• К химическим методам стерилизации относится стерилизация в сте-
рилпзациопных камерах воздушного стерилизатора (одно- или двух
камерных) емкостью 80 дм 1 и более парами формалина (рис. 3). На
дно камеры помещают формалин из расчета 10 г на 10 дм 1 камеры,
время стерилизации -16 ч. Химическим газовым способом стерили
зуются инструменты, имеющие эбонитовую основу, телескопы, все
лапароскопические ин
струменты, пне грумен-
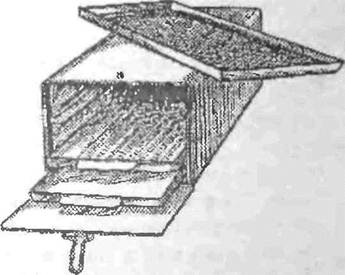 |
| Рис 3. Камера для иараформлпинивоп стерилизации |
гы с оптикой, особо точные и дорогостоящие инструменты. Перед газовой стерилизацией лапароскопические инструмент ы подвергаются дезинфекции в 3% растворе альдезона путем промывания в одной емкости, затем во второй емкости они замачиваются на 1 ч и по истечении времени ополаскиваются под проточной водой от дезинфицирующих средств. Химическая стерилизация может проводиться с применением жидких антисептиков Чаще всего применяю гея тройной раствор, %°и этиловый спирт, 6% раствор водорода пероксида, комбинированный дезннфектант инструментария, а Также дезинфектанты, производимые в РФ мчамшюл,
ГЛ VB \ IV. АСЕПТИКА II АНТИСЕПТИКА
бшшол, шицпн) и CIII \ (еапдекс). Для химической стерилизации инструменты погружают * о 1нн из перечне 1енных дезппфектаитов согласно инструкции по н\ использованию.
Стерилизация изделии hs резины, пластмассы может осуществляться в автоклавах паром под давлением 1,1 атм-30 мин пли 1,5 атм -15-20 мин. Резиновые и пластмассовые изделия разового использования стерилизуют в заводских условиях у-лучамп.
1.2.2. СТЕРИЛИЗ ЧЦИЯ ПЕРЕВЯЗОЧНОГО 1\I ЧТЕРИАЛА И ОПЕРАЦИОННОГО БЕЛЬМ
Перевязочный материал готовится из марли. Марля -это обезжиренная хлопчатобумажная ткань, обладает гигроскопичностью и выраженной капиллярностью. Из марли готовят салфетки (большие и малые), шарики, гу-р>нды. Большие салфетки связывают по 10 штук для удобства их подсчета во время полостных операций. Операционное белье - это халаты, колпаки, простыни, полотенца, пеленки, изготовленные из хлопчатобумажной ткани. Во многих клиниках применяются комплекты операционного белья одноразового использования, прошедшего стерилизацию в заводских условиях у-лучами. Для многократного применения белье после использованич подвергается стирке.
Перевязочный материал после использования сжигается.
Перед стерилизацией перевязочный материал и операционное белье укладывают в биксы Укладка может осуществляться одним из следующих способов.
• Универсальная укладка -- бикс условно разделяют на сектора и каждый сектор заполняют определенным видом материала или белья.
• Целенаправленная укладка- в бикс укладывают все необходимое для
выполнения малых операций и манипуляций (для трахеостомии и т.д.).
• Видовая укладка - используется в клиниках, где одновременно начи-
наю! работу несколько операционных. При этом способе укладки один бикс заполняется каким-то одним видом материала, другой халатами, третий - простынями и т.д. В центр биксов помещают тесты для контроля стерильности. Стерилизация производится в автоклавах паром под давлением. Биксы заполняют перевязочным материалом и операционным бельем, открывают боковые отверстия и загружают в предварительно подогретую стерилиза-ционную камеру автоклава.
Не нашли то, что искали? Воспользуйтесь поиском:
[youtube.player]АСЕПТИКА (греческий а- отрицательный +septikos гнойный, вызывающий нагноение) — система профилактических мероприятий, направленных против возможности попадания микроорганизмов в рану, ткани, органы, полости тела больного (раненого) при хирургических операциях, перевязках, эндоскопии и других лечебных и диагностических манипуляциях. Асептика включает:
а) стерилизацию инструментов, материалов, приборов и пр.,
б) специальную обработку рук хирурга,
в) соблюдение особых правил и приемов работы при производстве операций, исследований и т. п., г) осуществление специальных санитарно-гигиенических и организационных мероприятий в лечебном учреждении.
Метод асептики является дальнейшим развитием метода антисептики и тесно связан с ним (см. Антисептика).
Основоположники асептики — немецкие хирурги Бергманн (E. Bergmann) и Шиммельбуш (C. Schimmelbusch), а в России — М. С. Субботин, П. И. Дьяконов.
В 1890 году на X Международном конгрессе врачей в Берлине Бергманном был впервые провозглашен основной закон асептики: все, что приходит в соприкосновение с раной, должно быть свободно от бактерий.
Вначале метод асептики был направлен на предохранение больного и персонала от вредного действия антисептических препаратов (карболовая кислота, сулема и др.). Физические факторы, уничтожая микробов на всем, что соприкасается с раной, позволяли избежать непосредственного воздействия на рану токсичных антисептиков.
В дальнейшем выяснилось, что одна асептика не в состоянии обеспечить профилактику нагноений и что необходимо комплексное применение асептики и антисептики. Создано множество новых высокоактивных антисептических веществ и препаратов (антибиотики, сульфаниламиды, нитрофурановые соединения и др.), оказывающих менее вредное влияние на организм.
В целях обеспечения асептики в последние годы стал использоваться ряд физических факторов (радиоактивные излучения, ультрафиолетовые лучи, ультразвук и др.).
Выделяют два источника хирургической инфекции: экзогенный и эндогенный. Эндогенный источник находится в организме больного, экзогенный — в окружающей среде.
В предупреждении эндогенного инфицирования основная роль принадлежит антисептике, экзогенного инфицирования — асептике.
Экзогенная инфекция подразделяется на воздушную, капельную, контактную, имплантационную.
Источником воздушной инфекции являются микробные клетки, находящиеся в воздухе во взвешенном состоянии. Особенно насыщен микробами воздух городов, закрытых помещений, больниц.
Борьба с воздушной инфекцией — это прежде всего борьба с пылью. Основные мероприятия, направленные на уменьшение воздушной инфекции, сводятся к следующему:
1) устройство правильной вентиляции операционных и перевязочных (кондиционирование воздуха);
2) ограничение посещения операционных и сокращение передвижения по ним персонала и посетителей;
3) защита от статического электричества, способствующего рассеиванию пыли;
4) влажная уборка помещений;
5) регулярное проветривание и облучение помещения операционной ультрафиолетовыми лучами;
6) сокращение времени контакта с воздухом открытой раны.
Капельная инфекция — разновидность воздушной инфекции, когда источником инфицирования является воздух, загрязненный капельками слюны изо рта и дыхательных путей больного, персонала или мелкими каплями других инфицированных жидкостей. Капельная инфекция, как правило, наиболее опасна для больного.
Основные мероприятия, направленные на борьбу с капельной инфекцией,— запрещение разговоров в операционной, обязательное ношение марлевых масок, прикрывающих рот и нос персонала, а также своевременная текущая уборка операционных.
Контактная инфекция — инфицирование раны при соприкосновении с ней нестерильных инструментов, инфицированных рук, материалов и др.
Профилактика контактной инфекции заключается в стерилизации всех приборов, инструментов и материалов, соприкасающихся с раной (см. Стерилизация, в хирургии), и строгом соблюдении правил обработки рук хирурга (см. Обработка рук). Важное значение придается также оперированию в перчатках и выполнению большинства манипуляций с тканями при помощи инструментов, а не рук.
Имплантационная инфекция — инфекция, вносимая в рану шовным материалом, тампонами, дренажами, протезами и т. п.
Профилактика этой инфекции заключается в тщательной стерилизации шовного материала, дренажей, эндопротезов и т. д. и по возможности более редком использовании оставляемых в ране инородных тел (применение бестампонного метода лечения ран, рассасывающихся шовных материалов и т. п.).
Имплантационная инфекция часто может быть дремлющей (латентной) и проявить себя только через длительный период времени при ослаблении защитных сил организма.
Особое значение профилактика имплантационной инфекции приобретает при пересадке органов и тканей, так как при применении различных иммунодепрессорных веществ подавляются защитные силы организма, в результате чего обычно невирулентная сапрофитная микрофлора становится весьма опасной.
Метод асептики для уничтожения микроорганизмов и их спор требует применения физических факторов и химических веществ.
Из физических факторов наиболее часто используется действие высокой температуры, вызывающей денатурацию белков микробной клетки. Споры большинства микробов более устойчивы к действию высокой температуры.
Чувствительность микробов к температуре зависит от их вида, штамма и состояния микробной клетки (делящиеся и молодые бактерии более чувствительны). Важное значение имеет и среда, в которой находятся бактерии (белки, сахар уменьшают чувствительность, а щелочи и кислоты увеличивают ее). Холод задерживает размножение микробных клеток, не оказывая выраженного бактерицидного действия.
Выраженным бактерицидным действием обладают ультрафиолетовые лучи. От их действия погибают микробы в воздухе, на поверхности тканей, на коже живых объектов, на стенах и полу помещений и т. п.
В последнее время арсенал асептики пополнился гамма - лучами, источником которых обычно являются радиоактивные изотопы 60 Со и 137 Cs. Стерилизацию этими лучами проводят в специальных камерах при дозе 1,5—2 млн. р. Этим методом можно стерилизовать белье, шовный материал, системы для переливания крови и др.
Ультразвуковая стерилизация требует мощных генераторов ультразвука и практического значения пока не имеет.
Жидкие среды можно освобождать от микробов и спор, подвергая их фильтрации через бактериальные фильтры, однако они не задерживают фильтрующихся вирусов.
Химические вещества, применяемые для стерилизации, должны быть бактерицидными и не портить инструменты и материалы, с которыми они соприкасаются.
Кроме традиционных веществ, заимствованных из арсенала антисептики (йод, спирт, хлорамин и др.), для обеззараживания приборов, инструментов, материалов применяются и другие вещества (например, диацид).
В последнее время вместо повязок иногда для закрытия раны применяют пленкообразующие вещества (типа пластубола), которые обычно упаковываются в аэрозольные баллоны.
Важным мероприятием по обеспечению асептики является санация обслуживающего персонала. Исследования последних лет показывают, что нередко источником хирургической инфекции является медперсонал, в зеве и носоглотке которого часто находится антибиотикоустойчивая патогенная флора. В случаях, когда санация не дает результатов, приходится прибегать к трудоустройству стойких бациллоносителей вне хирургических отделений.
Знание и строгое соблюдение правил асептики всеми сотрудниками должно быть законом работы хирургических отделений. См. также Хирургическая операция.
[youtube.player]
ПРОФИЛАКТИКА КОНТАКТНОЙ ИНФЕКЦИИ
Предупреждения контактного инфицирования достигается соблюдением одного из основных принципов асептики: “Все, что приходит в соприкосновение с раной, должно быть стерильно”. Во время операции с раной соприкасаются:
- руки хирурга;
- операционное поле (кожа самого больного);
- хирургические инструменты;
- перевязочный материал и хирургическое белье.
Для того чтобы было стерильным все вышеперечисленное, производится обработка рук хирурга и операционного поля, стерилизация инструментов, перчаток, операционного белья, перевязочного и шовного материала.
ПРИНЦИПЫ И МЕТОДЫ СТЕРИЛИЗАЦИИ
СТЕРИЛИЗАЦИЯ – слово латинского происхождения ^епНБ – бесплодный), означает полное освобождение предметов от микроорганизмов путем воздействия на него физическими или химическими факторами.
Стерилизация является одним из основных элементов асептики. Благодаря ней достигается стерилизация всех предметов соприкасающихся с раной. Все методы стерилизации основаны на применении физических или химических факторов. В зависимости, какие предметы подвергаются обработке, избирается тот или иной метод воздействия. Существует множество методов стерилизации, но все они должны соответствовать определенным требованиям. Применяемые методы и средства стерилизации должны обладать следующим качествами:
- обладать эффективным бактерицидным действием.
- не вызывать повреждение тканей, быть безопасными для больных и медперсонала.
- не разрушать инструменты и оборудование.
Любой применяемый метод стерилизации должен в первую очередь обеспечить гибель всех, как патогенных, так и не патогенных микроорганизмов, при этом он должен быть безвреден для больных и медработников, не оказывать разрушительного действия на инструменты и приборы.
Существующие методы стерилизации делятся на физические и химические.
Физические методы: термическая обработка – обжигание и кипячение, стерилизация сухим жаром, стерилизация паром под давлением (автоклавирование); лучевая стерилизация.
Химические методы: стерилизация растворами химических веществ, стерилизация газообразными веществами.
Выбор метода стерилизации зависит в первую очередь от вида и свойств стерилизуемого предмета.
ФИЗИЧЕСКИЕ МЕТОДЫ СТЕРИЛИЗАЦИИ
Обжигание. В настоящее время не применяется, но его можно использовать при необходимости стерилизации металлических инструментов в полевых условиях. Обжигают инструменты открытым пламенем. В металлическую емкость укладывают инструменты, наливают небольшое количество этилового спирта и поджигают его.
Кипячение. Стерилизация кипячением в последнее время применяется редко. Это обусловлено тем, что при этом методе невозможно добиться уничтожения спороносных микроорганизмов, из-за невозможности достичь температуры выше 100 градусов. Стерилизация производится в электрических стерилизаторах. На специальную сетку помещают инструменты в раскрытом виде (шприцы в разобранном состоянии) и погружают в стерилизатор заполненный дистиллированной водой с добавлением гидрокарбоната натрия (20 г натрия гидрокарбоната на 1 л воды – 2 % раствор). Время стерилизации – 30 минут с момента закипания.
В настоящее время термическая стерилизация производится либо водяным паром в автоклаве при температуре 120-132°С, либо сухим жаром в сухожаровых стерилизаторах (шкаф) при температуре 170-200°С. При термической стерилизации необходимо выделять следующие рабочие фазы:
- Фаза нагревания – от начала подогрева до достижения предписанной температуры по термометру в рабочей камере;
- Время уравновешивания – от момента достижения температуры стерилизации в рабочей камере до момента выравнивания ее в стерилизуемом материале;
- Время уничтожения микробов, продолжительность которого предписана инструкцией;
- Время охлаждения – от момента прекращения нагревания до снижения температуры до 80°С при стерилизации сухим жаром и до 60°С при стерилизации в автоклаве.
Истинное время стерилизации в полезном пространстве состоит из времени уравновешивания, времени уничтожения и времени дополнительной безопасности, обеспечивающего надежность стерилизации (50 % времени).
Стерилизация сухим жаром. Стерилизацию осуществляют в сухожаровых шкафах-стерилизаторах, действующим фактором является воздух, нагретый до 170-200°С. При сухожаровой стерилизации происходит разогревание стерилизуемых объектов. Так как горячий воздух в отличие от водяного пара служит только переносчиком тепла, температура стерилизуемых предметов должна достигнуть 170-200°С. Нагревание обеспечивается за счет посту пления горячего воздуха через специальный клапан в нижней части воздушного стерилизатора, а его выход – через верхний клапан.
Путем сухожаровой стерилизации можно обрабатывать все термостабильные, негорючие материалы из стекла, металла или фарфора. Сухожаровая стерилизация непригодна для перевязочного материала, резины, катетеров, изделий из бумаги и пластиков.
Стерилизация осуществляется следующим образом:
- укладывают инструменты на полки шкафа-стерилизатора при открытой дверце при температуре 80°С высушивают инструменты в течение 30 минут.
- закрыв дверцу шкафа, стерилизуют в течение 1 часа при температуре 180°С.
- после остывания стерилизатора до 50-70°С дверцу приоткрывают, а при окончательном остывании инструментарий забирают.
Добавление новых материалов и предметов для стерилизации недопустимо.
Стерилизация паром. Действующим фактором при этом методе является горячий пар. Существует два метода стерилизации: стерилизация текучим паром и стерилизация под давлением. От первого метода в настоящее время отказались, так достигается температура 100°С, а этого недостаточно для уничтожения некоторых видов микроорганизмов. При стерилизации под давлением вода нагревается при повышенном давлении, поэтому повышается точка кипе- имя воды н соответственно температура пара (при давлении 2 атмосферы до 132,9°С).
Горячий водяной пар служит переносчиком тепла. Он действует интенсивнее, чем горячий воздух, т. к. высокая теплоемкость пара при конденсации переносится на стерилизуемый объект. Одновременно пар действует как непосредственный стерилизатор – стерилизующий агент действует путем гидратирования. коагуляции и гидролиза белков.
Стерилизация паром осуществляется в автоклавах. Аппарат для стерилизации под давлением (автоклав) состоит из двух металлических цилиндров разного диаметра, вставленных один в другой так, что между ними остается пространство, которое наполняется водой. Во внутреннюю камеру автоклава кладут стерилизационные коробки с фильтром, биксы с перевязочным материалом или пакеты с инструментами в двухслойной упаковке из бязи или в пергаментной бумаге. Плотно завинчивают боковую дверь парового стерилизатора и начитают стерилизацию в заданном режиме. Паровой стерилизатор оборудован термометром, манометром (указывает давление пара внутри аппарата) и предохранительным клапаном, который срабатывает при нарастании избыточного давления.
Все предметы, которые не выдерживают высокой температуры жаровой стерилизации и для которых температура пара не является повреждающей, должны стерилизоваться автоклавированием (перевязочный материал, резиновые и синтетические предметы, бумажные фильтры, закрытые ампулы и банки с водосодержащими препаратами и др.).
Перевязочный материал, белье, инструменты укладываются в металлические коробки (бикс Шиммельбуша), закрывают крышку и, оставив открытыми боковые отверстия, биксы загружают в автоклав. Проводить стерилизацию можно в 3 режимах – при давлении 1,1 атмосферы – 1 час, 1,5 атмосферы – 45 минут, 2 атмосферы – 30 минут. Перчатки стерилизуются при 1,1 атм. в течение 45 минут или при 1,5 атм. -15-20 минут. Хирургические инструменты и шприцы при 2 атм’ 20 мин
По истечении времени стерилизации биксы оставляют для просушки в автоклаве при приоткрытой крышке последнего. Боковые отверстия закрываются сразу после извлечения бикса из автоклава. На стерильный бикс прикрепляют бирку с указанием даты стерилизации. Закрытый бикс остается стерильным 72 часа. В случае открытия – 24 часа.
Основными методами стерилизации в настоящее время являются
- стерилизация сухим жаром и стерилизация паром под давлением. В лечебных учреждениях для проведения стерилизации создаются центральные стерилизационные отделения (ЦСО), где и осуществляется стерилизация инструментов (шприцы, иглы, простые хирургические наборы, зонды, катетеры и пр.) для всех отделений больницы. Хирургический инструментарий, стерилизуется в операционных блоках.
Для стерилизации может применяться ионизирующее излучение (У-лучи), ультрафиолетовые лучи и ультразвук. Наиболее часто применяется первый вид.
Стерилизацию ионизирующим излучением применяют для стерилизации шприцов, шовного материала, катетеров, зондов систем для переливания и. т. д. Инструменты и материалы стерилизуют в герметичных упаковках в заводских условиях в специальных помещениях. Срок хранения при гаком методе стерилизации 5 лет. Преимуществом этого вида стерилизации заключается в том, что при его применении не теряются свойства стерилизуемых объектов.
ХИМИЧЕСКИЕ МЕТОДЫ СТЕРИЛИЗАЦИИ Газовая стерилизация
При газовой стерилизации действующим агентом являются газообразные антисептики (пары формалина, окись этилена). Проводится она в специальных герметичных камерах, на дно которых кладут таблетки формальдегида. Инструменты помещают на сетку, над химическим препаратом. Сроки стерилизации 6-8 часов. Преимуществом метода является минимальное вредное влияние на стерилизуемые объекты. Поэтому газовая стерилизация применяется для стерилизации оптических, особо точных и дорогостоящих инструментов.
Стерилизация растворами антисептиков
В качестве антисептиков при стерилизации в растворах применяются тройной раствор, 96 % этиловый спирт, 6 % перекись водорода, спиртовой раствор хлоргексидина. Применяется этот метод для стерилизации режущих инструментов, так как не приводит к затуплению.
Стерилизацию осуществляют следующим образом, инструменты в раскрытом или разобранном виде погружают в раствор. Время стерилизации зависит от вида антисептика, при использования спирта или тройного раствора 2-3 часа, перекиси водорода – 6 часов.
Произвести стерилизацию – это не просто подвергнуть стерилизуемый объект воздействию физического или химического фактора. Современная стерилизация – это целый технологический процесс, включающий несколько этапов.
I этап— предстерилизационная подготовка
II этап — укладка и подготовка к стерилизации;
III этап — стерилизация;
IV этап — хранение стерильного материала.
Вне зависимости ог вида стерилизуемою объекта и метода стерилизации, этапность выполнения её сохраняется всегда.
СТЕРИЛИЗАЦИЯ ХИРУРГИЧЕСКИХ ИНСТРУМЕНТОВ
Этап 1 – предстерилизационная подготовка. Целью предстерн- лизационной подготовки является – механическая очистка инструментов, удаление пирогенных веществ, уничтожение вируса гепатита. До недавнего времени объем предстерилизационной подготовки определялся степенью инфицированности инструментов, обработка инструментов после чистых операций (перевязок), гнойных операций, операций у больных, перенесших гепатит, и в группе риска по СПИДу существенно отличались. Сейчас правила предстерилизационной подготовки ужесточены. Учитывая высокую опасность распространения СПИДа, обработка должна гарантировать уничтожение вируса иммунодефицита человека. Инструменты после гнойных операций, операций у больных, перенесших в течение 5 последних лет гепатит, а также при риске СПИДа обрабатываются отдельно от других.
Предстерилизационная подготовка состоит из следующих этапов:
Использованные инструменты погружаются в емкости с дезинфицирующими средствами. В качестве дезинфицирующих средств можно применять 3 % раствор хлорамина (экспозиция 40-60 минут), 6 % раствор перекиси водорода (экспозиция 90 минут), анолита (экспозиция 30 мин). Полидез – 1 % – 45’; 0,5 % – 60; комбинированный дезинфектант инструментария – 1 % – 15’; инкрасепт- 1 % – 30’, дезавит
- 1 % – 20’. После проведения дезинфекции инструменты промываются проточной водой.
Мытье инструментов осуществляют в специально приготовленном моющем растворе, в состав которого входит моющее средство (стиральный порошок), перекись водорода и вода. Инструменты погружаются в раствор, нагретый до 50-60°С. После 20 минутной экспозиции инструменты тщательно моют щетками в этом же растворе, а затем в проточной воде.
После мытья инструменты необходимо высушить. Сушить можно естественным путем, но наиболее часто сушку проводят в сухожаровом шкафу при 80′С в течение 30 минут.
После окончания предстерилизационной очистки подлежит проверить ее качество. Она считается эффективной, если на изделиях, подвергнутых обработке, не обнаружены остаточные количества крови или моюших средств, наличие которых определяют с помощью специальных проб. Эги пробы основаны на изменении цвета реактива в присутствии соответствующих веществ (кровь, щелочные моющие средства).
В настоящее время применяется азопирановая проба.
Азопирановая проба – раствор азопирана смешивают с 3 % перекиси водорода в равных частях, капают 2-3 капли и при присутствии следов крови немедленно или не позже, чем через Г появляется вначале фиолетовое, затем переходящее в розово-сиреневое окрашивание, при наличии ржавчины или хлорсодержащих окислителей – буроватое окрашивание.
Инструменты с наличием остатков крови подвергаются повторной предстерилизационной очистке.
Выбор метода стерилизации
Метод стерилизации избирается в зависимости от вида инструментов. Необходимо помнить, что любой метод должен, во-первых, обеспечивать полное уничтожение микроорганизмов, во-вторых, не приводить к быстрому разрушению стерилизуемых приборов и инструментов.
Хирургические инструменты делят на три группы:
- металлические (режущие и не режущие),
- резиновые и пластмассовые,
- оптические.
Для стерилизации металлических не режущих инструментов можно применяют стерилизацию горячим воздухом в сухожаровом шкафу или в автоклаве.
Для стерилизации режущих металлических инструментов применяют химическую стерилизацию в растворах антисептиков, но самым лучшим способом является газовая стерилизация. Применение термических способов приводит к быстрому их затуплению.
Стерилизация резиновых и пластмассовых инструментов осу- ществляется автоклавированием. Различные катетеры и зонды подвергаются лучевой стерилизации, чаще они используются однократно. Стерилизация перчаток также осуществляется автоклавированием.
Стерилизация оптических инструментов
Любые оптические инструменты, применяемые в хирургии, отличаются сложностью устройства и дороговизной. Поэтому стерилизация их осуществляется наиболее бережно. Оптимальным методом является газовая стерилизация. Стерилизации фиброгастроскопов, ко- лсноскопов, бронхоскопов может осуществляться методом холодной стерилизации с использованием химических антисептиков (этиловый спирт, хлоргексидин, сайдекс и. т. д., 40 % формалин с хлорамином в соотношении 1: 8-их парами 40’).
Этап 2 – укладка и подготовка к стерилизации.
В зависимости от избранного метода производится подготовка и укладка стерилизуемых предметов.
При подготовке к стерилизации в сухожаровых стерилизаторах, инструменты помещают в металлические коробки или укладывают их на металлические сетки в один слой. Шприцы разбирают и заворачивают в два слоя плотной бумаги.
При подготовке к стерилизации в автоклавах инструменты заворачивают в хлопчатобумажную ткань в виде пакета и укладывают в металлические коробки.
В случае стерилизации шприцев в автоклавах, их разбирают, отдельно в марлевые салфетки заворачивают цилиндр и поршень. Затем их заворачивают в хлопчатобумажную ткань и укладывают в бикс.
Резиновые перчатки пересыпают тальком, засыпая его внутрь, заворачивают попарно в марлевые салфетки и укладывают в отдельный бикс.
Этап 3 – стерилизация. Осуществляют стерилизацию избранным методом, соблюдая стандартные режимы.
Этап 4 – хранение стерильного материала. Стерильные биксы хранят в специальном помещении. Стерильность сохраняется в течение 48 ч, если биксы не вскрывались.
[youtube.player]Читайте также:


