Международное общество по изучению остеоартроза oarsi
Представлены последние рекомендации по ведению больных остеоартрозм коленных суставов в реальной клинической практике. Рекомендации обосновывают необходимость мультимодального подхода к лечению остеоартроза, пошаговую очередность применения всех имеющихся
The up-to-date recommendations on observation of patients with knee-joint osteoarthrosis in real clinical practice were presented. The recommendations substantiate multi-module approach to osteoarthrosis treatment, пошаговую single-step sequence of all available methods of this disease treatment.
Остеоартроз (ОА) представляет собой самую частую форму артрита и одну из главных причин нетрудоспособности [1]. Наиболее распространенная локализация ОА — коленные суставы, при которой наблюдается высокая частота болевого синдрома [2], поэтому эта форма ОА представляет собой хорошую модель для развития рекомендаций по лечению заболевания. И действительно, в последние 10 лет предложено множество рекомендаций, в том числе международных, созданных обществами врачей различных специальностей в разных странах. ОА, или остеоартрит, рассматривается в настоящее время не как единая болезнь, скорее как синдром, объединяющий различные фенотипические субтипы болезни, например, метаболический, возрастной, генетический, травматический и др. И хотя причины таких состояний многообразны, развитие болезни во всех случаях обусловлено клеточным стрессом и деградацией экстрацеллюлярного матрикса, которые возникают при макро- или микроповреждениях, и при этом активируются не нормальные адаптивные восстановительные ответы, включая провоспалительные пути иммунной системы, костное ремоделирование и образование остеофитов.
Несмотря на большое количество рекомендаций по лечению ОА, ведение больных до сих пор остается сложным вопросом, поскольку рекомендации часто содержат противоречивые данные. Возможное объяснение этому лежит в многообразии форм ОА, поэтому во всех метаанализах и обзорах, на основе которых создаются рекомендации по лечению ОА, констатируется высокая гетерогенность популяции больных, включенных в исследования, которая сама по себе может влиять на эффективность тех или иных средств для лечения ОА ( 1).
В последних рекомендациях Международного общества по изучению остеоартроза (The Osteoarthritis Research Society International, OARSI) 2014 г. [3] сделана попытка выделить определенные формы ОА с учетом локализации поражения и наличия коморбидности (рис. 2) и на основании такого разделения предложен дифференцированный подход к лечению (рис. 3). Однако эти рекомендации оставляют нерешенными ряд вопросов, например, при генерализованном процессе и коморбидности рекомендуется внутрисуставное (в/с) введение гормонов: в какие суставы — не понятно, ведь процесс генерализованный, а если у больного имеется сопутствующий диабет 2-го типа? Или назначение селективных нестероидных противовоспалительных препаратов (НПВП) при осложнениях со стороны сердечно-сосудистой системы и т. д. Что касается лечебных средств из группы симтоматических препаратов замедленного действия, то рекомендации еще более неопределенны. Глюкозамин и хондроитина сульфат не рекомендуется назначать для замедления сужения суставной щели, хотя существуют двойные слепые плацебо-контролируемые длительные исследования, показавшие их возможный структурно-модифицирующий эффект. Симптоматическое действие этих препаратов оценено как неопределенное, хотя размер анальгетического эффекта для хондроитина сульфата составляет от 0,13 до 0,75, для глюкозамина — от 0,17 до 0,45 [4]. По другим препаратам этой группы — рекомендации тоже неопределенные.
В июле 2014 г. [5] был предложен алгоритм ведения больных ОА коленных суставов для практики, отражающий последовательно основные принципы лечения ОА, созданный комитетом, состоящим из клиницистов и ученых разных стран, Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (European Society for Clinicaland Economic Aspects of Osteoporosis and Osteoarthritis, ESCEO), и учитывающий не только эффективность, но и безопасность лечебных мероприятий.
Как и во всех существующих рекомендациях, подчеркивается необходимость комбинации нефармакологических и фармакологических методов лечения ОА. Немедикаментозные методы обязательно должны включать образовательные программы, обеспечивающие больного знаниями о природе заболевания и разных методах лечения. В этих программах должна содержаться информация по изменению образа жизни: снижение избыточного веса, способы защиты или разгрузки суставов. В действительности чрезвычайно трудно убедить больного выполнять такие рекомендации, но необходимо разъяснять, что такие меры, по крайней мере, не будут вызывать усиление болей или ухудшать прогрессирование заболевания. Известно, что небольшое (до 5%) снижение веса при избыточной массе тела в большей степени улучшает функцию суставов, но не снижает выраженность боли. Основываясь на последнем качественном исследовании [6], комитет сделал заключение, что только снижение веса на 10% от первоначального вызывает значимое уменьшение симптомов ОА, более того, такая потеря веса улучшает качество и увеличивает толщину хряща медиального отдела бедренной кости [7]. Образовательные программы для больных должны содержать информацию по двигательной активности и лечебной физкультуре, поскольку эти методы (индивидуальные, групповые, занятия дома) благоприятно влияют на боль и функцию коленных суставов [8]. Убедительные данные получены по занятиям лечебной физкультурой в воде, по силовым упражнениям для нижних конечностей, тренировке квадрицепса, аэробным упражнениям, например ходьбе. И хотя четких доказательств влияния этих методов на прогрессирование ОА нет, по мнению экспертов, такие программы, лучше смешанные, должны быть обязательными для всех больных [9].
Вместе с тем использование только немедикаментозных методов после установления диагноза обычно бывает недостаточно, прежде всего, для купирования боли и улучшения функционального статуса, поэтому возникает необходимость добавления фармакологических методов лечения ОА.
Если больной испытывает боли в суставах (рис. 4), одновременно с немедикаментозными методами назначаются лекарственные средства либо в виде монотерапии, либо при недостаточной эффективности — комбинации препаратов, для более быстрого достижения удовлетворительного клинического эффекта (шаг 1). Впервые в рекомендациях обосновывается участие в лечебном процессе физиотерапевта, который оценивает функциональный статус больного, обращая особое внимание на отклонения оси суставов, поскольку варусная и вальгусная деформации являются признанными факторами риска не только развития, но и прогрессирования ОА. Использование надколенников и стелек улучшает биомеханику сустава, и, как следствие, уменьшается боль в суставах, улучшается их функция, а длительное их применение даже замедляет прогрессирование процесса [9]. Участие физиотерапевта в лечебном процессе не должно ограничиваться только первым этапом, поскольку параллельно с лекарственной терапией можно назначать и другие методы лечения для дополнительного уменьшения боли.
Одна из основных целей лечения заключается в уменьшении симптомов болезни. Практически в любых рекомендациях при небольших болях в суставах рекомендуется парацетамол в суточной дозе не больше 3,0 г из-за предположения о его большей безопасности по сравнению с другими анальгетическими средствами, несмотря на то, что он вызывает незначительное уменьшение боли. Но в последнее время безопасность такого лечения поставлена под сомнение, поскольку накопились данные о частых нежелательных лекарственных реакциях (НЛР) со стороны желудочно-кишечного тракта (ЖКТ), увеличении уровней печеночных ферментов, в США самой частой причиной лекарственного поражения печени признан парацетамол. Более безопасным было бы использование симптоматических препаратов замедленного действия (Symptomatic slow acting drugs for osteoarthritis — SYSADOA) в качестве базовой терапии с короткими курсами назначения парацетамола для быстрого обезболивающего эффекта. Последний Кохрановский обзор [11] показал, что глюкозамин (суммарно оценивались все препараты) уменьшает боль при ОА, однако отмечена высокая гетерогенность исследований, которая могла повлиять на результаты, тем более что субанализ подгрупп не выявил преимущества глюкозамина над плацебо по влиянию на боль. Вместе с тем 3 исследования продолжительностью от 6 месяцев до 3 лет у больных ОА с небольшой или умеренной болью без гетерогенности, проведенные в Европе, с применением кристаллизованного глюкозамина сульфата продемонстрировали его преимущество над плацебо по влиянию на боль (размер эффекта — 0,27 (95% CI: 0,12–0,43) [9] и функцию суставов (0,33 (95% CI: 0,17–0,48) [12], другими словами, размер эффекта оказался таким же, как при применении коротких курсов НПВП [13]. Кроме того, длительное лечение глюкозамина сульфатом задерживает прогрессирование ОА [14].
Хондроитина сульфат тоже обладает способностью замедлять прогрессирование ОА [15], кроме того, этот препарат обладает довольно выраженным действием на боль, и хотя мнения различных исследователей не всегда единодушны, размер анальгетического эффекта по некоторым данным достигает 0,75. Недавно опубликованное исследование показало эффективность хондроитина сульфата в отношении уменьшения структурных изменений в суставах с параллельным симптоматическим клинически значимым действием [16], что нашло подтверждение и в другой работе [17]. Помимо уже установленной эффективности, эти препараты обладают высокой безопасностью, частота НЛР при лечении этими средствами не отличалась от плацебо [11, 16], что тоже усиливает их роль в качестве базовой терапии ОА. Из-за предположения об аддитивном действии глюкозамин и хондроитина сульфат часто используются в комбинации. Так, в исследовании, проведенном в Америке [18], было отмечено, что комбинация глюкозамина гидрохлорида и хондроитина сульфата по анальгетическому действию превосходила плацебо у больных с умеренной и выраженной болью. В настоящее время показано, что такая комбинация имела одинаковую эффективность с целекоксибом после 6 месяцев лечения больных ОА коленных суставов с умеренными или сильными болями в суставах [19]. Представляет интерес недавно опубликованное 2-годичное исследование из Австралии, в котором продемонстрировано структурно-модифицирующее действие такой комбинации при ОА коленных суставов [20]. Структурно-модифицирующий эффект комбинации хондроитина сульфата и глюкозамина гидрохлорида подтвержден и учеными из Канады [21], когда независимо от приема анальгетиков или НПВП через 24 месяца отмечалась меньшая потеря объема хряща по сравнению с больными, не принимавшими такую комбинацию. Эффективность и безопасность применения комбинированной терапии хондроитина сульфатом и глюкозамина гидрохлоридом (Терафлекс) подтверждена и результатами исследования, проведенного в НИИР РАМН, у 50 амбулаторных больных с ОА коленных суставов. Более того, на основании годичного наблюдения 100 больных гонартрозом продемонстрировано, что интермиттирующая терапия Терафлексом (лечение — 3 месяца, 3 месяца — перерыв, 3 месяца лечения) обладает равной эффективностью с постоянным приемом препарата в течение 9 месяцев по влиянию на боль и функцию суставов [22].
Как правило, исследования по изучению так называемых препаратов замедленного действия (SYSADOA) проводятся с сопутствующей анальгетической терапией: либо парацетамол, либо НПВП, по снижению дозы которых косвенно судят о противоболевой и противовоспалительной эффективности исследуемых средств. Препараты SYSADOA обычно развивают свое действие через 4–8–12 недель от начала лечения, поэтому для купирования боли необходима обезболивающая терапия.
Прием анальгетиков и НПВП при усилении болей совместно с другими лекарственными препаратами, которые больной принимает для лечения сопутствующих заболеваний, приводит, как это наблюдается при длительном лечении многих хронических заболеваний, к снижению приверженности лечению. Известно, что повысить комплаентность можно либо изменяя схему лечения, например, уменьшая частоту приема лекарства, либо сочетая различные препараты в одной таблетке. Открытое 3-месячное рандомизированное сравнительное исследование эффективности и безопасности препарата Терафлекс Адванс, содержащего глюкозамин, хондроитина сульфат и ибупрофен, по сравнению с препаратами Терафлекс и ибупрофен у 60 пациентов с ОА коленных суставов показало, что Терафлекс Адванс, обладая хорошей переносимостью, быстрее, по сравнению с Терафлексом, уменьшает боль, скованность и улучшает функцию суставов и может быть рекомендован при ОА в первые три недели лечения с последующей заменой его на Терафлекс [23].
Доказательства по другим медленно действующим препаратам более скудны. Тем не менее, появляются препараты других групп, претендующие на роль структурно-модифицирующих средств. Например, стронций ранелат, который действует на субхондральную кость и хрящ, тем самым оказывая позитивное действие на прогрессирование ОА. Недавно проведенное высококачественное 3-годичное плацебо-контролируемое исследование установило, что стронций ранелат замедляет рентгенологическое прогрессирование ОА вместе с уменьшением симптомов заболевания [24]. Переносимость препарата в этом исследовании была хорошей, но Европейское агентство по лекарственным средствам (European Medicines Agency, ЕМА) недавно ограничило использование этого препарата, рекомендовав его применение только при тяжелом остеопорозе из-за возможного увеличения кардиоваскулярного риска, поэтому место этого препарата в лечении ОА в будущем будет нуждаться в переоценке.
Если после назначенного базового лечения больной все еще испытывает боль, можно добавлять локальные средства одновременно с немедикаментозными методами. Эффективность локальных средств установлена во многих исследованиях. Рандомизированные исследования подтвердили сходную эффективность локальных и пероральных НПВП. Локальные НПВП обладают лучшей ЖКТ-безопасностью, но чаще вызывают кожные НЛР, однако длительность исследований эффективности локальных средств, как правило, составляет в среднем только 12 недель, а длительных исследований нет для суждения о долгосрочном эффекте.
Члены комитета рекомендуют при неудовлетворительном симптоматическом эффекте переходить к следующему шагу 2. И здесь основная роль традиционно принадлежит НПВП. Известно, что и селективные, и неселективные НПВП обладают преимуществом по сравнению с парацетамолом по действию на симптомы болезни, размер эффекта на боль составляет до 0,29 (0,22–0,35) [13], т. е. в 2 раза превосходит эффект парацетамола. И действительно, больные отдают предпочтение НПВП. И хотя сравнение НПВП и глюкозамина сульфата не показало разницы в их эффективности по влиянию на боль и функцию суставов, члены комитета пришли к мнению, что НПВП нужно рекомендовать больным с выраженной болью, особенно когда SYSADOA не дают нужного эффекта. С другой стороны, при использовании SYSADOA в качестве базовой терапии они уменьшают потребность в НПВП. Недавние систематические обзоры не выявили различий по эффективности неселективных, селективных НПВП, поэтому выбор НПВП зависит от профиля безопасности препарата, сопутствующих заболеваний пациента и его состояния. ЦОГ-2 селективные НПВП ассоциируются с меньшей частотой ульцерогенного действия при коротких курсах применения, однако не ясно, как обстоят дела при длительном их применении, особенно целекоксиба и эторикоксиба. Действительно, недавно получены доказательства, что коксибы значимо увеличивают риск НЛР со стороны верхних отделов ЖКТ по сравнению с плацебо, хотя риск ниже, чем при использовании неселективных НПВП [25]. С одной стороны, при назначении неселективных НПВП требуется одновременный прием ингибиторов протонной помпы (ИПП), а с другой — принимая во внимание описанное выше и данные по затратной эффективности, члены комитета полагают, что даже у больных с нормальным риском ЖКТ-осложнений врачи должны рассматривать возможность назначения ИПП и при сочетании с селективными НПВП. У больных с высоким риском НЛР со стороны ЖКТ нужно избегать назначения неселективных НПВП, а селективные сочетать с ИПП. При сочетанном применении Аспирина со стандартными НПВП тоже увеличивается риск НЛР со стороны ЖКТ, в этом случае селективные НПВП частично улучшают толерантность со стороны ЖКТ, а сочетание их с ИПП еще больше снижает риск таких осложнений.
И стандартные, и селективные НПВП увеличивают риск серьезных осложнений со стороны сердечно-сосудистой системы, только Напроксен ассоциируется с меньшим риском тромботических кардиоваскулярных осложнений. Недавно проведенный метаанализ 638 рандомизированных исследований [25] показал, что коксибы, диклофенак и ибупрофен (в высоких дозах) увеличивали сосудистые коронарные осложнения, но не Напроксен [25], поэтому комитет рекомендует избегать назначения коксибов, диклофенака и высоких доз ибупрофена у больных с увеличенным кардиоваскулярным риском [25]. Данные более раннего метаанализа [26] показали, что среди широко применяемых НПВП Напроксен и низкие дозы ибупрофена в наименьшей степени увеличивают риск развития сердечно-сосудистых событий. Кроме того, нужно помнить, что нельзя назначать ибупрофен вместе с Аспирином из-за их фармакодинамического взаимодействия. Необходимо учитывать, что НПВП могут повышать артериальное давление, ухудшать течение сердечной недостаточности, вызывать почечную дисфункцию. НПВП нельзя назначать больным с хроническим заболеванием почек при сниженном клиренсе креатинина
Л. И. Алексеева, доктор медицинских наук, профессор
ФГБНУ НИИР им. В. А. Насоновой МЗ РФ, Москва
Марина Поздеева о патогенезе и эффективной фармакотерапии данной патологии
Остеоартроз (ОА) — распространенное заболевание суставов, причем прослеживается тенденция к росту числа случаев ОА: за последнее десятилетие первичная заболеваемость в РФ выросла на 20 %, а общая распространенность — на 48 % [1]. При этом ОА коленного сустава входит в число основных причин потери нетрудоспособности как у мужчин, так и у женщин [1].
Понятие и классификация остеоартроза
ОА представляет собой гетерогенную группу состояний различной этиологии и схожими биологическими, морфологическими и клиническими проявлениями. При ОА преимущественно поражаются несущие вес суставы: коленные, бедренные, плечевые и суставы пояснично-крестцового отдела. Могут пострадать дистальные и проксимальные межфаланговые суставы, пястно-запястные суставы, однако подобная локализация встречается гораздо реже. В развитии заболевания важную роль играют ежедневные нагрузки, которые большей частью даются на несущие суставы.
Первичным, или идиопатическим, считается остеоартроз, причина которого остается неустановленной. Он может быть локальным (поражены один или два сустава) и генерализованным (поражены три и более суставов). Локальный ОА чаще всего ассоциируется с поражением коленных суставов (гонартроз) и тазобедренных суставов (коксартроз). При вторичном ОА существует очевидная причина болезни: травма, метаболические нарушения, другие ревматологические заболевания в анамнезе и так далее.
Факторы риска остеоартроза
Причины возникновения остеоартроза суставов могут быть следующие:
- возраст
- ожирение
- травма
- наследственность (фамильная история ОА)
- низкий уровень эстрогенов у женщин
- мышечная слабость
- особенности труда (например, регулярные тяжелые физические нагрузки)
- инфекция
- акромегалия
- воспалительный артроз в анамнезе (например, ревматоидный артрит)
- наследственные метаболические нарушения (например, алкаптонурия, гемохроматоз, болезнь Вильсона)
- гемоглобинопатии (к примеру, серповидноклеточная анемия, талассемия)
- невропатические расстройства, ведущие к развитию сустава Шарко (сирингомиелия, спинная сухотка, сахарный диабет)
- морфологические факторы риска (например, врожденный вывих бедра)
- поражение костной ткани (болезнь Педжета, асептический некроз и другие)
- хирургические вмешательства на суставах в анамнезе (к примеру, менискэктомия)
Патофизиология ОА
Первичный и вторичный ОА имеют общую патологическую основу. Раньше предполагалось, что ОА — это дегенеративное расстройство, возникающее вследствие биохимического распада гиалинового хряща в синовиальных суставах. Однако сегодня принята несколько иная точка зрения, которая предполагает, что страдает не только суставной хрящ, но и весь сустав, в том числе субхондральная кость, синовиальная оболочка и близлежащие ткани.
Несмотря на дегенеративную природу ОА, появляется все больше свидетельств того, что после синтеза хондроцитами и выброса в суставную полость цитокинов развивается воспалительный процесс. Провоспалительные медиаторы (цитокины интерлейкин-1 и фактор некроза опухоли) не участвуют в деградации матрицы [2], а активируют хондроциты поверхностного слоя хряща, что увеличивает синтез матричных металлопротеиназ и, следовательно, дегенерацию суставного хряща.
В начальной стадии ОА из‑за повышения синтеза протеогликанов — основного компонента матрикса — происходит отек хряща. Этот этап может продолжаться несколько лет или даже десятилетий, и его основное проявление — это гипертрофия суставного хряща.
Далее, по мере прогрессирования ОА, уровень протеогликанов снижается до крайне низких значений, и изменяется их качественный состав. Поврежденный хрящ подвергается перегрузкам, вследствие чего повышается синтез металлопротеиназ (коллагеназы, стромелизина и других). Они способствуют дальнейшему разрушению протеогликанов и всей коллагеновой сети, что и предопределяет прогрессирующую дегенерацию хряща. В результате хрящ смягчается и теряет эластичность и повреждается все сильнее. Микроскопически на гладкой поверхности суставного хряща на этой стадии заболевания заметны шелушение и вертикальные расселины.
Для ОА характерны васкуляризация хряща и изменения в субхондральной кости. В ней формируется активно минерализующийся остеоид, а затем образуются субхондральные кисты и микропереломы. Это приводит к развитию субхондрального склероза.
Дифференциальная диагностика
Начальная цель, стоящая перед врачом, — дифференциация ОА от артритов, в том числе ревматоидного. Дифференциальная диагностика основывается на данных физического обследования и истории болезни. Картину дополняет рентгенологическое обследование и лабораторные показатели.
Симптомы остеоартроза
- боль в суставах (первый признак заболевания, может появляться на ранних стадиях);
- снижение амплитуды движения, крепитация — хруст в суставах (часто присутствует);
- чувство скованности во время или после отдыха. После сна характерна скованность суставов — обычно менее 30 минут.
- чаще всего поражаются дистальные межфаланговые суставы;
- могут поражаться проксимальные межфаланговые суставы и суставы у основания большого пальца;
- узлы Гебердена (пальпируемые остеофиты в дистальных межфаланговых суставах) более характерны для женщин, чем для мужчин;
- воспалительные изменения, как правило, отсутствуют или остаются незамеченными (маловыраженными).
Ревматоидный артрит (РА) преимущественно поражает запястья, а также метакарпофаланговые и проксимальные межфаланговые суставы. Поражение дистальных межфаланговых или суставов пояснично-крестцового отдела для него нехарактерно. Кроме того, РА связан с длительной (более 1 часа) утренней скованностью, припухлостью и повышением температуры суставов.
Также ОА следует дифференцировать от:
- аваскулярный некроз костной ткани
- фибромиалгия
- подагра и псевдоподагра
- анкилозирующий спондилоартрит
- нейропатическая артропатия (сустав Шарко)
- болезнь Лайма
- пателлофеморальный синдром
- псориатический артрит
Диагностика
Диагностика остеоартроза основана на данных клинического и рентгенологического обследования. В клинических исследованиях изучались возможности определения количества аутоантител и маркеров синовиальной жидкости как индикаторов ОА [4]. Ни один из этих показателей не доказал своей надежности для диагностики и контроля ОА.
Как правило, показатели острой фазы воспаления при ОА находятся в пределах нормы. В случае эрозивного артрита возможно повышение СОЭ. В синовиальной жидкости определяются лейкоциты в количестве ниже 2000 в мкл, с преобладанием мононуклеаров.
Метод выбора в диагностике ОА — рентгенографическое исследование [5]. Некоторые особенности суставного хряща и мягких тканей, которые не отображаются на рентгенограмме, можно визуализировать с помощью МРТ. Однако у большинства пациентов с ОА в проведении МРТ нет необходимости.
УЗИ не играет роли в повседневной клинической оценке пациента с ОА. Оно может применяться в качестве инструмента для мониторинга дегенерации хряща, а также для проведения внутрисуставных инъекций.
Артроцентез может помочь исключить воспалительный артрит, инфекции или кристаллическую артропатию, ассоциированную с отложением микрокристаллов различного состава.
От результатов диагностики зависит какие методы будут применяться для лечения остеоартроза.
Терапия
Лечение остеоартроза направлено на купирование болевого синдрома и улучшение функционального состояния сустава. В оптимальном варианте пациенты должны получать комбинацию нефармакологических методик и фармакотерапии [6].

- нормализация веса [7]
- лечебная гимнастика
- физиотерапия
- трудотерапия
- разгрузка некоторых суставов (например, колена, бедра)
Фармакотерапия ОА, рекомендации Международного общества по изучению ОА (OARSI), 2014 год
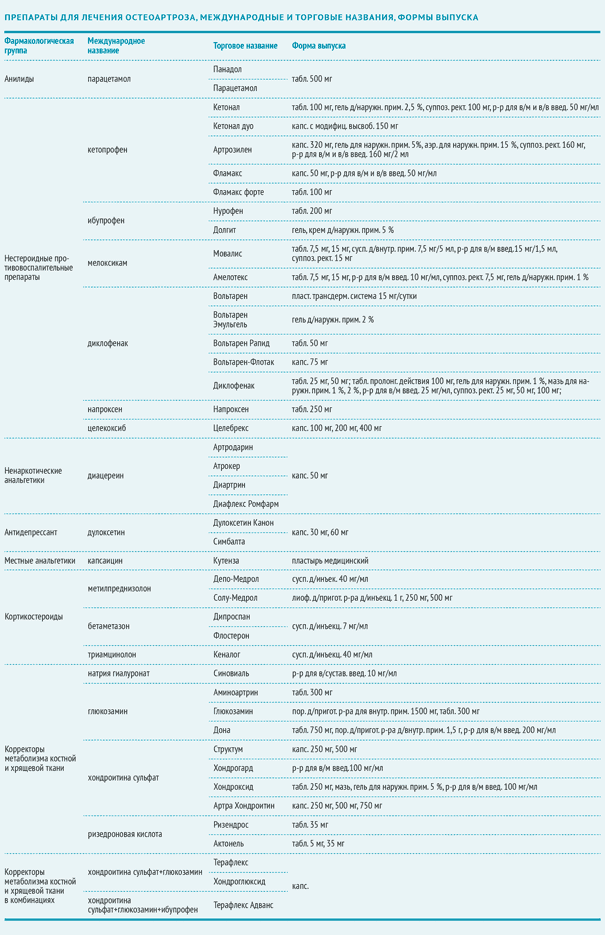
Применяют следующие препараты для лечения остеоартроза:
Мета-анализ 2010 года подтвердил эффективность парацетамола в качестве умеренного обезболивающего средства при ОА [8]. Однако исследования показали повышенный риск побочных эффектов, ассоциированных с применением парацетамола, включая желудочно-кишечные (ЖК) проявления и мультиорганные нарушения [8]. В связи с этими данными OARSI рекомендует применять препарат строго в соответствии с дозировкой и длительностью курса.
Сравнительное двойное слепое рандомизированное исследование 2011 года с участием 100 пациентов с ОА коленного сустава показало, что местный анальгетик капсаицин в качестве обезболивающего препарата при остеоартрозе на 50 % эффективнее, чем плацебо [9].
Последние исследования демонстрируют клинически значимый краткосрочный анальгетический эффект [10]. Есть еще несколько рекомендуемых препаратов для лечения остеоартроза.
Четыре исследования, изучающие применение хондроитина при ОА, показали неоднозначные результаты. В одних испытаниях было выявлено некоторое обезболивающее действие, а в других эффект хондроитина не отличался от эффективности плацебо [11]. Кроме того, специалисты Международного общества по изучению ОА — OARSI отмечают высокую степень неоднородности исследований и низкое их качество, в связи с чем окончательная оценка эффективности хондроитина крайне затруднена. Таким образом, в качестве симптоматического средства эффект хондроитина признан сомнительным, а в качестве препарата для лечения ОА не рекомендуется.
Мета-анализ 2010 года, изучающий данные шести исследований с участием 1533 пациентов, выявил относительно умеренный, но статистически значимый обезболивающий эффект ненаркотического анальгетика диацереина по сравнению с плацебо [12]. В мета-анализе также отмечено значительное увеличение риска диареи среди добровольцев, принимающих диацереин. Однако диацереин признан более безопасным, чем НПВП.
Исследования доказали, что ингибитор обратного нейронального захвата серотонина и норадреналина, антидепрессант III поколения дулоксетин эффективнее плацебо купирует боль при ОА [13]. Однако 16,3 % пациентов, получающих дулоксетин, испытывают побочные эффекты (по сравнению с 5,6 % в группе плацебо). К ним относятся тошнота, сухость во рту, сонливость, усталость, снижение аппетита, гипергидроз. В связи с этим необходимость в применении дулоксетина для лечения ОА у лиц с сопутствующими заболеваниями (сахарный диабет, артериальная гипертензия и другие сердечно-сосудистые заболевания, почечная недостаточность, ЖК-кровотечения, депрессия, ограничение физической активности, в том числе и вследствие ожирения) признана сомнительной*.
Два крупных исследования, оценивавших эффективность глюкозамина в лечении ОА дали противоречивые результаты [6]. Одно исследование показало статистически значимый анальгетический эффект, а другое засвидетельствовали отсутствие такового. Последний мета-анализ, в который вошло масштабное исследование, не доказал эффективности глюкозамина вовсе. На основании этих данных специалисты OARSI пришли к выводу о сомнительной эффективности глюкозамина в качестве симптоматического средства при ОА. В качестве средства для лечения ОА не рекомендуется [6].
Результаты клинических исследований (КИ), изучающих эффективность интраартикулярного введения гиалуроновой кислоты (ГК), оказались спорными [6]. Противоречивые данные мета-анализов и отдельных исследований ставят под сомнение целесообразность применения препаратов гиалуроновой кислоты при ОА коленного и тазобедренного суставов. При ОА нескольких суставов ГК не рекомендуется.
Прием данных препаратов входит в рекомендации по лечению остеоартроза пациентам без сопутствующих заболеваний. При сопутствующих заболеваниях ЖКТ необходимо наряду с НПВП назначать ингибиторы протонной помпы. Пациентам из группы высокого риска (ЖК-кровотечение, инфаркт миокарда, хроническая почечная недостаточность в анамнезе) пероральные НПВП категорически не рекомендуются.
Обзор литературы, проведенный японскими учеными в 2010 году, свидетельствует, что высокие дозы ризедроновой кислоты не уменьшают выраженность симптомов ОА, однако могут способствовать ослаблению прогрессирования ОА, сохраняя структурную целостность субхондральной кости [14]. Лабораторно этот эффект проявляется снижением уровня маркера деградации хряща CTX–II. Таким образом, эффективность резидроновой кислоты требует дальнейшего изучения.
Исследования показали умеренную эффективность кодеина и морфина при ОА коленного и бедренного сустава. Мета-анализ 2006 года, проведенный Кокрановским сообществом по результатам плацебоконтролируемых исследований с участием 1019 пациентов, выявил статистически значимые преимущества трамадола по сравнению с плацебо [15].
- Фоломеева О. М., Эрдес Ш. Ф. Распространенность и социальная значимость ревматических заболеваний в Российской Федерации // Доктор (ревматология). 2007. № 10. С. 3–12.
- Poole AR. An introduction to the pathophysiology of osteoarthritis. Front Biosci. 1999 Oct 15. 4: D662–70.
- van Baarsen LG et al. Heterogeneous expression pattern of interleukin 17A (IL-17A), IL-17F and their receptors in synovium of rheumatoid arthritis, psoriatic arthritis and osteoarthritis… Arthritis Res Ther. 2014. 16 (4):426.
- Brandt KD. A pessimistic view of serologic markers for diagnosis and management of osteoarthritis. Biochemical, immunologic and clinicopathologic barriers. J Rheumatol Suppl. 1989 Aug. 18:39–42.
- Recht MP et al. Abnormalities of articular cartilage in the knee: analysis of available MR techniques. Radiology. 1993 May. 187 (2):473–8.
- Zhang W et al. OARSI recommendations for the management of hip and knee osteoarthritis, part I: critical appraisal of existing treatment guidelines and systematic review of current research evidence. Osteoarthritis Cartilage. 2007 Sep. 15 (9):981–1000.
- Felson DT et al. Weight loss reduces the risk for symptomatic knee osteoarthritis in women. The Framingham Study. Ann Intern Med. 1992 Apr 1. 116 (7):535–9.
- Bannuru RRDU, McAlindon TE. Reassessing the role of acetaminophen in osteoarthritis: systematic review and meta-analysis. Osteoarthritis Research Society International World Congress; 2010 Sep 23–26; Brussels, Belgium. Osteoarthritis Cartilage 2010; 18 (Suppl 2):P 250.
- Kosuwon W et al. Efficacy of symptomatic control of knee osteoarthritis with 0.0125 % of capsaicin versus placebo. J Med Assoc Thai¼Chotmaihet Thangphaet 2010; 93 (10):118e95. Epub 2010/10/27.
- Bannuru RR et al. Therapeutic trajectory of hyaluronic acid versus corticosteroids in the treatment of knee osteoarthritis: a systematic review and meta-analysis. Arthritis Rheum 2009; 61 (12):1704–11.
- McAlindon T. E. et al. OARSI guidelines for the non-surgical management of knee osteoarthritis //Osteoarthritis and Cartilage. — 2014. — Т. 22. — №. 3. — С. 363–388.
- Bartels EM et al. Symptomatic efficacy and safety of diacerein in the treatment of osteoarthritis: a meta-analysis of randomized placebo-controlled trials. Osteoarthritis and Cartilage/OARS. Osteoarthritis Research Society 2010; 18 (3):289–96.
- Citrome L, Weiss-Citrome A. A systematic review of duloxetine for osteoarthritic pain: what is the number needed to treat, number needed to harm, and likelihood to be helped or harmed? Postgrad Med 2012; 124 (1):83.
- Iwamoto J. et al. Effects of risedronate on osteoarthritis of the knee //Yonsei medical journal. 2010. №. 2. 164–170 pp.
- Cepeda MS, Camargo F, Zea C, Valencia L. Tramadol for oste-oarthritis. Cochrane Database Syst Rev 2006; (3):CD005 522. Epub 2006/07/21.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Читайте также:


