Миелопролиферативная опухоль костного мозга неклассифицируемая
Хронические миелопролиферативные новообразования (МПН) являются клональным заболеванием гемопоэтической стволовой клетки, характеризующимся пролиферацией одной миелоидной линии или более (гранулоцитарной, эритроидной, мегакариоцитарной и тучноклеточной).
Согласно классификации ВОЗ (2008 г.), в зависимости от преобладания поражений тех или иных клеточных линий, в эту группу включают следующие нозологические формы.
Миелопролиферативные новообразования:
- хронический миелоидный лейкоз, BCR-ABL1 положительный
- хронический нейтрофильный лейкоз
- истинная полицитемия
- первичный миелофиброз
- эссенциальная тромбоцитемия
- хронический эозинофильный лейкоз неспецифицированный (ХЭЛ НС)
- мастоцитоз
- миелопролиферативное новообразование неклассифицируемое (НК)
Миелодиспластические/миелопролиферативные новообразования (МДС/МПН):
- хронический миеломоноцитарный лейкоз
- атипичный хронический миелоидный лейкоз BCR-ABL1 негативный
- ювенильный миеломоноцитарный лейкоз
- миелодиспластические/миелопролиферативные новообразования неклассифицируемые
условная форма: рефрактерная анемия с кольцевыми сидеробластами и тромбоцитозом
Миелоидные и лимфоидные новообразования, ассоциированные с эозинофилией и аномалиями PDGFRA, PDGFRB или FGFR1:
- миелоидные и лиимфоидные новообразования, ассоциированные с реаранжементом PDGFRA
- миелоидные новообразования, ассоциированные с реаранжементом PDGFRB
- миелоидные и лимфоидные новообразования, ассоциированные с аномалиями FGFR1
Ниже приводятся основные клинические, гематологические и лабораторные данные некоторых вышеуказанных нозологических форм (H.Bonner, A.J.Erslev, 1994).
Таблица 1. Основные клинические, гематологические и лабораторные данные нозологических форм

Хронический миеломоноцитарный лейкоз
Хронический миеломоноцитарный лейкоз (ХММЛ) относится к миелопролиферативным новообразованиям. В 1996 г. FAB-группа предложила различать два варианта ХММЛ. При количестве лейкоцитов менее 13,0х10 9 /л выставляется вариант МДС-ХММЛ, при лейкоцитозе выше 13,0х10 9 /л - вариант МПН-ХММЛ. Показано, что при отсутствии достоверных различий в клинико-гематологических признаках выживаемость при варианте МДС-ХММЛ выше, чем при варианте МПН-ХММЛ.
Хромосомные аномалии встречаются у 20-15% больных: del 7q, трисомия 8, der/del 12p; но del 5q- при этом варианте не встречается.
При ХММЛ избыточная пролиферация моноцитов может быть причиной спленомегалии (у 17% больных) и гепатомегалии (у 13% больных); иногда наблюдается лимфоаденопатия и гиперпластический гингивит.
Согласно классификации ВОЗ, выделяют следующие диагностические критерии для ХММЛ:
- моноциты периферической крови более 1,0х10 9 /л,
- менее 20% бластов в крови или костном мозге,
- отсутствие Ph-хромосомы или фузионного гена BCR/ABL,
- дисплазия одной или более миелоидных линий;
При отсутствии или минимальной миелодисплазии диагноз ХММЛ может быть выставлен при наличии:
- приобретенных клональных цитогенетических аномалий в костном мозге, или
- при наличии постоянного моноцитоза в течение последних трех месяцев с исключением других причин моноцитоза.
Диагноз ХММЛ-1 - при наличии 9 /л.
В данной классификации ХММЛ в количество бластов включают миелобласты, монобласты и промоноциты.
Дифференциальная диагностика проводится с ХМЛ и вариантами М4, М5 острый миелоидный лейкоз (ОМЛ).
При ХММЛ наиболее часто проводят монохимиотерапию гидроксимочевиной, дозы которой подбирают в зависимости от числа лейкоцитов. Сопоставимые результаты получены при терапии 6-меркаптопурином. Однако полные ремиссии при такой терапии не достигаются.
Атипичный хронический миелоидный лейкоз
Заболевание отличается агрессивным течением. Средняя продолжительность жизни составляет 11-18 месяцев. Дифференциальная диагностика должна проводиться в первую очередь с ХМЛ. Терапия практически идентична таковой при ХМЛ.
Ювенильный миеломоноцитарный лейкоз
Ювенильный миеломоноцитарный лейкоз (юММЛ) является гематопоэтическим клональным заболеванием, характеризуется преимущественной пролиферацией нейтрофильной и моноцитар-ной линий, отсутствием Ph-хромосомы и фузионного гена BCR/ABL.
При нем отмечено наличие мутаций в семействе генов RAS, отвечающих за ответ на факторы роста; мутаций гена PTPN11, и гена NF1, отвечающих за обратную регуляцию активности гена RAS. Эти мутации обеспечивают рост миелоидных предшественников в костном мозге без добавления факторов роста.
При обследовании в большинстве случаев выявляется гепатоспленомегалия, лимфоаденопатия. Диагностируется чаще у детей раннего и подросткового возраста, хотя могут болеть и лица молодого возраста. Дифференциальную диагностику необходимо проводить с ХМЛ детского возраста и ХММЛ. В категорию юММЛ включены лица с моносомией Хр7. Терапия проводится по общепринятым протоколам лечения ХММЛ с добавлением ретиноидов. Излечение возможно только при аллогенной трансплантации костного мозга (алло-ТКМ).
Хронический нейтрофильный лейкоз
Более поздние наблюдения при отсутствии цитогенетических изменений показали, что нейтрофилия обусловлена аномальной продукцией цитокинов при наличии опухоли или аномального воспалительного ответа. Клинические и лабораторные данные могут соответствовать таковым при ХМЛ в ХФ.
Однако в некоторых случаях при цитогенетическом и молекулярном изучении доказана клональность нейтрофильной линии. Поэтому хронический нейтрофильный лейкоз внесен по классификации ВОЗ в группу хМПН с рекомендацией подтверждения клонального характера миелоидной метаплазии данными цитогенетического исследования в случае наличия других опухолевых заболеваний. Терапия в случае доказанности клональности проводится так же, как и терапия ХМЛ в соответствующей фазе.
Хронический эозинофильный лейкоз неспецифицированный (ХЭЛ НС)
Случаи миелопролиферативных новообразований при отсутствии реаранжировки PDGFRA, PDGFRB или FGFR1 классифицируются как ХЭЛ НС при наличии эозинофилии крови >1,5х10 9 /л или более, количестве бластов в периферической крови менее 20%, отсутствии фузионного гена BCR-ABL1, наличии inv (16) (p13,1; q22) или t (16; 16) (p13,1; q22), пролиферации эозинофилов в костном мозге (КМ) и тканях различных органов (сердце, легкие, кожа, ЦНС, ЖКТ).
Подтверждением клональности лейкемических клеток в части случаев являются аномалии кариотипа: +8, моносомия 7, аберрация 4, 6, 10, 15 хромосом, а также мутация JAK2; отсутствует клональность Т-клеточных рецепторов.
Дифференциальный диагноз проводится с различными реактивными эозинофилиями, гиперэозинофильным синдромом (ГЭС) и опухолевыми заболеваниями с увеличением количества эозинофилов (лимфома Ходжкина, острый лимфобластный лейкоз и ХМЛ). Ранее ХЭЛ НС и ГЭС были объединены в одну нозологическую группу.
В настоящей классификации увеличение количества бластов в крови >2%, в КМ >5% и подтверждение клональности пролиферирующих клеток дает возможность разделить эти два патологических состояния. Терапия проводится по правилам лечения ХМЛ с обязательным назначением дезагрегантной терапии в связи с наличием тенденции к гиперкоагуляции и возможным тромбированием мезентериальных сосудов.
Классификация ВОЗ заболеваний тучных клеток
Классификация ВОЗ (2008 г.) заболеваний тучных клеток:
- кожный мастоцитоз;
- индолентый системный мастоцитоз;
- системный мастоцитоз, ассоциирующийся с клональным гематологическим заболеванием нетучноклеточной линии;
- агрессивный системный мастоцитоз;
- тучноклеточный лейкоз;
- тучноклеточная саркома;
- экстракожная мастоцитома.
Гематологические изменения при мастоцитозе включают анемию, лейкоцитоз с эозинофилией, гранулоцито- и тромбоцитопению. КМ поражен у пациентов с агрессивным или лейкемическим вариантом. В трепане при поражении костного мозга обнаруживают мультифокальные кластеры или инфильтрацию агрегатами тучных клеток, при гистологическом исследовании выявляют диффузную интерстициальную инфильтрацию.
Кожный мастоцитоз, или пигментная крапивница, встречается преимущественно у детей, проявляется мелкими папулезными, уртикарными, буллезными и диффузными розоватыми высыпаниями на коже.
Сиситемный мастоцитоз наблюдается чаще у взрослых и характеризуется аномальной инфильтрацией тучными клетками не только кожи, но и КМ, селезенки, ЖКТ и других внутренних органов. У части больных системный мастоцитоз ассоциируется с развитием хронического МПН, реже - МДС или зрелоклеточной лимфоидной пролиферации.
В клинической картине системного мастоцитоза выделяют две группы симптомов. Симптомы первой группы обусловлены инфильтрацией тучными клетками органов и тканей. К симптомам второй группы относятся: интоксикация, кожный зуд, остеопороз или остеофиброз, диарея и язвенные поражения ЖКТ, геморрагический синдром.
Клинический вариант системного мастоцитоза, протекающий с массивным поражением костного мозга (более 20% мастоцитов) и появлением аномальных тучных клеток в крови обозначается как тучноклеточный лейкоз. Данный вариант отличается отсутствием кожных поражений и неблагоприятным течением.
Диагностика мастоцитозов основывается на выявлении инфильтрации тучными клетками пораженных органов и тканей. Для уточнения диагноза проводят иммунофенотипическое определение CD2, CD 25, триптазы (G3) или определение мутации c-kit (CD 117).
Дифференциальная диагностика с реактивными гиперплазиями тучных клеток на фоне аллергических и опухолевых заболеваний основывается на данных морфологии.
В лечении используются ингибиторы продукции и антагонисты медиаторов, освобождающихся из тучных клеток. Имеются сообщения о положительных результатах применения препаратов интерферона и циклоспорина А в сочетании с метилпреднизолоном.
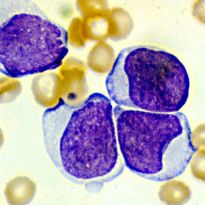
Далеко не каждый человек имеет представление о том, что такое миелопролиферативное заболевание. Однако те, кто столкнулся с данной патологией, знают о ней абсолютно все.
Это объясняется тем, что такие люди вынуждены на протяжении всей жизни наблюдаться у специалиста и поддерживать свое здоровье медикаментозными препаратами. Ведь не так просто самостоятельно вести борьбу с нарушениями в костном мозге, который производит стволовых кровяных клеток больше, чем это необходимо.
Описание патологии
Хроническое миелопролиферативное заболевание крови относится к группе патологий, характеризующихся чрезмерной выработкой тромбоцитов, эритроцитов, лейкоцитов.
В нормальном состоянии вырабатываются стволовые незрелые клетки. С течением времени происходит их созревание, они преобразуются в полноценные. Несформированные, в свою очередь, образуют три типа:
- тромбоциты, которые способствуют предотвращению кровотечений посредством формирования кровяных сгустков;
- эритроциты, которые участвуют в транспортировке кислорода и питательных веществ ко всем жизненно важным органам и тканям человеческого организма;
- лейкоциты, которые отвечают за обеспечение защитной реакции в борьбе с болезнями инфекционного характера или иными патологиями.
Прежде чем происходит их трансформация, стволовые клетки развиваются в несколько этапов. В случае проявления миелопролиферативного заболевания их большое количество преобразуется в один тип форменного кровяного элемента. Как правило, прогрессирование патологии происходит медленными темпами.
У пациентов, имеющих такой недуг, значительно возрастает риск образования тромбов и геморрагических осложнений.
Миелопролиферативные заболевания в большинстве случаев наблюдаются у мужчин в возрасте старше 40 лет. Женщины такому состоянию подвергаются значительно реже. Данные формы болезней нехарактерны для лиц младше двадцатилетнего возраста, у детей отмечаются лишь единичные случаи.
Виды патологий
По типу недуга выделяют следующую классификацию миелопролиферативных заболеваний:
- Истинная полицитемия. Характеризуется избытком эритроцитов, в результате чего наблюдается загустение крови. Находясь в большом количестве, данные клетки начинают скапливаться в селезенке, на фоне чего она увеличивается в размерах. Кроме этого, возможны кровотечения и формирование тромбов в сосудах. Такие нарушения способствуют инсульту или инфаркту. Но несмотря даже на такой возможный исход, протекает в доброкачественной форме и отличается большей выживаемостью по сравнению с остальными патологиями.
- Эссенциальный тромбоцитоз — большое количество тромбоцитов.
- Хроническая форма миелолейкоза. При данной патологии в костном мозге происходит избыточное скопление лейкоцитов.
- Эозинофильная лейкемия характеризуется чрезмерным содержанием эозинофилов, которые являются одним из видов лейкоцитов. Борются с инфекционными болезнями, спровоцированными определенными типами паразитов и отвечают за аллергические реакции организма на раздражители.
- Идиопатический миелофиброз. Наблюдается выработка патологических форменных элементов, постепенное замещение костного мозга фиброзной тканью.
- Хронический нейтрофильный лейкоз. Стволовые клетки формируют нейтрофилы, отвечающие за борьбу с патологиями инфекционного характера. Развивается медленно.
Все патологии могут переходить в лейкемию острой формы.
Стадии развития
Миелопролиферативный синдром не имеет стандартной системы стадирования, которую используют при выявлении степени развития опухолевых образований. Выбор метода лечения осуществляется в зависимости от типа патологии у больного.
Выделяют 3 основных пути, по которым опухолевый процесс распространяется по человеческому организму:
.jpg)
- Проникновение в клетки здоровой ткани.
- Лимфогенный путь. Попадание патогенных клеток в другие системы и органы происходит посредством лимфатических сосудов.
- Гематогенный. При проникновении в кровеносную систему злокачественные элементы с кровотоком попадают в здоровые ткани.
Характерные признаки
Клиническая картина каждого из заболеваний будет проявляться по-разному. Однако выделяют общие распространенные симптомы, характерные для всех миелопролиферативных патологий. К ним относят:

- утомляемость;
- стремительную потерю в весе, вплоть до анорексии;
- звон в ушах;
- нарушенное сознание;
- предрасположенность к синякам;
- возможные кровотечения;
- симптомы тромбоза;
- отеки;
- боли в суставах;
- болезненные ощущения в животе и левом предплечье.
У пациента могут наблюдаться такие признаки, как:
- кровоизлияние;
- бледность кожных покровов;
- увеличение печени или селезенки;
- плетора;
- лихорадка, сопровождающаяся проявлением пятен лилового окраса на конечностях и лице.
Только осмотр позволит дать оценку общему состоянию, а также выявить любые патологические отклонения, не соответствующие норме здорового организма.
Диагностические мероприятия
Лабораторная диагностика включает:
- проведение микроскопии мазка;
- сдачу общего анализа крови;
- цитогенетический анализ, определяющий уровень изменений в рh-хромосомах;
- полимеразную цепную реакцию.
Биопсия и аспирация возможны не во всех случаях. Проведение процедуры заключается во введении иглы в область грудины для взятия образца крови и костной ткани. Изучение полученных материалов позволяет определить наличие патологических элементов.
.jpg)
При подтвержденном диагнозе больные в течение всей жизни должны наблюдаться у гематолога.
Как лечатся миелопролиферативные болезни
В настоящее время применяют несколько терапевтических методов для лечения таких заболеваний. Выбор того или иного варианта зависит от общего состояния больного и выраженности клинических проявлений. Лечение возможно стандартным способом, неоднократно проверенным на практике, или экспериментальным, когда применяется новое средство.
Среди наиболее часто используемых методов выделяют следующие:
- Флеботомия. При данном методе берут забор крови из вены. После этого материал отправляется на биохимию или общий анализ. При лечении миелопролиферативного заболевания основная задача будет заключаться в понижении уровня эритроцитов.
- Аферез тромбоцитов. Этот способ похож на предыдущий, разница лишь в том, что действия направляются на уменьшение количества тромбоцитов с помощью предназначенного для этого оборудования. Суть метода заключается в следующем: кровь больного пропускается через так называемый сепаратор. В очищенном виде ее заново вливают пациенту.
- Химиотерапия. Подразумевает использование препаратов цитостатической группы. Они эффективно воздействуют на опухолевые клетки, в результат чего устраняют их и препятствуют развитию новообразований. Применение их возможно перорально, внутримышечно или внутривенно. В любом случае происходит проникновение активных компонентов лекарства в кровоток, что способствует подавлению патологических клеток. Такой метод называют системным. При региональном лекарственный препарат вводится в канал спинномозговой области или же непосредственно в орган, где происходят опухолевые изменения.
- Лучевая терапия. Основана на применении рентгеновского или иного излучения, имеющего высокие частоты. Данный метод способствует полному удалению опухолей и замедляет развитие новых образований. В медицинской практике используется два типа такого лечения:
- внешнее, при этом излучение идет от препарата, который располагают непосредственно около больного;
- внутреннее, когда трубки, иголки и катетеры наполняют средством, содержащим радиоактивные вещества; после этого их вставляют в саму опухоль или в ткань, находящуюся вблизи нее.
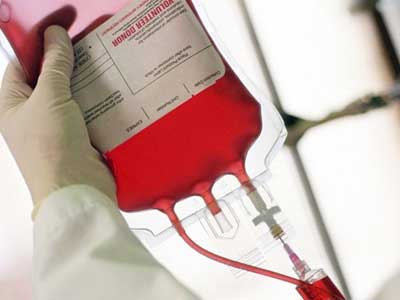
- Трансфузия — переливание крови, характеризуется замещением одних элементов на другие. В результате вместо клеток, подвергшихся разрушению, человек получает трансфузию, состоящую из тромбоцитов, эритроцитов и лейкоцитов.
- Химиотерапия с клеточной трансплантацией. Медикаментозные средства назначают в высоких дозах, а пораженные клетки замещают здоровыми, которые получают у самого больного или у донора. Такие элементы подвергаются заморозке. По завершении курса химиотерапии данный материал помещают в организм. Там они уже созревают и формируют новые клетки.
В каждом конкретном случае специальная диета для пациента разрабатывается индивидуально. Необходимо в как можно меньших количествах употреблять жирную, соленую и острую пищу. Питание обязательно должно быть сбалансированным.
Период восстановления
После того как все терапевтические мероприятия будут проведены, больной в обязательном порядке должен находиться постоянно под присмотром специалиста, то есть регулярно приходить на прием.
Чтобы оценить, насколько эффективным оказалось лечение, могут быть назначены те процедуры, которые применялись при диагностировании заболевания. Только после получения повторных результатов врач может прекратить, продолжить или сменить применяемую до этого схему терапии.
Ряд обследований должен проводиться постоянно, даже после окончания всего курса лечебного процесса. Это позволит прослеживать изменения в организме и не допустить или вовремя обнаружить рецидив.
Прогнозирование
При хронической форме течения заболевания с применением стандартных терапевтических методов в среднем продолжительность жизни примерно 5–7 лет.
В случае проведения трансплантации прогноз наиболее благоприятный. Излечение составляет около 60%. Эффективность данного метода будет зависеть от фазы патологии.
Ph-негативные миелопролиферативные заболевания (истинная полицитемия
эссенциальная тромбоцитемия
первичный миелофиброз) у взрослых
- Национальное гематологическое общество European Hematology Association The American Society of Hematology European Society of Pathology European Association for Haematopathology Российское общество патологоанатомов Российское онкогематологическое общество
Оглавление
- Ключевые слова
- Список сокращений
- Термины и определения
- 1. Краткая информация
- 2. Диагностика
- 3. Лечение
- 4. Реабилитация
- 5. Профилактика и диспансерное наблюдение
- 6. Дополнительная информация, влияющая на течение и исход заболевания
- Критерии оценки качества медицинской помощи
- Список литературы
- Приложение А1. Состав рабочей группы
- Приложение А2. Методология разработки клинических рекомендаций
- Приложение А3. Связанные документы
- Приложение Б. Алгоритмы ведения пациента
- Приложение В. Информация для пациентов
- Приложение Г.
Ключевые слова
Список сокращений
Алло-ТГСК – аллогенная трансплантация гемопоэтических стволовых клеток
Ауто-ТГСК – аутологичная трансплантация гемопоэтических стволовых клеток
БФ – бластная фаза
ВОЗ – Всемирная организация здравоохранения
ИП – истинная полицитемия
КТ – компьютерная томография
МДС – миелодиспластический синдром
МПЗ – миелопролиферативное заболевание
МПЗн – миелопролиферативное заболевание неклассифицированное
МРТ – магнитно-резонансная томография
НМГ – низкомолекулярный гепарин
ОВ – общая выживаемость
ОМЛ – острый миелоидный лейкоз
ПМФ – первичный миелофиброз
Пост-ИП МФ – постполицитемический миелофиброз
Пост-ЭТ МФ – посттромбоцитемический миелофиброз
ПЦР – полимеразная цепная реакция
УЗИ – ультразвуковое исследование
ХМЛ – хронический миелоидный лейкоз
ХФ – хроническая фаза
ЭТ – эссенциальная тромбоцитемия
P32 – радиоактивный фосфор
DIPSS (Dynamic International Prognostic Scoring System) – Динамическая международная шкала оценки прогноза
ELN (European Leukemia Net) - Европейская организация по изучению и лечению лейкозов
EORTC - Европейская организация по исследованиям в области лечения рака
G-CSF (granulocyte colony stimulating factor) - гранулоцитарный колониестимулирующий фактор
IPSET-thrombosis (The International Prognostic Score for ET) – Международный Прогностический Индекс рисков тромбоза при эссенциальной тромбоцитемии
IPSS (International Prognostic Scoring System) – Международная шкала оценки прогноза
IWG-MRT (The international working group for myeloproliferative neoplasms research and treatment) - Международная рабочая группа по изучению и лечению миелопролиферативных заболеваний
NSSN (National Comprehensive Cancer Network®) - Национальная Онкологическая Сеть США
PVSG (Polycythemia Vera Study Group) – группа по изучению истинной полицитемии
PUVA (psoralen + UVA treatment) – ПУВА – терапия; ультрафиолетовая фототерапия в комбинации с псораленом
?? - препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения.
Термины и определения
Трепанобиопсия – диагностическая процедура забора образцов костного мозга путем пункции гребня подвздошной кости.
1. Краткая информация
1.1 Определение
Миелопролиферативные заболевания (МПЗ) представляют собой клональные заболевания, возникающие на уровне стволовой кроветворной клетки. МПЗ характеризуются пролиферацией одной или более клеточной линии миелопоэза в костном мозге с признаками сохранной терминальной дифференцировки, и сопровождаются изменением показателей периферической крови.
Истинная полицитемия (ИП) (синонимы: эритремия, болезнь Вакеза, истинная красная полицитемия) – клональное МПЗ, которое характеризуется пролиферацией эритроидного, гранулоцитарного, мегакариоцитарного ростков миелопоэза, с преимущественной пролиферацией эритроидного ростка кроветворения (панмиелоз), увеличением числа эритроцитов и повышением уровня гемоглобина, тромбоцитозом, лейкоцитозом в периферической крови (панцитоз), независимостью эритропоэза от нормальных механизмов регуляции. Почти все больные являются носителями мутации JAK2V617F или другой функционально сходной мутации.
Эссенциальная тромбоцитемия (синонимы: первичный тромбоцитоз, идиопатический тромбоцитоз, геморрагическая тромбоцитемия) – клональное МПЗ с неконтролируемой пролиферацией мегакариоцитов, характеризующееся повышенным числом крупных и гигантских мегакариоцитов в костном мозге, тромбоцитозом в периферической крови (>450 х 109/л), высоким риском тромбозов и/или кровотечений.
Миелопролиферативное заболевание, неклассифицируемое (МПЗн) Согласно рекомендациям ВОЗ 2008 г., данный диагноз следует использовать при наличии клинических, лабораторных и гистологических (в трепанобиоптате костного мозга) признаков МПЗ, не соответствующих какой-либо определенной нозологической форме классических Ph-негативных МПЗ. Чаще всего эта категория используется: При ранних стадиях заболевания (манифестация) – при расхождении между клиническими, лабораторными и морфологическими данными, позволяющими верифицировать ту или иную нозологическую форму МПЗ. При бластной фазе заболевания, без предшествующего анамнеза и установленного ранее диагноза миелопролиферативного заболевания. При сочетании МПЗ с воспалительными, метаболическими или опухолевыми заболеваниями, маскирующими основные признаки той или иной нозологичесой формы. МПЗ неклассифицируемое не диагностируется: при объеме трепанобиоптата костного мозга недостаточном для адекватного анализа; при отсутствии предоставленных клиницистами клинических и лабораторных данных, при наличии предшествующей терапии цитостатиками или колониестимулирующими факторами; при наличии реаранжировки генов PDGFRA, PDGFRB, FGFR1, выявлении химерного гена BCR-ABL1.
Первичный миелофиброз (ПМФ) (синонимы: хронический идиопатический миелофиброз, агногенная миелоидная метаплазия, миелосклероз с миелоидной метаплазией, сублейкемический миелоз, хронический гранулоцитарно-мегакариоцитарный миелоз) возникает de novo, характеризуется клональной пролиферацией стволовых клеток, аномальной экспрессией цитокинов, фиброзом костного мозга, гепатоспленомегалией как следствие экстрамедуллярного гемопоэза, симптомами опухолевой интоксикации, кахексией, лейкоэритробластозом в периферической крови, лейкемической прогрессией, невысокой выживаемостью.
1.2 Этиология и патогенез Ph - негативных МПЗ
Этиология МПЗ до сих пор не установлена. Ведущей гипотезой является многоэтапность возникновения заболевания, где предрасположенность к болезни реализуется под воздействием внешних факторов, повреждающих геном нормальной клетки и приводящих к ее злокачественной трансформации. Несмотря на то, что в последние годы достигнуты значительные успехи в расшифровке молекулярно-генетических механизмов Ph-негативных МПЗ, первоначальная мутация, приводящая к малигнизации гемопоэтической клетки неизвестна [1].
Открытие мутации V617F в гене JAK2 в 2005г явилось значительным шагом в понимании биологических особенностей Ph-негативных МПЗ. Практически у всех пациентов с ИП выявляется мутация гена JAK2: в 96% случаев мутация JAK2V617F (14 экзон), в 2% наблюдений мутация в экзоне 12 гена JAK2 [2, 3]. Мутация JAK2V617F выявляется при ЭТ в 55% наблюдений и присутствует примерно в 45 - 68% случаев при ПМФ. Тогда как мутация в 12 экзоне гена JAK2 практически не встречается при ЭТ и ПМФ [4,5].
Помимо мутации гена JAK2 у больных МПЗ выявляют мутации и в других генах. Мутации гена MPL встречаются в 4% наблюдений при ЭТ, в 8% наблюдений при ПМФ, и редко при ИП. Причем наиболее частые мутации MPLW515L/K в экзоне 10 [6, 7, 8]. Мутация MPLS505N выявляется как при ЭТ, так и при наследственной тромбоцитемии [9, 10]. Данные мутации не являются строго специфичными для МПЗ и имеют вторичный генез в цепи генетических событий.
Не так давно появились данные о диагностической значимости соматических мутаций в 9 экзоне гена CALR, кодирующего белок кальретикулин. Выявлены 36 разных видов мутаций в этом гене, которые приводят к образованию дефектного белка. В исследованиях in vitro клетки, экспрессирующие мутированный ген, обладали способностью цитокин-независимого роста в культуре, что вероятно связано с активацией белков STAT5. У пациентов без мутаций в генах JAK2 и MPL мутации в данном гене были выявлены в 67% случаев при ЭТ и 88% - при ПМФ. Другие авторы также выявили крайне высокую частоту мутаций гена CALR у пациентов с МПЗ (в 70-84% случаев при отсутствии мутации гена JAK2). При этом мутации CALR были обнаружены в 8% случаев при миелодиспластическом синдроме и в единичных наблюдениях при других миелоидных неоплазиях. Важно, что ни в одном случае заболеваний не миелоидной природы, мутации в данном гене не были выявлены [11,12].
Мутации в генах JAK2, MPL, CALR имеют важное диагностическое значение. Их выявление свидетельствует о клональном характере заболевания и помогает в дифференциальной диагностике ИП, ЭТ, ПМФ от ряда других миелоидных неоплазий, а также вторичных эритроцитозов и тромбоцитозов. Наряду с этим активно изучается значимость данных мутаций в прогнозе МПЗ. Несмотря на ряд проведенных исследований, не представляется возможным сделать однозначное заключение в отношении прогностической значимости аллельной нагрузки JAK2V617F при ИП, ЭТ, ПМФ. Вопрос влияния аллельной нагрузки на выживаемость или прогрессирование ИП и ЭТ с исходом в миелофиброз требует дальнейшего изучения [13, 14].
При ИП и ЭТ выявляются и другие мутации: TET2, IDH, ASXL1, DNMT3A и др. [1]. Ни одна из них не специфична для классических Ph-негативных МПЗ, а их патогенетическая значимость исследуется.
Молекулярно-генетические нарушения при Ph-негативных МПЗ приводят к активации JAK-STAT сигнального пути. Результатом этого является повышение пролиферации и увеличение количества эритроцитов, лейкоцитов и тромбоцитов периферической крови при ИП или изолированный тромбоцитоз при ЭТ. Патогенез МПЗ, в частности ПМФ, сложен и состоит из цепи событий, первичным из которых является появление патологического клона. Известно, что лейкемические моноциты и мегакариоциты активно продуцируют множество цитокинов (TGF-?, FGF, VEGF, ANG1, OPG, BMP4), избыток которых стимулирует фиброз, неоангиогенез и приводит к остеосклерозу. Наряду с этим нарушается связь стволовых клеток с микроокружением, что способствует появлению экстрамедуллярных очагов гемопоэза, прежде всего в селезенке и печени. Массивный выброс цитокинов - одна из причин возникновения симптомов опухолевой интоксикации, что приводит к значительному ухудшению качества жизни пациентов с ПМФ [15].
Клональная миелопролиферация при Ph-негативных МПЗ также может сопровождаться вторичным воспалением с изменениями стромы костного мозга и патологической выработкой цитокинов. В развитии миелофиброза, как первичного, так и вторичного, остеосклероза и ангиогенеза вовлечены трансформирующий фактор роста бета (TGF-?) миелоидных предшественников, ростовой фактор вырабатываемый тромбоцитами (PDGFR) и эндотелиальный сосудистый фактор роста (VEGF) [16]. Патологическая выработка цитокинов, хемокинов и металлопротеиназ может участвовать в патологическом межклеточном взаимодействии нейтрофилов, моноцитов и мегакариоцитов, приводя к выходу CD34+ миелоидных предшественников и эндотелиальных клеток в периферическую кровь [17, 18].
1.3 Эпидемиология
ЭТ – редкое / орфанное заболевание. Популяционные эпидемиологические данные о заболеваемости и распространенности в России отсутствуют. Литературные данные о заболеваемости по данным зарубежных регистров составляют приблизительно 1,5 - 2,53 : 100 000 населения [19]. При анализе десятилетней динамики заболеваемости в Санкт-Петербурге ежегодная первичная заболеваемость колебалась от 0,60 до 2,10 и составила в среднем 1,30 на 100 000 населения в год [20].
1.4 Кодирование по МКБ 10
D47.4 – первичный миелофиброз
D45 – истинная полицитемия
D47.3 – эссенциальная тромбоцитемия
1.5 Классификация
В соответствии с классификацией ВОЗ 2008г группа хронических МПЗ объединяет восемь нозологических форм:
Читайте также:


