Микробиологические аспекты хирургических инфекций
Этиотропная антибиотико- и иммунотерапия больных с гнойно-воспалительными процессами: ЛИТЕРАТУРА
Опыт применения тиментина (тикарциллин/клавуланата) в лечении абдоминальной хирургической инфекции: tabfour
Характеристика смесей, используемых для питания детей раннего возраста в России: дети, питание, питательные смеси.
Роль антибактериальной профилактики и терапии при панкреонекрозе: tabeight
Ломефлоксацин в лечении инфекционных заболеваний глаз: ломефлоксацин, глазные инфекции, терапия.
Состояние иммунной системы у беременных и новорожденных группы высокого риска по внутриутробному инфицированию: беременность, плод, новорожденный, внутриутробные инфекции, клеточный иммунитет, гуморальный иммунитет, интерфероны, иммунокоррекция.
Государственный научный центр по антибиотикам, Российский государственный медицинский университет, Москва
Необходимость совершенствования принципов и методов антибиотикопрофилактики в хирургии в последнее десятилетие обусловлена возрастанием риска развития послеоперационных гнойных осложнений на фоне полиорганных нарушений функций жизнеобеспечивающих систем, барьерных функций слизистых оболочек, кожи и подкожных структур.
Введение антибиотиков перед операцией в период подготовки к наркозу является наиболее результативным способом предотвращения контаминации раны, как с точки зрения его эффективности, так и, особенно, предупреждения нежелательных последствий их длительного применения.
Выбор режимов антибиотикопрофилактики и лечения (при необходимости) должен быть строго индивидуализирован с учетом комплекса основных факторов (состояние больного, вид оперативного вмешательства) и наличия у больного сопутствующих заболеваний и других так называемых факторов риска, которые представлены в табл. 1.
| Таблица 1. Факторы риска, способствующие развитию хирургической инфекции | |
| Факторы, связанные с состоянием больного, свойствами возбудителя и состоянием окружающей среды | Факторы, обусловленные особенностями оперативного вмешательства, инструментального обследования |
| "Факторы" больного: возраст нарушение питания нарушение питания снижение иммунного статуса курение, алкоголизм сопутствующие болезни "Факторы" возбудителя: "Факторы" окружающей среды: | Особенности оперативного вмешательства: продолжительность операции тип предоперационной подготовки (использование антисептиков, виды обработки кожи и др.) протяженность разреза (нарушение анатомических барьеров) кровопотеря использование чужеродных материалов (протезы, дренажи, шовный материал) степень травматичности операции переливание крови тип перевязочного материала и др. |
Рекомендуемый антибиотик или комбинации препаратов многосторонне оцениваются с точки зрения широты спектра антимикробного действия, фармакокинетических и фармакодинамических свойств; скорости формирования устойчивости возбудителя, эффективности, переносимости, в том числе степени повреждающего действия на нормальную микрофлору больного.
Необходимо также прогнозировать экономические последствия неправильного выбора антибиотиков, поскольку развитие инфекции или осложнений, связанных с их применением, в послеоперационном периоде задерживает выздоровление больного, что требует дополнительного лечения и сопровождается значительным возрастанием стоимости койко-дня. И наоборот, адекватная антибиотикопрофилактика снижает частоту или полностью предупреждает развитие послеоперационных гнойных осложнений и уменьшает прогнозируемую общую стоимость лечения.
Одним из ориентиров определения необходимости проведения антибиотикопрофилактики и ее предполагаемой продолжительности является оценка операционных ран по степени их возможной микробной обсемененности. По этому показателю их обычно распределяют на "чистые", "условно-чистые", "загрязненные" и "грязные". Прогнозируемая частота послеоперационных гнойных осложнений в этих случаях может составлять 1,5; 10; 20-25 и 40-50% соответственно.
Такой подход является условным, однако он дает возможность планировать тактику антибактериальной защиты в период подготовки к операции. Безусловной является необходимость проведения антибиотикопрофилактики при "чистых" операциях (на сердце и сосудах, плановая холецистэктомия и др.) у ослабленных больных со сниженным иммунным статусом. Она является также необходимой при "чистых" операциях в случае большой продолжительности оперативного вмешательства, имплантации чужеродных материалов (протезирование сердечных клапанов, использование сосудистых протезов, при трансплантации органов, артропластике и др).
Антибиотикопрофилактика является обязательной при "условно-чистых" (умеренная степень микробной обсемененности), "загрязненных" и "грязных" ранах. При опасности инфицирования больных с "условно-чистыми" операциями нельзя ограничиваться только профилактическим введением антибиотиков. По показаниям необходимо сразу переходить на послеоперационную антибактериальную терапию (операции при хронических гнойных заболеваниях легких, почек, по поводу флегмоны , карбункулов , открытых травм, рваных ран и др.).
| Таблица 2. Ориентировочные схемы антибиотикопрофилактики инфекции в хирургии | |||
| Тип операции | Наиболее частые возбудители | Рекомендуемые антибиотики | Режимы применения |
| 1 | 2 | 3 | 4 |
| Чистые | |||
| Kардиоваскулярная хирургия: | |||
| - имплантация клапанов, аортокоронарное шунтирование; | S.aureus, S.epidermidis , Corynebacterium spp. , энтеробактерии | Цефазолин | 1 г в/в внутриоперационно и каждые 8 ч в течение суток |
| Цефуроксим | 1,5 г в/в внутриоперационно и три дозы в течение суток | ||
| - реконструктивные операции на крупных сосудах | Ванкомицин при выделении MRSA-штаммов | 1 г в/в до операции, каждые 12 ч в течение 48 ч | |
| То же | |||
| - ампутация нижних конечностей при ишемии (без признаков нагноения и некрозов) | S.aureus, S.epidermidis, энтеробактерии, анаэробы | Цефуроксим | 1,5 г в/в внутриоперационно, две повторные дозы каждые 8 ч |
| Цефокситин (при длительной операции) | 2 г в/в, две повторные дозы каждые 8 ч | ||
| Цефтриаксон | 2 г в/в однократно | ||
| - ортопедическая хирургия (в том числе артропластика) | S.aureus, S.epidermidis | Цефуроксим | 1,5 г в/в, повторно две дозы |
| Ванкомицин при выделении MRSA-штаммов | 1 г в/в с интервалом 12 ч, повторно (по показаниям) | ||
| Торакальная хирургия (закрытая травма грудной клетки без гнойных осложнений) | S.aureus, S.epidermidis, энтеробактерии | Цефуроксим | 1,5 г в/в внутриоперационно + 0,75 г каждые 8 ч в течение 48 часов |
| Условно-чистые | |||
| Операции на органах и тканевых структурах головы и шеи (в том числе полость рта, гортань) | S.aureus, Strеptococcus spp., оральные анаэробы | Цефазолин | 1 г в/в |
| Цефуроксим | 1, 5 г в/в, повторно по 0,75 г каждые 8 ч в течение 48 часов | ||
| Гастродуоденальная хирургия | Энтеробактерии, анаэробы, при пониженном значении рН желудочного сока | Цефазолин | 1 г в/в интероперационно |
| Цефуроксим + метронидазол | 1,5 г в/в + 0,5 г в/в | ||
| Операции на печени, желчных ходах, желчном пузыре | S.aureus, S.faecalis, энтеробактерии, анаэробы | Цефазолин | 1-2 г в/в |
| Цефуроксим | 1,5 г в/в однократно (при холецистэктомии - последующий переход на антибактериальную терапию) | ||
| Kолоректальная хирургия | Аэробы: энтеробактерии, энтерококки | 1. Внутрь: | |
| Неомицин , Эритромицин | по 1 г каждого препарата трехкратно за 1 день до операции с интервалом 8 ч | ||
| 2. Парентерально: | |||
| Цефокситин | 2 г в/в | ||
| Цефотетан | 1 г в/в | ||
| Цефтриаксон + метронидазол | 2 г в/в + 1 г в/в | ||
| Kлиндамицин + гентамицин * | 0,6-0,9 г в/в + 1,5 мг/кг в/в | ||
| Проникающая травма живота | Энтеробактерии, анаэробы | Цефокситин | 2 г в/в |
| Цефотетан | 2 г в/в | ||
| Тикарциллин / клавулановая кислота | 3,1 г в/в (3 г тикарциллина, 100 мг клавулановой кислоты) | ||
| Kлиндамицин + гентамицин | 0,9 г в/в + 1,5 мг/кг в/в, в/м (без ранения кишечника однократно, при перфорации - 2-5 дней) | ||
| Аппендэктомия (при неперфорированном аппендиксе) | Энтеробактерии, анаэробы | Цефокситин | 1 г в/в |
| Цефуроксим + метронидазол | 1,5 г в/в + 1 г в/в | ||
| Абдоминальная и вагинальная гистерэктомия | Энтерококки, энтеробактерии, анаэробы (бактероиды) | Цефазолин | 2 г в/в |
| Цефуроксим | 1,5 г в/в | ||
| Амоксициллин/клавуланат | 0,375 г в/в | ||
| Kесарево сечение (при риске разрыва матки; наличии воспалительных процессов) | Энтеробактерии, энтерококки, стрептококки гр.В, анаэробы | Цефазолин | 2 г в/в |
| Цефуроксим | 1,5 г в/в | ||
| Цефокситин | 2 г в/в | ||
| Прерывание беременности | Энтеробактерии, стрептококки гр.В; анаэробы | То же | |
| Доксициклин | 0,1 г x 2 раза в сутки внутрь | ||
| Грязные раны | |||
| Травмы живота с прободением кишечника | Энтеробактерии, энтерококки, анаэробы | Цефуроксим + метронидазол | 1,5 г в/в + 1 г в/в |
| Цефокситин | 2 г в/в | ||
| Цефотетан | 2 г в/в | ||
| Перфоративный аппендицит | Энтеробактерии, анаэробы | То же | |
| Перитонит гнойный | Энтеробактерии, энтерококки; клостридии при каловом перитоните | Цефалоспорины III поколения + метронидазол | 1-2 г в/в + 1 г в/в |
| Тиенам | 1-2 г в/в x 2 р/день (в течение 48 часов) | ||
| Kлиндамицин + гентамицин* | 0,9 г в/в + 1,5 мг/кг в/в x 3 раза в день (48 часов) | ||
| Открытые переломы конечностей | Staphylococcus spp., энтеробактерии, анаэробы | Цефуроксим | 0,75 г в/в x 3 р в день в течение 5 дней |
| Kлиндамицин | 0,9 г в/в x 3 р/день | ||
| Раны, уличные травмы, укусы | S.aureus, Streptococcus гр.А, Clostridium spp., Pasteurella multocida | Цефуроксим | 0,75 г в/в каждые 8 ч в течение 24 - 48 часов |
| Цефтриаксон | 2 г в/в однократно | ||
| Аденомэктомия: | |||
| при стерильной моче | Антибиотикопрофилактика не показана | ||
| при инфицированной моче | Подбор препаратов на основе бактериологического анализа мочи, определения антибиотикочувствительности | ||
Основными возбудителями послеоперационных гнойных осложнений при операциях на верхних отделах кишечника, печени, органах мочевыводящей системы являются стафилококки, энтерококки и энтеробактерии ( E.coli , Proteus spp. , Klebsiella spp. и др.), в отношении которых активны цефалоспорины I-II поколений, комбинированные препараты ингибиторов бета-лактамаз и пенициллинов , аминогликозиды, фторхинолоны (последние рассматриваются как резервная группа антибиотиков).
Основными контаминирующими микроорганизмами при колоректальной хирургии, аппендэктомиях, в оперативной гинекологии являются ассоциации аэробов и анаэробов, что требует назначения цефалоспоринов II-III поколения, различных комбинаций антибиотиков с антиаэробной и антианаэробной активностью (см. табл. 2).
Оценке роли микробного фактора в развитии инфекционного процесса всегда уделялось большое внимание, так как хорошо известно, что от вида микроба, вызвавшего инфекционный процесс, зависит специфика течения последнего и особенности морфологических изменений в органах. Это положение особенно важно учитывать в настоящее время, когда произошли значительные изменения в этиологической структуре возбудителей инфекционных заболеваний вообще и гнойных хирургических инфекций в частности, и на первое место выдвинулась проблема условно-патогенных возбудителей (Тимаков В. Д., Петровская В. Г., 1977).
Инфекционный процесс (инфекция в ране) развивается при нарушении равновесия между микробами, загрязняющими рану, и защитными силами макроорганизма, что проявляется клиническими симптомами воспаления. При развитии инфекционного процесса в ране в отличие от бактериального загрязнения происходит распространение микробов вглубь жизнеспособных тканей, в лимфатические и кровеносные пути, после чего резко проявляется патогенное воздействие бактерий как на течение местного раневого процесса, так и на весь организм.
По клинико-морфологическим проявлениям различают:
-гнойная инфекция - протекает с образованием гнойного экссудата в раневой полости на фоне относительной жизнеспособности окружающих тканей;
-гнилостная инфекция - характеризуется преобладанием некробиотических процессов в тканях вследствие деятельности патогенной микрофлоры;
-газообразующая инфекция - объединяет собой группу инфекционных осложнений раневого процесса, связанных с развитием в ране анаэробных клостридий и некоторых неклостридиальных анаэробов, признаком жизнедеятельности которых является образование газа в тканях;
-специфическая инфекция - к этой группе относят инфекционные осложнения ран, имеющие особую, только им присущую клиническую картину (столбняк, актиномикоз, дифтерия, сифилис, туберкулез и т. д.).
По клиническому течению различают:
-острая инфекция - возникающая в неинфицированных ранее тканях и протекающая с выраженными клиническими проявлениями, полностью исчезающими после купирования воспаления, заживления раны и выздоровления раненого;
-хроническая инфекция - этим термином обозначаются те случаи, когда процесс инфекционного воспаления в ране принимает затяжной характер. При этом воспалительные проявления, как правило, периодически исчезают, но при определенных неблагоприятных условиях возникают повторно. К особым видам хронической раневой инфекции относятся свищи (свищевые каналы) мягких тканей - узкие длинные ходы в тканях, сообщающие глубинный инфекционно-воспалительный очаг с окружающей средой. Появление длительно существующего свища свидетельствует о наличии поддерживающей причины, ликвидировать которую организм не может. Такими причинами могут быть инфицированные и окруженные грануляциями инородные тела, в том числе лигатуры, свободные костные отломки, инкапсулированные участки некроза;
-стертая инфекция (дремлющая) - характеризуется возникновением острого инфекционного воспаления в сроки, превышающие длительность типичного инкубационного периода (3-7 сут), торпидным течением, стертостью клинических проявлений самой инфекции. Характер клинического течения раневой инфекции определяется соотношением патогенных свойств микроорганизмов и иммунобиологических свойств организма, а также рациональностью проводимого лечения.
Раневая инфекция является частным, хотя и особым видом инфекционного процесса. В основе ее развития лежат определенные неспецифические и специфические реакции, знание которых необходимо клиницисту.
Иммунитет и факторы естественной резистентности призваны сохранять иммунологический гомеостаз, т.е. единство внутренней среды макроорганизма. Защитная реакция организма представляет собой определенную цепь событий, зависящих от состояния больного, дозы и свойств антигена.
Факторы защиты от инфекции делятся на несколько видов. Во-первых, это сывороточные (гуморальные) и клеточные факторы. Такое деление хотя и условно, так как первые являются продуктом клеток, но справедливо, если иметь в виду эффекторную функцию факторов защиты: в одном случае с антигеном реагируют сывороточные факторы, в другом- клетки хозяина. Далее выделяют факторы естественной резистентности, которые неспецифичны, т.е. не направлены на определенный антиген и потому способны реагировать со многими антигенными факторами. Наконец развивается иммунный ответ, направленный на конкретный антиген (т.е. специфичный).
ВИДЫ ЗАЖИВЛЕНИЯ РАНЫ.
Раневым процессом принято называть совокупность биологических явлений, последовательно развивающихся в тканях раны.
Местными (локальными) факторами, определяющими характер заживления раны, являются:
-объем повреждения тканей, размеры и форма раневого дефекта;
-присутствие в ране некротических тканей, сгустков крови, экссудата и инородных тел;
-наличие в ране гистотоксических веществ, создающих дополнительное повреждающее воздействие на ткани (боевые отравляющие вещества, компоненты ракетных топлив, горюче-смазочные материалы, радиоактивное загрязнение);
- состояние трофики тканей в зоне ранения, которое определяется характером повреждения и анатомическими особенностями кровоснабжения и иннервации;
- присутствие в ране патогенной микрофлоры и уровень обсемененности тканей.
Кроме того, тип заживления раны зависит от общего состояния раненого, уровня неспецифической резистентности организма и его иммунных сил. Сопутствующие заболевания (диабет, атеросклероз, последствия воздействия экстремальных факторов, переохлаждение, обезвоживание, кахексия, авитаминоз и т.д.), комбинирование ранения с поражающим действием современных видов оружия могут существенно ослабить защитные силы организма и способствовать неблагоприятному течению раневого процесса.
Принято выделять три вида заживления раны: заживление первичным натяжением, заживление вторичным натяжением, заживление под струпом.
Основные трудности в проблеме лечения ран и раневой инфекции заключаются в объективной диагностике фаз раневого процесса и прогнозирования течения заживления для разработки обоснованной тактики и принципов лечения.
Основным критерием оценки течения заживления является его клиническая характеристика, дополняемая двумя методами исследования- цитологическим и бактериологическим. Однако многие клинические критерии в значительной степени субъективны.
Клиническая картина процесса заживления является основой для его диагностики. К числу объективных можно отнести следующие симптомы: температуру тела, динамику изменений морфологического анализа крови и лейкоцитарный индекс инфильтрации (или интоксикации) по Кальф-Калифу.
Очень важны и местные симптомы – гиперемия, отечность и инфильтрация тканей в области раны, количество и характер отделяемого, однако только при визуальной оценке они могут трактоваться клиницистом весьма произвольно. Несложно выявить их динамику при обычном определении объема конечности, размеров инфильтрата или измерении количества отделяемого и цитологическом его исследовании. Температура тела является одним из существенных критериев оценки раневого процесса. Последовательное снижение ее свидетельствует о нормальном течении заживления. Напротив, сохранение на высоком уровне, стойкий субфебрилитет или повышение температуры говорят о развитии местных осложнений. О наличии или угрозе осложнения объективно свидетельствуют подъем СОЭ, лейкоцитоз и сдвиг формулы влево, лимфопения, в тяжелых случаях - анемия. При нормальном течении заживления эти показатели должны нормализоваться к 6-7-м суткам после операции.
Определенное диагностическое значение имеет формула Кальф-Калифа, характеризующая наличие или отсутствие инфильтратов в мягких тканях или внутриполостных. Я.Я.Кальф–Калиф эмпирически вывел формулу лейкоцитарного индекса инфильтрации - ЛИИ:
где Ми - миелоциты; Ю - юные, П - палочкоядерные, С - сегментоядерные нейтрофилы; Пл - плазматические клетки Тюрка; Л - лимфоциты; Мо - моноциты; Э - эозинофилы. В норме ЛИИ составляет 1,0-0,5.
Выделение микроорганизмов из стерильных в норме биологических субстратов имеет высокую диагностическую ценность в плане выявления микробной этиологии заболевания, а также в плане проведения дальнейшей этиотропной антибактериальной терапии и при необходимости противоэпидемических и профилактических мероприятий.
Кожные покровы и открытые раны являются сложными объектами для интерпретации результатов исследования, так как в норме не являются стерильными и густо заселены разнообразной микрофлорой. Проведение микробиологического исследования показано при наличии клинических признаков раневой инфекции и является обязательным диагностическим мероприятием. Объектом исследования являются как открытые гнойные раны, свищи, так и глубоко расположенные неоперированные гнойно-некротические поражения (абсцесс, флегмона и др.). Микробиологическое исследование проводят сразу же после выявления очага инфекции, при подозрении на него.
Материал для исследования при гнойно-воспалительных заболеваниях мягких тканей может быть получен различными путями. При открытых гнойных ранах материал отбирают стерильным тампоном, помещая его в транспортную среду. Более приемлемым, следует считать взятие для исследования биоптата, имеющего признаки гнойного воспаления. В случае закрытых гнойных процессов получают материал путем пункции гнойного очага или аспирации экссудата толстой иглой. При глубоких очагах инфекции неоценимую помощь оказывает УЗИ как в плане диагностики заболевания, так и для получения материала путем прицельной пункции для микробиологического исследования. При наличии обширных гнойных ран, имеющих различные патоморфологические изменения, образцы материала берут из нескольких участков.
Полученный материал, помещенный в стерильную пробирку, специальную транспортную среду или в шприце с закрытой иглой, желательно как можно быстрее доставить в бактериологическую лабораторию. Его сопровождают сведениями о больном и характере заболевания на специальном бланке.
Из каждого поступающего в лабораторию образца готовят мазок, которь окрашивают по Граму. Его микроскопируют, отмечая наличие и количество пол морфно-ядерных гранулоцитов и других клеток крови, количество и морфологи бактериальных клеток (кокки, палочки и др.) с указанием их окраски по Ipa.
Бактериоскопия мазка является чрезвычайно ценным методом исследования, который в течение короткого времени (до 1 ч) позволяет дать предварительные сведения о характере имеющейся микрофлоры в очаге инфекции. В некоторых случаях при выявлении характерной морфологии бактерий возможна родовая диагностика инфекции. Например, при обнаружении крупных грамположительных палочек с обрубленными концами можно с большой долей вероятности говорить о клостридиальной природе инфекционного поражения. Данные микроскопии служат ориентиром для назначения адекватной стартовой антибактериальной терапии.
Полученный клинический материал засевают на соответствующие питательные среды, проводят идентификацию бактерий с определением их родовой и видовой принадлежности. Само по себе обнаружение бактерий в ране не является подтверждением раневой инфекции. Данные бактериологического исследования всегда необходимо сопоставлять с клинической картиной заболевания. Этиологическая роль некоторых микроорганизмов в развитии инфекционного процесса может быть несущественна в результате простой колонизации раны данными бактериями.
При выделении ассоциации бактерий ведущее значение в течение гнойно-воспалительного процесса отдают более высоковирулентным видам, а при сходной степени вирулентности приоритетными признают виды, количественно преобладающие в ассоциации.
Открытые раны обычно очень быстро колонизируют внутрибольничные штаммы бактерий. У больных с системной воспалительной реакцией необходимо проводить неоднократные посевы крови.
До настоящего времени клиническая картина заболевания является основным методом диагностики анаэробной инфекции. Однако только микробиологическая диагностика с идентификацией возбудителя способна дать ответ об участии в патологическом процессе анаэробов. Между тем отрицательный ответ бактериологической лаборатории ни в коем случае не отвергает возможность участия анаэробов в развитии болезни, так как, по некоторым данным, около 50% анаэробов являются некультивируемыми.
Для диагностики анаэробной инфекции существуют современные высокоточные методы индикации. К ним в первую очередь относятся газожидкостная хроматография (ГЖХ) и масс-спектрометрия, основанные на регистрации и количественном определении метаболитов и летучих жирных кислот. Данные этих методов коррелируют с результатами бактериологической диагностики в 72%. Чувствительность ГЖХ составляет 91-97%, специфичность — 60-85%. К другим перспективным методам выделения возбудителей-анаэробов, в том числе из крови, относятся системы Lachema, Bactec, Isolator, окраска препаратов для обнаружения бактерий или их антигенов в крови акридиновым желтым, иммуноэлектрофорез, иммуноферментный анализ и другие.
Разнообразные микроорганизмы, заселяя практически любую природную среду, незримо сопутствуют человеку на протяжении всей его жизни. Обитая в почве, воде, воздухе, на растениях, на стенах жилых и производственных помещений, микроорганизмы постоянно контакт
Они широко распространены в окружающей среде: в почве, воде, в том числе в водопроводной и ключевой, в горячих минеральных источниках, на растениях, на каменистых породах и даже в пустынях. В организме человека актиномицеты сапрофитируют на коже, в ротовой полости, зубном налете, лакунах миндалин, верхних дыхательных путях, бронхах, на слизистой оболочке желудочно-кишечного тракта, влагалища, анальных складок и т. д.
Термин актиномицеты (устаревшее название лучистые грибки) распространяется в настоящее время на широкий круг грамположительных аэробных и микроаэрофильных бактерий, обладающих способностью к формированию ветвящегося мицелия с характерным спороношением, атакже палочек неправильной формы и кокковидных элементов, которые образуются в результате фрагментации мицелия.
К актиномицетам относятся бактерии родов Actinomyces, Actinomadura, Bifidobacterium, Nocardia, Micromonospora, Rhodococcus, Streptomyces, Tsukamurella и др.
Переходу актиномицетов из сапрофитического в паразитическое состояние способствуют снижение иммунозащитных сил организма, наличие тяжелых инфекционных или соматических заболеваний (хронической пневмонии, гнойного гидраденита, диабета и т. д.), воспалительные заболевания слизистых оболочек полости рта, респираторного и желудочно-кишечного тракта, оперативные вмешательства, длительное применение внутриматочных контрацептивов, переохлаждение, травмы и др.
В таких случаях развивается актиномикоз — хроническое гнойное неконтагиозное заболевание, обусловленное формированием характерных синюшно-красных, а затем багровых инфильтратов плотной консистенции с множественными очагами флюктуации и свищами с гнойным отделяемым в мягких и костных тканях практически любых локализаций. Длительность инкубационного периода может колебаться от 2–3 недель до нескольких лет (от времени инфицирования до развития манифестных форм актиномикоза).
Ведущим в развитии актиномикоза является эндогенный способ, при котором возбудитель проникает в ткани из мест его сапрофитического обитания, чаще всего через пищеварительный тракт и полость рта (кариозные зубы, десневые карманы, крипты миндалин). Наиболее благоприятные условия для внедрения актиномицетов создаются в толстой кишке, вследствие застоя пищевых масс и большей вероятности травматизации стенки. При экзогенном способе возбудители проникают в организм из окружающей среды аэрогенно или при травматических повреждениях кожи и слизистых оболочек.
Распространение актиномицетов из первичного очага поражения происходит контактным путем по подкожной клетчатке и соединительнотканным прослойкам органов и тканей. Возможен также и гематогенный путь при прорыве актиномикотической гранулемы в кровеносный сосуд.
В возникновении и формировании актиномикотического процесса также существенную роль играют сопутствующие аэробные и анаэробные бактерии. Большинство случаев актиномикоза обусловлены полимикробной флорой. Обычно наряду с актиномицетами выделяют Staphylococcus spp., Streptococcus spp., Fusobacterium spp., Capnocytophaga spp., Bacteroides spp., представителей семейства Enterobacteriaceae и др. Присоединение гноеродных микроорганизмов обостряет течение актиномикоза, изменяет его клиническую картину, способствует распространению процесса.
Клиническая картина актиномикоза разнообразна, встречается во всех странах в практике врачей различных специальностей (стоматологов, хирургов, дерматологов, гинекологов и др.). Основные локализации — челюстно-лицевая (до 80%), торакальная, абдоминальная, параректальная, мицетома (мадурская стопа). Кроме того, актиномикотические поражения проявляются не только в классическом виде с характерной инфильтрацией тканей, абсцессами и свищами, но и в виде доминирующей патогенной флоры неспецифического воспалительного процесса, осложняющего течение основного заболевания.
Актиномицеты могут играть активную роль в этиологии хронического тонзиллита. Небные миндалины колонизируются актиномицетами при хроническом тонзиллите и в ассоциации с другими бактериями часто провоцируют воспалительные реакции. Вследствие стоматологических процедур может возникнуть актиномикотическая бактеримия полости рта. В 30% случаев от 80% выявленных бактеримий определяется актиномикотическая природа стоматита, этиологическими агентами которого являются сапрофиты ротовой полости — A. viscosus, A. odontolyticus и A. naeslundi. Присоединяясь к местной патогенной флоре, актиномицеты способствуют развитию длительно незаживающего воспалительного процесса при угревой сыпи, трофических язвах, гиперемиях, мацерациях и мокнутиях на коже. Обладая высокой степенью колонизации кишечника, они являются одним из основных агентов дисбактериоза. Обобщая все вышеизложенное, нужно отметить, что бактерии из обширной группы актиномицетов могут фигурировать как участники любых инфекционных и воспалительных проявлений организма человека от дерматита до эндокардита.
Таким образом, актиномикоз, отличающийся многообразием локализаций и клинических проявлений, нужно своевременно диагностировать и возможно эффективно лечить, зная закономерности патогенетического развития, предрасполагающих факторов инфицирования, характеристик возбудителей и методов лечения.
Однако диагностика и лечение заболеваний, связанных с участием актиномицетов, являются предметами единичных специализированных лабораторий и клиник в мире. Трудности в их дифференциальной диагностике служат препятствием широкой известности этих микроорганизмов в клинической практике.
Диагностика актиномикоза
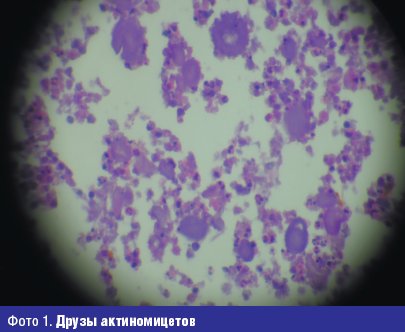
Друзы не образуются при нокардиозе. В тканях Nocardia обнаруживается в виде тонких нитей мицелия 0,5–0,8 мкм и палочковидных форм такой же толщины. Благодаря своей кислотоустойчивости Nocardia хорошо окрашивается по Граму–Вейгерту в синий цвет и по Цилю–Нильсену — в красный: все это позволяет проводить дифференциальную диагностику между актиномикозом и нокардиозом, т. к. это диктуется различием методов лечения при этих болезнях.
Важное значение для верификации актиномикоза любых локализаций имеет микробиологическое исследование, которое включает микроскопию и посев патологического материала на питательные среды. Оптимальная температура для роста 35–37°С.
При микроскопии клинического материала и выросших культур, окрашенных по Граму или метиленовой синькой, актиномицеты выглядят как ветвистые нити длиной 10–50 мкм или представлены полиморфными короткими палочками 0,2–1,0×2–5 мкм, часто с булавовидными концами, одиночные, в парах V- и Y-образной конфигураций и в стопках. Грамположительные, но часто окрашивание не типичное, в виде четок.
Многие аэробные актиномицеты хорошо растут на обычных бактериологических средах — мясо-пептонном, триптиказо-соевом, кровяном и сердечно-мозговом агарах. Для выявления микроаэрофильных видов используют тиогликолевую среду. Культуральные признаки актиномицетов весьма разнообразны. На плотных агаровых средах колонии по размерам напоминают бактериальные — диаметром 0,3–0,5 мм. Поверхность колоний может быть плоской, гладкой, бугристой, складчатой, зернистой или мучнистой. Консистенция тестовидная, крошковатая или кожистая. Многие актиномицеты образуют пигменты, придающие колониям самые различные оттенки: сероватые, синеватые, оранжевые, малиновые, зеленоватые, коричневые, черновато-фиолетовые и др.
Клинические аэробные изоляты, например Nocardia asteroids и Streptomyces somaliensis, на богатой питательной среде дают так называемый атипичный рост — плотные кожистые колонии, обычно не опушенные столь типичным для штаммов воздушным мицелием и без спороношения. Для проявления дифференцировки, образования характерных спор и пигментов требуются специальные среды: с коллоидным хитином, почвенным экстрактом или отварами растительных материалов.
За период 2007 года под нашим наблюдением находилось 25 больных с различными клиническими формами актиномикоза. Среди обследованных пациентов было 12 женщин и 13 мужчин (в возрасте 15–25 лет — 4 человека, 26–35 лет — 4 человека, 36–45 — 2, 46–55 — 5 человек и 56–66 лет — 10 человек).
Под нашим наблюдением находилась больная К., 43 лет с редким случаем первичного актиномикоза кожи мягких тканей паховых областей, свищевая форма.
Больна в течение 1 года, когда появились изменения в паховой области слева вследствие постоянного натирания кожи неудобным нижним бельем. К врачам не обращалась. Ухудшение в декабре 2007 г., когда появились 2 язвы, свищи с гнойным отделяемым. Консультирована дерматологом, который заподозрил неопластический процесс. Обследована онкологом, паразитологом. Диагноз онкологического или паразитарного заболевания установить не удалось. Направлена к микологу с подозрением на глубокий микоз. При осмотре: очаг поражения расположен в левой паховой области размером около 1,7×5 см, функционируют 2 свища со скудным гнойным и сукровичным отделяемым. Больная обследована в микологической лаборатории института им. Е. И. Марциновского ММА им. И. М. Сеченова на актиномикоз и бактериальную инфекцию. В исследуемом патологическом материале при микроскопии препаратов обнаружены актиномицеты, палочки, кокки, лептотрихии. При посеве гнойного отделяемого из свищей на питательные среды получен рост актиномицетов и кокковой флоры.
Диагноз актиномикоза кожи и мягких тканей верифицирован. Больная проходит наблюдение и лечение у миколога.
Больной Н., 24 лет с диагнозом угревая болезнь, актиномикоз (фото 2).
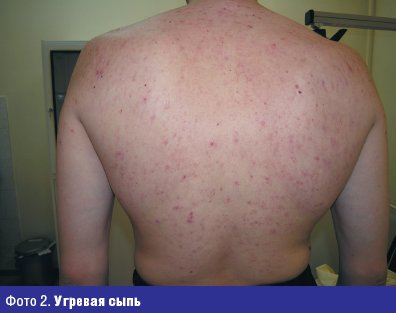
Жалобы на высыпания на коже туловища с детства. Достоверно можно говорить о давности заболевания 10 лет, когда в 14-летнем возрасте был установлен диагноз угревая болезнь. Больной лечился наружными средствами и антибиотиками различных групп с временным эффектом. Общее состояние в настоящее время осложнилось хроническим гастритом. При осмотре: кожа туловища, лица, спины поражены воспалительными элементами (папуло-пустулезная сыпь, открытые и закрытые комедоны), в некоторых местах сливного характера, инфильтрация кожи и мягких тканей. При микроскопическом исследовании себума из элементов угревой сыпи у больного обнаружены кокки и единичные палочки. В посеве из исследуемого материала в условиях микологической лаборатории (фото 3).
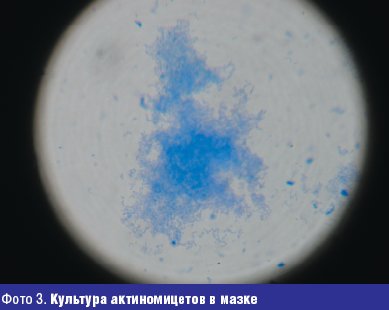
Диагноз: угревая болезнь, актиномикоз лица, туловища, спины кожи и мягких тканей вторичного характера, инфильтративная форма в стадии умеренно выраженного обострения. В настоящее время больному проводится лечение микологом в поликлинике института им. Е. И. Марциновского ММА им. И. М. Сеченова.
Лечение
Лечение больных актиномикозом проводится комплексное в различных сочетаниях в зависимости от локализации и клинических проявлений — препаратами йода, антибиотиками, иммунокоррегирующими и общеукрепляющими средствами, актинолизатом, проводят местное лечение мазями, физиотерапевтическими процедурами и хирургическим вмешательством.
Йодистые препараты (до 3 г йодистого калия в день), ранее доминирующие в терапии актиномикоза, в настоящее время могут применяться в комбинации с антибиотиками или рентгенотерапией, как дополнительное средство для размягчения и рассасывания инфильтрата.
При лечении актиномикоза также необходимо учитывать присоединяющуюся патогенную микрофлору, которая может проявлять повышенную резистентность к антибиотикам, что объясняется длительным предшествующим применением различных химиопрепаратов. С целью воздействия на сопутствующую флору используют метронидазол (Метрогил, Трихопол, Эфлоран) и клиндамицин (Далацин, Климицин). Хороший противовоспалительный эффект показывает применение сульфаниламидных препаратов (ко-тримоксазол, сульфадиметоксин, сульфакарбамид). При присоединении микотической инфекции назначают противогрибковые препараты: флуконазол, итраконазол, тербинафин, кетоконазол и др.
Общеукрепляющая терапия стимулирует реактивность организма и повышает эффективность иммунотерапии. Дезинтоксикационная терапия проводится внутривенными растворами Гемодеза, 5% раствором глюкозы и др. С целью активации регенерации применяется аутогемотерапия — еженедельно, всего на курс 3–4 переливания. Витамины назначают в среднетерапевтических дозах.
Иммунотерапия Актинолизатом способствует накоплению специфических иммунных тел и улучшает результаты лечения, позволяя снизить объем антибактериальных средств и избежать нежелательных побочных воздействий. Актинолизат вводят внутримышечно 2 раза в неделю по 3 мл, на курс 25 инъекций, курсы повторяют 2–3 раза с интервалом в 1 месяц.
В качестве местной терапии показано мазевое лечение с антибактериальными препаратами указанных групп, промывание свищей растворами антисептиков, препаратами фуранового типа, введение 1%, 2%, 5% спиртового раствора йода, которые способствуют очищению актиномикозных очагов и ликвидации воспалительных явлений.
Физиотерапевтические процедуры. В стадии формирования очага проводят электрофорез кальция хлорида и Димедрола. После вскрытия очагов при остаточных инфильтратах назначают электрофорез йода, Лидазы, флюкторизацию. Ультразвук применяется непосредственно на область очага поражения по общепринятой схеме в течение 12–25 дней (в зависимости от состояния больного и очага поражения) с интервалами в 3–4 месяца.
Хирургическое лечение проводится на фоне консервативной терапии и заключается в радикальном иссечении очагов поражения в пределах видимо здоровых тканей. При невозможности проведения радикальной операции (например, при шейно-челюстно-лицевом актиномикозе) показано вскрытие и дренирование очагов абсцесса.
Читайте также:


