Минеральные и костные нарушения при хронической болезни почек
Продолжаю лекцию по принципам консервативного лечения в нефрологии, размещение которой в свободном доступе приурочено к Всемирному дню почки. Во второй части (1 часть доступна здесь) давайте рассмотрим отдельные аспекты минеральных и костных нарушений при хронической болезни почек, в частности, важность ограничения в питании фосфат-содержащих продуктов, их влияние на развитие множественных гормональных сдвигов у пациентов с ХБП. Во многом эта тема перекликается с нефармакологическим диетическим лечением, а отчасти затрагивает те принципы консервативного лечения, которые связаны с назначением лекарственной терапии (и которая будет рассмотрена в третьей части лекции).
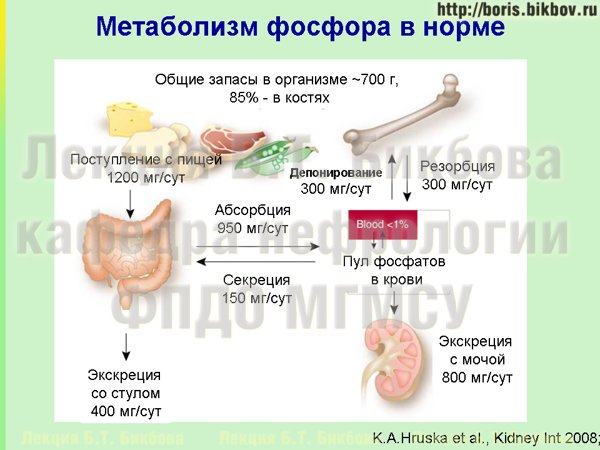
На этой схеме приведены основные аспекты метаболизма фосфатов в организме. За сутки с продуктами питания, которые мы едим, поступает примерно 1,2 грама фосфатов, и порядка 1 грама абсорбируется в кишечнике. Порядка 300 мг фосфатов в сутки динамически откладывается и высвобождается из костей, и в норме поддерживается нейтральный баланс между этими процессами. При нормальной функции почек значительная часть фосфора, которая поступает в организм, порядка 800 мг экскретируется почками с мочой, а около 200 мг экскретируется с калом за счет насосов, которые имеются в стенке кишечника.
У пациентов с хронической болезнью почек по мере снижения почечной функции уменьшаются и возможности экскреции фосфатов с мочой.
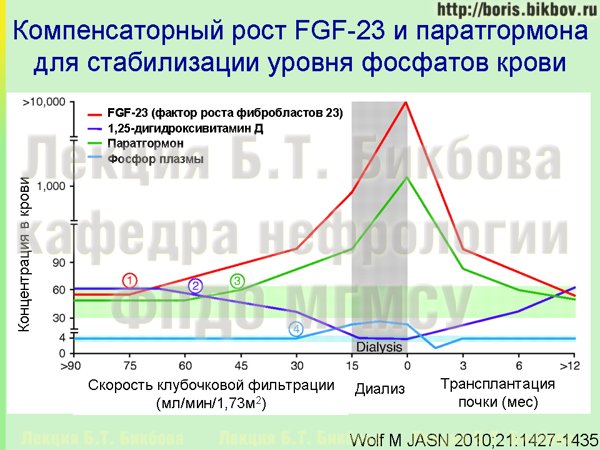
Следует сказать, что на довольно длительном промежутке времени не происходит повышения уровня фосфатов крови, несмотря на снижение скорости клубочковой фильтрации. Причины этого отражены на слайде, возможно он при первом взгляде выглядит несколько сложно, поэтому давайте остановимся на нем подробнее. На этой схеме по горизонтали показано развертывание во времени разных гормональных изменений у больного ХБП — в частности, снижение скорости клубочковой фильтрации, начало диализа, трансплантация почки. А линиями разного цвета показаны траектории изменения уровня фосфатов крови (светло-синяя линия), кальцитриола (темно-синяя линия), фактора роста фибробластов 23 (красная линия) и паратгормона (зеленая линия). График, конечно же, усредненный, но позволяет продемонстрировать основные закономерности изменения уровня этих субстанций, и их взаимное влияние.
Как уже было сказано, при снижении суммарной скорости клубочковой фильтрации происходит задержка фосфатов, и это активирует механизмы увеличения экскреции фосфатов — в частности, отмечается увеличение синтеза фактора роста фибробластов 23, который обладает фосфат-уретическим действием. Поэтому содержание фосфатов в плазме крови остается нормальным, однако уже на этой стадии ХБП отмечается рост концентрации фактора роста фибробластов 23, другой точкой приложения которого является сердечная мышца, и он же приводит к подавлению синтеза кальцитриола. По мере снижения СКФ концентрация фактора роста фибробластов 23 увеличивается еще больше, для того чтобы обеспечить еще большую стимуляцию выведения фосфатов с мочой, и поддержание концентрации фосфатов крови в нормальных пределах. Однако при этом увеличивается и подавление синтеза кальцитриола, и стимуляция гипертрофии миокарда. Поэтому следует помнить, что еще при достаточно сохранной функции почек и нормальном содержании фосфатов в крови, в действительности уже запускаются повреждающие механизмы, связанные с перегрузкой фосфатами.
Уровень фосфатов в крови у пациентов ХБП повышается обычно только на поздних стадиях, при крайне выраженном снижении скорости клубочковой фильтрации менее 40-30 мл/мин, когда эти механизмы компенсации увеличения экскреции фосфатов с мочой исчерпаны.
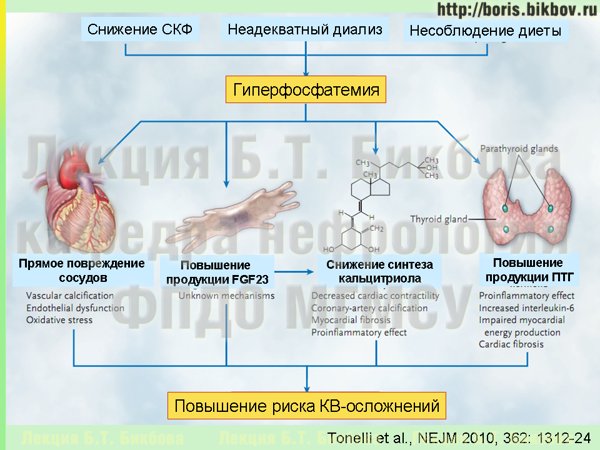
И если из-за невозможности выведения фосфатов почками и недостаточности других механизмов экскреции фосфатов происходит повышение уровня фосфатов в крови, то это приводит к целому ряду негативных последствий. Таким образом, избыточное поступление фосфатов с пищей и/или его недостаточное выведение являются теми пусковыми факторами, которые запускают весь каскад минеральных и костных нарушений при хронической болезни почек.
Гиперфосфатемия, а также повышенный уровень фактора роста фибробластов 23, запускают активацию паращитовидных желез — начинается развитие вторичного гиперпаратиреоза, одного из осложнений, которое выявляется у значительной части пациентов с ХБП поздних стадий. Гиперфосфатемия уменьшает и синтез кальцитриола и обуславливает развитие дефицита Д-гормона. Дефицит Д-гормона, в свою очередь, приводит к ослаблению контроля над синтезом паратиреоидного гормона и развитию вторичного гиперпаратиреоза, и этот же дефицит Д-гормона вызывает перестройку костной ткани, которая обуславливает повышенную частоту переломов у больных с поздними стадиями ХБП. Все эти неблагоприятные метаболические нарушения также дают развитие экстрасальной кальцификации (т.е. отложения кальция вне костной ткани), в том числе и в коронарных артериях. Совместно, за счет разных механизмов, которые мы сейчас подробно разбирать не будем, все эти факторы приводят к повышению риска сердечно-сосудистых осложнений.
Конечно же, возникает вопрос: что делать? Если у нас почки недостаточно эскретируют фосфаты, и исчерпан лимит увеличения выведения фосфатов через кишечник, то надо пациенту уменьшать употребление фосфора с едой, а если этого недостаточно — назначать фосфатбиндеры.

Проблема с ограничением поступления фосфора с пищей состоит в том, что в продуктах с высоким содержанием фосфора, чаще всего также и высокое содержание белка. И если мы ограничим эти продукты в рационе пациента, то с течением времени у него может развиться белково-энергетическая недостаточность, что будет иметь негативные последствия. Этого нельзя допускать. Поэтому надо мониторировать у пациента с ХБП развитие белково-энергетической недостаточности — безотносительно того, назначаете ли вы малобелковую диету или не назначаете. В любом случае, у больного с поздними стадиями хронической болезни почек обязателен активный мониторинг ряда маркеров белково-энергетической недостаточности.

Если говорить о конкретных продуктах питания, то у пациентов с повышенным уровнем фосфатов крови имеет смысл ограничивать в диете продукты с высоким соотношением фосфатов к белку. Хотя фосфаты содержатся в тех же продуктах, что и белок, но в ряде продуктов фосфатов гораздо больше, а в ряде продуктов их меньше при том же количестве белка. По таблицам продуктов пациент может посмотреть на этот коэффициент соотношения фосфатов к белку, и выбрать — какие продукты можно есть, а что лучше не есть, какие продукты надо ограничить или исключить полностью в зависимости от того, какое у него содержание фосфатов крови, какие у него другие показатели.
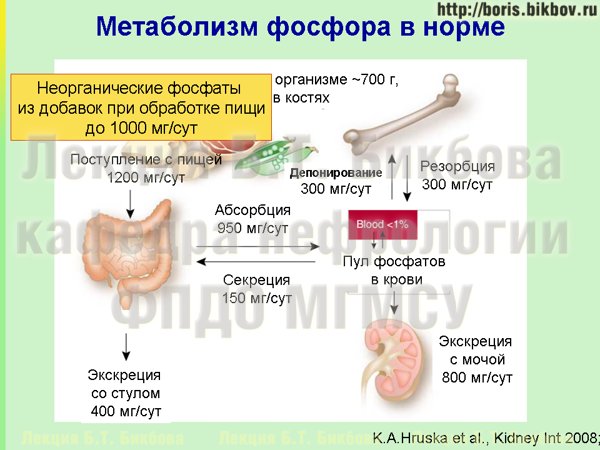
Важным источником фосфатов, поступающих с пищей, являются неорганические фосфаты. То поступление фосфатов с продуктами питания (1200 миллиграм в сутки), о которых мы говорили ранее — оно происходит за счет присутствия в рационе в мяса, рыбы, злаковых, сыров, и т.д. — то есть органической пищи, которая естественным образом получается. Однако в процессе приготовления пищи, в промышленных условиях в пищу добавляются неорганические фосфаты. Зачем это делается? Это делается для того, чтобы фосфаты притягивали воду и при этом увеличивался общий вес продукта. Покупая в магазине мясо, курицу, рыбу и т.д., мы должны понимать, что довольно часто в действительности мы покупаем не 1 кг мяса, а условно 900 грамм мяса, а остальные 100 грамм – это фосфаты с водой. К сожалению, во многих странах, включая и Россию, добавление фосфатов в продукты питания не указывается на упаковке, потому что этого не требует законодательство. С той же целью, но в еще больших количествах, неорганические фосфаты добавляются в сосиски, колбасы и прочие готовые продукты — для увеличения содержания в них воды. Поступление неорганических фосфатов с пищей может быть очень существенным, вплоть до 1000 миллиграм в сутки — то есть почти столько же, сколько поступает фосфатов с едой из органических продуктов. Особенностью неорганических фосфатов является практически полное всасывание их растворимых форм в кишечнике, и в организме человека неизвестны механизмы, которые бы регулировали всасывание неорганических фосфатов, тогда как для органических фосфатов (связанных с фосфолипидами и белком) такие механизмы существуют. Поэтому неорганические фосфаты практически полностью подвергаются абсорбции в кишечнике, поступают в кровоток, и почки должны усиленно работать для их выведения из организма.
При сниженной почечной функции фосфатный баланс становится положительным, запускаются все механизмы, о которых мы говорили выше, что связано с неблагоприятными исходами, с теми же кардиоваскулярными осложнениями. И если у пациента отмечается повышенный уровень фосфора в крови, то оптимальным будет переход на приготовленную самим пищу, поскольку если пациент берет курицу, мясо или рыбу и готовит ее сам, а не покупает готовые рыбные или мясные продукты в магазинах, то он уменьшает тем самым потребление неорганических фосфатов. Надо сказать, что влияние поступающих с пищей неорганических фосфатов показано не только для пациентов с ХБП, но и в отношении общей популяции. Поэтому даже в отношении здорового человека, если есть такая возможность, то лучше ограничить потребление промышленно приготовленных продуктов с фосфат-содержащими добавками для того, чтобы избежать негативных последствий и прогноз здорового человека сделать более благоприятным.

На этом слайде перечислены фосфат-содержащие добавки — различные дифосфаты, трифосфаты, пирофосфаты, и соответствующие им сокращения — с Е388 по Е341, и Е450, Е451, Е452. К сожалению, значительная часть продуктов с добавлением неорганических фосфатов не маркируется, но часть производителей это делает. Кроме того, в ряде стран законодательно регулируется необходимость указания этой информации в составе продуктов, поэтому перечисленные здесь названия можно увидеть на тех продуктах питания, которые представлены и у нас в России. Поэтому, если пациент с хронической болезнью почек видит эти сокращения в тех или иных продуктах, то лучше избегать их употребления.
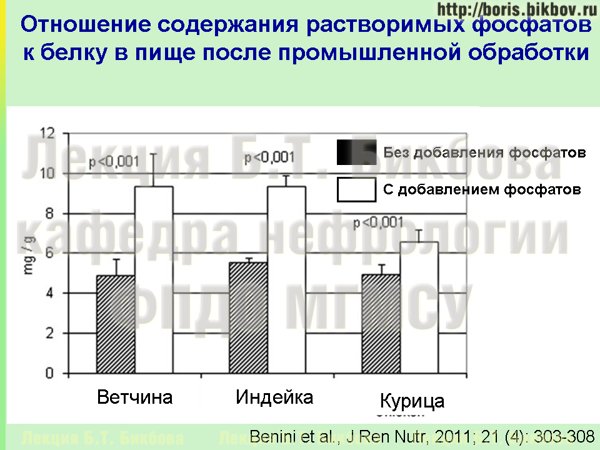
Если смотреть, насколько общее содержание фосфатов может быть увеличено за счет этих добавок, то на этом слайде приведен пример для ветчины, индейки и курицы. Они были сперва куплены как обычное свежее мясо, и впоследствии были приготовлены с добавлением неорганических фосфатов по обычной процедуре, которая применяется в промышленности. Видно, что содержание растворимых неорганических фосфатов по сравнению со свежим мясом в 1,5-2 раза повышается, может, в данном случае для курицы чуть меньше, но, тем не менее, повышается.
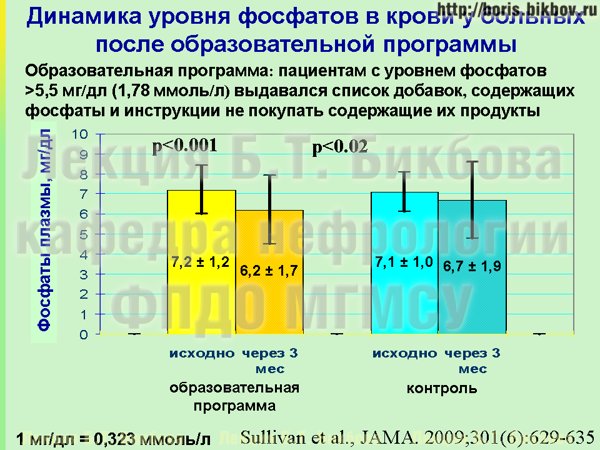
Можно ли с этими неорганическими фосфатами как-то бороться? Всего лишь одно исследование имеется по результатам вмешательства по данному вопросу. Это исследование у больных на гемодиализе. Пациентов, у которых уровень фосфатов превышал рекомендованные значения – 1,8 миллимоль на литр – разделили на 2 группы в одном из отделений диализа. Пациентам одной группы сказали: есть такие неорганические фосфаты, они содержатся в определенных добавках, и во многих промышленно приготовленных продуктах. Выдали пациентам этой группы список фосфат-содержащих добавок и маленькие линзочки, чтобы пациенты при походе в магазин, перед тем как купить продукт — читали состав, который на нем написан, и, соответственно, исключали продукты с явным содержанием неорганических фосфатов. Пациентам второй группы ничего не говорили, и они продолжали питаться так же как и раньше.
Что получилось через 3 месяца? Результаты отражены на слайде. Исследование было проведено в США, у них фосфаты измеряются в мг на децилитр, коэффициент конверсии в привычные нам ммоль на литр – 1 мг на децилитр составляет почти 0,3 миллимоль на литр. Отчетливо видно, что через 3 месяца после этой образовательной программы у пациентов удалось снизить уровень фосфатов в крови практически на 1 мг/децилитр, т.е. на 0,3 миллимоль на литр. Такое выраженное снижение было достигнуто фактически после однократного объяснения и при возможности раз в месяц позвонить медсестре, которая их могла проконсультировать — и это очень хороший результат, полученный малыми усилиями.
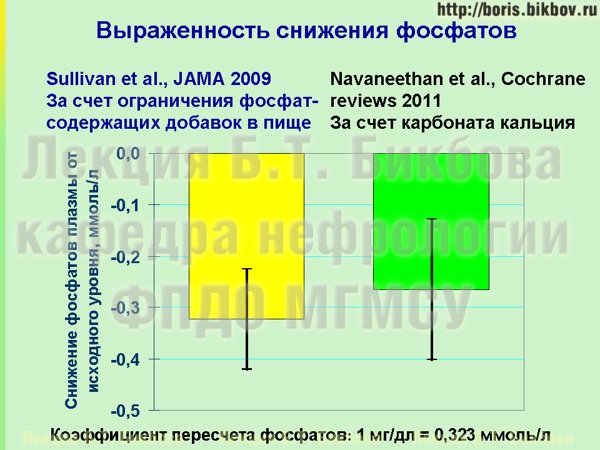
Это очень существенный показатель, который сопоставим со снижением уровня фосфатов в крови, которого мы можем добиться за счет назначения фосфатбиндеров. На этом слайде приведены результаты двух исследований. Желтый столбик – это как раз снижение уровня фосфатов в крови у пациентов за счет ограничения неорганических фосфатов, я в данном случае их уже перевел в миллимоли на литр. Зеленый столбик – это результаты Кокрановского мета-анализа с включением нескольких тысяч пациентов, это то снижение уровня фосфатов в крови, которого можно добиться за счет назначения карбоната кальция. Вы видите, что они практически сопоставимы, а главное, их можно комбинировать. Если заинтересованный в собственном здоровье пациент может ограничить поступление неорганических фосфатов за счет исключения из рациона соответствующих продуктов и перехода на преимущественное приготовление пищи дома, и при этом удается добиться нормального содержания фосфатов в крови, то такому больному можно даже не назначать препараты фосфатбиндеров. Но даже если только за счет диеты не удается нормализовать уровень фосфатов крови, то по крайней мере за счет диеты удается добиться существенного уменьшения принимаемого количества фосфатбиндеров. К сожалению, достаточно часто об этом пациенты не знают, а в отделениях диализа и нефрологии очень редко работает врач-диетолог, который может подробно пациенту об этом рассказать.

То, что мы обсудили по натрию, по фосфатам, по физической активности, практически было демонстрацией тех принципов консервативного лечения в отношении немедикаментозной терапии и постулата о лечения больного, а не болезни. Принципы консервативного лечения, конечно же, не ограничиваются только темой диеты и спорта. Безусловно, важнейшей составляющей любого лечения является медикаментозная терапия, о которой мы поговорим в третьей части лекции.
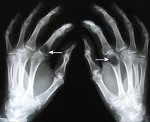
Почечная остеодистрофия – это изменение морфологии костей у пациентов с хроническим заболеванием почек, вызванное нарушением минерально-костного обмена. Симптомы включают патологические переломы, костные боли, деформацию скелета. Диагностика основана на данных биопсии, рентгенографии, денситометрии, КТ и МРТ, маркерах костного обмена. Лечение подразумевает коррекцию кальций-фосфорного обмена: назначают метаболиты витамина Д, фосфат-связывающие средства. При отсутствии эффекта возможно выполнение паратиреоидэктомии, в исключительных случаях производят трансплантацию почки.
МКБ-10
- Причины
- Патогенез
- Классификация
- Симптомы почечной остеодистрофии
- Осложнения
- Диагностика
- Лечение почечной остеодистрофии
- Медикаментозное лечение
- Хирургическое лечение
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Термин почечная остеодистрофия используется с 1943 года, когда была выявлена связь между костными изменениями и ХПН. В 2006 году предложено название МКН-ХБП (минерально-костные нарушения, связанные с хронической болезнью почек), патологию стали рассматривать как прогрессирующее осложнение почечной недостаточности. Нарушение присутствует у большинства пациентов с ХБП при снижении скорости клубочковой фильтрации ниже 50%, у 90-100% больных (взрослых и детей) с терминальной стадией ХПН, находящихся на заместительной терапии. Риск переломов по сравнению с общепопуляционным повышается в 4-5 раз. У пациентов старше 60 лет метаболическую остеопатию регистрируют в 3 раза чаще.

Причины
В норме костная ткань постоянно ремоделируется, а почки поддерживают нормальный уровень фосфора и кальция в крови. При гипокальциемии любого генеза паращитовидные железы выделяют гормон, который провоцирует вымывание минерала из костей, что приводит к их деминерализации. Почечная остеодистрофия – один из признаков хронической почечной недостаточности, которая является исходом многих урологических и нефрологических патологий. Поэтому заболевания, вызывающие ХПН, одновременно считают триггерами нарушения костного метаболизма:
- Врожденные и наследственные болезни. Поликистоз почек, синдром Альпорта и врожденная гипоплазия часто осложняются почечной недостаточностью с развитием метаболической остеопатии. Для этих патологий типичен отягощенный семейный анамнез. Частота встречаемости 0,5-3%. В большинстве наблюдений клинические проявления остеодистрофии присутствуют с детства (почечный рахит).
- Гломерулярные патологии. Включают первичные гломерулонефриты, вторичную гломерулярную болезнь почек, характерную для системной красной волчанки, диабетической нефропатии и геморрагических васкулитов. Сахарный диабет является одной из наиболее частых причин утраты функциональной способности почек, на его долю приходится 44%, на гломерулярную патологию – 8% случаев.
- Сосудистые заболевания. Атеросклероз и системный склероз с поражением почек нарушают кровоснабжение, вызывают ишемию тканей, следствием чего становится прогрессирующая гибель нефронов. Гипертоническая болезнь, осложненная нефропатией, в 30% случаев приводит к ХПН и метаболической болезни костной ткани. Остеодистрофия сочетается с серьезными осложнениями со стороны сердечно-сосудистой системы, сопряженными с высокой летальностью.
- Тубулоинтерстициальные болезни. Тубулоинтерстициальный нефрит, который прогрессирует до ХПН с нарушениями метаболизма костей, может носить идиопатический, лекарственный или иммунологический характер. Мочеполовой туберкулез, шистосомоз, нефрокальциноз также проявляются постепенной утратой функциональных структур почки. Применение противовирусных лекарств для лечения гепатита В, ВИЧ-инфекции связано с дисфункцией канальцев и гипофосфатемической остеомаляцией.
- Состояния, сопровождающиеся обструкцией. Мочекаменная болезнь, гиперплазия предстательной железы, опухоли малого таза и забрюшинный фиброз характеризуются нарушением адекватной уродинамики. Застой мочи способствует размножению бактериальной микрофлоры, развитию рецидивирующего вторичного пиелонефрита с гидронефротической трансформацией чашечно-лоханочной системы. При двустороннем поражении присоединяется ХБП, запускающая процессы остеодистрофии.
К утяжеляющим факторам относят неправильное питание, приводящее к гиповитаминозу витамина D, состояние постменопаузы, сопровождающееся нарушением минерального обмена, вредные привычки. К ренальной остеопатии предрасполагает пожилой возраст, неадекватный прием кальцитриола. У больных, принимающих антациды по поводу язв ЖКТ или получающих заместительную почечную терапию, в организме накапливается алюминий. Это является дополнительной причиной остеомаляции на фоне ингибирования активности остеобластов.
Патогенез
Почечная остеодистрофия описывается как результат гиперпаратиреоза, вторичной гиперфосфатемии с гипокальциемией, провоцируемых снижением экскреции фосфатов поврежденными почками. Наиболее важной причиной снижения уровня кальцитриола при ХПН является высокий уровень фактора роста фибробластов 23 (FGF23, фосфатонин), который вырабатывается остеоцитами и остеокластами в ответ на гиперфосфатемию. Соединение способствует уменьшению реабсорбции фосфора в проксимальных канальцах нефрона, блокирует активность 1-альфа-гидроксилазы.
1-альфа-гидроксилаза влияет на трансформацию 25(OH)D в 1,25(OH)2D и уменьшение всасывания витамина D стенками кишечника. Этот компенсаторный механизм поддерживает уровень фосфатов в норме при их усиленной экскреции с мочой. Поскольку большое количество FGF23 необходимо для поддержания нормального уровня сывороточного фосфора, синтез кальцитриола подавляется, что провоцирует снижение абсорбции Са, гипокальциемию. Этому же способствует деструкция проксимальных канальцев (место образования кальцитриола), ацидоз на фоне уремии, снижение запасов субстанций для выработки активного гормона.
Гипокальциемия поддерживается еще одним компенсаторным механизмом – усилением секреции паратиреоидного гормона. Его чрезмерная выработка увеличивает скорость резорбции, приводит к изменениям структуры скелета за счет вторичного гиперпаратиреоза. Прогрессирование ренальной дисфункции с гиперфосфатемией стимулирует гиперплазию паращитовидных желез, гиперсекрецию паратиреоидных гормонов, что постепенно ведет к развитию аденомы. Усиленный обмен и ремоделирование кости заканчиваются нарушением ее архитектоники, минерализации, утратой прочности.
Классификация
В основе систематизации патологии лежит оценка результатов гистологического исследования биоптатов костной ткани. Выделяют три основополагающих процесса, обозначаемых английской аббревиатурой TMV: интенсивность метаболизма (низкий, нормальный, высокий), минерализацию кости (нормальная, нарушенная), объем (низкий, в норме, высокий). Классификация была предложена экспертами в 2009 году, основана на корреляции между активностью обменных процессов костной ткани, морфологическими изменениями и содержанием в крови интактного паратиреоидного гормона. Почечная остеодистрофия, связанная с ХБП, может протекать:
- С увеличением процессов метаболизма. Клинические проявления включают фиброзный остеит, вторичный гиперпаратиреоз. Другое название – гиперпаратиреоидная болезнь костей.
- Со снижением обменных процессов. Группа включает адинамическую болезнь скелета, остеомаляцию (деминерализация костного вещества, не сопровождающаяся выраженным изменением белкового синтеза в матриксе и приводящая к размягчению кости).
- В комбинированном варианте. Комбинированная форма сочетает умеренный вторичный гиперпаратиреоз (ВГПТ) и остеомаляцию.
К наиболее распространенным формам почечной остеопатии относят фиброзный остеит и смешанную остеодистрофию (высокий метаболизм), умеренный ВГПТ (нормальный костный метаболизм), адинамическую костную болезнь и остеомаляцию, для которой характерен низкий уровень обмена. Фиброзный остеит считается классическим проявлением ВГПТ и уремии, встречается в 40%. Остеомаляция и сочетанная форма обнаруживаются менее чем в 10% биоптатов. На долю адинамической болезни, по разным источникам, приходится от 15-60%.
Симптомы почечной остеодистрофии
Патология включает признаки вторичного гиперпаратиреоза, рахита, остеомаляции и остеопороза. Рахит с остеомаляцией встречаются у детей, вторичный гиперпаратиреоз с остеомаляцией – у взрослых. Клиника вариативна, зависит от формы ренальной остеодистрофии. Заболевание долгое время протекает бессимптомно. В последующем пациенты предъявляют жалобы на суставные боли, усиливающиеся при движении, костную ломоту. При накоплении кальция в хрящах отмечается ограничение объема движений из-за утраты эластичности суставных поверхностей, появляется утиная (переваливающаяся) походка.
Кальцификация стенки поверхностных сосудов вызывает кальцифилаксию, что проявляется очагами некроза на коже. Процесс сопровождается кожным зудом, который может быть временным или постоянным. Кальций отвечает за нервно-мышечную передачу, ее нарушение проявляется мышечной слабостью, которая постепенно прогрессирует, распространяясь на верхние конечности. Со стороны нервной системы обнаруживается апатия, постоянная сонливость, ухудшение памяти. Сердечно-сосудистые проявления представлены загрудинной болью, одышкой, тахикардией.
Осложнения
К осложнениям относят переломы и деформации костей, разрывы сухожилий. Со стороны сердца регистрируют очаговые изменения миокарда, клиника напоминает инфаркт. Острый гиперкальциемический криз – неотложное состояние, которое требует немедленной госпитализации и развивается при достижении уровня Са выше 3,5 нмоль/л. Для него характерны резкая слабость, изменение сознания, абдоминальные боли, сопровождаемые неукротимой рвотой. ЭКГ фиксирует нарушение ритма, блокады.
Как осложнения рассматривают кальцификации сосудов, приводящие к атеросклерозу, гипертонии, застойной сердечной недостаточности. Отложение кальцинатов в легких может стать причиной дыхательной недостаточности. Почечная остеодистрофия с низким метаболизмом часто сопровождается тяжелой анемией, устойчивой к лечению эритропоэтином. При этом страдает общее самочувствие, значительно ухудшается качество жизни. У детей вследствие нарушенного минерального обмена развивается карликовость, О-образные и Х-образные деформации нижних конечностей.
Диагностика
Диагноз устанавливают на основании жалоб, данных физикального осмотра, оценки результатов лабораторных и инструментальных исследований. Наиболее информативна биопсия костной ткани, но вмешательство рекомендовано не всем пациентам из-за инвазивности. Процедуру осуществляют в специализированных клиниках для исключения адинамической формы патологии, в спорных ситуациях или при решении вопроса о целесообразности операции. К инструментальным и лабораторным способам диагностики остеодистрофии на фоне болезни почек относят:
- Рентгенографию. Первичный способ визуализации, используемый для оценки состояния костной ткани у пациентов, страдающих нефрологическими и урологическими заболеваниями. Рентгенограммы визуализируют переломы, специфические изменения скелета при остеодистрофиях. Из-за лучевой нагрузки методика имеет ограничения по количеству исследований, особенно в детском возрасте.
- Денситометрию. Обычно выполняют двухэнергетическую рентгеновскую абсорбциометрию в поясничном отделе позвоночника, проксимальном отделе бедренной кости и дистальном отделе предплечья. Исследование показывает изменения, типичные для остеопении и остеопороза, позволяет спрогнозировать риск переломов. Процедуру повторяют в динамике для оценки плотности костей на фоне проводимой терапии. Показаниями к денситометрии также являются ХПН, планируемый гемодиализ или трансплантация.
- МРТ и КТ. Назначаются при недостаточной информативности других методик. Компьютерная томография обеспечивает высококачественную визуализацию патологических изменений скелета, которые не выявляются при выполнении обычной рентгенографии. МРТ дает возможность оценить состояние прилегающих тканей: сухожилий, связок, хрящей.
- Лабораторные анализы. Оценка костного метаболизма позволяет судить о степени ремоделирования ткани. Уровень Са обычно низкий, сывороточный Р выше нормы (зависит от стадии ХБП). Щелочная фосфатаза повышена из-за остеобластической активности. Лучшим неинвазивным вариантом диагностики подтипов почечной остеодистрофии является определение уровня ПТГ для оценки костного метаболизма.
Дифференциальную диагностику проводят с миеломной болезнью, остеопорозом внепочечной этиологии, резорбтивной остеомаляцией на фоне дефицита витамина D. Основным критерием является сохранность почечной функции, мочевина и креатинин, как правило, не превышают нормы или снижены незначительно. Причиной остеомаляции иногда служит идиопатическая гиперкальциурия, не связанная с ацидозом. Ученые предполагают, что усиленная потеря Са происходит из-за сопутствующего пиелонефрита с аномальным строением канальцев.
Лечение почечной остеодистрофии
Заместительная терапия без других методик не может устранить нарушения фосфорно-кальциевого обмена и предотвратить костную патологию при терминальной уремии. Поддержка электролитного баланса включает назначение препаратов, которые способствуют обеспечению максимально близкого к норме уровня сывороточного кальция, фосфора, подавляют активность паратиреоидных желез. Адекватное лечение ренальной остеодистрофии во многом определяет качество жизни больных.
Огромное значение имеет диета, поскольку именно с пищей поступает большинство минералов. Гиперфосфатемию предупреждают ограничением продуктов, содержащих большое количество белка (мясо, молоко, яйца). Концентрацию кальция важно поддерживать на верхней границе нормы, для этого в рацион включают темно-зеленые овощи, тофу, цитрусовые, по показаниям дополнительно вводят кальциевые добавки. Соотношение Са и Р должно составлять 1:1. Врач постоянно контролирует электролиты крови, гормональный профиль, корректируют схему терапии.
Выбор того или иного препарата производится с учетом формы остеодистрофии, стадии хронической болезни почек, тяжести вторичного гиперпаратиреоза. При подборе учитывают побочные эффекты от приема медикаментов, выявляющиеся у пациента. К основным группам лекарственных средств относят:
- Фосфатбиндеры (связыватели фосфора). Кальция карбонат и кальция ацетат назначаются с начальных стадий ХПН, препятствует всасыванию фосфата в ЖКТ. Их прием особенно актуален при гемодиализе. При неэффективности пересматривают подход к ЗПТ: увеличивают площадь поверхности диализирующей мембраны, продолжительность процедуры, количество сеансов. Используемые ранее препараты на основе гидроокиси алюминия сейчас утратили актуальность из-за риска накопления соединения и связанных с этим осложнений. Их лучшей альтернативой является севеламер.
- Средства с витамином Д. Кальцитриол и альфакальцидол способствуют снижению активности паратиреоидных желез. При ЗПТ их применяют для профилактики и лечения вторичного гиперпаратиреоза. Персистирующая гипокальциемия с нормальными показателями фосфорного обмена корректируется путем назначения витамина D, который усиливает всасывание Са. На фоне приема уменьшается болевой синдром, усиливается минерализация костной ткани, особенно при фиброзно-кистозном остите.
- Бисфосфонаты. Опыт использования медикаментов этой группы недостаточен, есть данные, что препараты предотвращали костную деминерализацию после пересадки почки. ЗПТ и прием метаболитов витамина Д для коррекции вторичного гиперпаратиреоза иногда осложняется стойкой гиперкальциемией. Бисфосфонаты в таких случаях способствовали нормализации состояния, хорошо выводились из организма с помощью гемодиализа.
Удаление ткани паратиреоидных желез показано, если ПТГ превышает 800 пг/мл в течение 3 месяцев, несмотря на консервативную терапию и принятые меры: отмену витамина Д, отказ от использования диализирующего раствора с высоким содержанием Са, соблюдение диеты. Возвратная гиперкальциемия, появление ишемических некрозов, изнуряющий кожный зуд также требуют хирургического лечения. Вмешательство обосновано перед трансплантацией почки, поскольку послеоперационный период сопровождается гиперкальциемией. Наиболее часто выполняют субтотальную паратиреоидэктомию.
Прогноз и профилактика
При своевременной терапии почечная остеодистрофия поддается коррекции. Тяжесть состояния определяется стадией почечной недостаточности; после трансплантации почки прогноз для жизни более оптимистичен. Значительное улучшение самочувствия наблюдается при субтотальной резекции паращитовидных желез – минерализация усиливается через 3-6 месяцев после операции, в течение 10 дней купируется костно-суставной болевой синдром, увеличивается мышечная сила.
Профилактика подразумевает выявление гиперпаратиреоидных состояний, отказ от курения и злоупотребления алкоголем, правильное питание. Превентивные меры для пациентов на ЗПТ включают прием витамина Д после каждого сеанса гемодиализа. При первых симптомах неблагополучия со стороны органов мочевыделения важно сразу обратиться к урологу или нефрологу, что позволит диагностировать патологию на ранней стадии. Адекватное лечение помогает предотвратить или максимально отсрочить развитие почечной недостаточности, а следовательно – и остеодистрофии.
Читайте также:


