Молекулярно-биологический метод для диагностики инфекционных заболеваний
Молекулярно-биологические исследования – группа методов, предназначенных для детекции в биологическом материале нуклеиновой кислоты (РНК, ДНК).
В основе молекулярно-биологических исследований лежит воспроизведение механизма дублирования наследственной информации в геноме. Последовательность нуклеотидов в одиночной цепи ДНК или РНК закономерно воспроизводится в последовательности нуклеотидов комплементарной цепи благодаря исключительным биологическим свойствам азотистых оснований и специфических ферментных систем.
Технология амплификации, то есть производства множества копий ДНК из участка искомой ДНК или РНК, в клинико-диагностических лабораториях наиболее широко используется в формате полимеразной цепной реакции (ПЦР).
Организация лаборатории для ПЦР и правила работы регламентируются нормативными документами. Требования к площади: 2 – 3 несмежных помещения общей площадью не менее 20-30 м 2 , оснащенных водопроводом и приточно-вытяжной вентиляцией. В случае использования электрофореза для разделения ампликонов, три процедуры (подготовка анализируемых проб, амплификация и детекция результатов) должны быть физически изолированы друг от друга для предотвращения контаминации, и проводиться в разных помещениях, оснащенных предбоксами. Работа проводится в лабораторной одежде, сменяемой при переходе из одного помещения в другое.
ПЦР-диагностика включает следующие этапы:
¨ подготовка образца для тестирования;
¨ постановка и проведение собственно ПЦР (проведение реакции, направленной на накопление объекта исследования – амплификация);
¨ оценка результата (детекция ампликонов).
Подготовка образца для тестирования включает взятие материала и выделение мишеневой ДНК. Для проведения ПЦР необходимо выбрать биологический материал, с наибольшей вероятностью содержащий искомую ДНК (РНК). При этом для получения адекватных результатов большое значение имеет качество взятия образца для исследования, его хранение, транспортировка и предварительная обработка. ПЦР-анализ относится к прямым методам лабораторного исследования – образец анализируется на наличие ДНК (например, возбудителя). Поэтому для ПЦР-анализа пригоден любой клинический материал, потенциально содержащий возбудителей инфекций (соскоб эпителиальных клеток, мазок, плазма крови, сыворотка, лейкоцитарная масса, осадок мочи, слюна, спинномозговая жидкость, биоптаты и др.). При взятии биопроб для ПЦР-диагностики инфекционных заболеваний необходимо соблюдать следующие общие рекомендации:
· Взятие материала производить из предполагаемого места обитания микробов. При этом учитывать, что различные микроорганизмы имеют свои особенности локализации, пути распространения и выделения.
· Взятие биологического материала производить, по-возможности, в период обострения инфекции. За 10 дней до взятия материала на исследование необходимо прекратить прием химиопрепаратов и лечебные процедуры. У женщин материал следует брать перед менструацией или через 1-2 дня после ее окончания, причем накануне обследования женщины не должны проводить туалет наружных половых органов и спринцевание. Взятие биоматериала для контроля эффективности лечения должно проводиться не ранее чем через 3-4 недели после окончания терапии.
· Количество материала, забираемого для исследования, не должно быть избыточным, так как вместе с возбудителем в пробу попадают вещества, которые могут вызвать ингибирование ПЦР или способствовать деградации ДНК при хранении и транспортировке. При взятии мазков и соскобов наиболее адекватным инструментом является специальный урогенитальный зонд (щеточка), который собирает необходимое количество эпителия, не травмируя слизистую, и хорошо отдает собранный материал в жидкую транспортную среду.
· Для взятия биопроб необходимо пользоваться только одноразовым инструментом и одноразовыми пластиковыми контейнерами (или пробирками с транспортной средой) с плотно закрывающейся или завинчивающейся крышкой.
· При использовании венозной крови получают материал натощак из локтевой вены в одноразовую пластиковую пробирку с антикоагулянтом (ЭДТА иди цитрат натрия; гепарин использовать не рекомендуется) при необходимости исследования плазмы или без него (если предполагается исследовать сыворотку). Для исследования необходимо 1 мл отделенной плазмы или сыворотки.
Биологический материал, доставленный в ПЦР-лабораторию, исследуется в течение 2-х часов, а при необходимости сохраняется в замороженном виде (-18…-20 0 С) в течение 2-х недель (допускается только одно замораживание-оттаивание материала).
Для проведения ПЦР-анализа доставленный материал подвергается специальной обработке, в результате которой происходит лизис клеточного материала, удаление белковых и полисахаридных фракций, и получение раствора ДНК или РНК, свободной от ингибиторов и готовой для следующего этапа (амплификации). Выбор методики выделения ДНК (РНК) определяется, прежде всего, характером обрабатываемого клинического материала.
Накопление объекта исследования (амплификация)
Процесс амплификации проводится в специальном программируемом термостате – амплификаторе, который по заданной программе автоматически осуществляет смену температур согласно числу циклов амплификации.
Каждый цикл амплификации при полимеразной цепной реакции протекает в присутствии следующих основных компонентов:
· ДНК-матрица (ДНК или ее часть, содержащая искомый специфический фрагмент ДНК в образце любого происхождения);
· два синтетических олигонуклеотидных праймера, ограничивающих искомую мишеневую последовательность ДНК. Праймеры – синтетические олигонуклеотидные цепочки (20-30 нуклеотидов) со строго заданной последовательностью нуклеотидов, комплементарные определенным участкам на мишеневой ДНК.
· четыре дезоксирибонуклеотида – аденозин, цитидин, гуанозин, тимидин, которые являются материалом для синтеза новых комплементарных цепей ДНК;
· термостабильная ДНК-полимераза (Taq-полимераза), выдерживающая нагревание до 95°С, катализирующая удлинение цепей праймеров путем последовательного присоединения нуклеотидных оснований из смеси дезоксирибонуклеотидов к растущей цепи синтезируемой ДНК;
· реакционная среда с обязательным присутствием ионов магния, необходимых для поддержания активности ДНК-зависимой ДНК-полимеразы.
Исследователь должен заранее определиться какой участок ДНК из известной нуклеотидной последовательности определенного фрагмента ДНК-матрицы будет являться мишеневым (то есть подлежать копированию). В качестве мишеневой ДНК обычно выбирают высококонсервативные области генома, являющиеся специфичными, уникальными, например, для данного вида возбудителя. Следует помнить, что правильный выбор маркерного участка ДНК предопределяет специфичность реакции. Этот этап имеет важнейшее значение, так как может существенно повлиять на результат исследований и таит в себе наибольшее количество ошибок.
Для получения достаточного количества копий искомого специфического фрагмента амплификация ДНК должна включать несколько (20–40) циклов, каждый из которых состоит из 3-х основных этапов (рисунок 4.18).
Рисунок 4.18 - Основные этапы процесса амплификации
1. Денатурация ДНК – плавление ДНК (при 93-95 0 С в течение 30 – 40 с) и разъединение цепей, в результате чего цепочки ДНК становятся доступными для праймеров.
2. Присоединение праймеров (отжиг), происходит комплементарно к соответствующим последовательностям противоположных однонитевых цепей ДНК на границах cпецифического участка. Присоединенные праймеры ориентированы в направлении 5' -3', при этом 3' концы обращены друг к другу. Для каждой пары праймеров существует своя температура отжига в интервале 50 – 65 0 С. Продолжительность отжига 20-60 с.
3. Элонгация – комплементарное достраивание ДНК, происходит от 5'-конца к 3'-концу цепи в противоположных направлениях, начиная с участков присоединения праймеров. Материалом для синтеза новых цепей являются присутствующие в реакционной среде дезоксирибонуклеотиды. Процесс синтеза происходит при температуре 70-72 0 С, продолжительность этапа – 20-40 с.
Циклы амплификации повторяются многократно (30-50 раз), в результате каждого последующего цикла количество ампликонов удваивается и становится достаточным для детекции.
Детекция продуктов амплификации в традиционной ПЦР осуществляется следующими основными методами:
· электрофоретическое разделение ампликонов с последующей их визуализацией окрашиванием, например, бромидом этидия;
· гибридизационные методы детекции в планшетном формате с использованием иммуноферментной реакции с флюорогенными субстратами или прямого измерения флюоресценции олигонуклеотидного зонда после его гибридизации с продуктами реакции в жидкой фазе, либо на специальной подложке;
· высокоэффективная жидкостная хроматография.
Среди перечисленных методов детекции наиболее широко используется электрофорез ПЦР-амплификационной смеси на агарозном или полиакриламидном гелях. Специфичность полученного ампликона подтверждается его положением (размерами) по отношению к маркерным фрагментам или ДНК-стандарту, обязательно входящему в состав диагностической ПЦР тест-системы. Этап электрофореза увеличивает время и трудоемкость анализа, а значит, и стоимость. Поэтому в последние годы разработаны методы, позволяющие производить оценку результатов без процедуры электрофореза или с использованием скоростных и механизированных вариантов.
Специфичность ПЦР в разных лабораториях – 97-98%. Ложноположительные результаты обычно являются следствием контаминации (попадание из внешней среды в реакционную смесь специфических молекул ДНК). Перекрестная контаминация от пробы к пробе может наблюдаться в процессе обработки биоматериала или при раскапывании реакционной смеси. Она приводит к появлению спорадических ложноположительных результатов (случайные ошибки). С другой стороны, возможна контаминация продуктами амплификации (ампликонами), имеющая наибольшее значение, так как ампликоны в процессе реакции накапливаются в огромных количествах и могут загрязнять посуду, автоматические пипетки, лабораторные столы или даже поверхность кожи сотрудников через аэрозоли и загрязнение приборов. Такая контаминация приводит к появлению систематических ложноположительных результатов. Отсюда необходимость жестких требований к условиям организации ПЦР-лабораторий и проведению ПЦР-анализа (см. выше).
Последнее изменение этой страницы: 2016-08-01; Нарушение авторского права страницы
[youtube.player]Биологический метод заключается в выделении чистой культуры возбудителя путем заражения лабораторных животных исследуемым материалом от больного и последующим бактериологическим исследованием трупа животного.
Биологический метод проводится с использованием чувствительных лабораторных животных. Для экспериментального заражения чаще используют белых мышей, крыс, морских свинок и кроликов. Для некоторых специальных исследований служат обезьяны, кошки, собаки, лошади, крупный и мелкий рогатый скот, дикие животные (хомяки, суслики, дикие крысы, полевки), птицы (куры, голуби и т. д.), а также куриные эмбрионы. При выборе вида лабораторного животного необходимо учитывать степень его восприимчивости к изучаемому возбудителю инфекции. Для получения сравнимых результатов исследования проводят на животных одного вида, пола и массы.
Лабораторные животные используются не только с целью выделения и накопления чистой культуры, но и для изучения клинической картины заболевания и для учета реакции нейтрализации токсина антитоксической сывороткой.
Существуют следующие способы заражения: подкожный, внутрикожный, накожный, внутримышечный, внутрибрюшинный, внутривенный, пероральный (через рот), интраназальный (через нос в дыхательный тракт), введение в глаз, введение в центральную нервную систему. При внутрикожном или накожном способе заражения шерсть на месте введения или нанесения материала удаляют выстриганием, выщипыванием или депилированием.
Вскрытие следует производить непосредственно после гибели животного, чтобы избежать проникновения микроорганизмов из кишечника в кровь и другие органы. Все наблюдения, сделанные во время вскрытия, протоколируют. Отмечают вид животного, номер, время и место заражения, материал, применяемый для заражения, время гибели, обнаруженные изменения и т. д. Во время вскрытия необходимо следить за тем, чтобы жидкость и кусочки тканей и органов не попали на стол. После каждой манипуляции инструменты промывают водой или спиртом и прожигают. Отмечают цвет, величину и консистенцию каждого органа. Из измененных органов (или из всех, в зависимости от цели эксперимента) делают высев на питательные среды, мазки и мазки-отпечатки. Для посева прижженную поверхность органа надрезают стерильным скальпелем, из глубины органа вырезают маленький кусочек, часть его помещают в питательную среду, а из другой делают мазки-отпечатки, прикладывая срезанную часть к стеклу. Обязательно делают посев крови из сердца. Для этого прижигают раскаленным скальпелем верхушку сердца и стерильной пастеровской пипеткой прокалывают прожженный участок, кровь при этом поднимается в капилляр. Кровь из капилляра выдувают в жидкие питательные среды и делают из нее мазки. После окончания вскрытия производят тщательную уборку рабочего места. Труп животного сжигают или автоклавируют. Инструменты стерилизуют кипячением или автоклавируют. Доску или кювету протирают спиртом и прожигают или заливают на сутки дезинфицирующим раствором. Мазки фиксируют в пламени или жидким фиксатором, окрашивают и изучают.
Биопроба — метод контроля биологических препаратов (вакцин, сывороток), основанный на их введении лабораторным животным с целью оценки токсичности, пирогенности и иммунологической активности.
III. План практической работы
1. Провести обнаружение бактериальных структур, являющихся факторами патогенности
а) капсулы бактерий в готовых мазках
Для обнаружения капсул используют метод Бурри-Гинса: на первом этапе тушь, обтекая капсульные бактерии, создает черный или коричневый фон (соответствующий цвету туши) на котором хорошо видны неокрашенные бактерии, которые на втором этапе окрашиваются фуксином в красный цвет, а капсула остается бесцветной. Таким образом, капсулы бактерий хорошо видны на темном фоне в виде прозрачных, белых ореолов вокруг красных бактерий.
б) жгутиков бактерий — зарисовать различные варианты расположения жгутиков (монотрих, лофотрих, амфитрих, перитрих).
По количеству и расположению жгутиков различают монотрихи — один жгутик, перитрихи — жгутики по всей поверхности бактериальной клетки, лофотрихи — пучок жгутиков на одном конце клетки, амфитрихи — единичные жгутики или пучки жгутиков на разных полюсах клетки.
в) корд-фактора у патогенных микобактерий
При культивировании микобактерий на предметных стеклах, погруженных в жидкую среду на основе цитратной крови, микроколонии вирулентных штаммов вырастают в виде переплетающихся кос — тяжей, вследствие наличия корд-фактора. Для их обнаружения стекла окрашивают по методу Циля-Нильсена и проводят иммерсионную микроскопию (метод микрокультивирования по Прайсу).
2. Учесть результаты определения факторов патогенности стафилококка: гемолизина, лецитиназы и плазмокоагулазы.
Гемолизин (экзофермент, по механизму действия мембранотоксин) определяют путем посева испытуемой культуры на чашки Петри с кровяным агаром. Посевы инкубирую при 37°С в течение 18-24 часов. Вокруг колоний гемолитических микроорганизмов образуются зоны полного (β) или неполного, зеленящего (α) гемолиза.
Для обнаружения лецитиназы производят посев исследуемой культуры на питательный агар с лецитином (желточный агар). Вокруг колоний бактерий, выделяющих фермент, образуется зона помутнения с перламутровым блеском.
Плазмокоагулаза выявляется при посеве испытуемой культуры в 0,4 мл стерильной цитратной плазмы крови. Посевы инкубируют при 37°С в течение 2-5 ч. В случае образования фермента происходит свертывание плазмы (образование геля), а в контроле она остается жидкой (золь).
3. Учесть результаты определения токсигенности дифтерийной палочки, зарисовать.
Полоску фильтровальной бумаги, пропитанной антитоксической противодифтерийной сывороткой, накладывают на поверхность прозрачного сывороточного агара в чашке Петри. Культуры дифтерийной палочки сеют бляшками на расстоянии 0,6-0,8 см от полоски фильтровальной бумаги и 1-1,5 см друг от друга. Исследуемые и контрольную (токсигенную) культуры дифтерийной палочки чередуют с одной стороны полоски фильтровальной бумаги, а напротив, с другой стороны полоски сеют одноименные культуры (дубли). Чашку инкубируют при 37 ◦ С в течение 24-48 часов. Затем проводят учет. Положительной реакция считается при наличии тонкой линии преципитата между полоской фильтровальной бумаги и ростом бактерий в виде бляшки, отрицательной — при её отсутствии. Реакция считается специфичной, если контрольная (токсигенная) культура дала положительный результат.
4. Зарисовать схему этапов проведения биологического метода диагностики инфекционных заболеваний.
5. Заполнить таблицы по теме занятия
6. Решить ситуационные задачи
УИРС.Учесть результаты чувствительности микрофлоры зева к антибактериальным препаратам, заполнить таблицу.
IV. Примеры ситуационных задач
Ситуационная задача № 1
Больной А, 18 лет, поступил в инфекционное отделение с карбункулом затылочной области. При проведении бактериологического исследования выделена чистая культура этиологического агента инфекционного заболевания. При изучении факторов патогенности выделенной чистой культуры выявлена зона опалесценции на желточном агаре и зона полного просветления на кровяном МПА. Дайте характеристику данного микроорганизма.
- лецитиназа положительный
- лецитиназа отрицательный
- плазмокоагулаза положительный
- уреаза положительный
- гемолитический (β-гемолиз)
В инфекционное отделение детской областной больницы поступил ребенок 6 лет с подозрением на дифтерию. В ходе бактериологического исследования выделена чистая культура дифтерийной палочки (Corynebacterium diphtheriae). При проведении реакции преципитации в агаровом геле с антитоксической противодифтерийной сывороткой определяется зона преципитации. Сформулируйте заключение:
- исследуемая культура дифтерийной палочки лецитиназа положительна
- исследуемая культура дифтерийной палочки токсигенна
- исследуемая культура дифтерийной палочки коагулаза положительна
- исследуемая культура дифтерийной палочки не токсигенна
Теоретические вопросы для рубежного контроля знаний
1. Антибиотики и антимикробная терапия
2. Основные группы химиопрепаратов и антибиотиков
3. Механизмы действия антибактериальных препаратов на микроорганизмы
4. Побочное действие антибиотиков
5. Механизмы антибиотикорезистентности микроорганизмов
6. Методы определения чувствительности микроорганизмов к антибиотикам
8. Формы симбиоза
9. Классификации инфекционных заболеваний и форм инфекций
10. Периоды и исходы инфекционного заболевания
11. Патогенность и вирулентность, единицы вирулентности
12. Основные факторы патогенности микроорганизмов
13. Микробные токсины
14. Биологический метод диагностики инфекционных заболеваний

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.


Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
[youtube.player]Молекулярно-биологические методы исследования играют большую роль в современной медицине, криминалистике и биологии. Благодаря достижениям в области изучения ДНК и РНК, человек способен изучить геном организма, определить возбудителя заболевания, распознать нужную нуклеиновую кислоту в смеси кислот и т.д.
Молекулярно-биологические методы исследования. Что это такое?
Еще в 70-80-х годах ученым впервые удалось расшифровать геном человека. Это событие дало толчок развитию генной инженерии и молекулярной биологии. Изучение свойств ДНК и РНК привело к тому, что теперь можно использовать эти нуклеиновые кислоты в целях диагностики заболевания, изучения генов.
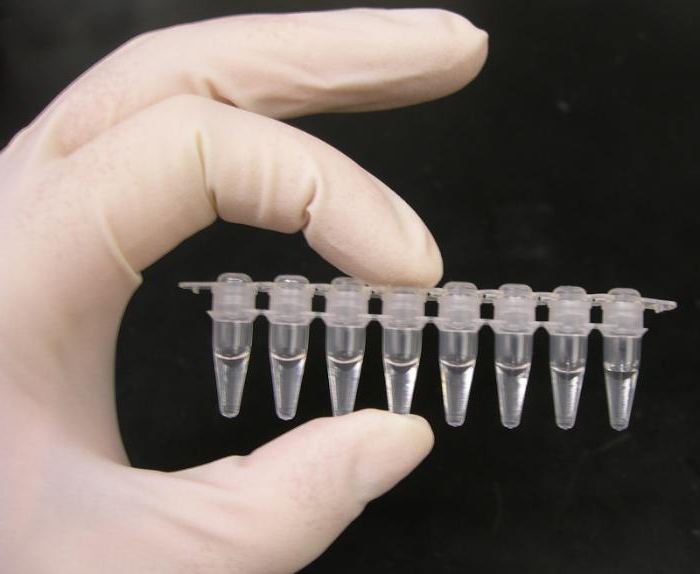
Получение ДНК и РНК
Молекулярно-биологические методы диагностики требуют наличия исходного материала: чаще это нуклеиновые кислоты. Существует несколько способов выделения этих веществ из клеток живых организмов. Каждый из них имеет свои достоинства и недостатки, и это надо учитывать при выборе метода выделения нуклеиновых кислот в чистом виде.
1. Получение ДНК по Мармуру. Метод заключается в обработке смеси веществ спиртом, в результате чего чистая ДНК выпадает в осадок. Минусом этого способа является использование агрессивных веществ: фенола и хлороформа.
2. Выделение ДНК по Буму. Основное вещество, которое используется здесь, – это гуанидин тиоционат (GuSCN). Оно способствует осаждению дезоксирибонуклеиновой кислоты на специализированных субстратах, с которых в последующем можно ее собрать с помощью специального буфера. Однако GuSCN – это ингибитор ПТЦ, и даже небольшая его часть, попавшая в осажденную ДНК, может повлиять на ход полимеразной цепной реакции, которая играет важную роль при работе с нуклеиновыми кислотами.
3. Осаждение примесей. Метод отличается от предыдущих тем, что осаждаются не сами молекулы дехоксирибонуклеиновой кислоты, а примеси. Чтобы это осуществить, используют ионообменники. Недостаток в том, что не все вещества могут осадиться.
4. Массовый скрининг. Используется этот способ в тех случаях, когда не нужны точные сведения о составе молекулы ДНК, а необходимо получить какие-то статистические данные. Объясняется это тем, что структура нуклеиновой кислоты может повредиться при обработке детергентами, в частности, щелочами.

Классификация методов исследования
Все молекулярно-биологические методы исследования делятся на три большие группы:
1. Амплификационные (с использованием множества ферментов). Сюда относится ПЦР – полимеразная цепная реакция, которая играет большую роль во многих из методов диагностики.
2. Неамплификационные. Эта группа методов связана непосредственно с работой смесей нуклеиновых кислот. Примерами являются 3 вида блоттингов, in situ гибридизация и т.д.
3. Методы, основанные на распознавании сигнала от молекулы зонда, который связывается с определенной ДНК или РНК зонда. Пример - система гибридизации в растворе Hybride Capture System (hc2).
Ферменты, которые могут использоваться в молекулярно-биологических методах исследования
Многие методы молекулярной диагностики подразумевают использование обширного диапазона ферментов. Ниже представлены применяемые наиболее часто:
2. ДНК-полимераза – синтезирует двухцепочечную молекулу дезоксирибонуклеиновой кислоты.
3. Обратная транскриптаза (ревертаза) – используется для синтеза ДНК на матрице РНК.
4. ДНК-лигаза – отвечает за образование фосфодиэфирных связей между нуклеотидами.
5. Экзонуклеаза – удаляет нуклеотиды с концевых участков молекулы дезоксирибонуклеиновой кислоты.
ПЦР – основной способ амплификации ДНК
Полимеразная цепная реакция (ПЦР) активно используется в современной молекулярной биологии. Это метод, при котором из одной молекулы ДНК можно получить огромное количество копий (амплифицировать молекулы).
Основные функции ПЦР:
- клонирование участков ДНК, генов.
Для проведения полимеразной цепной реакции необходимы следующие элементы: исходная молекула ДНК, термостабильная ДНК-полимераза (Taq или Pfu), дезоксирибонуклеотид-фосфаты (источники азотистых оснований), праймеры (2 праймера на 1 молекулу ДНК) и сама буферная система, в которой возможно проведение всех реакций.
ПЦР состоит из трех этапов: денатурация, отжиг праймеров и элонгация.
1. Денатурация. При температуре 94-95 градусов по Цельсию просходит разрыв водородных связей между двумя цепями ДНК, и в итоге мы получаем две одноцепочечные молекулы.
2. Отжиг праймеров. При температуре 50-60 градусов по Цельсию происходит присоединение праймеров на концах одноцепочечных молекул нуклеиновой кислоты по типу комплиментарности.
3. Элонгация. При температуре 72 градусов происходит синтез дочерних двухцепочечных молекул дезоксирибонуклеиновой кислоты.

Секвенирование ДНК
Молекулярно-биологические методы исследования часто требуют знания последовательности нуклеотидов в молекуле дезоксирибонуклеиновой кислоты. Для определения генетического кода проводится секвенирование. Молекулярная диагностика будущего будет основана на знаниях, полученных при определении последовательности человека.
Выделяют следующие виды секвенирования:
- секвенирование по Максаму-Гилберту;
- секвенирование по Сэнгеру;
- пиросеквенирование;
- нанопоровое секвенирование.
Полимеразная цепная реакцияпозволяет обнаружить микроб в исследуемом материале (воде, продуктах, материале от больного) по наличию в нем ДНК микроба без выделения последнего в чистую культуру.
Для проведения этой реакции из исследуемого материала выделяют ДНК, в которой определяют наличие специфичного для данного микроба гена. Обнаружение гена осуществляют его накоплением. Для этого необходимо иметь праймеры комплементарного З'-концам ДНК. исходного гена. Накопление (амплификация) гена выполняется следующим образом. Выделенную из исследуемого материала ДНК нагревают. При этом ДНК распадается на 2 нити. Добавляют праймеры. Смесь ДНК и праймеров охлаждают. При этом праймеры, при наличии в смеси ДНК искомого гена, связываются с его комплементарными участками. Затем к смеси ДНК и праймера добавляют ДНК-полимеразу и нуклеотиды. Устанавливают температуру, оптимальную для функционирования ДНК-полимеразы. В этих условиях, в случае комплементарное™ ДНК гена и праймера, происходит присоединение нуклеотидов к З'-концам праймеров, в результате чего синтезируются две копии гена. После этого цикл повторяется снова, при этом количество ДНК гена будет увеличиваться каждый раз вдвое. Проводят реакцию в специальных приборах — амплификаторах. ПЦР применяется для диагностики вирусных и бактериальных инфекций.
Рестрикционный анализ. Данный метод основан на применении ферментов, носящих название рестриктаз. Рестриктазы представляют собой эндонуклеазы, которые расщепляют молекулы ДНК, разрывая фосфатные связи не в произвольных местах, а в определенных последовательностях нуклеотидов. Особое значение для методов молекулярной генетики имеют рестриктазы, которые узнают последовательности, обладающие центральной симметрией и считывающиеся одинаково в обе стороны от оси симметрии. Точка разрыва ДНК может или совпадать с осью симметрии, или быть сдвинута относительно нее.
В настоящее время из различных бактерий выделено и очищено более 175 различных рестриктаз, для которых известны сайты (участки) узнавания (рестрикции). Выявлено более 80 различных типов сайтов, в которых может происходить разрыв двойной спирали ДНК.
В геноме конкретной таксономической единицы находится строго определенное (генетически задетерминированное) число участков узнавания для определенной рестриктазы.
Если выделенную из конкретного микроба ДНК обработать определенной рестриктазой, то это приведет к образованию строго определенного количества фрагментов ДНК фиксированного размера.
Размер каждого типа фрагментов можно узнать с помощью электрофореза в агарозном геле: мелкие фрагменты перемещаются в геле быстрее, чем более крупные фрагменты, и длина их пробега больше. Гель окрашивают бромистым этидием и фотографируют в УФ-излучении. Таким образом можно получить рестрикционную карту определенного вида микробов.
Сопоставляя карты рестрикции ДНК, выделенных из различных штаммов, можно определить их генетическое родство, выявить принадлежность к определенному виду или роду, а также обнаружить участки, подвергнутые мутациям.
Этот метод используется также как начальный этап метода определения последовательности нуклеотидных пар (секвенирования) и метода молекулярной гибридизации.
Метод молекулярной гибридизации позволяет выявить степень сходства различных ДНК. Применяется при идентификации микробов для определения их точного таксономического положения.
Метод основан на способности двухцепочечной ДНК при повышенной температуре (90 °С) в щелочной среде денатурировать, т. е. расплетаться на две нити, а при понижении температуры на 10 °С вновь восстанавливать исходную двухцепочечную структуру. Метод требует наличия молекулярного зонда.
Зондом называется одноцепочечная молекула нуклеиновой кислоты, меченная радиоактивными нуклидами, с которой сравнивают исследуемую ДНК.
Для проведения молекулярной гибридизации исследуемую ДНК расплетают указанным выше способом, одну нить фиксируют на специальном фильтре, который затем помещают в раствор, содержащий радиоактивный зонд. Создаются условия, благоприятные для образования двойных спиралей. В случае наличия комплементарности между зондом и исследуемой ДНК, они образуют между собой двойную спираль.
Риботипирование и опосредованная транскрипцией амплификация рибосомальной РНК. Последовательность нуклеотидных оснований в оперонах, кодирующих рРНК, отличается консервативностью, присущей каждомувиду бактерий. Эти опероны представлены на бактериальной хромосоме в нескольких копиях. Фрагменты ДНК, полученные после обработки ее рестриктазами, содержат последовательности генов рРНК, которые могут быть обнаружены методом молекулярной гибридизации с меченой рРНК соответствующего виды бактерий. Количество и локализация копий оперонов рРНК и рестрикционный состав сайтов как внутри рРНК-оперона, так и по его флангам варьируют у различных вида бактерий. На основе этого свойства построен метод риботипирования, который позволяет производить мониторинг выделенных штаммов и определение их вида. В настоящее время риботипирование проводится в автоматическом режиме в специальных приборах.
Опосредованная транскрипцией амплификация рРНК используется для диагностики смешанных инфекций. Этот метод основан на обнаружении с помощью молекулярной гибридизации амплифицированных рРНК, специфичных для определенного вида бактерий. Исследование проводится в три этапа:
1. Амплификация пула рРНК на матрице выделенной из исследуемого материала ДНК при помощи ДНК-зависимой РНК-полимеразы.
2. Гибридизация накопленного пула рРНК с комплементарными видоспецифическим рРНК олигонуклеотидами, меченными флюорохромом или ферментами.
3. Определение продуктов гибридизации методами денситометрии, иммуноферментного анализа (ИФА).
Реакция проводится в автоматическом режиме в установках, в которых одномоментное определение рРНК, принадлежащих различным видам бактерий, достигается разделением амплифицированного пула рРНК на несколько проб, в которые вносятся комплементарные видоспецифическим рРНК меченые олигонуклеотиды для гибридизации.
Расшифруйте результаты
Реакция Райта (реакция развёрнутой агглютинации) + - сомнительная агглютинация (титр 1:50). При таких результатах рекомендуется повторная постановка р-ции Райта через некоторое время (7-10 дней)
Пробы Бюрне (кожно-аллергическая проба) ++++ - резко положительная. Она определяет способность организма специфически отвечать местной реакцией кожи на внутрикожное введение бруцеллина – фильтрата бульонной культуры бруцелл. Она становится резко положительной на 3-4 день от начала болезни, в дальнейшем сохраняется с большим постоянством на протяжении очень длительного времени, даже после клинического выздоровления.
ОФП (опсонофагоцитарная проба) 6 –слабоположительная. Её проводят с 15-20 дня заболевания. Она основана на способности сегментоядерных нейтрофилов фагоцитировать бруцеллы благодаря наличию в крови человека специфических опсонинов, нарастающих в процессе бруцеллезной болезни (можно определить по формуле: Фагоцитарное Число Больного разделить на Фагоцитарное Число Здорового (Фагоцитарное Число – это среднее число поглощенных микробных клеток в одном фагоците)).
Реакция Райта и проба Бюрне взаимно дополняют друг друга. Максимальный диагностический эффект достигается при комплексном их применение, что является надежным способом диагностики бруцеллеза. Вследствие сомнительной реакции Райта можно предположить: латентный период либо недавно перенесенное заболевание – бруцеллез. А положительная пробы Бюрне сохраняется в течение длительного времени, даже после полного клинического выздоровления.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 81
1. Гонококк и гонококковая инфекция.
Нейсcерии – грамотрицательные аэробные кокки, относящиеся к роду Neisseria, включающему 8 видов: Neisseria meningitides, Niesseria gonorrhoeae, N. flava, N. subflava, N. perflava, N. sicca.
Морфология: неподвижные неспорогенные грамотрицательные диплококки, образующие капсулу, полиморфны – встречаются в виде мелких или крупных форм а так же в виде полочек, хорошо окрашиваются анилиновыми красителями (метиленовым синим, бриллиантовым зелёным и т. д.), под действием пенициллина образуют L-формы, могут менять свойства и превратиться в грамположительную форму.
Культуральные свойства: аэробы, хемоорганотрофы; для роста требуют свежеприготовленные влажные среды с добавлением нативных белков крови, сыворотки или асцитической жидкости . Не вызывают гемолиза на средах, содержащих кровь; на средах с добавлением молока, желатина и картофеля не растут. На плотных питательных средах через 24ч, при содержании протеина II образуют слегка мутные бесцветные колонии, не содержащие его образуют круглые прозрачные колонии в виде капель росы, на жидких питательных средах растут диффузно и образуют плёнку, через несколько часов оседающую на дно.
Биохимическая активность: крайне низкая – разлагают только глюкозу, продуцируют каталазу и цитохромоксидазу, протеолитическая активность отсутствует, H2S, аммиака, индола не образует.
Антигенная структура: Содержит А и К антигены, ЛПС обладают сильной иммуногенностью, основную антигенную нагрузку несут пили и белки мембраны. Наружная мембрана содержит протеины I, II, III классов, проявляющих сильные иммуногеннные свойства
Факторы патогенности: капсула, пили, эндотоксин, белки мембраны
Капсула обладает антифагоцитарным действием. Пили обеспечивают адгезию к эпителию. Клеточная стенка содержит эндотоксин. Поверхностный белок I класса – обеспечивает устойчивость к бактерицидным факторам слизистых оболочек. Класса II – (протеины мутности, ОРА-протеины) обуславливают прикрепление к эпителию, препятствуют фагоцитозу. N. синтезируют IgA протеазу, расщепляющую Ig.
Резистентность: очень неустойчивы в окружающей среде, чувствительны к действию антисептиков, высокочувствительны к пенициллинам, тетрациклину, стрептомицину. Способны к утилизации пенициллинов при приобретении бета-лактамаз.
Патогенез:Входные ворота – цилиндрический эпителий мочеполовых путей. Гонококки прикрепляются к эпителию посредством поверхностных белков, вызывают гибель и слущивание клеток, захватываются клетками, где размножаются, попадают на БМ, после чего попадают на соед. ткань и вызывают воспаление или попадают в кровь с возможным дессиминированием.
Иммунитет – почти отсутствует.
Серодиагностика. В некоторых случаях ставят РСК Борде — Жангу. В качестве антигена используют взвесь убитых гонококков. Реакция Борде—Жангу имеет вспомогательное значение при диагностике гонореи. Она положительна при хронической и осложненной гонорее.
Лечение: антибиотикотерапия (пенициллин, тетрациклин, канамицин), иммунотерапия - Гонококковая вакцина - взвесь гонококков, убитых нагреванием, используется для вакцинотерапии хронической гонореи.
2. Понятие об экзо - и эндогенной, очаговой и генерализованной, острой и подострой, хронической, абортивной, смешанной, вторичной инфекциях. Реинфекция, суперинфекция, рецидив. Понятие о внутриутробных, профессиональных инфекциях. Примеры.
Инфе́кция — заражение живых организмов микроорганизмами — бактериями, грибами, простейшими, — или вирусами. Термин означает различные виды взаимодействия чужеродных микроорганизмов с организмом человека (в медицине), животных (в зоотехнике, ветеринарии), растений (в агрономии).
Эндогенная инфекция - инфекция, обусловленная активацией уже находящегося в организме облигатно-патогенного микроба (напр., микобактерий туберкулеза) или микробами - нормальными обитателями тела человека. Обычно наступает в результате снижения естественного или (и) приобретенного иммунитета, а также в результате пассивного заноса большой дозы микроба в стерильные области тела человека. методы микробиол. д-ки такие же, как при экзогенных инфекциях. Кроме установления возбудителя, важно определить, в т ч. иммунол. методиками, поврежденное звено иммунной системы и факторы, вызвавшие его повреждение. Следует отличать от метастатической инфекции.
Экзогенная инфекция - инфекция, вызванная возбудителем, поступившим в организм из окружающей среды. Экзогенная микрофлора вегетирует на поверхности кожи и слизистых оболочек человека, находится на предметах окружающей среды, в воздухе. Экзогенная инфекция подразделяется на воздушную, капельную и контактную.
Инфекция очаговая — это И., при ко то рой процесс ло ка ли зу ет ся в опре де лен ном органе или тка ни орга низма; суще ство ва ние И. о. от рица ет ся, мож но го во рить лишь о ло каль ном про яв ле нии вза и модействия воз бу ди те ля с ма к ро орга низмом.
Очаговые инфекции вызывают, как известно, иногда, кроме тканевых и висцеральных определений, суставные, почечные, сердечно-сосудистые, эндокринные и пр., и различные неопределенные расстройства общего порядка: астению, адинамию, бессонницу или сонливость, кефалалгию, разные неопределенные мышечные и суставные алгии, пальпитации, диспептические расстройства.
Инфекция генерализованная - И., при которой возбудители распространились преимущественно лимфогематогенным путем по всему макроорганизму.
Развитие острой инфекции с включением специфических иммунных форм защиты можно разбить на ряд этапов.
1. Начало инфекционного процесса - этап, характеризующийся моментальным включением неспецифических форм иммунного реагирования .
2. Индукция специфического ответа - этап, обусловленный неспособностью врожденного иммунитета нейтрализовать патоген. Начинается формирование пула антигенспецифических Т-клеток и В-клеток . При этом на фоне раннего развития специфического ответа происходит размножение и накопление патогена.
3. Через 4-5 дня от момента заражения сформированные клоны Т- и В-клеток начинают атаку на патоген, завершающуюся его уничтожением.
4. Заключительный этап характеризуется накоплением специфических к патогену клеток памяти. В итоге с окончанием инфекционного процесса при участии факторов специфической иммунной защиты формируется состояние протективного иммунитета к конкретной инфекции.
Абортивная инфекция — одна из наиболее распространённых форм бессимптомных поражений. Такие процессы могут возникать при видовой или внутривидовой, естественной либо искусственной невосприимчивости (поэтому человек не болеет многими болезнями других животных). Механизмы невосприимчивости эффективно блокируют жизнедеятельность микроорганизмов, возбудитель не размножается в организме, инфекционный цикл возбудителя прерывается, он погибает и удаляется из макроорганизма.
Смешанные инфекции - инфекционные процессы, развивающиеся в организме при одновременном сочетанном воздействии двух и более возбудителей.
Реинфекция - повторное заражение переболевшего какой-либо инфекционной болезнью возбудителями той же болезни, приведшее к развитию инфекционного процесса.
Суперинфекция - (superinfection) - повторное заражение новым инфекционным заболеванием в условиях незавершившегося инфекционного заболевания, вызванное другим микроорганизмом, обычно устойчивым к лекарственному веществу, которое применялось для лечения первичной инфекции. Возбудителем новой инфекции может быть один из тех микроорганизмов, которые в норме являются безвредными обитателями человеческого организма, но становятся патогенными при удалении других микроорганизмов в результате приема лекарственных веществ; или же он может являться устойчивой разновидностью возбудителя первичной инфекции.;
Рецидив в медицине — возобновление болезни после кажущегося полного выздоровления (ремиссии). Рецидив объясняется тем обстоятельством, что патоген в ходе лечения не полностью исчезает из организма и, в определённых условиях, вновь вызывает появление симптомов заболевания.
Внутриутробные инфекции (ВУИ) — это различные инфекционные заболевания эмбриона, плода и новорождённого, заражение которыми происходит внутриутробно и в процессе родов. Возбудителями инфекции могут быть вирусы, бактерии и (реже) паразиты. Путь передачи — вертикальный, от матери к плоду.
Профессиональные инфекции - Инфекционные заболевания, возникновение которых связано с производственной деятельностью. Профессиональные группы риска: животноводы, заготовители кормов, ветеринары, работники мясокомбинатов, молокозаводов, предприятий по обработке кожи и меха. Заражения - через ЖКТ, поврежденные кожу или слизистые, через легкие, через переносчиков (клещи, кровососущие насекомые). Имеет сезонный характер.
Профилактика: механизация процессов, утилизация отходов животного происхождения, СИЗ, личная гигиена.
3. На прибывшем в порт судне обнаружены трупы грызунов. Наметить план лабораторной индикации возбудителя, противоэпидемических мероприятий.
В результате того, что грызуны являются переносчиками опасных инфекций (чума, лептоспироз, трихофития, микоспория, и др.) необходимо провести вскрытие и взять мазки-отпечатки с различных органов и тканей. Далее провести лабораторную диагностику данных мазков (микроскопическую, бактериологическую) и отметить присутствие или отсутствие патогенных микроорганизмов. Данные вскрытия трупа запротоколировать. Труп животного после вскрытия подлежит уничтожению.
Противоэпидемические мероприятия заключаются в обследование работников судна (при обнаружении возбудителя в грызунах) и дератизации, дезинфекции.
[youtube.player]Читайте также:


