Моноклональные антитела при васкулите
Плазмаферез
В ревматологии плазмаферез начали использовать с 70-х годов XX века [J.V.Jones et а1., 1976].
Его механизмы действия связывают с улучшением функциональной активности ретикулоэндотелиальной системы, удалением аутоантител, циркулирующих иммунных комплексов и воспалительных медиаторов из кровяного русла.
Общие рекомендации по применению плазмафереза при ревматических заболеваниях, включая системные васкулиты, суммированы в таблице 6.6.
Таблица 6.6. Рекомендации по применению плазмафереза
| 1. Следует удалять не менее 40 мл/кг/сутки плазмы 3 раза в неделю в течение 3 недель или 60 мл/кг/сутки в течение 6 дней. |
| 2. Во всех случаях, за исключением тромботической тромбоцитопенической пурпуры, для замещения потери жидкости следует использовать 4—5%-ный раствор альбумина. |
| 3. Следует сочетать плазмаферез с интенсивной глюкокортикоидной и цитотоксической терапией. В день проведения процедуры плазмафереза прием глюкокортикоидов (ГК) и цитотоксиков следует осуществлять после нее. |
Полагают, что проведение сеансов плазмафереза при системной красной волчанке (СКВ) наиболее оправдано у больных с криоглобулинемией, повышением вязкости крови, тромботической тромбоцитопенической пурпурой, тяжелым васкулитом [Y.Tatner et al., 1987], с резистентными к ГК и цитостатикам формами пролиферативного нефрита, а также аутоиммунной гемолитической анемией, антифосфолипидным синдромом (АФС) [S.Kobayashi et al., 1992] и геморрагическим волчаночным пневмонитом [R.W.Erikson & W.Emlen, 1994].
При системных васкулитах плазмаферез в сочетании с глюкокортикоидами применяют для лечения узелкового полиартериита (УП), ассоциированного с вирусом гепатита В, эссенциального криоглобулинемического васкулита, гранулематоза Вегенера [Е.Н.Семенкова и О.Г.Кривошеев, 1995; R.A.Luqmani et al., 1996].
Однако, по данным L.Guillevin и соавт. (1992), частота обострений и 7-летняя выживаемость у больных УП и синдромом Чарга—Стросса, получавших ГК изолированно или в сочетании с процедурами плазмафереза, были одинаковы. По мнению авторов, показанием к применению плазмафереза при системных васкулитах является острое, прогрессирующее течение заболевания, проявляющееся быстропрогрес-сирующим нефритом и тяжелым васкулитом.
Сообщается об эффективности повторных процедур малообъемного (750—1000 мл/сутки) плазмафереза при артериите Такаясу [T.Zhdanova et al., 1995].
Общая частота осложнений при проведении плазмафереза колеблется от 4,5 до 25%. Наиболее часто встречаются кардиогенный шок, анафилактические и цитратные реакции. При корректном проведении процедур плазмафереза инфекционные осложнения встречаются крайне редко [M.A.Pohl et al., 1991].
Иммунотерапия
При васкулитах иммунотерапевтические методы лечения должны быть в первую очередь направлены на раннее селективное подавление активации Т-лимфоцитов, макрофагов и эндотелиальных клеток (ЭК), снижение синтеза или инактивацию провоспалительных цитокинов.
Частично эти задачи решаются назначением глюкокортикоидов, цитостатиков, внутривенного иммуноглобулина (ВВИГ) и плазмафереза. Однако в настоящее время разрабатываются новые подходы к иммунотерапии этих заболеваний. Они связаны с использованием моноклон ал ьных антител к широкому спектру мембранных антигенов мононуклеарных клеток и эндотелия, цитокинам, естественным лигандам цитокиновых рецепторов и растворимых антагонистов цитокинов или химических веществ, обладающих иммуномодулирующей активностью.
Предполагается, что введение антител может не только вызывать элиминацию соответствующих клеток-мишеней, но и вести к изменению их функциональной активности [H.Waldman, 1989].
При ревматоидном артрите (РА) после введения моноклональных анти-СD4+ антител в некоторых случаях наблюдается положительная динамика со стороны внесуставных (язвы голени) проявлений заболевания [G.R.Burmester & F.Emmrich, 1991].
По данным Mathieson и соавт. (1990), использование антител к CDw52 (САМРАТН-1Н) позволяет достигнуть длительной ремиссии у больных с тяжелым ревматоидным васкулитом. При гранулематозе Вегенера также отмечен положительный клинический эффект от применения этих антител.
При системных васкулитах, по-видимому, наибольшее значение будет иметь введение антител к ФНО-а и молекулам адгезии (VCAM-l/VLA-4) [J.M.Clements et al., 1996].
В последнее время в клинической практике широко применяются иммунокорректоры животного происхождения, а именно препараты тимуса и их синтетические аналоги.
В нашей стране при васкулитах апробирован препарат тимуса — тактивин, который оказался гетерогенным по функциональным свойствам. Тактивин восстанавливает число Т-лимфоцитов у больных со сниженным их содержанием, повышает киллерную активность, в зависимости от дозы влияет на функции естественных киллерных клеток, в низких дозах стимулирует продукцию ИФ-а.
Однако его применение в качестве монотерапии при васкулитах неэффективно. Наиболее обосновано назначение этого препарата в сочетании с ГК и циклофосфаном (ЦФ) [А.Г.Бородин, 1994].
В целом новые направления иммунотерапии системных васкулитов связаны с применением биотехнологических препаратов, позволяющих селективно влиять на функциональную активность иммунокомпетентных клеток, синтез цитокинов, экспрессию молекул адгезии и др. (табл. 6.9) [Е.Л.Насонов и А.А.Баранов, 1999].
Таблица 6.9. Варианты иммунотерапии системных васкулитов
| Тип терапии | Метод терапии |
| Пассивная: селективная неселективная | Аналоговые пептиды Моноклональные антитела к идиотипам, экспрессирующимся на аутореактивных T- и В-лимфоцитах Моноклональные антитела к пептидспецифическим участкам Т-клеточных рецепторов а/В Моноклональные антитела к Т-клеточным рецепторам Моноклональные антитела к антигенспецифическим участкам молекул класса II главного комплекса гистосовместимости (ГКГ) Моноклональные антитела к CD4 молекулам лимфоцитов Моноклональные антитела к цитокинам Моноклональные антитела к CD4 молекулам лимфоцитов и цитокинам (комбинированная терапия) Иммуноадгезины |
| Активная | Моноклональные антитела, несущие внутреннее отображение антигенов ГКГ класса 11 Моноклональные антитела, несущие внутреннее отображение CD4 |
Диета
Местное лечение
В ряде случаев при язвенных поражениях кожи важное значение имеет местное лечение, которое должно быть этапным [О.Л.Иванов, 1999]. Возможно наложение примочек или мазей с протеолитическими ферментами.
Для местного лечения целесообразно использовать и препарат аргосульфан (Jelfa), который представляет собой крем с 2%-ной серебряной солью сульфатиазола. Он оказывает выраженное местное антимикробное и болеутоляющее действие. По нашим данным, он эффективен для лечения трофических язв голеней различного генеза.
Так, мы наблюдали 14 больных (четверо мужчин и 10 женщин, в возрасте от 27 до 72 лет), из которых 8 страдали посттромботической болезнью глубоких вен нижних конечностей, 1 — кожным васкулитом, 1 — артериитом Такаясу, 2 — первичным антифосфолипидным синдромом, 1 — РА и 1 — сахарным диабетом.
У всех больных на момент обследования имели место трофические язвы нижних конечностей, преимущественно голеней, с выраженным болевым синдромом. Давность появления язвенных дефектов кожи колебалась от 1 до 12 месяцев.
Препарат аргосульфан (Jelfa) наносили на язвы кожи тонким слоем, один раз в сутки. Эффективность терапии оценивали на 3-й и 10-е сутки от момента ее начала.
У 13 (92,8%) из 14 больных уже на второй-третий день после начала лечения отмечалось значительное уменьшение болевого синдрома. У 1 больной с кожным васкулитом он уменьшился на 8—9-е сутки Средние значения болевого синдрома, выраженные в баллах по визуальной аналоговой шкале, достоверно снижались (рис. 6.5)

Рис. 6.5. Динамика болевого синдрома на фоне применения аргосульфана (Jelfa)
При этом у всех больных наблюдалось уменьшение отека кожи вокруг язв,, появление грануляций. У 5 из 14-и пациентов отмечалось уменьшение размеров язв.
Препарат аргосульфан (Jelfa) хорошо переносился больными, только в одном (7,1%) случае имело место незначительное увеличение размера язвы, без каких-либо местных аллергических реакций. Таким образом, препарат аргосульфан (Jelfa) необходимо включать для местного лечения язвенных дефектов кожи, разбивающихся на фоне различной сосудистой патологии, в том числе системных васкулитов.
Другие аспекты лечения васкулитов
Другие аспекты ведения больных с васкулитами связаны с привлечением для их лечения у социалистов различного профиля. Развитие осложнений при этих заболеваниях, как правило, требует согласованных действий терапевтов, нефрологов, отоларингологов, невропатологов; хирургов, окулистов и др. В этих ситуациях особенно важен единый подход к лечению васкулитов.
Насонов Е.Л., Баранов А.А., Шилкина Н.П.



Заведующий ревматологической клиникой медицинского центра Ихилов – Сураски

Узнать стоимость комплексной телемедицины
Обследование в Топ Ихилов при васкулите
За 3-4 дня вы проходите обследования у израильских специалистов и получаете точный диагноз и индивидуальный протокол лечения.
День I – Прием и осмотр врача
Познакомьтесь со своим куратором: заведующим отделением диагностики доктором И. Молчановым. Доктор сопровождает и консультирует вас в процессе обследования и лечения. При встрече вас ждут:
- Консультация с заведующим отделения диагностики
- Составление истории болезни на иврите
- Осмотр
- Подготовка документов на иврите и русском
- Разъяснение порядка прохождения процедур и анализов
- Направления на исследования
День II – Визуализация очагов болезни, диагностика
В лаборатории Топ Ихилов на новейшем оборудовании выполняются комплексные клинические, биохимические тесты. В том числе:
- Анализы крови и мочи. При васкулитах в моче обычно обнаруживается кровь или белок. В крови может быть повышен уровень С-реактивного белка, снижен уровень гемоглобина. Иногда в крови обнаруживаются особые иммуноглобулины — ревматоидный фактор.
- Ангиография. Это исследование позволяет оценить состояние сосудов и обнаружить изменения сосудистой стенки. Оно представляет собой рентгенологическое исследование с применением контрастного вещества.
- Биопсия. На анализ берется участок ткани, в котором наиболее выражены изменения, связанные с заболеванием.
День III – Постановка диагноза. Индивидуальный протокол лечения
Вы получаете результаты обследования и протокол лечения. Коллегия врачей под руководством профессоров Дана Каспи и Ори Элькаям составляет оптимальный план лечения для прицельной борьбы с вашим заболеванием.
Индивидуальный протокол составляет для вас сам профессор Мейрав Лидар . Применить протокол вы можете в любой клинике мира.
Время пребывания в Израиле для выполнения полного план обследования: 3-4 рабочих дня. Цена – $555.
Пакет комплексной телемедицины по лечению васкулита — $540.
✓ Прямо сейчас – Возможность пройти бесплатную консультацию с ревматологом Топ Ихилов
Важно верно определить тип болезни, прежде чем начинать лечение по месту жительства. Прямо сейчас бесплатно проконсультируйтесь с израильским врачом. Узнайте, сколько стоят в Топ Ихилов нужные вам диагностические процедуры.
Как проходит видео консультация
Отзыв пациентов о диагностике в Топ Ихилов
Чем отличается лечение васкулита в Израиле от лечения в странах постсоветского пространства
- Высокое качество лекарственных препаратов. Все препараты, применяемые для лечения васкулита, произведены в Израиле. Риск получить поддельные лекарства – нулевой.
- Комплексный подход к диагностике и лечению. С больными васкулитом работают врачи разных специальностей: ревматологи, иммунологи, нефрологи, гастроэнтерологи и др. Они делают все возможное для того, чтобы обеспечить пациенту максимальные шансы достичь ремиссии.
- Применение инновационных методов лечения. В Израиле при лечении васкулита применяется препарат, содержащий моноклональное антитело, – ритуксимаб. Это лекарство безопасно при длительном приеме. Опыт израильских врачей доказывает эффективность этого препарата.
Специальное обращение заведующей онкологического отделения Ихилов др. И. Стефански по поводу лечения в Израиле во время коронавируса
Лечением и обследованием пациентов с диагнозом болезнь Рейно в Топ Ихилов занимаются ведущие ревматологи Израиля:

Профессор Ори Элькаям – считается авторитетнейшим ревматологом страны. Много лет возглавляла Израильскую ревматологическую ассоциацию. Занимается лечением псориаза и псориатического артрита, кардиологической диагностикой у пациентов с ревматическими заболеваниями.

Профессор Мейрав Лидар – ведущий израильский ревматолог, иммунолог, специалист по лечению аутоиммунных заболеваний – как распространенных, так и редких. Опыт работы в ревматологии – около 39 лет. Возглавляет ревматологическое отделение крупной государственной больницы Шиба.

Профессор Яков Эвлин – руководит отделением государственной клиники Ихилов. Использует современные методы диагностики ревматических заболеваний (биопсию синовиальной жидкости и т.п.). При лечении применяет инновационную биологическую терапию.
Как сэкономить средства на лечении в Израиле
Методы лечения васкулита в Израиле
- Кортикостероиды. Эти препараты помогают справиться с воспалением и симптомами заболевания. Так как кортикостероиды обладают многочисленными побочными эффектами, при их назначении очень важен опыт врача. Израильские специалисты индивидуально подбирают для пациентов оптимальные схемы приема лекарства, позволяющие минимизировать риск побочных эффектов.
- Иммуносупрессоры и цитостатики. В число этих препаратов входит, например, метотраксат. Препараты этих групп подавляют активность иммунитета, направленную на собственные ткани организма.
- Моноклональные антитела. Как уже было сказано, к этой группе лекарств относится весьма эффективный препарат ритуксимаб.
Плазмаферез – это инновационный метод, применяющийся в последние годы, предполагает очистку крови от веществ, вызывающих воспаление сосудов. Кроме того, эта процедура улучшает микроциркуляцию крови и повышает эффективность медикаментозного лечения в Израиле.
| Процедура | Цена, $ |
|---|---|
| Плазмаферез | 3671 |
| Прием ревматолога | Запросить стоимость |
| Ангиография | 619 |
*Внимание! Платежи вносятся только через кассу клиники Ихилов-Сураски. Избегайте посредников.
Получите протокол лечения израильского врача не выходя из дома
- Позвоните в клинику прямо сейчас по российскому номеру +7-495-7773802 (ваш звонок будет автоматически и бесплатно переведён русскоязычному врачу — консультанту в Израиль).
- Или заполните данную форму. Наш врач свяжется с вами в течение 2-х часов.
Причиной большинства васкулитов считаются перенесенные инфекционные заболевания, в том числе гепатит В, а также некоторые лекарственные препараты, включая антибактериальные средства, витамины группы В, анальгетики и др. Факторами риска являются пол и возраст. Так, например, геморрагическим васкулитом болеют в основном молодые люди и дети.
На начальных стадиях заболевание проявляется возникновением язв, узелков и пурпуры (капиллярных кровоизлияний) на коже. Больной теряет вес, у него периодически повышается температура до 37.5-38 градусов С. При васкулите нередко поражаются суставы, почки, органы ЖКТ, сердце и органы дыхания.

Профессор Мейрав Лидар
Ведущий специалист департамента ревматологии
- 4971
- 4,1
- 0
- 5
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
![]()
Анна Огородник
![]()
Антон Чугунов![]()
Андрей Панов




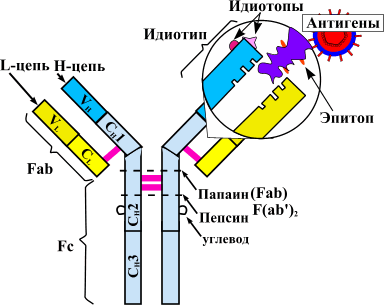
Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.
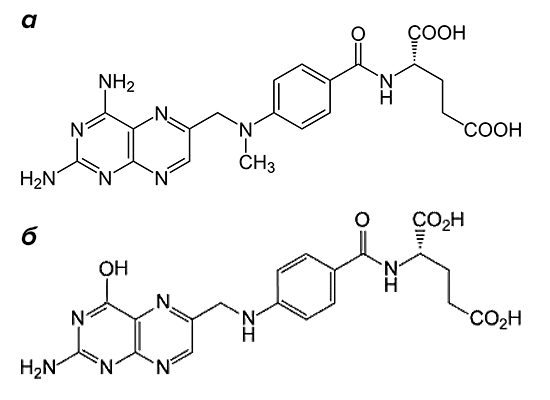
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
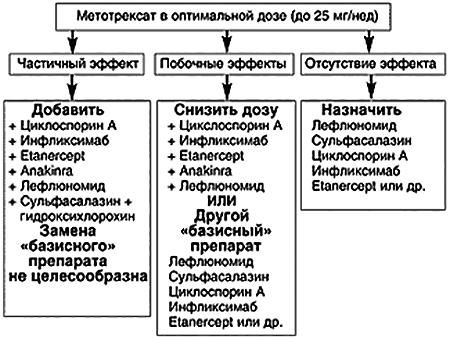
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
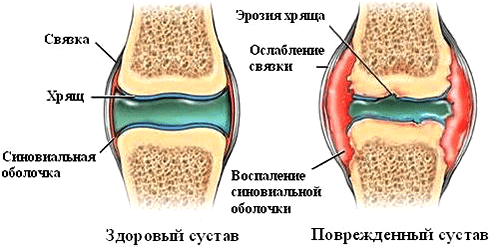
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
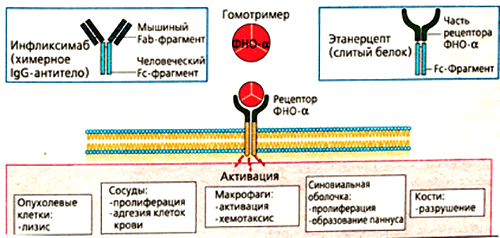
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
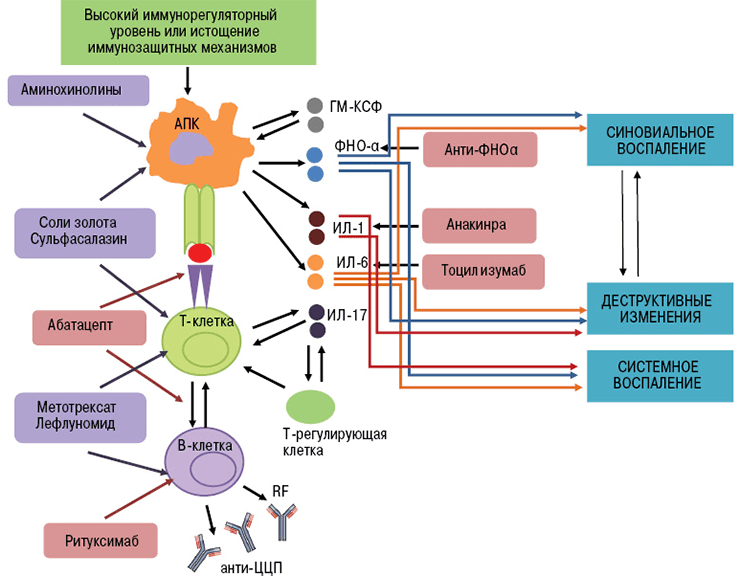
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
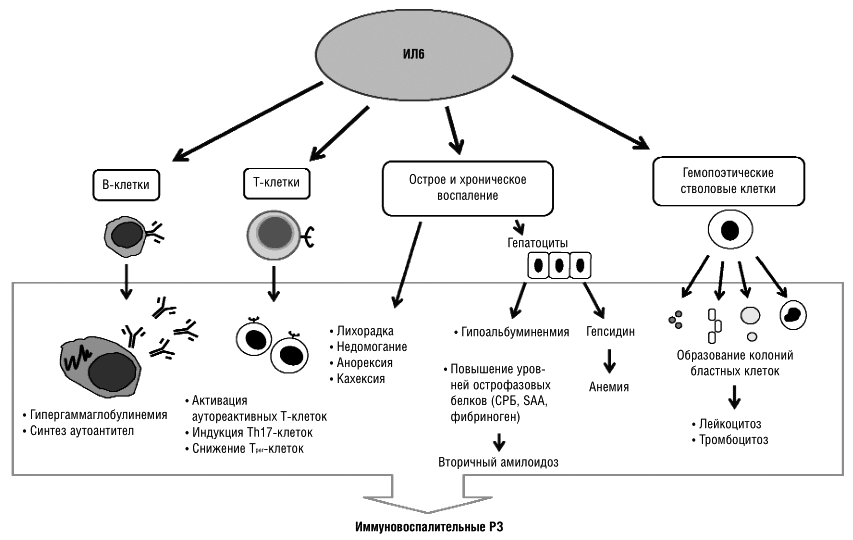
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
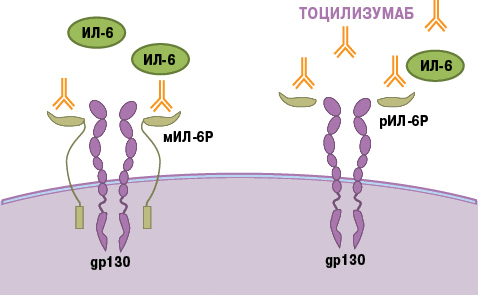
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
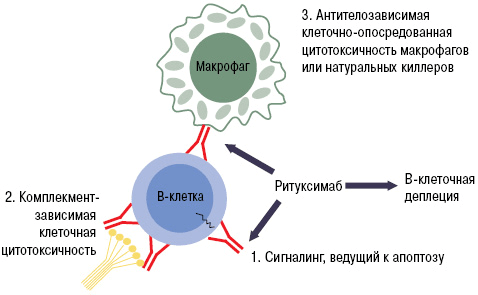
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
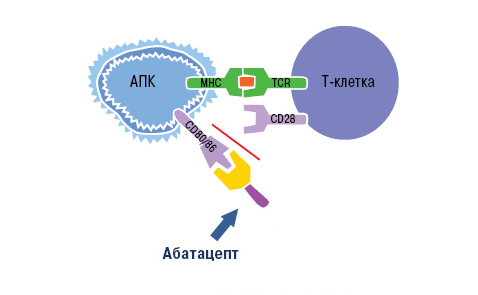
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Читайте также:





