Может ли антифосфолипидный синдром перейти в волчанку
По определению ВОЗ (1993 г.) системная красная волчанка (СКВ) – хроническая прогрессирующая полисистемная болезнь неизвестной этиологии с различными клиническими и лабораторными проявлениями вариабельностью течения и прогноза. В основе, которой лежат иммунологические нарушения, приводящие к чрезмерной продукции аутоантител, часть из которых вызывает цитотоксическое повреждение, другие участвуют в формировании иммунных комплексов и развитии иммунного воспаления. Заболеваемость СКВ колеблется в пределах 4–250 случаев на 100000 населения; приблизительно 90% всех больных составляют женщины [1,2]. СКВ наиболее часто развивается в репродуктивном возрасте, при этом во время беременности и в послеродовом периоде значительно возрастает риск обострения. Соотношение женщин и мужчин, страдающих СКВ, в среднем приближается к 6:1, а в постпубертатном периоде достигает 10:1. У лиц младше 15 и старше 65 лет половые различия в заболеваемости СКВ существенно меньше. Заболевание у мужчин дебютирует в более старшем возрасте. Средний возраст начала СКВ у мужчин, по данным Hochberg M., составлял 40,4 года против 31,8 лет у женщин. Отдельные авторы считают, что пик заболеваемости СКВ у мужчин приходится на возрастную группу 50–59 лет [1,2].
В связи с тем, что СКВ остается одной из наиболее тяжелых форм диффузных болезней соединительной ткани, существенно влияющей на качество и продолжительность жизни, целью нашей работы явилось, изучение частоты встречаемости заболеваний внутренних органов у больных СКВ. В основу нашей работы положены результаты ведения регистра больных СКВ в Воронежском регионе (Черных Т. М., 2000г.), который в настоящее время включает базу данных на 325 пациентов [2,5].
Проблема полового диморфизма сохраняет свою актуальность в рамках еще одного направления исследований в ревматологии – антифосфолипидного синдрома (АФС). Своеобразной моделью для изучения взаимосвязи аутоиммунитета и атеросклероза является иммунно-обусловленная тромбофелия, известная как антифосфолипидный синдром (АФС), к основным проявлениям которого относят венозные и артериальные тромбозы, тромбоцитопеиию, привычное невынашивание беременности, а также поражение центральной нервной системы и сосудов. Серологическими маркерами АФС являются антифосфолипидные антитела (аФЛ), представленные антителами, обусловливающими ложноположительную реакцию Вассермана (ЛПРВ), волчаночным антикоагулянтом (ВА) и антителами к кардиолипнну (аКЛ). АФС может быть первичным (ПАФС) или развиваться в рамках других ревматических заболеваний (РЗ), чаще системной красной волчанки (СКВ). Еще в ранних исследованиях был описан бимодальный характер смертности при СКВ - "ранняя" наиболее часто связана с активностью заболевания и присоединением вторичной инфекции, в то время как по мере увеличения продолжительности болезни одно из первых мест (примерно у трети пациентов) в структуре летальности занимает сердечно-сосудистая патология, обусловленная атеросклерозом и тромботическими осложнениями [3,5]. По данным проспективных исследований примерно у 10% пациентов с СКВ наблюдаются клинические проявления атеросклероза (стенокардия, инфаркт миокарда, поражение мозговых и периферических артерий), а на аутопсии атеросклероз выявляется более чем у половины пациентов. Субклинические формы заболевания (наличие бессимптомных атеросклеротических бляшек) регистрируются у 35-40% больных [3,4]. В недавних исследованиях было показано, что относительный риск развития атеросклероза при СКВ составляет 4,8 (по выявлению атеросклеротических бляшек в сонных артериях с помощью ультразвукового исследования) и (при изучении содержания кальция в коронарных артериях по данным электронно-лучевой компьютерной томографии) [4,2].
Как и другие аутоиммунные ревматические болезни, АФС чаще наблюдается у женщин, чем у мужчин (соотношение 5:1). Частота первичного и вторичного АФС почти одинакова. Заболевание обычно дебютирует в среднем возрасте (около 35 лет), но может встречаться и позже. По данным Cervera R. и соавт., у 13% больных симптомы АФС появились в возрасте старше 50 лет. Для АФС, развившегося в пожилом возрасте, характерно преобладание мужчин, нередкое развитие инсульта и ишемической болезни сердца и низкая частота сетчатого ливедо [3,5].
В исследование включены 325 пациентов, из них 225 по данным персонифицированного регистра больных СКВ (разработанного в период 1989 - 2001 Т.М. Черных), и 100 пациентов наблюдавшихся в период 2003 - 2006 гг.: 57 больных с СКВ без АФС и 43 больных СКВ с АФС. Помимо тщательного клинического обследования пациентам проводилась электрокардиография, эхокардиография. Серологическими маркерами АФС были антикардиолипиновые антитела и волчаночный антикоагулянт. Статистическая обработка материала производилась пакетом Statistica 6.0 [3,4].
Критериям АФС соответствовали 38,7% больных. Сравнительный анализ групп больных в зависимости от наличия или отсутствия АФС выявил определенные закономерности. Тромбозы встречались только у больных с АФС: в 48,3% случаях – венозной и в 24,1% случаев – артериальной локализации с преобладанием тромбозов коронарных артерий. Частота тромбоцитопении (37,9%) была значительно выше у больных с АФС по сравнению с больными без АФС (2,2%), при этом в группе без АФС тромбоцитопения регистрировалась на фоне активности основного заболевания. Частота таких симптомов, как мигрень, судорожные припадки, хорея, поражение клапанного аппарата сердца и легочная гипертензия, у мужчин с АФС значительно превышала таковую у больных без АФС [3,4].
Полученные данные позволили сделать вывод, что у мужчин, страдающих СКВ, АФС является частым клинико–лабораторных симптомокомплексом, может наблюдаться в дебюте заболевания и характеризуется относительно высокой частотой коронарного тромбоза.
Что касается патологии сердечно-сосудистой системы, то по данным проспективных исследований, примерно у 10% больных СКВ наблюдаются клинические проявления атеросклероза: стенокардия, инфаркт миокарда, поражение мозговых или периферических артерий, а при аутотопсии атеросклероз выявляют более чем у половины пациентов [3,4].
По нашим данным частота различных пороков сердца при СКВ с АФС была достоверно выше (p
[youtube.player]
Всего лишь сорок лет назад врачи даже не подозревали о существовании антифосфолипидного синдрома. Открытие принадлежит врачу Грэму Хьюзу, который практиковал в Лондоне. Он подробно описал его симптомы и причины возникновения, поэтому иногда АФС еще называют синдромом Хьюза.
При развитии антифосфолипидного синдрома в крови появляются антифосфолипидные антитела (АФЛА), способствующие усиленному образованию тромбов в просветах сосудов. Они могут стать причиной осложнения беременности и даже вызвать ее прерывание. Чаще всего АФС диагностируют у женщин в возрасте 20-40 лет.
Патогенез развития антифосфолипидного синдрома
В крови человека на фоне антифосфолипидного синдрома начинают циркулировать антитела, которые разрушают фосфолипиды, находящиеся в мембранах клеток тканей организма. Фосфолипиды присутствуют в тромбоцитах, в нервных клетках, в клетках эндотелия.
Фосфолипиды могут быть нейтральными и отрицательно заряженными. В последнем случае их называют анионными. Именно эти два вида фосфолипидов встречаются в крови чаще остальных.
Так как фосфолипиды могут быть разными, то и антитела к ним вырабатываются разные. Они способны вступать в реакцию как с нейтральными, так и с анионными фосфолипидами.
Определяют антифосфолипидный синдром по иммуноглобулинам, которые появляются в крови при развитии заболевания.
Среди них различают:
Волчаночные иммуноглобулины lgG, lgM. Впервые эти антитела были выявлены у пациентов с системой красной волчанкой. При этом удалось обнаружить у них повышенную склонность к тромбозам.
Антитела к кардиолипиновому антигену. Этот компонент теста позволяет обнаружить у человека сифилис. При этом в его крови будут циркулировать антитела класса A, G, M.
Антитела, которые представлены сочетанием кардиолипина, фосфатадилхолина и холестерина. Они способны давать положительный результат при проведении реакции Вассермана (диагностика сифилиса), но этот результат бывает ложным.
Суммарные иммуноглобулины классов A, G, M (бета-2-гликопротеин-1-кофакторзависимые антитела к фосфолипидам). Так как бета-2-гликопротеин-1 являются фосфолипидами-антикоагулянтами, то появление к крови антител, направленных на их уничтожение, приводит к усиленному формированию тромбов.
Обнаружение антител к фосфолипидам позволяет диагностировать антифосфолипидный синдром, выявление которого сопряжено с рядом трудностей.
Особенности диагностики АФС

Антифосфолипидный синдром дает ряд патологических симптомов, которые наталкивают на мысль о данном нарушении. Однако, чтобы выставить верный диагноз, потребуется провести лабораторные исследования. Причем их будет немалое количество. Сюда входит сдача крови на общий и биохимический анализ, а также проведение серологических тестов, дающих возможность обнаружить антитела к фосфолипидам.
Применение одного метода исследования недостаточно. Часто пациентам назначают анализ на реакцию Вассермана, который способен давать положительный результат не только при антифосфолипидном синдроме, но и при иных заболеваниях. Это приводит к постановке неверного диагноза.
Чтобы минимизировать вероятность врачебно-диагностической ошибки, следует назначать пациенту с симптомами АФС комплексное обследование, которое должно включать в себя:
Обнаружение волчаночных антител – это анализ, который при подозрении на АФС выполняют в первую очередь.
Обнаружение антител к кардиолипиновому антигену (реакция Вассермана). При АФС анализ будет положительным.
Тест на бета-2-гликопротеин-1-кофакторозависимые антитела к фосфолипидам. Показатели этих антител будут превышать допустимые границы нормы.
Дополнительные методы диагностики, которые может назначить врач:
Анализ ложноположительной реакции Вассермана.
Проведение пробы Кумбаса.
Обнаружение в крови ревматоидного фактора и антинуклеарного фактора.
Определение криоглобулинов и титра антител к ДНК.
Иногда врачи, при подозрении на АФС, ограничиваются забором крови на обнаружение волчаночного антикоагулянта, но в 50% случаев это приводит к тому, что нарушение остается неустановленным. Поэтому при наличии симптомов патологии, следует проводить максимально полное исследование. Это позволит вовремя обнаружить АФС и начать терапию. Кстати, современные медицинские лаборатории имеют тесты, которые дают возможность провести именно комплексную диагностику, так как они оснащены всеми необходимыми реагентами. Между прочим, в некоторых таких системах в качестве вспомогательных компонентов используется змеиный яд.
Причины развития АФС
Антифосфолипидный синдром чаще всего манифестируется на фоне таких патологий, как:
Системная склеродермия, ревматоидный артрит, синдром Шегрена.
Раковые опухоли в организме.
Аутоиммунная тромбоцитопеническая пурпура, которая может быть спровоцирована системой красной волчанкой, склеродермией или ревматоидным артритом. Наличие пурпуры в разы повышает риск развития антифосфолипидного синдрома.
ВИЧ-инфекция, мононуклеоз, гепатит С, эндокардит, малярия. АФС может развиваться при вирусных, бактериальных и паразитарных инфекциях.
Заболевания, поражающие ЦНС.
Период вынашивания ребенка, роды.
К АФС может иметься наследственная предрасположенность. При этом в фенотипе крови человека будут иметься специфичности DR4, DR7, DRw53.
Прием некоторых лекарственных препаратов, например, психотропных, противозачаточных и оральных контрацептивов.
Чем дольше в крови присутствуют антифосфолипидные антитела, тем быстрее у человека разовьется АФС. Причем причина их появления не имеет значения.
Виды АФС
Различают следующие виды АФС:
Первичный антифосфолипидный синдром, который развивается сам по себе, то есть его началу не предшествует какое-либо заболевание.
Вторичный антифосфолипидный синдром, который развивается на фоне аутоиммунной патологии, например, при системной красной волчанке.
Катастрофический антифосфолипидный синдром, который диагностируют редко, но при этом данная форма патологии является крайне опасной. Развивается заболевание стремительно и приводит к формированию тромбов по всем сосудам организма. Часто такой синдром становится причиной летального исхода.
АФЛА-негативный синдром, который сложно обнаружить. При этой форме болезни в крови отсутствуют волчаночные антитела и антитела к кардиолипину.
Синдром Снеддона – это заболевание, которое развивается на фоне АФС. При этом у человека случаются эпизоды тромбоза сосудов головного мозга. Симптомами нарушения являются синюшные кожные покровы и повышенное артериальное давление. Синдром Снеддона относят к одному из возможных вариантов течения болезни.
Опасность антифосфолипидного синдрома
Антитела к фосфолипидам, которые появляются при АФС, нарушают нормальное функционирование системы гемостаза. Это приводит к тому, что в сосудах начинают формироваться тромбы, у человека развивается тромбоз.
При АФС страдают не только капилляры, но и крупные сосуды. В целом, тромбы могут образовываться в любой вене или артерии, которые несут кровь к разным органам. Поэтому симптомы данного нарушения весьма разнообразны.
Осложнения АФС
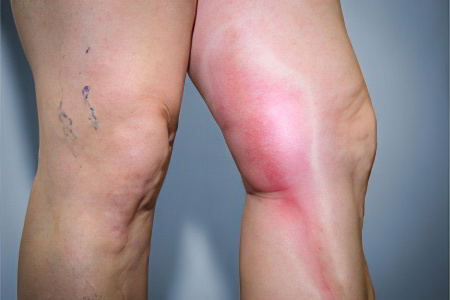
Антифосфолипидный синдром провоцирует формирование тромбов в сосудах. Чаще всего от тромбоза страдают вены нижних конечностей. Если тромб отрывается, то с током крови он попадает в сосуды, питающие легочную ткань. Это влечет за собой развитие опасного состояния, которое называется тромбоэмболия легочной артерии. Если тромб перекрывает магистральный сосуд легкого, то происходит его инфаркт, прекращается сердечная деятельности. Часто ТЭЛА заканчивается гибелью больного, причем летальный исход может наступить очень быстро.
Когда тромб перекрывает мелкие сосуды, у человека имеется шанс на восстановление, но при этом он должен быть экстренно доставлен в медицинское учреждение. Даже в этом случае вероятность возникновения тяжелых последствий для здоровья крайне высока.
Тромбы при АФС могут образовываться в почечных артериях. На фоне таких тромбозов развиваются тяжелые почечные патологи, например, синдром Бадда-Киари.
Реже тромбы формируются в капиллярах сетчатки глаза, в подключичных венах, в центральных венах надпочечников, что ведет к развитию недостаточности этих органов. Также на фоне тромбоза возможно развитие синдрома нижней или верхней полой вены.
Тромбоз с закупоркой артерий различной локализации может приводить к инфаркту, гангрене, некрозу головки бедра.
Антифосфолипидный синдром во время беременности

Развитие антифосфолипидного синдрома во время беременности может приводить к таким серьезным последствиям, как:
Выкидыш на ранних сроках беременности. Риск самопроизвольного аборта тем выше, чем больше в крови женщины циркулирует антител к кардиолипиновому антигену.
Развитие фетоплацентарной недостаточности, которая ведет к гипоксии плода с задержкой его развития. При неоказании медицинской помощи сохраняется высокий риск внутриутробной гибели ребенка.
Развитие гестоза с эклампсией и преэклампсией.
Повышение артериального давления.
Развитие HELLP-синдрома с гемолизом, поражением паренхимы печени и с тромбоцитопенией.
Преждевременная отслойка плаценты.
На фоне АФС попытки зачать ребенка методом экстракорпорального оплодотворения могут заканчиваться неудачно.
Как обнаружить АФС во время беременности
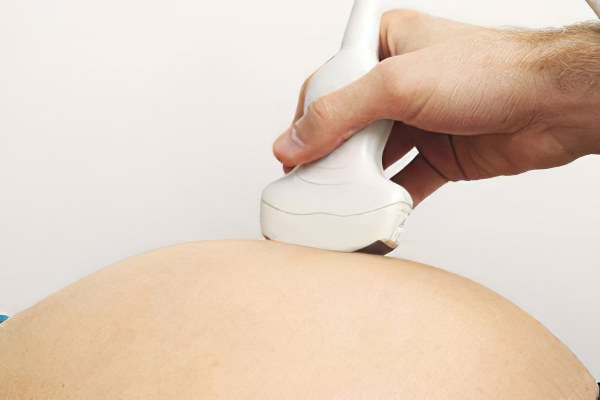
Женщины, которые находятся в группе риска по развитию АФС, должны быть у врача на особом контроле.
По показаниям, им могут быть назначены следующие диагностические процедуры:
Регулярное выполнение гемостазиограммы.
Внеплановое УЗИ плода с допплерографией маточно-плацентарного кровотока.
УЗИ сосудов ног, головы, шеи, почек, глаз.
ЭхоКГ для проверки работы сердечных клапанов.
Это позволит своевременно обнаружить развитие серьезных осложнений беременности, таких как: ДВС-синдром, пурпура, ГУС.
Кроме врача-гинеколога беременной женщине с диагностированным антифосфолипидным синдромом может потребоваться консультация иных узких специалистов, например, ревматолога, кардиолога, невролога и пр.
Лечение сводится к приему глюкокортикостероидов и препаратов-антиагрегантов. Дозу должен подбирать врач. Также могут быть назначены гепарины и иммуноглобулины. Эти препараты вводят на фоне контроля картины крови.
Ели женщина уже страдает от АФС, но не планирует беременность, то для контрацепции ей не следует использовать гормональные препараты. В противном случае можно усугубить течение болезни.
Какие системы организма страдают при АФС, симптомы нарушений

Антифосфолипидный синдром сопряжен с риском развития различных заболеваний. Причем пострадать могут любые органы и системы, даже головной мозг. При поражении его сосудов возможно развитие транзиторной ишемической атаки или инфаркта.
Это сопровождается такими симптомами, как:
Слабоумие, которое постоянно прогрессирует.
Также АФС может проявляться следующими неврологическими симптомами:
Выраженные головные боли, протекающие по типу мигрени.
Неконтролируемая дрожь конечностей.
Симптомы, характерные для поперечного миелита. Они возникают по той причине, что при АФС страдает спинной мозг.
Самым грозным осложнением при поражении сердца является инфаркт. Он развивается при условии, что тромбы формируются в коронарных артериях. Если задействованы их мелкие ответвления, то инфаркту будет предшествовать нарушения сокращения сердца. Также АФС может привести к развитию порока сердца, к формированию внутрисердечного тромба. Такие косвенные признаки антифосфолипидного синдрома способны затруднять диагностику причины болезни.
Симптомы АФС в зависимости от того, какой именно орган оказался поражен тромбозом, будут следующими:
Повышение артериального давления наблюдается при тромбозе почечных артерий.
При закупорке тромбом легочной артерии развивается ТЭЛА, что ведет к резкому ухудшению самочувствия человека. Иногда гибель больного может наступить мгновенно.
Кровотечение в желудочно-кишечном тракте.
Появление подкожных кровоизлияний, некроз кожи, язвы на ногах – все эти симптомы развиваются при поражении дермы.
Клиника АФС разнообразна. Точные симптомы описать невозможно, так как в патологический процесс могут быть вовлечены любые органы и системы.
Лечение АФС

Лечение АФС должно быть комплексным. Основная его направленность – это предотвращение осложнений тромбозов.
Больной обязательно должен соблюдать следующие рекомендации:
Отказаться от непосильных физических нагрузок.
Нельзя долгое время оставаться без движения.
Отказ от травматических видов спорта.
Отказ от перелетов.
Медикаментозная терапия сводится к назначению следующих препаратов:
Варфарин – препарат из группы непрямых антикоагулянтов.
Гепарин, Надропарин кальция, Эноксапарин натрия – препараты, относящиеся к прямым антикоагулянтам.
Аспирин, Дипиридамол, Пентоксифиллин – препараты-антиагреганты.
Ели больной находится в тяжелом состоянии, то ему вводят высокие дозы глюкокортикостероидов, выполняют переливание плазмы.
Прием антикоагулянтов и антиагрегантов должен быть длительным. Иногда эти препараты назначают пожизненно.
АФС – это не приговор. Если заболевание диагностировано на начальном этапе его развития, то прогноз благоприятный. При этом пациент должен соблюдать все рекомендации врача, принимать препараты, которые он ему назначает. Женщины имеют высокие шансы на зачатие и рождение здорового ребенка.
Осложняет течение болезни системная красная волчанка, тромбоцитопения, стойкое повышение артериального давления, высокий уровень антител к кардиолипиновому антигену с тенденцией к их росту.
В обязательном порядке пациент с диагностированным АФС должен наблюдаться у ревматолога. Ему потребуется регулярно сдавать кровь на анализ, а также проходить иные диагностические и лечебные процедуры.
Антифосфолипидные антитела в крови – норма или патология?
Иногда уровень антифосфолипидных антител может быть повышен у здорового человека. У 12% людей эти антитела присутствуют в крови, но заболевания при этом у них не развивается. Чем старше человек, тем выше могут быть показатели патологических иммуноглобулинов. Также имеется вероятность возникновения ложноположительной реакции Вассермана, к чему пациент должен быть готов. Главное не впадать в панику и пройти комплексную диагностику.
Видео: АФС и другие тромбофилии в акушерстве:

Автор статьи: Волков Дмитрий Сергеевич | к. м. н. врач-хирург, флеболог
Образование: Московский государственный медико-стоматологический университет (1996 г.). В 2003 году получил диплом учебно-научного медицинского центра управления делами президента Российской Федерации.
[youtube.player]Омская государственная медицинская академия, Омск
В статье рассмотрены аспекты применения низкомолекулярных гепаринов у женщин группы риска по тромботическим осложнениям в репродуктивной медицине.
Ключевые слова: генетическая тромбофилия, невынашивание беременности, антифосфолипидный синдром, низкомолекулярные гепарины, бемипарин.
Сведения об авторе:
Литневская М.А. – к.м.н., ОГМА
Pathogenic Aspects of LMWH Administration in Case of Thrombophilia as a Part of Assisted Reproductive Technologies
M.A. Litnevskaya
Omsk State Medicine Academy, Omsk
Paper reviews issues on the use of low-molecular-weight heparins in women of high thrombotic risk in reproductive medicine.
Keywords: inherited thrombophilia, miscarriage, antiphospholipid syndrome, LMWH, bemiparin.
Важнейшее значение при желании супружеской пары стать родителями имеет возможность зачатия и способность вынашивания желанной беременности.
Проблема бесплодного брака во всем мире приобрела в настоящее время не только медицинское, но и существенное социально-демографическое значение. По данным ВОЗ, частота бесплодного брака составляет 10–15% от числа супружеских пар и имеется тенденция к росту этого показателя. В отдельных регионах России, по данным ряда эпидемиологических исследований, этот показатель с каждым годом увеличивается и приближается в настоящее время к 20%. В нашей стране эта проблема приобретает особую значимость в связи с прогрессивным снижением рождаемости в последние десятилетия [1–4].
Активное внедрение в клиническую практику программы экстракорпорального оплодотворения (ЭКО) и переноса эмбриона (ПЭ) делает актуальным повышение эффективности и профиля безопасности данных процедур для здоровья матери и будущего ребенка. Не каждая беременность приводит к материнству и после проведения этой высокотехнологичной методики.
Научные исследования, посвященные изучению физиологии и патологии системы гемостаза, дополнили сведения о механизмах различных видов тромбообразования, выявили ранее неизвестные наследственные дефекты системы гемостаза (тромбофилии) и некоторые иммунные формы тромбозов. По данным литературы, около 30% населения имеют генетические формы тромбофилии. Доказана важная роль этих нарушений в патогенезе различных видов патологии у матери и плода, привычном невынашивании беременности [5–7].
Неоспоримо доказано, что тромбозы магистральных сосудов и тромбоэмболия легочной артерии являются самыми серьезными осложнениями при тяжелых формах СГЯ и наиболее частыми причинами летальных исходов у данного контингента больных [10]. Описаны тромбозы глубоких вен конечностей, яремной, подключичной и нижней полой вен. Могут поражаться церебральные, позвоночные, подключичные, сонные, бедренные и брыжеечные артерии, аорта [8, 11].
При наличии генетических и приобретенных (антифосфолипидный синдром – АФС) форм тромбофилии могут иметь место субклинические аборты, что маскируется в виде бесплодия неясного генеза. У пациенток с бесплодием неясного генеза и неудачами ЭКО (при исключении всех других возможных причин бесплодия и неудач ЭКО) необходимо обследование на наличие скрытой тромбофилии, поскольку бесплодие в таких случаях может быть обусловлено ранними преэмбрионическими потерями вследствие дефектов имплантации оплодотворенной яйцеклетки [12, 13].
При возникновении беременности спонтанно, вне проведения процедуры ЭКО, возникает физиологическая активация внутрисосудистого свертывания крови.
В течение ряда последних лет выявлено существенное количество ранее неизвестных скрытых генетически обусловленных дефектов гемостаза, предрасполагающих к тромбообразованию и становящихся позитивными при возникновении запускающего фактора (мутация фактора V Leiden, мутация протромбина G20210A, синдром липких тромбоцитов, гипергомоцистеинемия и пр.) [14, 15].
К факторам риска венозных тромбозов в акушерской практике относятся: проведение стимуляции суперовуляции в программе ЭКО, сопряженное с гиперэстрогенией, возраст старше 35 лет, кесарево сечение, многочисленные роды, ожирение (масса тела больше 80 кг), иммобилизация и ограничение подвижности, сахарный диабет, гипертоническая болезнь, заболевания сердца, нефропатический синдром и другая экстрагенитальная патология, гестозы, многоплодная беременность, преждевременная отслойка нормально расположенной плаценты, тромбоз глубоких вен в анамнезе или легочная эмболия в связи беременностью, операцией или приемов оральных контрацептивов, АФС, генетические дефекты гемостаза, предрасполагающие к тромбозу, подавление лактации эстрогенами или длительный прием оральных контрацептивов до беременности [16, 17]. По обобщенным данным мировой литературы, на 1000 родов приходится от 2 до 5 тромботических осложнений [18].
Эффекты тромбофилии, генетически обусловленной, или у женщин с АФС, представляются как дефект имплантации плодного яйца, недостаточная глубина инвазии трофобласта, неполноценная плацентация и, как следствие, эндотелиопатия [12, 19].
По данным разных авторов, генетические формы тромбофилии среди причин привычной потери беременности составляют 10–30%. Большинство исследований подтверждают, что более 50% беременных после ЭКО сталкивается с проблемой невынашивания, особенно велик риск прерывания беременности в I триместре. Частота самопроизвольных выкидышей в I триместре при беременности, наступившей в результате ЭКО, достигает 21%. По данным работ [12, 20], нарушения, связанные с тромбофилией и неадекватным образованием фибрина, начинают формироваться еще на этапе имплантации оплодотворенной яйцеклетки, инвазии трофобласта, формирования плаценты, поэтому важно еще до зачатия проводить профилактику более поздних осложнений. Мутация протромбина G20210A впервые была описана Poort et al. в 1996 г., когда были обследованы 28 больных с семейным анамнезом. Риск возникновения тромбозов при этой мутации возрастает почти в 3 раза. Функциональные исследования в ряде случаев (почти у 87% с мутацией протромбина) выявляют повышенный уровень протромбина (>115%). Согласно данным мультицентрового трайла, проведенного в 9 странах, включавшего 5527 пациентов, была выявлена гетерозиготная форма мутации протромбина G20210A. Недавно были опубликованы данные о частом сочетании мутации гена протромбина и V фактора. Для сочетания этих факторов характерны очень ранние тромбозы в возрасте 20–25 лет, с увеличением тромбоэмболических осложнений при беременности и после родов [21].
В последние годы появились данные о важной роли гипергомоцистеинемии в патогенезе микроциркуляторных и тромботических осложнений при различных заболеваниях, в том числе в акушерской практике [22]. Гипергомоцистеинемия рассматривается в настоящее время как фактор повышенного риска целого ряда акушерских осложнений, таких как привычные ранние потери беременности, раннее начало гестоза, преждевременная отслойка нормально расположенной плаценты, задержка внутриутробного развития, а также тромбозы и тромбоэмболии. Впервые резистентность к активированному протеину С (APC-R), как причина наследственной тромбофилии, была описана в 3 разных семьях Dahlbaeck и соавт. в 1993 г. Следствием этой мутации являются нарушения в функционировании системы протеина С, представляющей собой важнейший естественный антикоагулянтный путь. В условиях нормы АРС ингибирует коагуляцию путем расщепления ограниченного числа пептидных связей как в интактном, так и в активированном факторе V (FV/FVa), а также в VIII факторе (FVIII/FVIlla). АРС-зависимое расщепление FVa стимулируется протеином S и протеолитически модифицированного FV под действием АРС.
По данным J.Meinardi и соавт. (1999), среди 228 носителей мутации риск прерывания в 2 раза выше, чем в группе женщин с невынашиванием, но не носителей мутации, 80% потерь беременности у носителей мутации были в I триместре и до 16 недель [23].
В исследовании S.N.Ваге и соавт. (2000) сообщили, что риск выкидыша и бесплодия в 2,5 раза выше для носителей мутация V Leiden [24]. По данным A.Gerhardt и соавт. (2000), лейденская мутация наблюдалась у 44% женщин из 119 с тромбоэмболическими осложнениями при беременности.
Процесс имплантации, инвазии трофобласта и дальнейшее успешное функционирование плаценты являются сложным процессом эндотелиально-гемостазиологических взаимодействий со сложной регуляцией, который объективно нарушается при тромбофилии, в том числе и в случае генетических дефектов свертывания [25]. Уровень ингибитора активатора плазминогена I (PAI-I) у лиц с 4G/4G почти на 25% выше, чем у лиц с 5G/5G. Мутация 4G/4G ассоциируется при этом с повышенным риском тромбозов. Кроме того, следует отметить, что ряд исследователей свидетельствует о высокой корреляции между мутацией 4G/4G и инсулинорезистентностью, которая часто сопровождает, как известно, и синдром поликистозных яичников. Важно подчеркнуть, что высокий уровень PAI-1 (результат полиморфизма гена PAI-1 4G/4G) уже на этапе имплантации плодного яйца и инвазии трофобласта оказывает свое негативное влияние и способствует неполноценной нидации и недостаточной инвазии трофобласта, что, в свою очередь, объясняет высокую частоту как ранних выкидышей, так и плацентарных аномалий и гестоза [12, 26]. АФА повышают экспрессию PAI- I и тканевого фактора (ТФ), что усиливает протромботические механизмы и снижает активность фибринолиза, что ведет к дефектам имплантации и снижению глубины децидуальной инвазии трофобласта [12].
Антифосфолипидные антитела напрямую или опосредованно, влияют на процесс имплантанции и ранние эмбрионические стадии. Согласно данным литературы [20], частота гибели эмбриона/плода без лечения у женщин с АФА составляет 80–95%. В литературе имеются данные о том, что АФА обнаруживается в общей популяции с частотой 5–17%; значительно чаще встречаются при привычном невынашивании, заболеваниях органов малого таза, таких как эндометриоз, хронический сальпингоофорит и спаечный процесс, бесплодии неясного генеза, повторных неудачных попытках ЭКО. Предполагается возможная этиологическая роль АФА в генезе бесплодия и привычного выкидыша. АФА могут препятствовать развитию цитотрофобласта в синцитиотрофобласт на ранних сроках беременности [29].
При АФА имеет место циркуляция в крови антител, иммуноглобулинов класса М, G, А, к фосфолипидным детерминантам клеточных мембран. Эти антитела самостоятельно или при образовании комплексов с другими белками плазмы (так называемыми кофакторами – b2-гликопротеин-1, протромбин и др.) способны повреждать мембраны эндотелия, нарушая баланс в звене естественных антикоагулянтов и ингибиторов свертывания, и провоцировать тромбофилическую ситуацию.
Повреждающее действие может осуществляться АФА вследствие изменения адгезивных характеристик предимплантационного эмбриона, нарушения слияния синцития и снижения глубины инвазии трофобласта, а также подавления продукции ХГЧ. Тромботические тенденции усиливаются за счет предоставления матриц для реакций свертывания [4, 26]. Инвазия трофобласта в спиральные артерии связана с продукцией ацетилглицеринового эфира фосфатидилхолина. Этот процесс нарушается при наличии АФА.
Таким образом, вышеизложенное показывает, что:
1. При проведении вспомогательных репродуктивных технологий (программы ЭКО и ПЭ) прием массивных доз препаратов для стимуляции суперовуляции у пациенток, имеющих мультигенную форму тромбофилии (сочетание циркуляции АФА и генетических дефектов системы гемостаза) может являться причиной тромботических осложнений.
2. При наличии тромбофилии имеет место прерывание беременности на ранней эмбриональной стадии, что связано с влиянием тромбофилии на имплантацию плодного яйца, инвазию трофобласта и плацентацию.
3. При наличии факторов риска, которые возникают при проведении программы ВРТ в процессе стимуляции овуляции, понижается процент преодоления эмбрионического порога при наступлении беременности после ЭКО и повышается риск тромботических осложнений.
При выявлении активации внутрисосудистого свертывания крови базисной является противотромботическая терапия низкомолекулярными гепаринами (НМГ). Коррекция состояния системы гемостаза препаратами данной группы требует контроля исходного уровня тромбоцитов и динамического контроля этого показателя, с учетом возможного развития гепарининдуцированной тромбоцитопении.
Бемипарин является НМГ новой генерации. Препарат имеет среднюю молекулярную массу 3,6 кДа, причем 74,6% фракций имеет массу 2–6 кДа, а доля гепариновых фракций с массой выше 6 кДа намного ниже, чем у других НМГ. Таким образом, бемипарин обладает наименьшей молекулярной массой из всех используемых сегодня НМГ. Именно низкомолекулярные фракции определяют анти-Ха-активность, а избыток средне- и высокомолекулярных фракций дает анти-Па-активность, т.е. активность в отношении тромбина, что повышает риск развития кровотечений. Анти-Ха-активность бемипарина составляет 80–110 МЕ/мг, а анти-Па-активность – 5–10 МЕ/мг, то есть соотношение анти-Ха/анти-Па-активности составляет 8:1. Биодоступность бемипарина, как и у остальных НМГ, очень высока и после подкожного введения достигает 96% [30–32].
В последнее время появились исследования, продемонстрировавшие эффективность бемипарина при ряде акушерских патологий и высокий профиль безопасности в акушерстве для профилактики тромбозов [33]. Известно проспективное исследование [34], в которое были включены 273 женщины младше 40 лет, перенесшие ранее репродуктивные неудачи. Пациенткам с тромбофилией выполнялась тромбопрофилактика бемипарином в дозе 3500 МЕ/сут. В итоге уровень благоприятных репродуктивных исходов в этой группе составил 55%, что позволило предположить положительную роль проведенной терапии бемипарином.
Учитывая, экзогенную гормональную нагрузку при проведении стимуляции суперовуляции в программе ЭКО и риск развития СГЯ, а также возможного возникновения тромботических осложнений, угрожающих жизни пациенток, необходим скрининг и контроль системы гемостаза не только для благополучного исхода беременности, но и для безопасности проведения вспомогательных репродуктивных технологий (ЭКО и ПЭ). Это позволит лечащему врачу иметь точку отсчета для начала медикаментозной терапии, определять дозу и кратность вводимого антикоагулянта (бемипарина), осуществлять контроль эффективности при проведении терапии и влиять на реализацию положительного репродуктивного исхода.
[youtube.player]Читайте также:


