Опухоль таранной кости что делать
Людмила Пашкевич, доктор мед. наук, профессор, заслуженный врач РБ;
Иосиф Воронович, доктор мед. наук, профессор, заслуженный деятель науки РБ;
Мохаммад Мохаммади, кандидат мед. наук, доцент, РНПЦ травматологии и ортопедии.
Диагностика новообразований стопы далеко не проста из-за особенностей анатомического строения и многообразия патологии. По данным зарубежной и отечественной литературы, частота новообразований составляет от 2,7% до 20,7%.
В строении стопы 26 костей, 33 сустава и более 100 сухожилий, связок и мышц, не считая сосудов и нервов, что обусловливает многообразие нозологических форм поражения. Это значительно усложняет распознавание опухолевого процесса на ранних этапах. Требуется дифференциальная диагностика с воспалительными, дегенеративно-дистрофическими, посттравматическими заболеваниями. От предельно точной верификации зависит адекватность выбранного метода лечения, а в конечном итоге — судьба пациента.
Стопа играет исключительно важную роль в статико-динамическом равновесии человеческого тела, является органом опоры и движения. На нее приходится значительная весовая нагрузка. Изменение анатомической формы одной из костей (особенно таранной и пяточной) при поражении опухолью приводит к нарушению функции отдельных суставов. Поэтому выявление патологии в начальной стадии имеет важное социальное и прогностическое значение.
Цель нашего исследования — изучение клинической, рентгенологической и морфологической характеристики диагностики опухолей стопы.
Материалом послужили истории болезни, рентгенологические снимки, CT-scan, MRI и операционная мягкая и костная ткань пациентов РНПЦ травматологии и ортопедии, имевших опухоли стопы.
Для патоморфологического исследования опухолевые ткани после фиксации и деминерализации окрашивали H&E и по Ван-Гизону, PAS, альциановым синим и IHC-методом к S-100, EMA, CK, Vim, ki-67, p53, bcl-2, CD 34 and Desmin.
Мы сопоставили клинико-рентгенологические проявления и морфологическую структуру у 228 пациентов с опухолями стопы. Доброкачественные были у 195 человек, первично-злокачественные — у 26, метастатические — у 7. Чаще новообразования поражали пяточную, таранную и плюсневую кости, а также проксимальные фаланги пальцев. Из доброкачественных преобладали костная киста (28 случаев), ОБК (14), хондрома (10). Подногтевые экзостозы (63 случая) чаще локализовались в ногтевой фаланге I пальца, поражая гребешок ногтевой фаланги. Среди первично-злокачественных преобладали синовиома (10) и остеогенная саркома (7). Хондросаркома и фибросаркома встречались у 4 больных (по 2 случая). У 5 метастатические опухоли урогенитального и колоректального происхождения локализовались в пяточной кости. Для каждой формы установлены критерии агрессивности. Выявлены клинико-рентгенологические и морфологические диагностические признаки, наиболее характерные для доброкачественных и злокачественных опухолей.
Несвоевременная диагностика нередко связана с неспецифичностью симптоматики, схожестью клинических и рентгенологических проявлений с другими патологическими процессами (зачастую картина расценивается как артрит, артроз, лигаментит, посттравматические изменения). И лечение начинают с физиотерапевтических процедур, которые лишь стимулируют рост новообразования, усиливают боли. Пациенты поступают в специализированные учреждения уже в далеко зашедшей стадии процесса, им выполняют радикальные хирургические вмешательства (вплоть до экстирпации пораженной кости).
Всем 228 наблюдаемым пациентам сделали операции — объем и характер зависел от нозологической формы новообразования, агрессивности процесса, направленности роста и размера очага деструкции.
Маскируются под артроз
Доброкачественные новообразования стопы, медленно растущие и расположенные внутри кости, диагностируют довольно поздно. Они длительно дают знать о себе лишь периодической неинтенсивной болью, которая ошибочно трактуется как проявление деформирующего артроза, плоскостопия, пяточной шпоры и т. д. Наибольшие трудности при диагностике вызывают кистоподобные процессы (энхондрома, хондромиксоидная фиброма, остеобластома, солитарная и аневризмальная костная киста, гигантоклеточная опухоль кости).
Остеома наблюдалась нами у 12 пациентов в возрасте от 8 до 51 года. Частая локализация — плюсневые кости (I — 4, II — 3, III — 1), ладьевидные кости (2 наблюдения). По гистологическому строению у 6 человек была губчатая остеома, у 4 — компактная. Клиническая картина характеризовалась умеренно выраженными болями, рентгенологически определялся участок повышенной плотности костной ткани.
Остеоид-остеома отмечена в 6 наблюдениях с преобладающей локализацией в таранной кости — 5 (в пяточной — 1). Встречалась у больных 12–23 лет. Имела типичную клиническую, рентгенологическую и морфологическую картину. Основной клинический симптом этой опухоли — резкая боль, усиливающаяся по ночам. При определении остеоид-остеомы пяточной кости следует проводить дифференциальную диагностику с костно-мозговой пазухой пяточной кости — редким вариантом развития, когда в кости есть участок, практически лишенный костного вещества и содержащий костный мозг. Изредка в центре пазух встречаются мелкие включения, обусловленные фронтальным расположением костных балок.
Гигантоклеточная опухоль кости была у 14 пациентов в возрасте от 11 до 33 лет (в основном женщины — 9). Локализовалась в таранной кости (7 случаев), в пяточной (1), в плюсневых костях (4), в первой клиновидной (1). Течение гигантоклеточной опухоли в костях стопы нами отмечено как благоприятное. Только у 1 человека произошел рецидив. Характеризуется умеренно нарастающими по интенсивности болями; ячеистым строением, с истончением кортикального слоя, вздутием пораженного отдела кости.
Солитарная костная киста наблюдалась у 28 пациентов (из них 20 мужчин). Пяточная кость — наиболее частая локализация (23 наблюдения).
Образование встречалось и в плюсневых костях (3 случая), основной фаланге I пальца (2). Возрастной диапазон — от 15 до 23 лет. Диагностика костной кисты не представляла затруднений. Во всех случаях диагноз верифицирован морфологически.
Точный диагноз — только после гистологии
Гемангиома диагностирована в 8 наблюдениях с преимущественной локализацией в пяточной кости (5 человек), в таранной, основных фалангах I и V пальцев стопы (по 1 случаю). Возраст пациентов — от 10 до 78 лет. Клинико-рентгенологическая диагностика затруднена. Точный диагноз поставили только после гистологического исследования. Смешанная гемангиома была у 4 больных, капиллярная — у 2, кавернозная — у 2.
Хондрома выявлена у 10 человек, возраст — от 9 до 15 лет. Локализация у 5 пациентов в фалангах пальцев, у 3 — в плюсневых костях, у 1 — в пяточной, у 1 — в клиновидной кости. В 3 наблюдениях отмечен патологический перелом. Следует отметить медленное и относительно благоприятное течение хондромы. Клиническая картина начальной стадии развития бессимптомна. Боли появляются в более позднем периоде.
Припухлость и деформация в месте локализации свидетельствуют об обширном поражении кости. Рентгенологическая картина вариабельна. Развиваясь внутри кости, хондрома значительно вздувает ее, придавая вид булавы, резко истончает кортикальный слой, нередко до едва различимого ободка.
Следует выделить 3 вида деструкции при хондромах: литический очаг; деструкция кости с точечными участками обызвествления хрящевой ткани; обызвествление или окостенение. Основные дифференциально-диагностические признаки хондром, отличающие их от гигантоклеточной опухоли кости, костной и аневризмальной кисты, — особая структура пораженной кости, наличие пятнистости, очагов уплотнения, неравномерность рисунка.
Подногтевые экзостозы (63 случая) представляют собой пограничные процессы с преимущественной локализацией в области ногтевой фаланги I пальца стопы (48) и значительно реже — в ногтевых фалангах других пальцев (III — 7, IV — 3, V — 4). Отмечены в возрасте от 13 лет до 31 года.
Лечение — только хирургическое.
Первично-злокачественные новообразования были у 26 пациентов. Из них у 10 — синовиома, у 7 — остеогенная саркома, у 2 — хондросаркома, у 2 — фибросаркома.
Остеогенная саркома локализовалась преимущественно в пяточной кости (5 наблюдений), в медиальной клиновидной — 1 и в средней фаланге V пальца — 1. Возраст пациентов — от 7 до 45 лет. Все прооперированы. По гистологическому строению в 2 случаях диагностирован хондробластический вариант остеогенной саркомы, в 1 — телеангиэктотический, в 3 — остеобластическая остеогенная саркома, в 1 — смешанный вариант.
Ночная боль — настоящая
Следует отметить, что всех пациентов беспокоили боли, нарастающие по интенсивности и изнуряющие, особенно ночью. Длительность клинической симптоматики от появления первичных болей до поступления в специализированные учреждения составила от 3 до 10 месяцев. Лишь после рентгенологического обследования была заподозрена злокачественная опухоль. Наиболее характерные признаки при поражении пяточной кости: гомогенное опухолевое костеобразование, поражающее почти всю кость; очертания пяточного бугра и нижнего края кости нечеткие, как бы расплывчатые. У 4 пациентов отмечено разрушение кортикального слоя по нижнему краю. Ни в одном наблюдении реакции периоста не выявлено.
Мы объясняем это особенностями анатомического строения — отсутствием камбиального слоя надкостницы, что следует учитывать при постановке диагноза. Патоморфологические исследования после экстирпации пяточной кости подтвердили наличие остеогенной саркомы.
Пациентов направили на дальнейшее лечение в РНПЦ онкологии и медицинской радиологии им. Н. Н. Александрова.
При ретроспективном изучении первичной рентгенограммы выявлены участки опухолевого костеобразования и мелкие остеолитические очажки деструкции с незначительным внекостным остеогенезом (если образование локализовалось в медиальной клиновидной кости). Периостальной реакции нет. Морфологический диагноз: смешанный вариант остеогенной саркомы медиальной клиновидной кости.
Для хондросаркомы с локализацией в кубовидной (1 случай) и II пястной кости (1 наблюдение) характерно медленное, слабоболезненное клиническое течение. Рентгенологически определяется литический очаг деструкции с мелкими участками уплотнения, разрушением кортикального слоя кости, отсутствием периостальной реакции и наличием экстраоссального компонента с мелкоточечными участками уплотнения.
Окончательный диагноз поставлен после морфологического исследования.
Без биопсии стопу не понять
Синовиальная саркома встречалась преимущественно у женщин (9) в возрасте от 25 до 70 лет. У мужчин — 1 наблюдение. Локализовалась у 7 пациентов в плюснефаланговых сочлениях, у 3 — в таранно-пяточном. Процесс долго протекает бессимптомно, безболезненно (до 3 лет, у 1 пациентки — 7 лет), но есть припухлость. Затем наступает период более ускоренного роста новообразования и усиления болей. Клинико-морфологические сопоставления с применением гистохимических и иммуногистохимических методов позволили установить, что более агрессивное течение процесса с сильными, изнуряющими болями характерно для гистиоидной формы с выраженным атипизмом клеточных элементов и значительным количеством атипичных митозов (до 10 в одном поле зрения). Для высокодифференцированных синовиом, где менее выражен атипизм, а фигур митозов — 1–2 в поле зрения, прогноз более благоприятный.
Метастатические поражения исключительно в пяточной кости были у 5 пациентов на 5–6-м десятилетии жизни. Характеризовались постепенно нарастающей болью, которая изнуряла. Рентгенологически выявлялся очаг неоднородной структуры с резким истончением кортикального слоя кости, в 2 наблюдениях целостность его была нарушена и определялся экстраоссальный компонент. Окончательный диагноз установлен только после гистологического изучения удаленных новообразований.
Отметим, что метастатические поражения костей стопы крайне редко встречаются в костной онкологии. Все пациенты поступали в клинику после осмотра онкологами. Лишь после установления вторичного характера поражения пяточной кости, благодаря гистологическим исследованиям и дальнейшим углубленным анализам и наблюдениям, онкологи установили первичный очаг. Это был рак урогенитального и колоректального происхождения.
Хирургическое вмешательство зависело от нозологической формы новообразования, его локализации и степени распространения.
Для доброкачественных и диспластических процессов единственный эффективный метод лечения — хирургический. Нами применялись резекция, экскохлеация, экстирпация и экзартикуляция пальцев.
При локализации процессов в наружных или задненаружных отделах тела таранной кости использовали чрезлодыжечный доступ, при расположении в шейке и переднем отделе блока таранной кости — передний доступ. В пяточной кости прибегали к наружному доступу, если новообразование было в наружных отделах. К внутреннему доступу — при поражении внутренних отделов.
Нами применялись преимущественно тыльные доступы при поражении других костей стопы; лишь в единичных случаях — подошвенный доступ.
Важно строго соблюдать принципы абластики — производить резекции в пределах видимых здоровых тканей. В сомнительных случаях взять экспресс-биопсию для уверенности в полном удалении опухоли. При ограниченных патологических процессах делали краевую резекцию, при более распространенных — сегментарную.
Когда новообразование вблизи суставного конца кости (особенно при опухоли хрящевого генеза), показана резекция суставного конца пораженного сегмента. При тотальном поражении нужна тотальная экстирпация любой кости стопы. Чтобы сохранить форму кости и функцию сустава, дефекты замещали с помощью ауто- и аллотрансплантатов. Изучив отдаленные результаты, считаем, что более полноценный пластический материал для заполнения дефектов костей стоп после удаления опухолей — аутотрансплантаты, взятые из гребня подвздошной или из дистального метафиза большеберцовой кости.
Для полноценной функции стопы нужно стараться сохранить хорошую подвижность в плюснефаланговых суставах.
При поражении опухолью дистальных отделов плюсневых костей с распространением деструкции в головку плюсневой кости выполняли сегментарную резекцию плюсневой кости с оставлением костно-хрящевого колпачка по методике Куслика. Экстирпация фаланг пальцев, за исключением первого пальца стопы, производилась при обширных поражениях проксимальных фаланг.
Выбор тактики хирургического лечения злокачественных новообразований согласовывали с онкологами РНПЦ онкологии и медицинской радиологии им. Н. Н. Александрова.
Анализируя материалы историй болезни, отмечаем, что диагностические ошибки при клинико-рентгенологическом обследовании допущены в пределах 9%. Наиболее трудными для распознавания были остеобластома (гигантская остеоид-остеома), гемангиомы пяточной и таранной костей, хондромиксоидная фиброма. В сложных случаях поставить диагноз помогала биопсия. Мы широко применяли метод экспресс-биопсии с последующим удалением патологического очага в пределах видимых здоровых тканей. Считаем это оправданным при наличии квалифицированных специалистов по костной патологии.
Какие выводы нужно сделать?
1. Обследовать пациентов с новообразованиями стопы комплексно, применяя весь современный
диагностический арсенал, включая КТ и МРТ.
2. Окончательный диагноз ставить только после патоморфологического исследования. Гистохимический и иммуногистохимический методы изучения опухолевой ткани тоже обязательны.
3. Объем и вид оперативного вмешательства непосредственно зависят от нозологической формы опухоли, ее локализации, распространения и степени агрессивности.
Переломы и вывихи таранной кости случаются нечасто. Они обычно происходят в результате мощного воздействия, например ДТП, падения с высоты или сильного удара в область голеностопного сустава.
Таранная кость — это мощная опорная структура, которая несет на себе колоссальную нагрузку веса всего организма. Давление на нее больше, чем на любую другую кость скелета.
В таранной кости различают тело и головку. Головка — самая передняя часть таранной кости — отделена от тела шейкой. Тело таранной кости практически полностью покрыто суставным гиалиновым хрящом.
Таранную кость снабжают кровью несколько сосудов, входящих в нее в области шейки. При переломах эти сосуды повреждаются. Без достаточного питания таранная кость начинает разрушаться. Разрушение кости вследствие нарушения кровообращения в ней называется асептическим некрозом. Асептический некроз и последующее нарушение функции голеностопного сустава — частый исход неправильного лечения травм таранной кости.
Наиболее распространены переломы шейки, головки, тела таранной кости, повреждения хряща суставной площадки. Переломы в основном оскольчатые и со смещением. Обычно переломы сочетаются с повреждениями связок вокруг голеностопного сустава и заднего отдела стопы. Переломы таранной кости часто вызывают разрыв кожи. Такие переломы считаются открытыми и требуют незамедлительного хирургического лечения.
Пациенты часто оказываются жертвами падения с высоты, авто- и мотоаварий. Также причиной переломов могут быть выворачивающее воздействие на таранную кость при падении со сноуборда или травмы во время занятий экстремальными видами спорта.
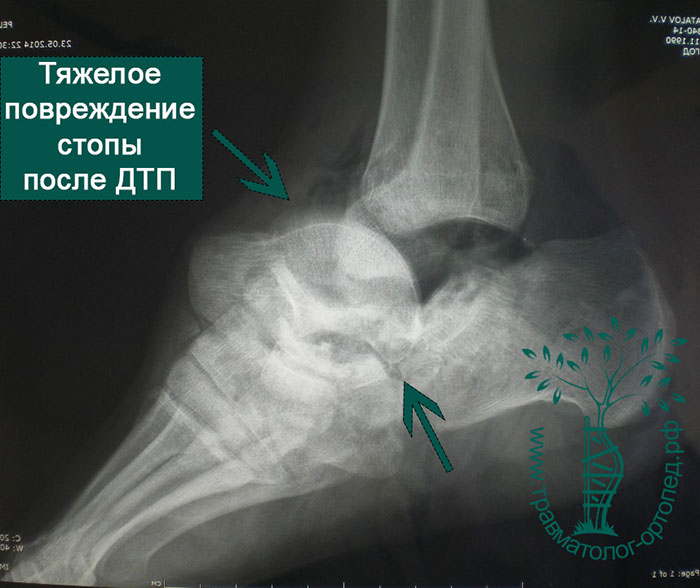
Голеностопный сустав и стопа болезненны и отечны. Если отломки таранной кости сместились, то можно заметить деформацию контуров стопы. При вывихах и подвывихах таранной кости кожа из-за деформации может натянуться, отслоиться от кости, инфицироваться и погибнуть. Чтобы избежать подобных осложнений, необходимо как можно быстрее диагностировать и устранить смещение таранной кости.
Переломы таранной кости, даже со смещением, достаточно сложны для диагностики и требуют значительного опыта у врача. Как правило, многие переломы таранной кости не всегда удается рассмотреть на первичных рентгенограммах. Компьютерная томография дает гораздо больше информации. КТ незаменима при планировании операции. По нашему мнению, КТ с 3D-моделированием должна выполняться всем пациентам без исключеня перед хирургическим вмешательством.
Также с помощью КТ и МРТ возможно выявить не видное на обычных рентгенограммах повреждение хряща таранной кости.
Тактика лечения таких переломов консервативная. Пациенту накладывается сапожок из обычного или пластикового гипса в особом положении стопы. Пластиковый гипс (полимерная повязка) в этом смысле более предпочтителен в гигиеническом плане (в нём можно мыться в ванне или принимать душ). Также полимерная повязка имеет значительно меньший вес, в отличие от классического гипса. По этой причине полимерная повязка позволяет облегчить процесс лечения у полных или ослабленных пациентов.
Нагрузка на ногу запрещается в течение 4–6 недель. Далее разрешается небольшая частичная небольшая нагрузка на стопу. Через 10–12 недель повязку снимают и доводят функцию нижней конечности до нормальных показателей.
Переломы таранной кости обычно со смещением или оскольчатые, с вовлечением голеностопного или подтаранного сустава. Иногда отломки смещены полностью.
Переломы со смещением с наличием подвывиха в смежных суставах должны быть оперированы. Во время операции производится открытая репозиция перелома и фиксация винтами.
При некоторых переломах операция на таранной кости может выполняться по малоинвазивной технологии. Для малоинвазивных операций не требуется широких разрезов кожи.
С помощью специальных инструментов и приспособлений производится закрытая репозиция перелома таранной кости. Затем производится рентгенологический контроль непосредственно в операционной и при удовлетворительном стоянии отломков выполняется фиксация спицами или стягивающими винтами через проколы кожи.
В послеоперационный период стопа переводится в возвышенное положение до спадения отека. Рекомендуется ношение ортезной повязки.
Для таранной кости характерны остеохондральные повреждения. Остеохондральными называются повреждения, при которых травмируются суставной хрящ и небольшой участок подлежащей кости. Обычно причиной остеохондральных повреждений является подвывих стопы, например при растяжении связок голеностопного сустава. Если фрагмент суставного хряща небольшой, его можно удалить артроскопическим путем. Во время артроскопического вмешательства травмированный участок таранной кости обрабатывается особым образом. Производятся перфорация кости, обработка плазмой (это требуется для стимуляции восстановления хрящевой ткани).
При переломах таранной кости нередко повреждаются мягкие ткани и кожа. Раны при открытых переломах порой бывают больших размеров. Существует риск инфицирования таких ран и кости.
Лечение такого повреждения должно быть начато незамедлительно, в экстренном порядке. Под наркозом производится хирургическая обработка раны с удалением всех нежизнеспособных тканей. В нашей клинике раны лечат новым инновационным методом отрицательного давления. После обработки к ране присоединяется специальный небольшой аппарат. С помощью данного аппарата и набора особых повязок в ране создается вакуум. Прибор постоянно эвакуирует из раны патологическое отделяемое, препятствуя ее инфицированию и нагноению. Само по себе отрицательное давление стимулирует и ускоряет заживление раны. После того как рана зажила, выполняется окончательная операция по фиксации перелома винтами.
При неправильно выполненной операции, если репозиция произведена неточно, перелом таранной кости может срастись со смещением. Неправильно сросшийся перелом таранной кости может привести к деформации суставной поверхности, ограничению движений и болевым ощущениям при опоре.
Кроме того, при нарушении техники хирургического вмешательства, а также повреждении сосудов, питающих таранную кость, может развиться асептический некроз таранной кости. Частота развития некроза зависит также от тяжести самой травмы и может варьироваться от 10 до 40%. При асептическом некрозе костная плотность тела таранной кости уменьшается. Форма таранной кости при остеонекрозе изменяется, что может повлиять на функцию всей стопы. Таранная кость уплощается (сплющивается). Иногда таранная кость при некрозе может распадаться на фрагменты.
Причиной боли и тугоподвижности после перелома таранной кости может стать и артроз подтаранного или голеностопного сустава. Он связан с повреждением суставов как непосредственно в момент травмы, так и в результате деформации при неправильном сращении таранной кости.
Обычно с болевым синдромом при артрозе можно справиться путем назначения обезболивающих препаратов. В некоторых случаях боль не позволяет вернуться к прежней нагрузке, поэтому показан артродез пораженного сустава. Артродез — это искусственное замыкание сустава, позволяющее уменьшить симптоматику при артрозе.
Таранная кость наиболее часто поражается остеобластекластомой, хондромой и хондросаркомой. При ограниченных, строго очерченных очагах, располагающихся в шейке и головке таранной кости, возможна резекция шейки и головки с последующей аутопластикой дефекта, артродезированием с ладьевидной костью.
Поражение всей таранной кости при быстро растущих опухолях требует или полного удаления таранной кости, или, при некоторых злокачественных опухолях, ампутации голени. Удаление таранной кости (астрогалэктомия) при опухолевом поражении — сложная операция, не имеющая ничего общего с астрогалэктомией, производимой при косолапости.
Операция полного удаления таранной кости при опухолевом поражении ее должна быть выполнена абластично. Нельзя брать таранную кость костедержателем и повертывать ее так, чтобы было удобно пересечь те или иные связки, нельзя резко супинировать и пронировать стопу во время операции, чтобы не нарушить целость опухоли, что особенно опасно при опухолях хрящевого генеза.
Удалять таранную кость следует из двух дугообразных разрезов — внутреннего и наружного, проходящих кзади от лодыжек. Сначала делают внутренний разрез над проекцией сосудисто-нервного пучка несколько кзади от внутренней лодыжки, переднюю часть разреза поднимают почти на тыльную поверхность стопы, чтобы можно было рассечь связки таранно-ладьевидного сустава. Выделяют и приподнимают на держалках сосудисто-нервный пучок, сухожилия задней большеберцовой мышцы и общего сгибателя пальцев, после чего рассекают весь связочный аппарат по внутренней поверхности и таранно-ладьевидные связки. Наружный разрез позволяет рассечь связки по наружной поверхности, и осторожно, чтобы не разорвать истонченный кортикальный слой, таранную кость удаляют через медиальный разрез.
В том случае, если во время операции выясняется, что опухоль (хондросаркома) распространяется на окружающие ткани, то кожные раны зашивают, стопу обертывают стерильным бельем, меняют перчатки, инструменты и проводят ампутацию голени. Если же удаление таранной кости прошло гладко, стопу сдвигают несколько кзади, чтобы вилка голеностопного сустава располагалась над передним отделом пяточной кости, и рану послойно зашивают. Это положение стопы фиксируют гипсовым сапожком на срок 1 — 1VS мес, разрешая больному постепенно нагружать ногу. Однако с годами развивается деформирующий атроз, появляются боли.
Поэтому нами предложена следующая операция (авторское свидетельство № 825039). После удаления таранной кости производят косую остеотомию (протяженность 8—10 см) большеберцовой кости в нижней трети из внутреннего разреза, который начинают несколько выше (рис. 34.3). Нижний отломок смещают до упора в верхнюю поверхность пяточной кости и заднюю поверхность ладьевидной. Удаляют хрящевой покров с суставных поверхностей и связки для образования костного сращения между большеберцовой, пяточной и ладьевидной костями. Отломки большеберцовой кости соединяют винтами и винтом же фиксируют болыпеберцовую кость к пяточной.

Рис. 34.3. Операция С.Т.Зацепина при разрушении таранной кости опухолью. а, б — таранная кость разрушена гигантоклеточной опухолью, патологический перелом; в, г — большеберцовая кость удлинена путем косой остеотомии, конец кости артродезирован с пяточной и ладьевидной костями.
Удаляют хрящевой покров и связки с медиальной поверхности наружной лодыжки, которую фиксируют винтом или костным аллогенным кортикальным штифтом к дистальному отломку большеберцовой кости. Послойно зашивают раны, накладывают гипсовую повязку. Этот способ операции позволяет получить хороший результат, исключить укорочение конечности, хромоту и развитие деформирующего артроза.
Ангиография при опухолях костей. Работа, проведенная нами совместно с В.Н.Бурдыгиным, Л.П.Кузьминой, А.А.Беляевой, М.К.Климовой, позволила убедиться в ценности ангиографии при диагностике опухолей костей вообще и патогномоничной симптоматике (остеоид-остеома, пигментно-виллезно-узелковый синовит).
Первое, что позволяет определить ангиография, — это степень смещения магистрального сосудистого пучка:
• незначительное отклонение от естественного хода;
• выраженное смещение с образованием дуги той или иной кривизны;
• резкое смещение в одной или двух плоскостях с образованием угла, приближающегося к прямому.
Совершенно естественно, что чем больше смещение и давление, тем сильнее воздействие опухоли на сосуды. Поскольку стенки вены тоньше и менее эластичны, чем у артерии, вена раньше уплощается, иногда настолько существенно, что тонкий ее просвет, заполненный уже сильно разбавленным в венозной фазе контрастным веществом, бывает или плохо виден, или не виден вовсе, а при операции оказывается, что вена сохранилась и просвет ее проходим.
При тромбозе магистральной вены, в чем можно убедиться с помощью флебографии, всегда бывают хорошо видимы коллатеральные вены, подкожные, которые компенсируют отток. Поэтому если во время операции хирургу не нужно иссекать большие массивы мягких тканей, когда возможно повреждение венозных коллатералей мягких тканей, то сдавление магистральной вены не влияет на план операции, если же во время операции будет нарушен отток по коллатералям, то в план операции нужно включать и пластику венозного сосуда. Артериальные сосуды могут быть смещены быстро растущей опухолью на значительные расстояния без заметного уменьшения диаметра сосуда, и только очень сильное натяжение, сдавление в узком желобе, образовавшемся в ткани опухоли, резкое изменение направления сосуда могут привести к сужению просвета артерии, гибели эластической и внутренней оболочек с последующим тромбозом.
Для уточнения границ распространения опухоли следует производить ангиографию. Поскольку на ангиограммах не бывают видны внутрикостные сосуды, то они и не помогают уточнению границ опухоли внутри кости. Границы опухоли кости в мягких тканях видны значительно лучше в результате изменения направления сосудов II, III, IV порядков, огибающих или питающих образование, а в капиллярной части злокачественной опухоли, расположенной в мягких тканях, и отдельные парабластоматозные узлы, не видимые на обычных рентгенограммах, достаточно интенсивно окрашиваются контрастом, что очень помогает хирургу. Истинные размеры хондросарком, паростальных сарком и опухолей с растущей хрящевой тканью, костно-хрящевых экзостозов позволяют увидеть их при ангиографическом исследовании. Эти размеры значительно больше определяемых на обычной рентгенограмме.
Многие годы нами производились сохранные операции без ангиограмм, причем операционные методики и техника операционных вмешательств были разработаны так, что опытный хирург на первом этапе, постепенно выделяя сосудистый пучок, вовремя замечает степень их сдавления или тромбоза и может изменить первоначальный план операции.
Хирургу, имеющему ангиограммы до операции, как правило, не приходится менять план операции, если он правильно понял произошедшие изменения в сосудистом русле, обнаружил распространение мягкотканного компонента опухоли, оценил изменения сосудистых стенок, поврежденных опухолью, правильно диагностировал наличие аневризмы и т.п. Особенно ценные сведения дает ангиография при рецидиве опухоли в ткани. Поэтому последние 20 лет мы стали широко пользоваться при обследовании больных ангиографическими данными, однако необходимо помнить, что это — инвазивный метод обследования и без достаточно определенных показаний его производить не следует; рекомендуется использовать УЗИ.
С.Т.Зацепин
Костная патология взрослых
Читайте также:


