Остеомиелит кролика что это
Источник: материалы XVII Московского международного конгресса по болезням мелких домашних животных
В последние годы, по данным ветеринарных клиник, хронический остеомиелит стал регистрироваться всё чаще и составляет на сегодняшний день 4,5% от общего количества хирургическибольных животных. В настоящее время проблема лечения такой категории больных является сложной, так как основной метод лечения - секвестротомия в сочетании с введением антибиотиков и сульфаниламидов (В. А. Лукьяновский, 1984) является высокотравматичным, и не всегда позволяет добиться полного выздоровления. Кроме того, травма, сопутствующий ей травматический шок, средства для общей анестезии, антибиотики, часто используемые в послеоперационный период, нередко провоцируют развитие вторичных иммунодефицитов (Ю. А.Ватников, 2002). К этому стоит добавить множественную антибиотикорезистентность возбудителей остеомиелита, часто наблюдаемую в последнее время, и некротизированную костную ткань, окружающую очаг остеомиелита и препятствующую транспорту лекарственных веществ при любом способе их введения в организм (Л. Г. Григорянц с соавт.,1991). Учитывая эти факторы, следует рассматривать иммунотерапию как один из основных компонентов в комплексном лечении больных хроническим остеомиелитом животных. В медицинской практике при данной патологии хорошо зарекомендовал себя генноинженерный аналог эндогенного цитокина – интерлейкин-2 человека, известный под названием Ронколейкин (Б. А. Жанкин, Т. Ж. Султанбаев и др., 2004).
Целью нашего исследования явилось изучение терапевтической эффективности Ронколейкина в комплексном лечении больных остеомиелитом животных. Оценочным критерием служили морфологические изменения в костях, возникающие под действием применяемых средств терапии.
При морфологическом исследовании кости на 45 сутки экспериментального моделирования отмечали следующие изменения: остеоны различного диаметра, некоторые из которых полнокровны и умеренно склерозированы, небольшие очаги разрушения костной ткани, в грануляционной ткани – умеренная диффузная клеточная инфильтрация, представленная лимфоцитами, сегментоядерными лейкоцитами. Эндост с пролиферацией остеобластов. Костный мозг был представлен жёлтым костным мозгом с полнокровными, склерозированными сосудами.
Больных хроническим остеомиелитом кроликов разделили на три группы по принципу аналогов, по 5 голов в каждой. Первая группа служила контролем. Второй группе вводили цефазолин в дозе 10 тыс. ЕД /кг живой массы, внутримышечно, 2 раза в сутки, 10 дней подряд. Для лечения третей группы экспериментальных животных применяли цефазолин в той же дозе, в комплексе с Ронколейкином, который инъецировали в дозе 20 тыс. МЕ /кг живой массы, подкожно, 1 раз в день на 1, 2, 4 и 6 сутки терапии.
В гистосрезах большеберцовых костей контрольной группы кроликов на 45-е сутки наблюдения отмечали фрагменты компактной костной ткани, переходящие в трабекулы подлежащей губчатой кости. Единичные трабекулы были утолщены, умеренно полнокровны.
В межбалочных пространствах отмечали наличие фиброретикулярной ткани. Жёлтый костный мозг местами обеднён элементами красного костного мозга. Фрагменты грануляционной ткани с клеточной инфильтрацией, представленной плазмоцитами, сегментоядерными лейкоцитами, единичными гистиоцитами. Периост и эндост не визуализировались.
К этому же времени в гистопрепаратах костей животных второй группы наблюдали костную пластинку, имеющую компактное строение, неактивный периост, остеоны различного диаметра. Некоторые из остеонов полнокровны и слегка склерозированы. Отмечались небольшие очаги
разрушения костной ткани. В грануляционной ткани – изменённая диффузная клеточная инфильтрация лимфоцитами, плазмоцитами, сегментоядерными лейкоцитами. Эндост местами с умеренной пролиферацией остеобластов. Костный мозг представлен, в основном, жёлтым костным мозгом, местами с полнокровными склерозированными сосудами.
К 45-м суткам морфологические изменения в большеберцовых костях кроликов третей группы были следующими: костная пластинка компактного строения, переходящая в трабекулы подлежащей губчатой костной ткани, имела участки обызвествления. Межбалочные пространства содержали фиброретикулярную ткань. Встречались очаги разрастания костной ткани, вокруг которых располагались грануляции со слабой клеточной воспалительной реакцией (рис.8). Костный мозг полнокровный с элементами красного костного мозга. Периост частично был сохранён, эндост – без изменений.
Полученные данные дают нам основания предположить, что костной ткани контрольной группы кроликов развилась картина хронического воспаления. Об этом свидетельствует наличие в образовавшейся грануляционной ткани единичных гистиоцитов, плазмоцитов, сегментоядерных лейкоцитов. Патоморфологическая картина, наблюдаемая при исследовании гистосрезов костей кроликов второй группы, свидетельствует о течении подострого воспаления. Наличие очагов обызвествления и развитие молодой грануляционной ткани, выявляемые у кроликов третьей группы, являются признаками благоприятного течения процесса в зоне поражения, что, на наш взгляд, может быть обусловлено иммуномодулирующим действием Ронколейкина.
Таким образом, применение рекомбинантного интерлейкина-2 человека (Ронколейкина) в комплексной терапии при остеомиелитах животных может быть рекомендовано в качестве средства иммунореабилитации больных остеомиелитом животных.
Остеомиелит (Osteomyelitis) - воспаление костного мозга. Принято различать две группы остеомиелитов - асептические (более легкая форма) и инфекционные. Инфекционные остеомиелиты классифицируют по роду возбудителей: на гнойный, актино- микозный, туберкулезный, сапной и т. д. У животных чаще всего наблюдается гнойный и актиномикозный остеомиелит. В зависимости от путей проникновения микробов различают следующие разновидности гнойного остеомиелита: гематогенный, если вирулентные микробы заносятся током крови в сосуды костного мозга по продолжению, когда гнойный процесс распространяется с мягких тканей на надкостницу, а затем по фолькмановским и гаверсовым каналам в костный мозг; раневой, если причиной развития остеомиелитического процесса послужило открытое механическое повреждение.
Гнойное воспаление костного мозга изолированно протекает очень редко. В процесс быстро вовлекаются все элементы кости: эвдост, губчатое вещество, компактная часть и надкостница. Таким образом, остеомиелит есть воспаление всей кости - паностит.
По течению гнойные остеомиелиты делят на острые и хронические. Острые гнойные остеомиелиты характеризуются бурным течением, диффузным поражением с ярко выраженными септическими явлениями, и нередко они заканчиваются гибелью животного от сепсиса. Хронические гнойные остеомиелиты протекают локализованно с образованием секвестров, ограниченных разросшейся остеоидной тканью, и гнойных свищей.
У животных наиболее часто гнойным остеомиелитом поражаются нижняя челюсть (при гнойном периодонтите и пульпите коренных зубов), ребра, пястная и плюсневая кости, маклоковый бугор, остистые отростки.
Этиология. Предрасполагающими причинами служат травмы кости, охлаждение, истощение, авитаминоз и тяжелые заразные заболевания, понижающие резистентность костного мозга и сопротивляемость организма к инфекции в целом. Непосредственными причинами асептического остеомиелита чаще всего являются закрытые механические повреждения (ушибы, сотрясения, удары и т. п.), а гнойного - открытые переломы, проникающие до кости инфицированные ранения, гнойные периоститы.
Патогенез. Асептическое воспаление костного мозга обычно сопровождается гиперемией, экссудацией и эмиграцией лейкоцитов. Протекает оно благоприятно и заканчивается бесследно. При вовлечении в воспалительный процесс эндоста возможно образование внутренних накостников - эндостоза.
При внедрении микробов в костный мозг первоначально возникает диффузное реактивное воспаление, которое характеризуется расширением сосудов и гиперемией костного мозга, повышением проницаемости сосудов и воспалительным отеком, замедлением кровотока, стазом в капиллярах и мелких сосудах. В даль-нейшем развивается тромбангит и тромбофлебит, а также фибриноидное набухание сосудистой стенки и ее некроз. Костномозговая ткань пропитывается серозно-фибринозным, а затем гнойным экссудатом. Гнойно-некротический процесс может распространяться по гаверсовым и фолькмановским каналам и достигать надкостницы и окружающих мягких тканей, образуя в них абсцессы, при самостоятельном вскрытии которых образуются гнойные свищи. Абсцедирование и эвакуация через свищи наружу гнойно-некротических масс приводит к снижению интоксикации организма и затуханию острых воспалительных явлений.
Диффузное эндостальное или периостальное нагноение вызывает омертвение костной ткани, которая под влиянием демаркационного воспаления отторгается в виде костных секвестров (см. Некроз кости).
Секвестр на границе живой и мертвой ткани со стороны периоста, губчатого вещества, гаверсовых каналов и костного мозга отграничивается оссеоидной грануляционной тканью. Последняя, обызвествляясь, образует костный футляр (секвестральная коробка), выстланный грануляциями. В стенке секвестральной коробки обычно имеются отверстия, через которые гной прорывается в мягкие ткани, под кожу, образуя затеки и свищи. Последние чаще закрываются после оперативного удаления костного секвестра и гноя или самостоятельного их выхода; реже это наблюдается при наличии секвестра по мере затихания острых воспалительных явлений и инкапсуляции его. В последнем случае при неблагоприятных условиях (инфекционные заболевания, истощение, травма, охлаждение и т. п.) может развиться воспалительный процесс и возникнуть рецидивирующий хронический остеомиелит.
При остеомиелите происходят изменения химического состава различных тканей организма, нарушения активности ферментных систем, белкового, углеводного, минерального, липидного и витаминного обменов.
Изменения в минеральном составе костной и зубной тканей в различные периоды заболевания проявляются не только понижением в них кальция, фосфора и азота, но и нарушением их соотношений. В сыворотке крови количество кальция повышается, а фосфора понижается, наступают значительные сдвиги кислотно-щелочного равновесия в сторону ацидоза.
Уровень витаминов - аскорбиновой кислоты, тиамина, филлохинона и ретинола - резко падает. Это свидетельствует об истощении запасов витаминов в организме. Поэтому необходимо больным остеомиелитом в процессе лечения вводить в рационы повышенное количество указанных витаминов.
Раневой остеомиелит в отличие от гематогенного вызывается смешанной инфекцией, которая проникает в кость в место перелома снаружи, а при огнестрельных ранениях - одновременно с ранящими металлическими осколками. Гнойный воспалительный процесс в этом случае развивается не в замкнутой полости костномозгового канала, а в концах переломанной кости и между отломками. Костный мозг при этом также травмируется и инфицируется, но воспалительный процесс редко распространяется по костномозговому каналу, так как он ограничен краевой зоной и пограничным грануляционным барьером.
Гематогенный остеомиелит развивается под влиянием одного вида микроба (моноинфекция) в замкнутой костномозговой полости в виде флегмоны костного мозга. Остеомиелитический процесс развивается всегда изнутри кнаружи: гной, просачиваясь через гаверсовы и фолькмановские каналы, отслаивает надкостницу. Компактный слой кости, омываемый с наружной и внутренней стороны гноем, омертвевает и затем превращается в костный секвестр.
Клинические признаки. Гнойный остеомиелит протекает разнообразно. В острых случаях появляются симптомы тяжелого инфекционного заболевания: повышаются температура тела, частота пульса и дыхания, развивается гиперлейкоцитоз. Моча часто содержит капельки жира, которые хорошо обнаруживаются при окраске суданом III.
При заболевании кости конечности внезапно наступает сильная хромота, при движении животное совершенно не опирается на конечность. В области поражения и смежных участках наблюдается обширное припухание, обусловленное инфильтрацией мягких тканей и надкостницы. Пальпацией, а особенно перкуссией, на месте поражения обнаруживается болезненная реакция. Регионарные лимфатические узлы увеличены и болезненны при пальпации.
В более поздние сроки происходит увеличение пораженной кости вследствие развития оссифицирующего периостита. В окружающих мягких тканях формируются мелкие гнойнички или абсцессы, которые, вскрываясь наружу, образуют свищи, сообщающиеся с костномозговой полостью. Гнойный экссудат при остеомиелите обычно имеет примесь капелек жира костного мозга и мелкие час-тички разрушенной кости.
У лошадей, свиней и собак из свищей истекает большое количество гнойного экссудата с ихорозным запахом. У рогатого скота выделение гноя, как правило, незначительное.
Хроническое течение остеомиелита приводит к избыточному образованию костной ткани со стороны надкостницы (гиперос- тоз), разрежению кортикального слоя кости (остеопороз) и некрозу, что обнаруживается при рентгеновском исследовании. Припухлость мягких тканей уменьшается, она становится плотной и более четко контурирующей в очаге поражения кости.
Диагноз подтверждают рентгенографией.
Прогноз осторожный или сомнительный.
Лечение. В острых случаях гнойного остеомиелита из общих мероприятий больному животному назначают полный покой, обильную подстилку, рацион, богатый витаминами. В целях предупреждения развития сепсиса, ограничения остеомиелитическо- го процесса и поднятия защитных иммунобиологических реакций применяют антибиотики в сочетании с сульфаниламидами, камфорную жидкость Кадыкова, новокаиновую блокаду, переливание крови.
Местно на ранних стадиях остеомиелитического процесса рекомендуют внутрикостное введение антибиотиков на новокаине с целью оборвать дальнейшее его развитие. В запущенных случаях также назначают внутрикостное введение антибиотиков в период предоперационной подготовки, чтобы подавить инфекцию и облегчить послеоперационное течение.
При остеомиелитах, сопровождающихся прогрессирующим разрушением кости, а также тяжелой септической интоксикацией, целесообразно наиболее раннее оперативное вмешательство. Выжидательное отношение к такого рода гнойным очагам совершенно недопустимо. Оперативное лечение должно быть направлено на ликвидацию гнойно-некротического процесса путем удаления пораженных костей в пределах здоровых тканей. Для обеспечения хорошего стока гнойного экссудата и проведения секвестротомии разрезы делают по возможности широкие. Обнажение и удаление очага поражения производят, как правило, поднадкостнично, так как восстановление костной ткани в дальнейшем идет в основном за счет надкостницы. Последнюю отделяют вместе с мягкими тканями. Трепанацию секвестральной коробки или кости осуществляют с помощью долот или фрез. Некротические костные стенки удаляют люэровскими щипцами, секвестры и разросшиеся грануляции - острой ложкой.
Следует иметь в виду, что при удалении костных секвестров и некротических тканей целесообразно перед проведением кюрета- жа секвестральную полость хорошо промыть теплым раствором фурацилина, а затем обработать спирт-эфиром. По окончании операции полость вновь орошают спирт-эфиром и обильно при-сыпают тонкими пудрами сложных антисептических порошков с обязательным включением в них антибиотиков. Хорошее действие оказывают синтомициновая и стрептомициновая эмульсии, а также линимент А. В. Вишневского, которыми заливают рану и пропитывают марлевые дренажи.
Для обеспечения полного покоя оперируемой области и предупреждения переломов или смещения отломков накладывают гипсовую повязку, которую снимают после исчезновения острой воспалительной реакции. В ряде случаев делают окончатую гипсовую или шинно-гипсовую повязку. При гнойном остеомиелите трубчатых костей у овец и собак хороший результат дает орошение пораженных костномозговых полостей свежеприготовленным 2%-ным раствором хлорацида в сочетании с травертиновой подкормкой, которая стимулирует остеогенез и нормализует минеральный обмен.
При хронических формах остеомиелита лечение должно быть оперативным (секвестротомия) и сочетаться с антибиотиками и сульфаниламидными препаратами. Из физических методов лечения при подостро и хронически протекающем асептическом остеомиелите назначают ультрафиолетовое облучение в эритемных дозах, УВЧ, озокерито- и парафинолечение. Две последние процедуры в основном показаны после оперативных вмешательств в стадии затихания воспалительного процесса, при отсутствии выраженного нагноения и затеков.
Профилактика. Сводится к возможно ранней и тщательной обработке ран и особенно открытых переломов.
Владельцы патента RU 2377011:
Изобретение относится к области ветеринарии. Способ включает комплексную терапию и иммуностимулирующий препарат-корректор интерферонового статуса. Дополнительно индуцируют рост, деление и активность Т- и В-лимфоцитов иммунной системы введением ронколейкина на 1, 2, 3 и 6 сутки терапии в нормативной дозе 20 тыс.МЕ/кг живой массы на курс лечения. Способ сокращает сроки лечения, устраняет необходимость проведения повторных курсов терапии. 3 табл.
Изобретение относится к ветеринарии, а именно к способам иммунотерапии заболеваний, протекающих со снижением иммунного статуса, конкретно к способам лечения больных хроническим остеомиелитом животных.
Известен способ лечения больных хроническим остеомиелитом (патент №2073514), включающий введение антибактериальных и десенсибилизирующих средств, витаминов, анаболов с дополнительным введением до и после операции ксимедона по 0,5 г 4 раза в день в течение 20 суток и последующим повторением курсов лечения через 6 месяцев на протяжении 1,5 лет.
Недостатками данного способа являются длительный курс лечения (до 20 суток) и необходимость проведения повторных курсов лечения данным препаратом через 6 месяцев на протяжении 1,5 лет.
Известен способ лечения остеомиелита (прототип - патент РФ на изобретение №2152214), включающий иммуностимулирующие препараты, согласно которому корригируют интерфероновый статус введением индукторов интерферона класса неовир, циклоферон в дозе 500-1600 мг на курс лечения. Данные стимуляторы интерферонообразования вводят с момента поступления больного внутримышечно через день курсом 5-7 инъекций в дозе 4-6 мг/кг, в итоге курс лечения по длительности составляет 14 суток.
Недостатками данного способа являются длительный курс лечения (до 14 суток) и необходимость проведения повторного курса лечения при существенном снижении интерферонового статуса.
Технической задачей является сокращение сроков лечения, устранение необходимости в проведении повторных курсов терапии.
Техническая задача достигается способом лечения хронического остеомиелита у животных путем осуществления традиционной комплексной терапии, включающей иммуностимулирующий препарат-корректор интерферонового статуса, отличающийся тем, что дополнительно индуцируют рост, деление и активность Т- и В-лимфоцитов иммунной системы введением ронколейкина на 1, 2, 3 и 6 сутки терапии в нормативной дозе 20 тыс.МЕ/кг живого веса.
Отличие предлагаемого изобретения от прототипа состоит в том, что дополнительно индуцируют рост, деление и активность Т- и В-лимфоцитов иммунной системы введением ронколейкина на 1, 2, 3 и 6 сутки терапии в нормативной дозе 20 тыс.МЕ/кг живого веса.
Способ осуществляют следующим образом.
Проводят традиционную комплексную терапию, включающую санацию гнойного очага, его дренирование, антибактериальную, дезинтоксикационную, десенсибилизирующую и антиоксидантную терапию, одновременно проводят стимуляцию иммунитета: коррекцию интерферонового статуса, дополнительное индуцирование роста, деления и активности Т- и В-лимфоцитов путем введения ронколейкина в дозе 80 тыс.МЕ/кг живого веса на курс лечения. При этом вводят с момента поступления больного животного внутримышечно или подкожно на 1, 2, 3 и 6 сутки по 20 тыс.ME на 1 кг живого веса.
| Таблица №1 | |||
| Иммунологические показатели в процессе моделирования хронического остеомиелита у кроликов | |||
| Срок моделирования | Показатели | ||
| Содержание γ-ИНФ, (пг/мл) | Содержание Т-лимфоцитов, (%) | Содержание В-лимфоцитов, (%) | |
| До начала моделирования | М-19,14 | М-37,3 | М-13,1 |
| m-1,32 | m-1,20 | m-1,12 | |
| К концу моделирования (к 45 суткам) | М-8,94 | М-23,4 | М-9,2 |
| m-1,03 | m-0,23 | m-0,13 |
Как видно из таблицы 1, количество Т-лимфоцитов в периферической крови экспериментальных животных к 45 суткам достоверно ниже (23,4%), чем до экспериментального моделирования (37,3%). В процессе экспериментального моделирования наблюдалась тенденция к стойкому снижению В-лимфоцитов. Так, до заражения их процент в среднем составлял 13,1, а уже к 45-м суткам болезни - 9,2. Уровень γ-ИНФ (γ-интерферон) перед экспериментальным моделированием составлял 19,14 пг/мл, а к 45-м суткам после операции резко снизился до 8,94 пг/мл. По данным иммунологических показателей, все кролики нуждались в иммунной реабилитации.
После окончания курса лечения экспериментально больных животных хроническим остеомиелитом кроликов по предлагаемому способу и по способу прототипа у кроликов, которым вводился ронколейкин, наблюдалось более благоприятное течение процесса по сравнению с группой, которой вводили циклоферон. Оно выражалось в ранней нормализации температуры, исчезновении рентгенологических признаков воспаления, развитии грануляционной ткани. Клиническое улучшение подтверждается данными лабораторных исследований, приведенных в таблице №2.
| Таблица №2 | ||||||
| Иммунологические показатели у кроликов в процессе их лечения по предлагаемому способу и по способу прототипа | ||||||
| Срок лечения | Показатели | |||||
| Содержание γ-ИНФ, (пг/мл) | Содержание Т-лимфоцитов, (%) | Содержание В-лимфоцитов, (%) | ||||
| по предлагаемому способу | по прототипу | no предлагаемому способу | по прототипу | no предлагаемому способу | по прототипу | |
| До начала лечения | М-8,94 | M-8,94 | М-23,4 | M-23,4 | М-9,2 | М-9,2 |
| m-1,03 | m-1,03 | m-0,23 | m-0,23 | m-0,13 | m-0,13 | |
| На 1 сутки лечения | М-8,95 | M-8,93 | М-23,5 | M-23,4 | М-9,3 | М-9,2 |
| m-1,11 | m-0,12 | m-0,27 | m-0,42 | m-0,03 | m-0,15 | |
| На 2 сутки лечения | М-16,93 | М-10,83 | М-25,4 | M-23,7 | М-10,1 | М-9,2 |
| m-0,96 | m-1,17 | m-0,13 | m-0,17 | m-0,15 | m-0,23 | |
| На 3 сутки лечения | М-25,28 | М-12,72 | М-28,8 | M-24,1 | М-12,62 | М-9,3 |
| m-1,01 | m-1,01 | m-1,01 | m-1,03 | m-0,32 | m-0,18 | |
| На 4 сутки лечения | М-25,29 | М-14,61 | М-28,8 | M-24,4 | М-14,3 | М-9,3 |
| m-1,03 | m-0,89 | m-0,23 | m-1,18 | m-0,65 | m-0,56 | |
| На 5 сутки лечения | М-23,87 | М-16,51 | M-26,1 | M-24,7 | М-12,9 | М-9,4 |
| m-1,19 | m-1,05 | m-1,14 | m-0,65 | m-1,12 | m-0,6 | |
| На 6 сутки лечения | М-23,85 | M-20,29 | M-26,4 | M-24,9 | М-13,0 | М-9,6 |
| m-0,94 | m-1,11 | m-0,31 | m-0,23 | m-0,01 | m-0,47 | |
| На 7 сутки наблюдения (через 6 суток от начала лечения) | M-28,18 | М-20,32 | M-29,3 | M-25,1 | М-14,8 | М-9,6 |
| m-1,74 | m-1,07 | m-1,42 | m-0,87 | m-1,12 | m-1,04 | |
| На 8 сутки наблюдения (через 7 суток от начала лечения) | M-28,13 | М-21,06 | M-29,7 | M-25,3 | М-14,5 | М-9,5 |
| m-0,94 | m-0,74 | m-1,12 | m-1,17 | m-0,95 | m-1,24 | |
| На 9 сутки наблюдения (через 8 суток от начала лечения) | M-28,15 | M-21,86 | M-29,9 | M-25,6 | М-14,6 | М-9,6 |
| m-0,91 | m-1,02 | m-1,08 | m-0,82 | m-0,82 | m-0,14 | |
| На 10 сутки наблюдения (через 9 суток от начала лечения) | M-28,20 | М-22,61 | M-29,8 | M-25,9 | М-14,7 | М-9,6 |
| m-1,06 | m-0,57 | m-0,85 | m-1,25 | m-1,04 | m-0,84 | |
| Через 14 суток от начала лечения | М-28,86 | M-27,02 | M-32,14 | M-26,3 | М-17,6 | М-9,6 |
| m-1,94 | m-1,17 | m-1,59 | m-0,76 | m-1,43 | m-0,68 | |
| Через 20 суток после курса лечения | М-28,03 | M-25,63 | M-39,6 | M-20,6 | M-22,3 | М-8,8 |
| m-1,87 | m-1,24 | m-1,64 | m-0,87 | m-1,18 | m-0,07 |
Иммунологические показатели уровня γ-ИНФ, Т- и В-лимфоцитов, представленные в таблице 2, свидетельствуют о том, что за первые трое суток введения происходит накопление препарата в крови, который провоцирует клетки организма к выработке γ-интерферона, Т- и В-лимфоцитов. Затем на 4 и 5 сутки уровень γ-интерферона, Т- и В-лимфоцитов остается практически без изменений, поэтому нет необходимости ежедневного введения препарата. Тем не менее, на 5-е сутки уровень γ-интерферона Т- и В-лимфоцитов несколько уменьшается, поэтому на 6-е сутки снова вводится ронколейкин. А после истечения 6-х суток, кроме нормализации иммунологических показателей, наблюдается улучшение состояния животных по клиническим признакам и стойкий терапевтический эффект в течение последующих суток наблюдения без регистрации случаев возникновения рецидивов.
Из таблицы 2 также видно, что применение препарата-корректора ронколейкина в комплексном лечении хронического остеомиелита через 6 суток курса терапии приводит к достоверному повышению в 1,3 раза уровня Т-лимфоцитов в периферической крови группы больных животных, леченных по предлагаемому способу. У больных животных, которым ронколейкин не применялся, а вводился циклоферон, через 6 суток лечения повышение Т-лимфоцитов было минимальным (в 1,1 раза). Через 6 суток от начала лечения наблюдалось увеличение количества В-лимфоцитов в 1,6 раза у кроликов, в комплексном лечении которых применялся ронколейкин, и практически не изменилось у экспериментальных животных, которым инъецировали циклоферон. Так, процент Т-лимфоцитов на 20-е сутки после окончания курса терапии составил 39,6 в крови кроликов, лечение которых проводилось по предлагаемому способу, и 20,6 - в крови кроликов группы сравнения. Относительное содержание В-лимфоцитов к этому же периоду составило 22,3 и 8,8% соответственно. Изменения в клеточном звене иммунитета кроликов, леченных по методу прототипа, позволяют выявить недостаточное функционирование иммунной системы. По окончании курса терапии по предлагаемому способу у экспериментально больных кроликов через 6 суток содержание γ-ИНФ увеличилось в 3 раза, в то время как у кроликов, леченных по методу прототипа, содержание γ-ИНФ увеличилось в 3 раза только через 14 суток. Кроме того, у животных, которым применялся ронколейкин, в отдаленном периоде (к 20-м суткам) после окончания курса терапии показатель γ-ИНФостался на высоком уровне, в то время как в группе кроликов, которым применялся циклоферон, произошло его снижение в 1,2 раза.
Сохранение показателя γ-ИНФ на высоком уровне свидетельствует о достижении стойкого клинического эффекта, что исключает необходимость в проведении повторных курсов терапии. Предложенный способ сокращает сроки лечения с 14 до 6 дней (таблица №3).
| Таблица №3 | ||
| Сравнительные показатели продолжительности курса лечения по предлагаемому способу и по способу-прототипу | ||
| Показатель | По прототипу | По предлагаемому способу |
| Продолжительность курса лечения (сутки) | 14 | 6 |
Результаты проведенных исследований позволяют сделать вывод, что использование ронколейкина в коррекции нарушений процессов костеобразования и иммунодепрессий является эффективным и может быть использован в клинике.
Способ лечения хронического остеомиелита у животных путем осуществления традиционной комплексной терапии, включающей иммуностимулирующий препарат-корректор интерферонового статуса, отличающийся тем, что дополнительно индуцируют рост, деление и активность Т- и В-лимфоцитов иммунной системы введением ронколейкина на 1, 2, 3 и 6 сутки терапии в нормативной дозе 20 тыс.МЕ/кг живой массы на курс лечения.
Содержание декоративных грызунов и кроликов — широко распространенное в настоящее время увлечение.Наиболее часто дома содержат крыс, сирийских и карликовых (Кемпбелла и джунгарских) хомячков, песчанок, морских свинок, шиншилл, дегу и представителя отряда зайцеобразных, кролика.
По типу питания этих животных разделяют на две группы:
— всеядные грызуны – крысы, хомяки, песчанки;
— травоядные – кролики, морские свинки, шиншиллы и дегу.
Однако животные из этих групп различаются между собой не только составом рациона, но и анатомией и физиологией зубов, прежде всего, коренных.
Особенностью травоядных грызунов является пожизненный постоянный рост коронки всех зубов, как резцов, так и коренных зубов. У всеядных грызунов – постоянно растут только резцы, а коренные имеют стабильную длину коронки. Стачивание растущих зубов обеспечивается прежде всего за счет трения верхних зубов об нижние (а не за счет поедания твердого корма или специальных минеральных камней). Также происходит и самозатачивание резцов. Грызунов имеют различия в зубной формуле, т.е. говоря по-простому – разное количество зубов во рту (у кролика – 28, у свинки и шиншиллы – 20). Общим для всех грызунов и кроликов является наличие в ротовой полости резцови коренных зубов при отсутствии клыков.
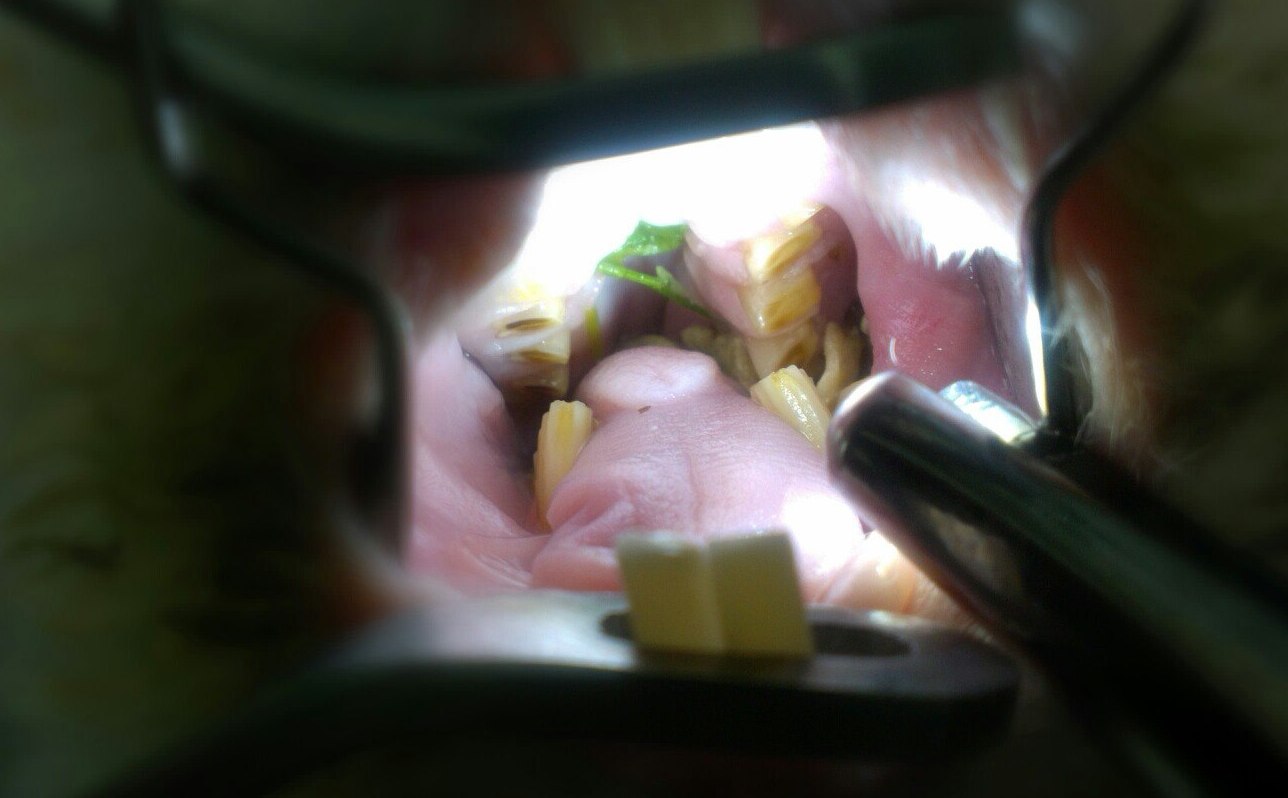
Важным моментом нормального пищеварительного процесса в ротовой полости является окклюзия — совпадение жевательных поверхностей противостоящих зубов (верхних и нижних). Достаточно небольшой дислокации (смещения положения в сторону на доли миллиметра) и процесс роста зуба становится избыточным, что приводит к изменению коронки (ее удлинению, нарушению формы, появлению острых граней и отростков). Развивается малокклюзия.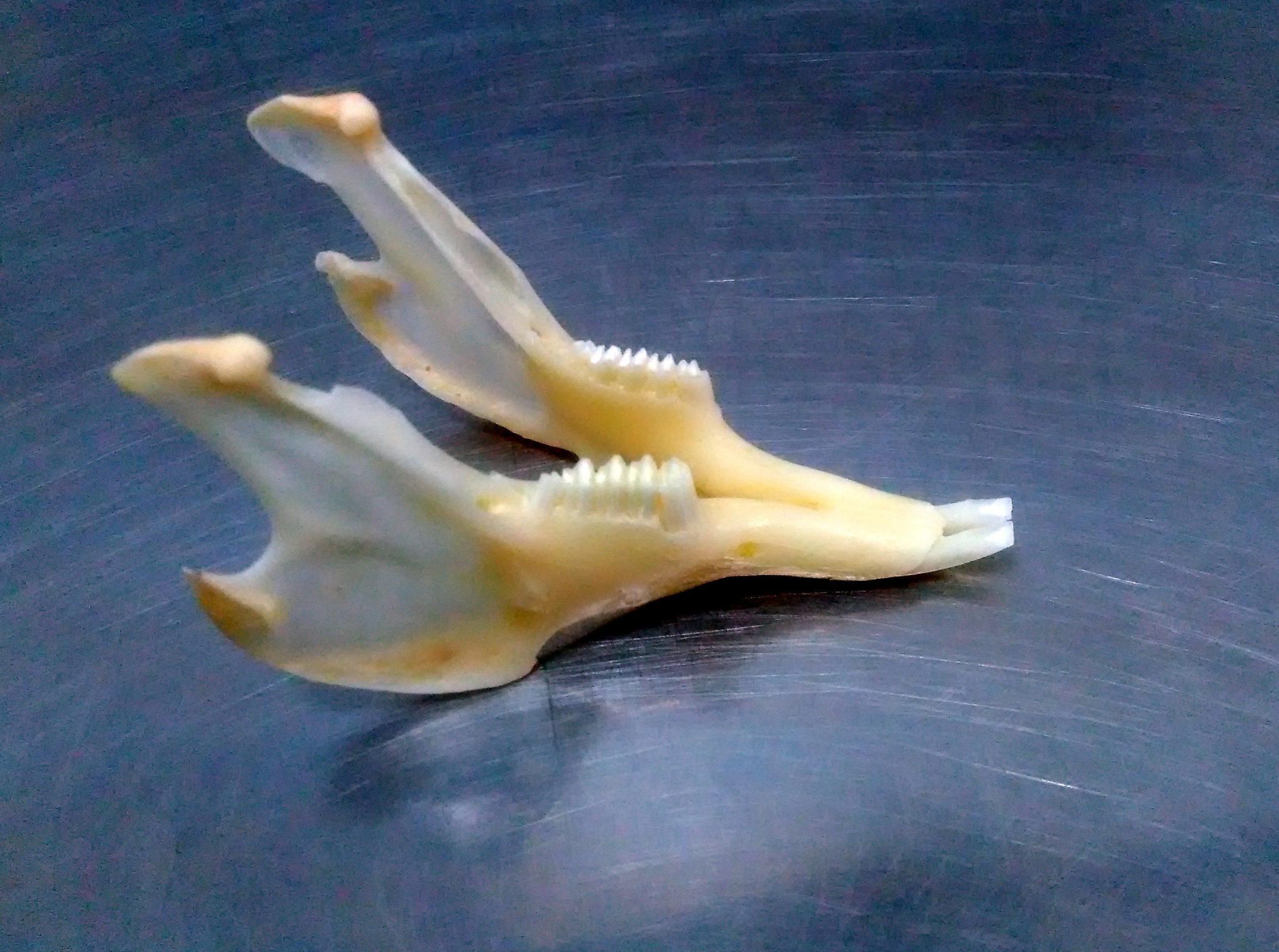
Малокклюзия – заболевание, вызванное несовпадением жевательных поверхностей и приводящее к неправильному стиранию зубов и формированию на них выступов, травмирующих мягкие ткани ротовой полости и окружающие зуб костные структуры.
Непосредственно малокклюзия — это именно нарушение правильного стачивания зубов. Однако следствием малокклюзии становится развитие и иных заболеваний и патологических состояний:
1. повреждение слизистой оболочки/образование язв в ротовой полости и на языке;
2. нарушение роста корней зубов;
3. инфицирование носослезного канал, заглазничного пространства, костной ткани, с дальнейшим развитием гнойного конъюнктивита, заглазничных абсцессов, абсцессов нижней челюсти, остеомиелита;
4. нарушение работы височно-челюстного сустава;
5. отказ от пищи, истощение, обезвоживание животного, развитие тимпании и\или атонии желудочно-кишечного тракта;
6. угроза сепсиса и гибели питомца;
7. развитие вторичных заболеваний вне пищеварительного тракта – дерматита, пододерматита, ринита, баланопостита.
Все эти заболевания рассматриваются как единый процесс, и обобщается одним названием – дентальный синдром или дентальная болезнь.
Причины развития малокклюзии:
— генетический дефект челюстного аппарата;
— нарушение плотности тканей зубов вследствие погрешностей в кормлении (нарушение обмена кальция, фосфора и витамина Д);
— травматическая малокклюзия – последствия травмы в области головы;
— имеются данные, что у большинства травоядных грызунов и кроликов старше 3-4 лет имеется та или иная форма/стадия дентальной болезни.
Наиболее заметные для владельца симптомы дентальной болезни:
— полный или частичный отказ от пищи;
— быстро прогрессирующее истощение;
— ухудшение внешнего вида волос по всему телу, обильное выпадение волос;
— загибание резцов в ротовую полость или рост за пределы ротовой полости,
— воспаление губ, десен, обильное слюноотделение изо рта;
— припухлости (абсцессы) в области нижней челюсти;
— выделение гноя из глаз (гнойный конъюнктивит);
— отсутствие дефекации.
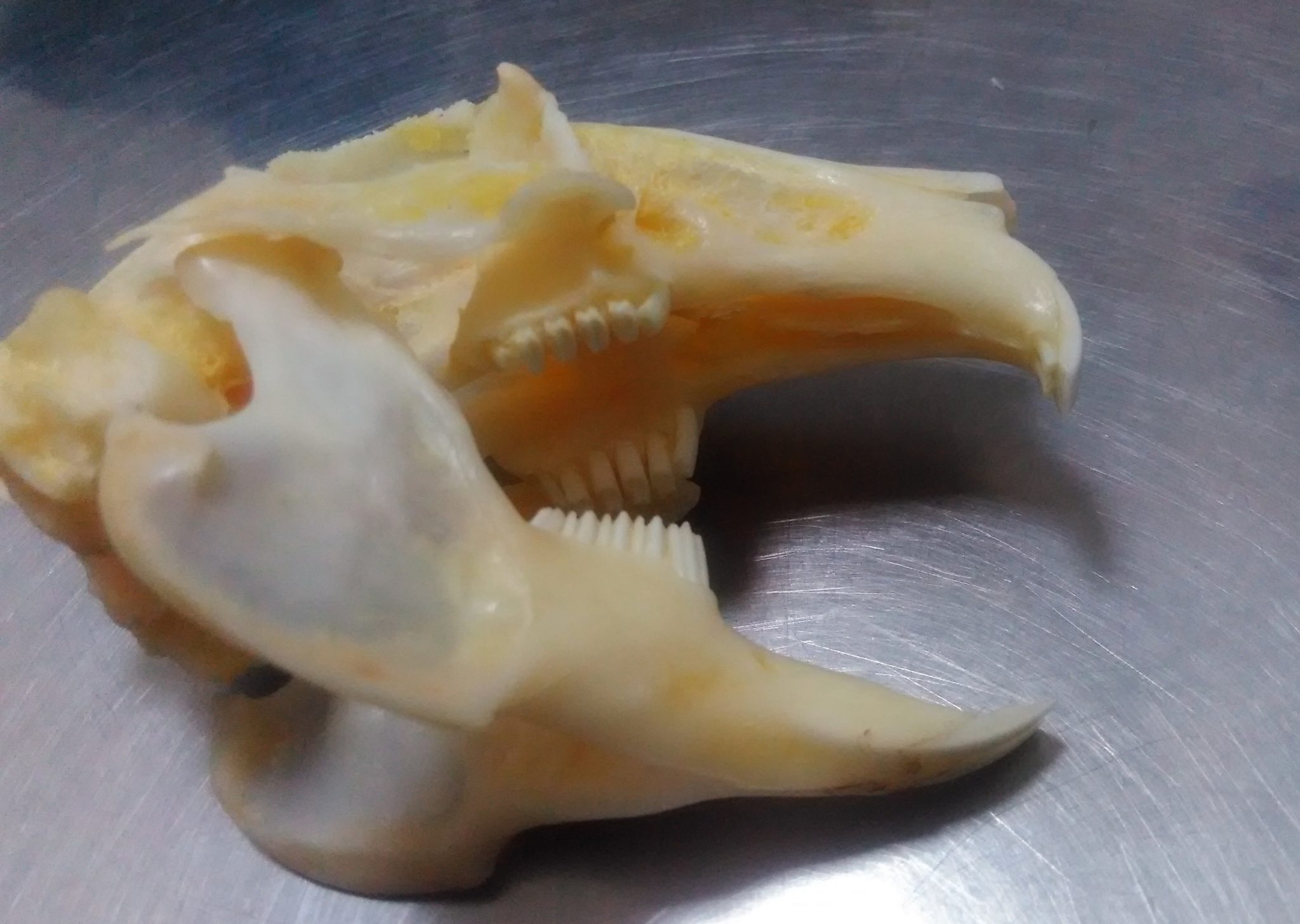
Диагностика дентальной болезни в ветеринарной клинике включает:
1. сбор данных о животном (возраст, беременности, состав рациона);
2. клинический осмотр;
3. дентальное обследование (осмотр ротовой полости и коренных зубов) — основной этап диагностики, чаще всего сразу сопровождающийся лечебными процедурами (коррекцией). Проводится под общим наркозом.
4. рентгенологическое исследование.
Другими вариантами лечения дентальной болезни могут являться хирургическое лечение (вскрытие) абсцессов, удаление резцов и/или коренных зубов, санация носо-слезного канала, удаление глазного яблока. Данные процедуры так же проводятся под общим наркозом и сопровождаются предоперационной подготовкой и постоперационной поддерживающей терапией.
Прогноз при дентальной болезни зависит от причин и степени нарушения окклюзии и наличию вторичных патологических процессов (наличие абсцессов, развитие остеомиелита и т.д.).
В некоторых случаях исправление патологического роста зубов на ранней стадии позволяет добиться полного выздоровления. Чаще всего – дает возможность продлить жизнь и улучшить ее комфорт.
Реабилитационный период после проведения коррекции может включать:
— принудительное кормление до восстановления самостоятельного приема пищи;
— промывание ротовой полости антисептическими растворами;
— применение противовоспалительных препаратов;
— антибиотикотерапия (при наличии гнойного процесса);
— применение прокинетиков (стимуляторов моторики кишечника);
— применение кортикостероидов;
— парентеральное введение растворов жидкостей (подкожные, внутривенные, внутрикостные инъекции/инфузии) в условиях стационара.
Дентальная болезнь и малокклюзия – распространенная проблема декоративных травоядных грызунов и кроликов, требующая экстренной (не позднее 3 суток с момента отказа от пищи) диагностики и лечения с применением специального оборудования (стоматологические инструменты, средства обеспечения ингаляционной анестезии) и учетом (знанием) особенностей анатомии и физиологии домашних животных данной группы.
Казаков Артем Аркадьевич, ветеринарный врач, квн.
Ветеринарный врач Семиротова Татьяна Сергеевна
Читайте также:


