Остеопороз при дисфункции яичников
Яичники входят в женскую репродуктивную систему и производят главные гормоны, необходимые для менструации, зачатия и беременности. При нарушении функции этих органов, сбивается менструальный цикл и не происходит овуляция. Дисфункция яичников — одна из самых частых причин бесплодия.
Что такое дисфункция яичников
Дисфункция яичников – это нарушение деятельности органов, вызванное какой-либо проблемой со здоровьем: инфекционно-воспалительным процессом, нагрузкой на нервную систему, расстройством эндокринной системы. Так как яичники — часть единой гормональной системы организма, в которую также входят гипоталамус, гипофиз и надпочечники, дисфункция яичников может быть как причиной, так и следствием расстройств в других органах.
Проблема женщинам хорошо заметна, но часто не вызывает беспокойства, так как считается, что нерегулярные месячные — беда небольшая. Дисфункциональные маточные кровотечения (вне нормальных периодов), также как и симптомокомплекс ПМС (эмоциональная нестабильность, нервозность, тянущие боли внизу живота и пр.), тоже списываются на любые причины, вплоть до плохой погоды, только не на болезнь.
К сожалению, результат дисфункции яичников — серьёзные гормональные заболевания: эндометриоз, миома матки, мастопатия, рак молочных желез, бесплодие. Именно поэтому важно своевременно отреагировать на первые тревожные сигналы патологии, дабы обезопасить себя от тяжёлых последствий.
Симптомы дисфункции яичников
Работа парных желез регулируется гормонами передней доли гипофиза, потому в основе нарушения их работы лежат регулярные сбои гипоталамо-гипофизарной системы. Для патологии характерны следующие симптомы:
- сбой менструального цикла: его чрезмерное удлинение (более 35 дней) либо укорочение (менее 21 дня), нерегулярность месячных;
- олигоменорея – чрезмерная редкость и скудность менструаций;
- полименорея – частые, длительные (более 7 дней) и обильные менструации (более 150 мл).
Ежемесячные обильные кровотечения могут привести к падению уровня гемоглобина и, как следствие этого, бледности кожи и слизистых, извращению вкуса и обоняния, сухости кожи, ломкости ногтей.
- Проблемы с зачатием. При дисфункции яичников нарушается процесс созревания яйцеклетки, учащаются ановуляторные циклы, поэтому оплодотворение произойти не может. Если же беременность всё-таки наступила, то возрастает вероятность выкидыша .
- Кровянистые выделения, происходящие в период между менструациями (с продолжительностью более 3 суток).
- Дисменорея – болевой синдром при менструациях. У женщин ухудшается общее самочувствие, нарушается трудоспособность, появляется тошнота, головная боль, диарея, боли внизу живота тянущего или схваткообразного характера, отдающие в поясницу.
- Комплекс симптомов ПМС : раздражительность, плаксивость, психологические перемены, слабость, сильная усталость, апатия и т.д..
- Аменорея – отсутствие месячных более 6 месяцев. Как правило, данный признак свидетельствует о запущенности патологии. При этом значительно повышается риск возникновения онкологического или сердечного заболевания. У женщин наблюдается изменение психики.
Причины нарушений работы яичников
Дисфункция яичников может возникнуть в результате серьёзного заболевания либо при функциональных расстройствах. Так, среди причин нарушения работы органа выделяют:
- Нарушения на уровне гипоталамус-гипофиз;
- Воспалительные процессы во внутренних половых органах (матке, яичниках, шейке матки): сальпингиты, эндометриты, оофориты;
- Эндокринные заболевания – ожирение, сахарный диабет , заболевания щитовидной железы и надпочечников. Они вызывают нарушение гормонального статуса, что в итоге отражается на репродуктивной функции;
- Гинекологические заболевания такие, как эндометриоз , аденомиоз , фибромиома , опухоли яичников и матки;
- Низкий иммунитет;
- Доброкачественные и злокачественные опухоли внутренних половых органов;
- Внешние факторы: голодание, чрезмерная худоба, длительные стрессы, физическое и моральное переутомление, нарушения режима сна, недостаток отдыха, акклиматизация, чрезмерное увлечение солнечными лучами, приём некоторых лекарственных препаратов, химио- и лучевая терапия;
- Ошибка при установке внутриматочной спирали ;
- Медицинский или самопроизвольный аборт . Особо опасно прерывание первой беременности, поскольку в организме резко обрывается перестройка на вынашивание плода. Как результат, возникает стойкая дисфункция с угрозой бесплодия ;
- Наследственная предрасположенность;
- Употребление алкоголя, наркотиков, курение.
Виды дисфункции яичников
Выделяют следующие виды дисфункции яичников:
- Ювенильная – проявляется у девушек 12-14 лет;
- Климактерическая – характерна для женщин в возрасте 45-55 лет;
- Ановуляторная – возникает вследствие нарушения работы коры головного мозга и гипоталамо-гипофизарной системы;
- Синдром истощения яичников, или преждевременный климакс . Такое патологическое состояние может возникать у женщин младше 40 лет с нормальным менструальным циклом и детородной функцией в прошлом. Оно проявляется вторичной аменореей, бесплодием и вегетососудистыми нарушениями;
- Синдром резистентных яичников – характеризуется нечувствительностью яичников к гонадотропной стимуляции. Проявляется вторичной аменореей и бесплодием у женщин младше 35 лет.
Ювенильная патология связана с нарушениями в системе гипоталамуса-гипофиза. Нарушения менструального цикла, аменорея и ациклические маточные кровотечения могут наблюдаться у девушек в течение 2 лет после менархе. Спровоцировать их могут различные факторы: травма головного мозга, менингит, инфекционные и вирусные заболевания (корь, краснуха, тонлизит, ОРВИ). Как правило, такой вид нарушений преходящий и исчезает через несколько месяцев или лет.
Климактерическая патология возникает при инволюции репродуктивной системы, т.е. это естественное угасание нормальной деятельности яичников. Об этом свидетельствует менопауза – беспричинное отсутствие менструаций более 6 месяцев. Иногда провокаторами патологии становятся гипертоническая болезнь, лишний вес, ожирение, сахарный диабет, расстройства ЦНС. Такое состояние – благоприятная среда для развития ишемической болезни сердца и разрушения костной ткани.
Климактерическая дисфункция яичников проявляется рядом симптомов:
- обильность потоотделения;
- беспокойство сна;
- учащённое мочеиспускание;
- сухость кожи и слизистых оболочек влагалища;
- приливы жара, сопровождающиеся покраснением кожи;
- эмоциональная нестабильность.
- Данное возрастное явление необратимо. Однако избавиться от неприятных симптомов можно с помощью гормонозаместительной терапии либо альтернативных методов – приема биоидентичных гормонов, эстроген-рецепторных модуляторов, фитогормонов.
Диагностика
Обследованием и лечением дисфункции яичников занимается специалист гинеколог-эндокринолог. На первичном приёме он выявляет и оценивает симптомы патологии с учётом информации о наследственности, жизненном и акушерском анамнезе, менструальной функции. Затем проводится гинекологический осмотр с взятием мазков.
В индивидуальном порядке назначается комплекс диагностических процедур, который может включать в себя:
- УЗИ малого таза ;
- УЗИ молочных желез ;
- УЗИ щитовидной железы ;
- УЗИ надпочечников ;
- анализ мочи и крови (общий, биохимический );
- анализ крови и мочи на гормоны (ЛГ, ФСГ, эстрогены, прогестерон, пролактин);
- микроскопию и бакпосев секрета на влагалищную микрофлору;
- ПЦР-анализ на половые инфекции (кандидоз, хламидиоз и т.д.);
- измерение базальной температуры (для определения фазы цикла, в котором есть нарушения);
- электрокардиография (для исключения сердечно-сосудистой патологии);
- анализ крови на содержание гормонов надпочечников и щитовидной железы ;
- исследование состояния гипофиза с помощью рентгена черепа, МРТ и КТ головного мозга;
- электроэнцефалография для исследования состояния головного мозга;
- гистероскопия с прицельной биопсией шейки матки;
- диагностическое выскабливание полости матки и цервикального канала для дальнейшего гистологического исследования соскоба.
Лечение
Лечение дисфункции яичников всегда строго индивидуально. Главными целями терапии являются:
- остановка кровотечений, угрожающих жизни;
- устранение причин патологии;
- восстановление менструального цикла.
При кровотечении, угрожающем жизни пациентки (низкий уровень гемоглобина, бессознательное состояние или профузное кровотечение) могут назначаться:
- раздельное выскабливание слизистой матки для дальнейшего гистологического анализа;
- симптоматическая терапия (иногда с элементами гормонов) до полной остановки кровотечения;
- приём препаратов прогестерона с 16 по 25 дни цикла для профилактики кровотечения и восстановления регулярности цикла;
- приём железосодержащих препаратов для лечения анемии;
- приём комбинированных оральных контрацептивов для нормализации цикла (продолжительность 3-6 месяцев и более), если женщина не планирует зачатие. Если беременность планируется, назначается стимуляция овуляции.
После остановки кровотечения назначается терапия для ликвидации причины патологии. Она может включать следующие процедуры:
Замечание. Женщинам, в анамнезе которых наблюдалась дисфункция яичников, установка внутриматочной спирали противопоказана.
Осложнения и последствия
Расстройство гормональной функции яичников при отсутствии своевременного лечения может повлечь за собой тяжёлые последствия. Без коррекции патология приводит к стойкому нарушению гормонального статуса женщины, наиболее вероятным исходом которого будет бесплодие либо невозможность выносить ребёнка. Также значительно возрастает риск возникновения серьёзных заболеваний репродуктивной системы, особенно у женщин предменопаузального возраста (40-45 лет):
- фибромиома;
- мастопатия ;
- эндометриоз;
- миома матки;
- рак тела матки;
- рак молочных желез.
Вероятность беременности
Дисфункция яичников – не приговор для женщин, желающих завести ребёнка. Беременность возможна, но только с медикаментозной поддержкой. Подготовка и отношение к ней должны быть особенно внимательными.
Продолжительность лечения составляет около 6 месяцев и проходит под пристальным наблюдением гинеколога-эндокринолога. Женщине назначается курс гормональной терапии, направленной на восстановление овуляторного менструального цикла. Когда зрелый фолликул достигает 18 мм, а толщина эндометрия – 8-10 мм, женщине вводится ХГЧ, провоцирующий овуляцию. Контроль овуляции осуществляется с помощью УЗИ фолликулов , измерения базальной температуры и анализа крови.
По статистике для 90% женщин терапия оказывается успешной и добиться зачатия удаётся. Дальнейшая беременность ведётся под тщательным наблюдением.
Профилактика
Чтобы предупредить возникновение расстройства гормональной функции яичников, необходимо соблюдать простые меры предосторожности:
- соблюдение правил личной гигиены;
- регулярное посещение гинеколога (2 раза в год);
- своевременное лечение заболеваний половых органов;
- здоровый образ жизни, полноценное питание;
- психоэмоциональная стабильность, исключение стрессов и волнений;
- грамотный приём гормональных препаратов;
- отказ от искусственного прерывания беременности;
- умеренная физическая активность;
- ведение контроля массы тела;
- защита от сильной и частой инсоляции;
- профилактика и своевременное лечение эндокринных заболеваний;
- избегание переохлаждения;
- отказ от вредных привычек.
Где пройти обследование и вылечить дисфункцию яичников в СПБ
Заметив у себя признаки неправильной работы яичников, обязательно обратитесь в клинику Диана. Наш адрес: Санкт-Петербург, Заневский пр-т, 10. У нас можно сдать комплекс анализов , пройти все виды УЗИ , а затем получить консультацию опытных гинекологов и эндокринологов . Стоимость обследования и лечения дисфункции яичников: УЗИ — 1000 руб., прием врача — 1000 руб. Стоимость анализов можно узнать по бесплатному телефону: 8 (800) 707-1560
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter
О.Ф.Серова, В.У.Торчинов
Московский областной НИИ акушерства и гинекологии (директор – член-корр. РАМН, проф.В.И.Краснопольский)
Остеопороз - системное метаболическое заболевание скелета, характеризующееся уменьшением массы костной ткани в единице объема по отношению к нормальному показателю у лиц соответствующего пола и нарушением микроархитектоники костной ткани с последующим повышением хрупкости костей и учащением риска переломов. Являясь широко распространенным обменным заболеванием костей, остеопороз имеет огромное медико-социальное и экономическое значение. Следует отметить, что остеопороз развивается постепенно и долгое время может оставаться незамеченным. Проявление характерных его симптомов достигает максимума приблизительно через 10-15 лет существования остеопенического синдрома.
Несмотря на то, что исследования последних лет направлены преимущественно на изучение костной ткани в перименопаузальном периоде, в настоящее время обсуждается тот факт, что истоки остеопороза лежат в детстве.
В работах многих авторов указывается на взаимосвязь развития постменопаузального остеопороза с возрастом менархе, гормональным дисбалансом и сопутствующими нарушениями менструального цикла у девочек в подростковом периоде (Байдак М.М., 1994; Вихляева Е.М., 1997). Доказано, что риск развития остеопороза у человека зависит от уровня его пиковой костной ткани, которая достигается в возрасте между 20 и 30 годами. Роль половых гормонов и их дефицита в развитии остопороза и остеопении особенно важна в пубертатном и репродуктивном периодах.
В пубертатном периоде возрастает продукция половых гормонов и скелет становится мишенью их действия. Особенности формирования скелета в значительной степени зависят от преобладания женских или мужских половых гормонов. Активация костного обмена проявляется в прогрессирующем увеличении костной массы. Как преждевременное половое созревание, так и его задержка влияют на формирование скелета посредством замедления или ускорения костного обмена.
Между процессами резорбции и формирования кости существует тесная контролируемая гормонами взаиморегуляция, которая осуществляется на тканевом уровне. Гормоны наряду с физической активностью и полноценным питанием входят в число основных факторов, определяющих массу кости и качество костной ткани.
Наиболее распространенная классификация остеопороза учитывает возраст его развития и основные этиологические факторы:
- Первичный остеопороз
- постменопаузальный,
- сенильный,
- ювенильный,
- идиопатический.
- Вторичный остеопороз (составляет менее 15 % случаев остеопороза), возникает в результате:
- ревматических заболеваний,
- эндокринных болезней,
- болезней крови,
- болезней органов пищеварения (особенно тех, которые характеризуются нарушением всасывания в кишечнике),
- болезней печени,
- болезней почек,
- приема лекарственных препаратов.
В настоящее время отмечается рост заболеваемости ювенильным остеопорозом, наблюдающимся у молодых людей, костная масса которых не достигла своего пикового значения.
В основе жизнедеятельности костной системы лежат два взаимосвязанных и взаимозамещающих процесса: процесс созидания, образования новой кости и процесс разрушения – резорбции старой (ремоделирование кости).
Выделяют следующие периоды возрастных изменений костного скелета:
- С момента рождения до закрытия эпифиза (к 20-25 годам) - достижение пиковой костной массы - прогрессивное увеличение объема костной ткани за счет эндохондрального и периостального окостенения.
- К 30-35 годам начинается потеря костной массы до 1% в год от пиковой массы.
- До 40-45 лет процессы костной формации и резорбции происходят с одинаковой интенсивностью.
- После 45 лет процессы резорбции превалируют над процессами костеобразования.
Вероятность развития остеопороза у взрослого человека определяют стартовая минеральная плотность костной ткани (МПКТ) и скорость потери костного вещества, а также нарушение процессов ремоделирования.
Факторы, контролирующие и инициирующие костную перестройку, условно можно разделить на 4 группы:
- Гормоны, регулирующие обмен кальция: паратгормон, активный метаболит витамина D – кальцитриол, кальцитонин.
- Системные гормоны: глюкокортикоиды, тироксин, инсулин, гормон роста, половые гормоны.
- Факторы роста: белковые факторы плазмы, тромбоцитов и костной ткани;
- Местные факторы, продуцируемые самими костными клетками: простагландины Е, оказывающие активирующие влияние на остеокласты
Развитию остеопороза могут способствовать многие причины: генетические (наследственная предрасположенность), гормональные (позднее начало менструации, аменорея, бесплодие, ранняя менопауза), экстрагенитальные заболевания, особенности питания, низкая физическая активность, недостаточное потребление кальция, дефицит витамина Д, курение, алкоголизм, значительное употребления кофе, длительное применение некоторых лекарств (глюкокортикоиды, антикоагулянты, антиконвульсанты, тиреоидные препараты и др).
В костном ремоделировании порядок событий четко запрограммирован. Под влиянием определенных стимулов группа остеокластов резорбирует костную ткань на глубину около 50мкм. Пространство резорбированной кости покрывается остеобластами, которые формируют новообразованную костную ткань с остеоцитами, погруженными в зрелую кость. Процесс ремоделирования кости осуществляется с разной скоростью практически всю жизнь, что проявляется костной перестройкой. Ежегодно перестраивается от 2-4 % до 10% костной ткани, то есть за 10-20 лет обновляется половина скелета.
Основным субстратом для минерализации костной ткани является кальций, который играет значимую роль в формировании скелета. Достаточное потребление кальция в детском и подростковом периодах необходимо для достижения оптимального пика костной ткани. В теле взрослого человека содержится около 1200г кальция, из которого 98,9% приходится на скелет. Недостаток кальция приводит к увеличению синтеза паратгормона, в результате чего происходит активное вымывание кальция из костной ткани, снижение МПКТ, развитие остеопении и остеопороза. В условиях гипокальциемии ослабляется и стимулирующее влияние кальцитонина на остеобласты.
Механизмы влияния половых гормонов на костную ткань чрезвычайно важны и до конца не изучены. Однако после открытия специфических рецепторов на остеобластах к эстрогенам, андрогенам, гормону роста и тиреоидным гормонам стало очевидно, что губчатое вещество костной ткани является своеобразным органом-мишенью для половых гормонов. Наиболее значимое влияние на костно-минеральный обмен оказывают эстрогены, так как они активизируют остеобласты, подавляют продукцию интерлейкинов, активируя апоптоз остеокластов, способствуют торможению костной резорбции, снижают чувствительность костной ткани к рассасывающему влиянию паратгормона, повышают чувствительность костной ткани к витамину D3, стимулируют синтез кальцитонина, регулируют процессы всасывания и выделения Са, активируют апоптоз остеокластов. Снижение уровня эстрогенов ведет к ускорению костного обмена и потере костного вещества. Тестостерон активизирует анаболические процессы в костях. Прогестерон оказывает антирезорбтивное действие за счет прямого стимулирующего действия на остеобласты или опосредованно путем блокады рецепторов этих клеток к глюкокортикоидам, активирующим апоптоз остеобластов, а также может самостоятельно активировать апоптоз остеокластов.Глюкокортикоиды ингибируют всасывание кальция в кишечнике и повышают экскрецию его с мочой, приводят к снижению процесса превращения витамина D в активные метаболиты. Тиреоидные гормоны активируют остеокласты Пролактин регулирует процесс костеобразования, степень снижения которого зависит от уровня повышения пролактина. Инсулин стимулирует активность остеобластов. Соматотропный гормон стимулирует синтез кальцитриола, который увеличивает всасывание кальция в кишечнике.
Методы определения МПКТ
- Однофотонная денситометрия - для сринингового измерения МПКТ кисти, дистальных отделов костей предплечья или голени.
- Двухфотонная рентгеновская денситометрия - для исследования любой кости или всего скелета в двух и более проекциях.
- Количественная компьютерная томография - для получения трехмерного изображения, что позволяет произвести прямое определение плотности и пространственного отделения трабекулярной кости от кортикальной.
- Ультразвуковая денситометрия - для скриннингового исследования (пяточная кость, надколенник, большеберцовая кость, фаланги пальцев кисти).
- Исследование биохимических маркеров (остеокальцин -ОК, щелочная фосфатаза -ЩФ, Са, Р и др. проколлагеновые пропептиды).
I группа - 48 женщин, гормональные изменения у которых соответствовали синдрому поликистозных яичников (СПКЯ).
II группа - 11 пациенток с функциональной гиперпролактинемией.
III группа - 20 пациенток с врожденной дисфункцией коры надпочечников (ВДКН).
IV группа - 9 пациенток с гипогонадотропной гипофункцией яичников.
V группа - 12 пациенток с гипергонадотропной гипофункцией яичников. Из них 8 пациенток с дисгенезей гонад и 4 - с синдромом истощения яичников (СИЯ).
Мы провели анализ основных клинических характеристик, которые могут влиять на формирование костной ткани. Ожирение II- III степени чаще всего наблюдалось у пациенток с СПКЯ и гиперпролактинемией ( 68,5% и 27,3% соответственно). У пациенток с ВДКН, гипо- и гипергонадотропными состояниями чаще отмечался дефицит массы тела ( 55,5%; 15,0% и 15,0% соответственно). Первичная аменорея наблюдалась чаще у пациенток V группы (66,6%), IV группы (55,5%) и III группы (35,0%) , вторичная аменорея - у пациенток II, IV и V групп (63,6%; 44,4% и 33,3% соответственно).
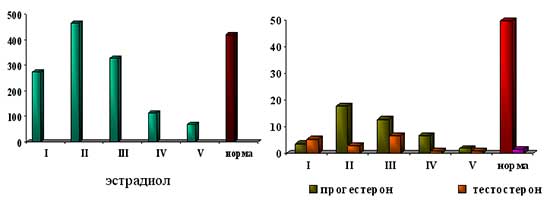
Исследование сывороточных уровней яичниковых гормонов показало, что наиболее низкие показатели эстрадиола, прогестерона и тестостерона также определялись у пациенток с гипо- и гипергонадотропными состояниями, гиперандрогения была выявлена у всех пациенток с ВДКН и у большинства женщин с СПКЯ (рис. 1).
Рис. 1. Содержание эстрадиола (пмоль/л), прогестерона (нмоль/л) и тестостерона (нмоль/л) у обследованных пациенток
Оценка результатов двухэнергетической ренгеновской абсорбциометрии проводилась только по Z-критерию, оценивающего МПКТ относительно возрастной нормы. Мы не учитывали значения Т-критерия, который сравнивает полученную МПКТ с пиковой костной массой, поскольку большинство обследованных пациенток были в возрасте до 30 лет, т.е. до достижения пика костной массы.
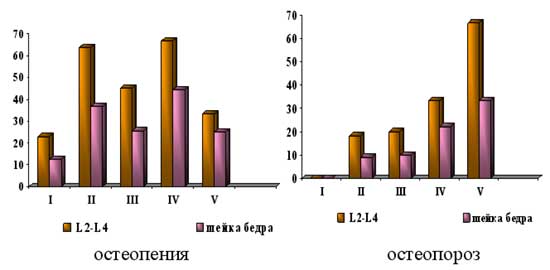
Поскольку остеопоротические изменения развиваются неравномерно в различных отделах скелета, нами проанализированы данные денситометрического исследования поясничных позвонков (L2–L4), состоящих преимущественно из трабекулярной ткани, и проксимального отдела бедра, представленного в основном кортикальной тканью.
Частота выявления остеопении и остеопороза у наблюдаемых пациенток в поясничном отделе позвоночника была почти в 2 раза больше, чем в шейке бедра, Снижение МПКТ выявлено более, чем у половины (54,0%) женщин: остеопения - в 37%, остеопороз - в 17% случаев. При этом, снижение МПКТ наблюдалось у всех пациенток с гипо- и гипергонадотропными состояниями (рис. 2). Средние значения Z-критерия в этих группах были самыми низкими (-3,1±0,3 и –3,5±0,5 соответственно). По-видимому это объясняется низким содержанием эстрогенов и прогестерона в сыворотке крови и, соответственно, отсутствием их участия в процессах ремоделирования кости.
Рис. 2. Частота выявления остеопении и остеопороза у пациенток с дисфункцией яичников
Исследование биохимических показателей фосфорно–кальциевого обмена (уровня ионизированного кальция и фосфора, а также показателей активности процессов костеобразования - ОК, ЩФ) показало, что их достоверного изменения у пациенток всех групп не наблюдалось.
При сопоставлении результатов рентгенологической денситометрии с клиническими и лабораторными данными выявлено, что степень снижения МПКТ зависит от:
- веса пациенток - она была более выражена при низкой массе тела, при которой усиливается негативное влияние дефицита эстрогенов на костную ткань. Избыток массы тела может отчасти защищать костную ткань, вероятно за счет экстрагонадного синтеза эстрогенов. Поэтому у пациенток с СПКЯ, больше половины которых страдали ожирением, снижение МПКТ было минимальным;
- от длительности аменореи - степень снижения МПКТ была максимальной у пациенток с первичной или вторичной аменореей длительностью более 1 года;
- от гормонального гомеостаза - степень снижения МПКТ прямо пропорциональна сывороточному содержанию тестостерона и пролактина и обратно пропорциональна содержанию эстрогенов и прогестерона;
Всем пациенткам в течение года проводилась дифференцированная гормональная терапия в зависимости от характера и степени нарушения функции яичников. Пациенткам с СПКЯ назначались гестаген-эстрогенные препараты (Диане-35, Регулон). При функциональной гиперпролактинемии применяли бромкриптин в индивидуально подобранных дозах. После нормализации уровня пролактина этим пациенткам назначали Регулон. Пациенткам с ВДКН назначали Диане-35 в виде монотерапии или в сочетании с андрокуром. Следует отметить, что длительное назначение глюкокортикоидов этим пациенткам нецелесообразно ввиду негативного влияния их на состояние МПКТ.
Пациенткам с гипогонадотропной гипофункцией яичников назначалась циклическая гормональная терапия Эстрожелем и Утрожестаном, так как в этих случаях целесообразно применение натуральных гормонов.
Эстрожель – гель для наружного применения, содержащий 17β-эстрадиол. Одна доза (2,5г/сут) препарата достаточна для поддержания МПКТ. Эстрожель создает оптимальную стабильную концентрацию эстрадиола в плазме, которая анологична средней фолликулярной фазе, позволяет избежать первичного печеночного метаболизма и метаболических нарушений (повышения триглицеридов и ЛПНП), в меньшей степени влияет на коагуляционный потенциал крови. Утрожестан – натуральный прогестерон физиологично дополняет эстрогены в защитном действии на костную ткань. Благодаря “естественным” связям c рецепторами во всех органах и тканях при его применении не происходит удлинения времени взаимодействия с рецепторным аппаратом. Кроме того, он восполняет дефицит эндогенного прогестерона, обеспечивая адекватную секреторную трансформацию эндометрия и нормализацию менструального цикла.
Пациенткам с гипергонадотропной гипофункцией яичников проводилась заместительная гормональная терапия препаратом Фемостон 2/10.
Контрольное обследование , проведенное через 6 месяцев и 1 год, показало, что на фоне гормональной терапии отмечалось восстановление менструального цикла через 6 месяцев у 93% пациенток, через 1 год – у 96%. Лишь у 4 пациенток с дисгенезией гонад менструальноподобной реакции в течение года наблюдения не было в связи с выраженными анатомическими изменениями матки.
Особого внимания заслуживает факт значительного уменьшения частоты остеопении и особенно остеопороза на фоне лечения. Так, если до лечения остеопения выявлялась у 37 пациенток , а остеопороз – у 17, то через 6 месяцев после лечения – у 12 и 5 соответственно, а через 1 год – лишь у 6 (6,0%) и 1 (1,0%) соответственно. Наиболее выраженное увеличение МПКТ было отмечено у женщин с гиперпролактинемией. Явления остеопороза сохранялись лишь при гипергонадотропных состояниях.
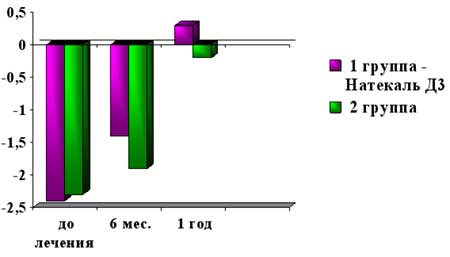
В нашем исследовании была проведена также оценка эффективности применения препарата кальция Натекаль Д3 для восстановления МПКТ в комплексном лечении пациенток с дисфункцией яичников. Для этого 54 пациентки с нарушением МПКТ были разделены на 2 группы: 1-я группа – 27 пациенток, которые в комплексе с гормональной терапией получали Н Натекаль Д3 в течение 6 месяцев, 2-я группа – 27 пациенток, которые получали только гормональную терапию. Средние значения Z-критерия в обеих группа были идентичны (-2,4± 0,6 и -2,3± 0,7 соответственно).
Динамическое определение МПКТ убедительно показало, что на фоне применения препаратов кальция в комплексной терапии дисфункции яичников у пациенток основной группы наблюдается более быстрое и выраженное восстановление МПКТ (рис. 3).
Рис. 3. Динамика восстановления костной ткани у пациенток с дисфункцией яичников (Z-критерий)
Таким образом, проведенные исследования показали наличие изменений костно-минерального метаболизма у молодых пациенток с нарушением менструального цикла по типу олигоменореи, а также возможность восстановления МПКТ до достижения пика костной массы в отличие от постменопаузального периода, в котором можно лишь существенно уменьшить скорость и степень ее снижения.
- женский пол;
- возраст;
- этническая принадлежность;
- низкая масса тела;
- низкие показатели костной массы;
- генетические причины;
- гормональные (позднее начало менструаций, аменорея, бесплодие, ранняя менопауза – синдром истощения яичников [СИЯ]);
- экстрагенитальная патология;
- особенности питания;
- низкая физическая активность;
- недостаточное потребление кальция;
- дефицит витамина D;
- курение;
- алкоголизм;
- потребление кофеинсодержащих напитков в больших количествах;
- длительное применение некоторых лекарств (глюкокортикоидов, антикогулянтов, тиреоидных препаратов и др).
- І поколение – дидронел, бонефос, этидронат;
- ІІ поколение – алендронат (фосамакс), памидронат, тилудронат;
- ІІІ поколение – ибандронат, ризендронат, золедронат.
Считают, что бисфосфонаты могут ингибировать активность остеокластов. Не исключено также, что они воздействуют на остеобласты и снижают продукцию остеобласт-активирующего фактора. D.M. Black et al. (1996) [29], изучая эффективность алендроната (фосамакса), доказали, что через три года лечения риск развития переломов снижается на 40%. Селективные эстроген-рецепторные модуляторы, представленные тамоксифеном и ралоксифеном, являются своеобразной альтернативой ЗГТ.
В исследованиях В.П. Сметник и соавт. (2001) доказано антирезорбтивное влияние ралоксифена на МПКТ позвоночника и шейки бедра, что подтверждается достоверным снижением риска переломов позвоночника на 30-60% [30]. Для лечения остеопороза и синдрома истощения яичников (СИЯ) у молодых женщин важным является проведение базисной терапии – назначение витамина D и кальция. В этом отношении заслуживает внимания препарат витрум кальциум + витамин D, в состав которого входит карбонат кальция из раковин устриц. Две таблетки этого лекарственного средства соответствуют суточной дозе кальция (1000 мг) и витамина D3 (400 МЕ).
Особого внимания заслуживает препарат остеомат, в состав которого входят витамин D, карбонат кальция, а также комплекс минералов: магний, цинк, медь, марганец и бор. Суточная доза составляет две таблетки. Приведенная схема лечения остеопороза в равной степени применима как у женщин репродуктивного возраста с этим заболеванием и СИЯ, так и у пациенток с остеопорозом, развившимся после овариоэктомии.
Цель настоящей работы состояла в обзоре литературы по причинным факторам остеопороза и установлении наследственного характера заболевания у больных СИЯ.
Под нашим наблюдением находились 57 пациенток с остеопорозом и СИЯ и 10 фенотипически здоровых женщин с нормальной менструальной функцией без остеопороза в возрасте от 29 до 42 лет, которым проводили комплексное обследование традиционными методами (клиническими, гормональными, ультразвуковыми). С целью диагностики патологии применяли метод ДЭРА, позволяющий провести раннюю диагностику остеопении и остеопороза и дать динамическую количественную оценку МПКТ. Как указывает Н.А Берестовая (2001) [25], при использовании этого метода минимальная лучевая нагрузка составляет всего примерно 0,1% от окружающего фона.
Основной причиной возникновения СИЯ являются хромосомные аномалии и аутоиммунные расстройства, выражающиеся во врожденной гипоплазии яичников с недостаточностью фолликулярного аппарата, пре- и постпубертатной деструкции зародышевых клеток, первичном поражении ЦНС и гипоталамической области. В настоящее время считается, что СИЯ является генерализованным аутоиммунным диатезом.
В то же время N. Andrew и соавт. (2000) [26] отмечают, что несмотря на то что аутоиммунные заболевания выявляют у 10-20% женщин с СИЯ, роль аутоиммунных процессов и некоторых инфекций в развитии этой патологии остается не до конца изученной. Частота развития СИЯ в популяции составляет 1,5%, а в структуре причин вторичной аменореи – до 10%.
Представляют огромный научно-практический интерес исследования А.Б. Лившиц, Л.А. Лившиц, С.А. Кравченко (2006) [27], в которых рассматриваются клинические и генетические аспекты патогенеза СИЯ.
С целью выявления роли наследственных факторов развития остеопороза всем 57 пациентам с СИЯ применяли клинико-генеалогический метод исследования. Семейную частоту данной патологии у них определяли по всем трем степеням родства.
Цитогенетическое исследование проводили путем изучения культуры лимфоцитов периферической крови, приготовленной по стандартной методике с дифференциальной G- и С-окраской хромосом для выявления гетерохроматических образований (модификация Summer). Применение С-окрашивания позволяет обнаружить в изучаемых хромосомах различные варианты полиморфизма, обусловленные изменчивостью величины структурного гетерохроматина.
Содержание гормонов (адренокортикотропного, тиреотропного, ФСГ и ЛГ) в сыворотке крови определяли на автоанализаторе Immulite 1000 (США). Также всем 57 женщинам обязательно проводили комбинированную высокоразрешающую 2D/3D трансабдоминальную и трансвагинальную эхографию органов малого таза с помощью УЗ-системы экспертного класса Voluson 730 Pro General Electrick (США).
Основными показаниями к применению ДЭРА у пациенток были жалобы на периодически возникающую боль в спине, пояснично-крестцовой области, подключичной области, ребрах; у некоторых – отмечались отеки, боль в суставах. На приливы жара к голове жаловались 39 (68,4%) женщин, которые возникли через 45-60 дней после прекращения менструаций; у 19 (33,3%) – показаниями к проведению ДЭРА было снижение концентрации ионизированного кальция в крови.
Необходимо отметить, что у 41 (71,9%) женщины выявляли нейровегетативные, психоэмоциональные, обменно-эндокринные симптомокомплексы: общая слабость, головная боль, бессонница, быстрая утомляемость, боль в области сердца, снижение трудоспособности. Обращает на себя внимание то, что у пяти (8,7%) пациенток имели место переломы различных частей скелета: лучевой кости – у двух (3,5%), предплечья – у двух (3,5%) и трещина поясничного позвонка диагностирована у одной (1,7%) женщины.
В исследуемую группу не вошли женщины с различными сопутствующими патологиями:
- заболеваниями эндокринной системы (гиперкортицизмом, тиреотоксикозом, гипогонадизмом, гиперпаратиреозом, сахарным диабетом, гипопитуитаризмом, полигляндулярной эндокринной недостаточностью);
- системными заболеваниями соединительной ткани;
- заболеваниями желудочно-кишечного тракта;
- патологией почек (хронической почечной недостаточностью, почечным канальцевым ацидозом, синдромом Фанкони);
- заболеваниями кроветворной системы;
- генетическими нарушениями (синдромом Марфана, гомоцистеинурией и лизинурией);
- другими заболеваниями и состояниями (овариоэктомией, хроническими болезнями легких, алкоголизмом, нервной анорексией, дефицитом питания);
- принимающие некоторые виды медикаментов (кортикостероиды, антиконвульсанты, фуросемид, агонисты гонадотропного рилизинг-гормона, иммунодепрессанты, препараты, содержаще алюминий, в т.ч. антациды, тиреоидные гормоны и антибиотики тетрациклинового ряда).
При анализе родословной у 57 больных остеопорозом и СИЯ среди родственников пробанда второй и третьей степени родства (в трех поколениях: мать, сестры, бабушка, тети, племянницы) установлена наследственная отягощенность. У 29 женщин в возрасте до 38-39 лет были жалобы на боль в суставах, особенно локальную в поясничном или в грудном отделе позвоночника, раннее прекращение менструаций и синдром вегето-сосудистой дистонии.
У 17 пациенток отмечена клиническая картина пояснично-крестцового радикулита, дисфункциона-льные маточные кровотечения, проявившиеся до 33 лет. В семи случаях имели место переломы различных частей скелета (кистей рук, поясничной и грудной области) и альгодисменорея в возрасте до 35 лет; в пяти – изменение осанки с прогрессирующим ограничением двигательной функции позвоночника и прекращение менструаций с тяжелыми вегето-сосудистыми нарушениями в возрасте 29-32 лет.
У всех обследуемых с остеопорозом и СИЯ менструальная функция изначально была не нарушена;
отмечалось своевременное менархе с 11 до 15 лет. Затем внезапно появились клинические признаки, характерные для климакса: у 13 пациенток менструации прекратились с 29 лет, у 25 – с 33 лет, у 14 – с 35-37 лет и у пяти женщин – с 38-42 лет. Клиническая картина у них характеризовалась приливами, слабостью, быстрой утомляемостью, головной болью, болью в сердце, снижением трудоспособности.
На начальных этапах заболевание проявлялось аменореей или олигоменореей продолжительностью от 5 мес до 2,5 лет. Нарушений липидного обмена не отмечено. Феноморфограмма не нарушена, выявлен женский тип. Гипоплазия молочных желез не наблюдалась.
При ультразвуковом сканировании выявлено резкое уменьшение размеров матки и яичников, фолликулы в них полностью отсутствовали. У всех пациенток в возрасте от 29 до 37 лет показатели МПКТ были ниже нормативных. При этом степень снижения коррелировала с длительностью периода отсутствия менструаций (ПОМ). Так, признаки остеопороза отсутствовали у двух (3,5%) пациенток в возрасте 29 лет; остеопения отмечалась в 13 (22,8%) случаях, остеопороз – в 44 (77,2%).
У семи (12,3%) пациенток в возрасте от 35 до 42 лет имело место снижение МПКТ в зоне Варда (условная часть проксимального отдела бедренной кости, представленная трабекулярной костной тканью малой плотности с преимущественно продольным расположением трабекул, которое обеспечивает прочность кости). Этот показатель наглядно отражает зависимость выявленных изменений от возраста и длительности ПОМ.
Наиболее значительное снижение МПКТ наблюдалось у женщин старшего возраста (39-42 лет), однако выраженного снижения этого показателя в области шейки бедра у них не обнаружено. При индивидуальном анализе полученных результатов отмечено, что у 14 (24,5%) пациенток в возрасте 29-35 лет с ранним наступлением менопаузы средние показатели МПКТ приближались к таковым у женщин старшего возраста (до 42 лет).
В то же время у шести (10,5%) из 52 пациенток в возрасте 29-32 года и у двух (3,5%) в возрасте 39-41 года показатели МПКТ были в пределах нормы. У этих женщин отмечались повышенная масса тела (индекс массы тела более 20), отсутствие вредных привычек, преобладание в пищевом рационе молочных и углеводных продуктов.
При анализе показателей МПКТ обнаружены некоторые особенности по зонам исследования в зависимости от возраста. Так, у 21 (36,8%) пациентки в возрасте 31-42 лет наибольшее снижение показателей МПКТ выявлено в области позвонков LII-LIV, а у семи (12,3%) – в зоне Варда. Вместе с тем у 38 (66,6%) пациенток в проксимальных отделах бедра эти показатели были в пределах нормы. Результаты нашего исследования согласуются с данными других авторов [7]. Анализ величин МПКТ (7 + 21) у пациенток с ПОМ показал, что в 28 (49,2%) случаях имели место ее нарушения. Таким образом, анализ показателей МПКТ свидетельствует, что степень костного метаболизма зависит от длительности ПОМ и возраста пациенток.
Гормональное исследование продемонстрировало низкий (ниже, чем в раннюю фолликулярную фазу) уровень эстрадиола и повышение уровня ФСГ у всех пациенток с остеопорозом и СИЯ. Содержание ФСГ у них было в три раза выше, а ЛГ – в четыре раза выше уровня базальной секреции ЛГ, чем у пациенток группы контроля.
Проба с клостилбегитом (по 100 мг в течение пяти дней) у пациенток с остеопорозом и СИЯ не привела к стимуляции функции яичников. При введении хорионического гонадотропина активация также не наблюдалась. Уровень пролактина у этих женщин был в
2,5 раза ниже по сравнению с контролем.
Для выявления резервных возможностей гипоталамо-гипофизарной системы проводили пробу с рилизинг-гормоном ЛГ (РГЛГ) (100 мкг). Было установлено, что несмотря на значительное повышение уровня гонадотропинов (ФСГ и ЛГ) после введения РГЛГ, учащения приливов у исследуемых женщин не наблюдалось. Из этого следует, что у них резервные способности гипоталамо-гипофизарной системы были сохранены.
Исходя из вышеизложенного, можно сделать вывод, что повышение секреции гонадотропных гормонов у женщин с остеопорозом и СИЯ возникало вторично, в ответ на резкое снижение гормональной функции яичников в результате истощения фолликулярного аппарата.
У всех исследованных выявили изменения на ЭЭГ, отражающие функциональные сдвиги преимущественно в среднестволовых структурах мозга. У девяти из них отмечали нарушения, характерные для патологии гипоталамических ядер; у 13 – изменения ЭЭГ имели более выраженный характер и свидетельствовали о нарушении функции стволово-диэнцефально-лимбических структур. Этим пациенткам проводили магнитно-резонансную томографию головного мозга; в проекции гипофиза патологии не обнаружено.
При неврологическом и офтальмологическом обследованиях у пациенток с остеопорозом и СИЯ также не выявлено изменений, которые указывали бы на органическое поражение ЦНС. У 11 (19,3%) из них отмечены хромосомные аберрации в Х-хромосоме.
Выводы
1. Проведенный обзор литературы и результаты собственных наблюдений свидетельствуют, что генеалогическое исследование пациенток с остеопорозом и СИЯ подтверждает возможность генетической предрасположенности к этому заболеванию и оправдывает научный поиск новых этиологических факторов возникновения этой патологии.
2. Показания к применению ДЭРА у женщин репродуктивного возраста (до 42 лет) с остеопорозом и СИЯ должны быть строго дифференцированны – стойкое прекращение менструальной функции при наличии факторов риска развития остеопороза (в прошлом – переломы при минимальных травмах, стойкий эстрогенный дефицит и отягощенный генетический анамнез).
3. Даже длительное проведение гормональной и антирезорбтивной терапии не позволяет в полной мере гарантировать защиту от потери костной массы. Несмотря на это, указанные методы лечения остаются незаменимыми в профилактике данных заболеваний у женщин репродуктивного возраста с эстрогенным дефицитом.
4. Степень костного метаболизма зависит от длительности ПОМ и возраста, поэтому критериями эффективности лечения остеопороза у молодых женщин являются:
- уменьшение или исчезновение болевого синдрома;
- повышение физической и двигательной активности;
- изменение показателей биохимических маркеров костного ремоделирования, которые являются чувствительными тестами для ранней оценки (через 3-6 мес) результатов комплексной ЗГТ и антирезорбтивного лечения, когда ДЭРА еще не дает соответствующих сведений.
5. Использование современных методов терапии, направленных на предотвращение потерь костной ткани и остеопоротических переломов у женщин репродуктивного возраста, позволит решить проблему остеопороза и СИЯ у пациенток с наследственной предрасположенностью к этим заболеваниям.
Читайте также:


