Острый гематогенный остеомиелит метаэпифизарный остеомиелит
 |  |  |  |
Метаэпифизарный остеомиелит встречается преимущественно у детей грудного возраста. Однако в этой возрастной группе новорожденные дети поражаются чаще. Гематогенным путем инфекция (чаще стафилококк) попадает в метафиз кости, где и развивается воспалительный процесс, однако вследствие особенностей кровоснабжения ме-таэпифизарной границы у детей раннего возраста он распространяется на ростковую зону и эпифиз, располагающийся внутри сустава. Поэтому основные клинические симптомы обусловливаются развитием острого артрита.
Клиническое течение. Метаэпифизарный остеомиелит, как правило, начинается остро с повышения температуры, вялости, отказа от еды, щажения больной конечности, при этом ребенок держит ее в вынужденном положении.
Морфологически в кости при остеомиелите у детей раннего возраста преобладают некротические процессы, сопровождающиеся гибелью и рассасыванием костной ткани в области метафиза, повреждением ростковой зоны и суставных поверхностей. Однако в этом возрасте репаративные процессы выражены хорошо, в связи с чем перехода этой формы остеомиелита в хроническую не происходит. Функциональные нарушения в отдаленные сроки могут быть выражены значительно и объясняются нарушением роста конечности, деформациями в суставах (рис. 69).

Рис. 69. Последствия эпифизарного остеомиелита, перенесенного в период новорожденности. Обширный дефект суставного конца бедренной кости. Рентгенограммы больного 12 лет. а — прямая проекция; б — боковая проекция.
Рентгенологические признаки остеомиелита выявляются раньше, чем при других формах. Уже на 8—10-й день можно найти ряд характерных симптомов: утолщение мягких тканей на стороне поражения, расширение суставной щели, легкую периостальную реакцию (рис. 70). Очаги деструкции в метафизе на рентгенограммах выявляются лишь на 3-й неделе от начала заболевания, а о степени разрушения эпифиза кости и зоны роста можно с достоверностью судить лишь после того, как появится ядро оскостенения (рис. 71). Наиболее часто поражаются дистальный и проксимальный концы бедренной кости, проксимальный—плечевой и большеберцовой костей.

Рис. 70. Рентгенограммы коленного сустава ребенка в возрасте 1 мес. Ранние рентгенологические признаки метаэпи-физарного остеомиелита: периостит, расширение суставной щели, утолщение мягких тканей.

Рис. 71. Рентгенограмма плечевого сустава ребенка 11/2 мес. Эпиметафизарный остеомиелит, выражена деструкция проксимального метафиза плечевой кости.
Лечение. При метаэпифизарном остеомиелите лечение имеет свои особенности. Общая терапия осуществляется по принципам лечения острой гнойной хирургической инфекции с учетом возраста ребенка. Применяют антибиотики широкого спектра действия и обладающие тропностью к костной ткани (линкомицин), дезинток-сикационную и иммунотерапию.
Важную роль играет иммобилизация, которую осуществляют с помощью вытяжения по Шеде (на нижней конечности) или повязки Дезо (на верхней конечности). Хирургические манипуляции в области ростковой зоны и гипсовые лонгеты у новорожденных не применяют. При явной клинике артрита лечение проводится с помощью пункций, удалением выпота из сустава с последующим введением в него антибиотиков.
При локализации процесса в проксимальном эпифизе бедренной кости по стихании острого воспалительного процесса с целью профилактики патологического вывиха бедра применяют повязки-распорки. Дети, перенесшие острый гематогенный метаэпифизарный остеомиелит, должны находиться под диспансерным наблюдением врача-ортопеда или хирурга.
Исаков Ю. Ф. Детская хирургия, 1983г



Острый гематогенный метаэпифизарный остеомиелит (МЭО) у детей ранней возрастной группы продолжает оставаться тяжелым гнойно-септическим заболеванием в педиатрической хирургической практике [1,2]. В последнее десятилетие он занимает одно из первых мест в гнойно-септической хирургии по частоте исхода в бактериальный сепсис. Динамика количества случаев заболевания не имеет четкой тенденции к снижению, что подтверждается высокой частотой встречаемости патологического процесса среди новорожденных, в т.ч. маловесных недоношенных детей, имеющих ряд физиологических и иммунологических особенностей, усугубляющих тяжесть течения заболевания [3]. Значимым в этиологии является патоморфоз возбудителей последнего десятилетия, характеризующийся уменьшением частоты роста культур моностафилококковой флоры (Stafilococcusaureus) до 50 %. Отмечается активный рост микст-культур эпидермального стафилококка с другими микроорганизмами (клебсиеллами, энтерококками), их ассоциации с анаэробами и культурами грибов рода Кандида [4]. Многообразие клинических проявлений процесса и наличие атипичных форм могут увести от своевременной постановки диагноза МЭО. Этиопатогенез заболевания отличается тем, что до оссификации эпифизов имеет место морфофункциональная незрелость ростковой зоны, хондробласты расположены хаотически, их упорядочивание происходит параллельно оссификации эпифиза (от центра зоны роста в направлении к периферии), и в соответствии с этим зона роста постепенно приобретает барьерные свойства. Вот почему при отсутствии ядра окостенения, воспалительный процесс пенентрирует зону роста в центральной части, при появлении ядра оссификации пенентрация происходит в периферической части.
Поражение эпифиза сопровождается деструкцией последнего, с вовлечением в патологический процесс сустава и возникновением артрита, который в свою очередь приводит к патологическому вывиху и параартикулярной флегмоне. Дискредитированная ростковая зона частично или полностью погибает, и это в дальнейшем обусловливает возникновение приобретенных пороков развития (укорочение или удлинение, деформации конечностей).
Таким образом, исходом заболевания могут быть ортопедические осложнения, влекущие инвалидизацию ребенка, от 10 до 40 % случаев. МЭО представляет собой один из наиболее сложных вариантов течения гнойно-воспалительного процесса, требующего детального анализа течения заболевания, а также применения доступных для использования эффективных методов диагностики [5].
Цель исследования: изучить особенности клинического течения метаэпифизарного остеомиелита, провести сравнительный анализ возможностей различных методов диагностики.
Материалы и методы
В исследование включено 64 ребенка в возрасте от 0 до 3-х лет с острым гематогенным метаэпифизарным остеомиелитом, находившихся на стационарном лечении по поводу данного заболевания в отделении гнойной и экстренной хирургии ДОКБ г. Твери с 2005 по 2015 г. Для уточнения особенностей клинического течения различных форм МЭО был проведен анализ результатов стандартного комплекса клинико-диагностических мероприятий, проведенного у всех поступивших. Диагноз ставился на основании анализа жалоб больного, данных анамнеза, клинического осмотра, использовались методы бактериологической и лабораторной диагностики, методы медицинской визуализации (рентгенография, ультразвуковое исследование, компьютерная томография, магнитно-резонансная томография).
Результаты исследования и их обсуждение
В структуре обследуемых больных наибольшую группу составили дети до 1 года (n=4875 %), наиболее часто заболевание возникало в возрасте до 1 месяца (n=30; 46.8 %), от 1 г. до 3-х лет госпитализировано 16 (25 %) детей (таблица 1).
Число пациентов, n
От 1 месяца до 1 года
От 1 года до 3-х лет
По половой принадлежности преобладали мальчики (n=39; 60.9 %). Больные из районов области составили 60.9 % (n=39). В первые трое суток болезни был госпитализирован 21 ребенок (32.8 %). Наибольшее число пациентов (n=33; 51.5 %) обратилось за помощью детского хирурга на 4–7 сутки заболевания. Оставшиеся в более поздние сроки (n=10; 15.5 %). Анализ сроков поступления в специализированный хирургический стационар выявил достаточно позднее обращение за медицинской помощью, что связано с трудностями ранней диагностики МЭО из-за многообразия клинических проявлений заболевания, отсутствия ранних патогномоничных жалоб, преобладания у малышей общих реакций над местными, особенностями психофизиологического статуса пациентов раннего возраста. Немаловажная роль принадлежит ошибкам диагностики на догоспитальном этапе. Учитывая распределение больных по месту обращения, замечено, что достаточно большая группа детей поступала из род. домов (n=17; 26.5 %), из стационара (отделение патологии новорожденных) – (n=21;32.8 %). По направлению участковых педиатров, хирургов травматологов (n=23;35.9 %), 3 человека обратились самостоятельно.
Для характеристики клинического течения МЭО использовалась классификация Т.П. Краснобаева. Встречалась местная форма (n= 53;82.8 %) заболевания, септикопиемическая (n= 11; 17.2 %), токсическая форма не зарегистрирована. Из септических осложнений на первом месте оказалась пневмония (n= 6;54.5 %). Также имели место перикардит (n=3;27.2 %), поражение почек (n=1; 9 %), средний гнойный отит (n=1;9 %). Локальная форма заболевания превалировала в возрастной группе от 1 г. до 3-х лет. Результаты оценки степени тяжести состояния показали, что дети поступали в стационар преимущественно в состоянии средней степени тяжести (n=36;56.2 %). В тяжелом состоянии доставлено 28 детей (43.7 %). Это связано с поздним обращением за специализированной хирургической помощью, низкой иммунологической резистентностью детского организма, быстрым нарастанием симптомов интоксикации ввиду выраженности альтеративного компонента воспалительной реакции в раннем возрасте. Дети, поступившие в тяжелом состоянии, были госпитализированы в отделение реанимации, где проводилось непрерывное мониторирование жизненно важных функций организма и интенсивная комплексная терапия заболевания. В типичных случаях заболевание начиналось остро: (n=52; 81.2%), возникала резкая боль в пораженной конечности (n= 49; 76.5 %). Появлялись и нарастали симптомы интоксикации: повышение температуры тела (n=60; 93.7 %), вялость, отказ от еды (n= 44; 68.7 %). В тяжелых случаях возникала тахикардия (n=9; 14 %), тахипноэ (n=8; 12.5 %) менингеальные явления (n=4; 6.25 %).
При клиническом осмотре обращало на себя внимание вынужденное положение конечности, ограничение или отсутствие активных движений, болезненность при пальпации и попытке пассивных движений. (n=56; 87.5 %), отмечалась выраженная стойкая контрактура суставов (n=48; 75 %), что связано с вовлечением в процесс связочного аппарата и параартикулярных тканей. В более поздние сроки появлялось увеличение объема сустава из-за наличия в его полости жидкости (2–5 сутки и позже), гиперемия над очагом поражения –(n= 43; 67 %).
Факторы риска развития заболевания выявлены в 34 (53.1 %) случаях. Это –неблагоприятный антенатальный период: внутриутробная гипоксия плода разной степени выраженности, очаги хронической инфекции, синдром интоксикации у матери, оперативные роды, травматизация в родах, недоношенность, перинатальное поражение ЦНС, катетеризация центральной вены, низкая оценка по шкале Апгар, предшествующие гнойные заболевания. Важная роль отводится гипоксии не только как промоутеру каскада метаболических нарушений, но и фактору, способствующему развитию генерализованных форм МЭО. Результаты проведенных исследований показали, что у всех больных с септикопиемической формой выявлены факторы риска [6,7].
По локализации остеомиелитического очага преобладало поражение эпифизов длинных трубчатых костей скелета с поражением суставов в виде гнойных артритов: бедренной кости с поражением тазобедренного сустава (n=26;40.6 %), большеберцовой (n=13; 20 %), малоберцовой (n=11; 17.1 %), костей предплечья (n=5;7.8 %). Множественное поражение костей при МЭО отмечено у 2 (3 %) детей.
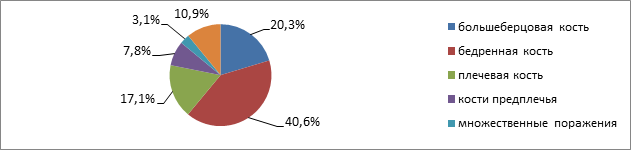
Рис.1. Локализация очага воспаления
С целью выявления этиологического фактора заболевания применялись бактериоскопический и бактериологический методы исследования с определением чувствительности микрофлоры к антибиотикам. При первичном заборе биоматериала идентифицирован возбудитель у 46(71.8 %) больных. Анализ полученных результатов показал, что в большинстве случаев основным этиологическим фактором является золотистый стафилококк (n=28;43.7 %), также были обнаружены другие виды стафилококка (n=4;8.6 %), энтерококк и клебсиелла (n=2;3.1 %) в равных количествах, гемолитический стрептококк (n=3;4,6 %), протей (n=1;1.5 %), кишечная и синегнойная палочка (n=2;3.1 %) и (n=1;1.5 %) соответственно, полифлора (n=3;4.6 %).
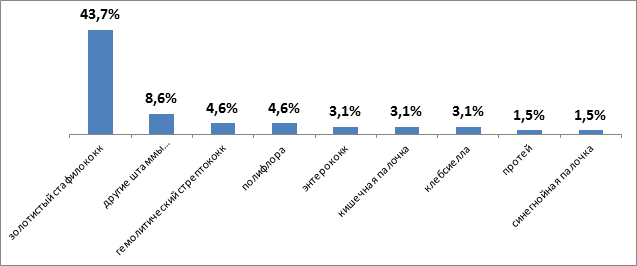
Рис. 2. Результаты высева микрофлоры из очага поражения
При анализе изменений состава периферической крови, констатирована анемия (n= 34;53.1 %), лейкоцитоз (n= 57;89 %), палочкоядерный сдвиг (n= 49; 76.5 %), ускорение СОЭ (n=28; 43.7 %). У больных с септикопиемической формой регистрировалась тромбоцитопения (n=11;7.2 %) у большинства пациентов имелись признаки системного воспалительного ответа (нейтрофильный лейкоцитоз со сдвигом формулы влево). В биохимическом анализе крови сохранялась нормогликемия (n=58; 90.6 %). Гипергликемия зарегистрирована с максимальным значением 13 ммоль/л (n=4; 6.25 %). Гипогликемия с минимальным значением 2.8 ммоль/л (n=2; 3.1%). Изменения белкового спектра крови проявлялись умеренной гипопротеинемией (n=29; 45.3 %). Повышение уровня С-реактивного белка как неспецифического маркера воспаления определялось качественным методом, было положительным (n= 44; 68.7 %) и резко положительным (n=13;20.3 %). Также имел место отрицательный результат (n= 7; 10.9 %). Лабораторные показатели, характеризующие функцию почек, оставались в пределах референтных значений. Средние значения электролитного обмена соответствовали возрастной норме. В ряде случаев отмечено изменение фибринолитической активности (n= 24;37.5 %).
В последнее десятилетие МЭО занимает одно из первых мест в гнойно-септической хирургии по частоте исхода в бактериальный сепсис. Для ранней диагностики септического процесса, в случае ухудшения состояния ребенка проводился прокальцитониновый тест сыворотки крови экспресс-методом по Brachms (n= 14; 21 %). Выполнение исследования позволило определить клиническую форму заболевания. В результате была диагносцирована местная форма (n=5;7.8 %) – прокальцитонин сыворотки крови 2 состояние трактовалось как сепсис, осложнивший остеомиелит – (n= 9;14 %).
На диагностическом этапе установления МЭО применяли различные методы медицинской визуализации. В качестве стандартизированного лучевого метода исследования опорно-двигательного аппарата стартовым являлась рентгенография пораженного отдела скелета. (n=64; 100 %). Метод позволял оценить форму, контуры, соотношения между костями. Ранние рентгенологические признаки заболевания в виде утолщения мягких тканей на уровне поражения, расширения суставной щели, размытости контуров эпифиза, остеопороза края метафиза выявлены в среднем на 3–5 день болезни (n=19;29.6 %). На 10–14 день болезни регистрировалась периостальная реакция и очаги деструкции в метаэпифизарной зоне (n= 47; 73.4 %). Рентгенографический метод не обладает достаточной чувствительностью к визуализации хрящевых структур в начальные периоды развития заболевания.
Магнитно-резонансная томография (МРТ) является высокоинформативным методом, обладающим высокой чувствительностью и достаточной специфичностью в интрамедуллярную фазу МЭО, позволяет выявить изменения костного мозга, определить так называемые участки патологической гидратации, а также оценить суставные поверхности и околосуставные мягкие ткани. К недостаткам метода следует отнести необходимость проведения анестезиологического пособия для исключения двигательной активности пациентов младшей возрастной группы во время исследования. МРТ использовали в качестве уточняющей методики в интрамедуллярную фазу (n=4 ;6.25 %) [8].
Компьютерная томография (КТ) – метод выбора для оценки суставных поверхностей, мягких тканей, изменений костного мозга, позволяет выявить отек мягких тканей и деструкцию кости, не замеченную на обычных рентгенограммах, наилучший метод выявления секвестров. КТ недавно внедрена в работу клиники (n=8;12.5 %). Сопряжена с лучевой нагрузкой, зарекомендовала себя как оптимальный способ ранней диагностики МЭО, уже на 2-е сутки заболевания в кортикальном слое проявляются отчетливые рентгенодеструктивные изменения костных структур.
Ультразвуковая диагностика выполнена всем пациентам с МЭО (n=64;100 %), в дебюте заболевания (n=29;45.3 %). Методика показала высокую информативность (80 %), верифицируемую во время операции. Проникающая способность ультразвука у детей раннего возраста большая, чем у более старших, что связано с незавершенным процессом остеогенеза, когда эпифизы костей состоят в основном из хрящевой ткани. Исследование позволило оценить состояние мягких тканей, определить анатомические взаимоотношения в суставе, состояние капсулы (уплотнение и утолщение), суставной полости, ядер окостенения, определить утолщение надкостницы, распознать поднадкостничные абсцессы, визуализировать участки деструкции кости в метаэпифизарной зоне [9,10]. В процессе проведения исследования были обнаружены следующие УЗ-признаки изменения анатомических структур: утолщение мягких тканей, повышение эхогенности, жидкостные парартикулярные скопления (n=32;50 %); изменения внутрисуставной полости (утолщение капсулы сустава, наличие внутрисуставной жидкости – n=39;60.9 %); изменения однородности эпифизарного хряща (n=34;53 %); изменение формы и структуры ядра окостенения эпифизарного конца конечности (n=27;42.1 %); изменения метаэпифизарной зоны (нечеткость, неровность дефект зоны предварительного обызвествления, анэхогенные участки и включения – n=43 67.1 %); изменения надкостницы (неровность наружного контура, утолщение, повышение эхогенности n=25;39 %). Основной УЗ-признак МЭО –изменения в метаэпифизарной зоне – появлялся на 4–7 день болезни.
Выводы и заключение
Т.о., резюмируя полученные результаты, отмечено, что метаэпифизарный остеомиелит наиболее часто встречается в группе новорожденных детей, у каждого из которых обнаружены факторы риска возникновения заболевания в виде внутриутробной гипоксии плода, наличия очагов хронической инфекции и синдрома интоксикации у матери, недоношенности. В большинстве случаев в дебюте заболевания преобладало наличие общей симптоматики. Локальные проявления прогрессировали медленно. Основным этиологическим фактором являлся золотистый стафилококк. Первичный очаг воспаления локализовался преимущественно в эпифизах длинных трубчатых костей нижних конечностей. В ранней диагностике заболевания методом выбора является компьютерная томография и ультразвуковое исследование.
Острый гематогенный остеомиелит (ОГО) – гнойное воспаление кости, при котором поражаются костный мозг, компактное вещество и надкостница. В некоторых случаях остеомиелит возникает в результате перехода гнойного процесса на кость из прилегающих мягких тканей или других органов (одонтогенный остеомиелит, связанный с кариесом зубов; остеомиелит ребра вследствие эмпиемы плевры; остеомиелит фаланг пальцев, при панариции и т.д.).
Наиболее частым возбудителем остеомиелита (75 –95%) считают золотистый стафилококк или комбинацию стафилококка с протеем и синегнойной палочкой. ОГО – заболевание растущего организма. Чаще всего (96%) заболевание встречается у детей младшего школьного возраста. Большую роль в процессе развития остеомиелита у детей играют возрастные анатомические особенности строения и кровоснабжения костей:
- значительно развитая сеть кровеносных сосудов,
- автономность кровоснабжения эпифиза, метафиза и диафиза,
- наличие большого количества мелких разветвлений сосудов, идущих радиарно через эпифизарный хрящ к ядру окостенения.
У детей первых 2 лет жизни преобладает эпифизарная система кровоснабжения, в то время как метафизарная начинает развиваться уже после 2 лет. Эпифизарная и метафизарная системы обособлены, но между ними имеются анастомозы. Общая сосудистая сеть образуется только после окостенения зоны эпифизарного роста. Для детей младше 2 - 3 лет характерно поражение метаэпифизарных зон. С возрастом, когда начинает усиленно развиваться система кровоснабжения метафиза, чаще всего страдает диафиз.
Патогенез ОГО до настоящего времени полностью не изучен. Главными звеньями патогенеза являются:
- наличие экзо- и эндоинфекции,
- анатомические особенности кости,
- снижение иммунологической реактивности организма.
Важная особенность воспалительного процесса состоит в том, что он замкнут ригидными стенками костной трубки; это приводит к сдавливанию вен, а затем и артерий. Косвенным доказательством такой трактовки нарушения кровообращения кости служит боль, которая является следствием гипертензии в костномозговом канале. Величина внутрикостного давления при ОГО достигает 300-500 мм вод. ст. (при норме 60-100 мм вод. ст. у здоровых детей). Если остеомиелитический процесс не диагностируют в стадии воспаления в пределах костномозгового канала, то с 4-5-х суток от начала заболевания гной распространяется по костным (гаверсовым) канальцам и питательным (фолькманновским) каналам под надкостницу, постепенно отслаивая ее.
В более поздние сроки (8-10 сут и позже) гной и продукты распада продолжают отслаивать периост, затем гной прорывается в мягкие ткани, образуя межмышечные и подкожные флегмоны. В этих случаях идет речь о запущенной диагностике остеомиелита, лечение которого представляет значительные сложности. Боль, как правило, стихает при самопроизвольном вскрытии субпериостального абсцесса в окружающие мягкие ткани, так как снижается давление в костномозговом канале.
В настоящее время гематогенный остеомиелит принято классифицировать следующим образом:
Клиника
В зависимости от места поражения кости различают остеомиелиты эпифизарные, метафизарные, диафизарные губчатых, коротких и плоских костей. Клиническое течение и лечение ОГО зависит от локализации воспалительного процесса и возраста ребенка. Поражение метафизов и диафизов длинных трубчатых костей возникает преимущественно у детей старше 3 лет. Клинические проявления заболевания разнообразны и зависят от вирулентности возбудителя, возраста и реактивности ребенка, а также от локализации процесса.
Токсическая (адинамическая, молниеносная) форма острого гематогенного остеомиелита является наиболее тяжелой. В ее течении преобладают общие явления гнойной интоксикации. Заболевание начинается внезапно с повышения температуры тела до 40-41° С. Общее состояние очень тяжелое, наблюдаются помрачнение сознания, бред, галлюцинации. Пульс частый, слабого наполнения. Тоны сердца приглушены. Вследствие крайне тяжелого состояния практически невозможно определить первичный очаг воспаления: ребенок не жалуется на боль, а местные изменения в первые сутки не выражены. Диагностика токсической формы чрезвычайно сложна.
Септико–пиемическая форма заболевания наиболее часто встречается у детей и сопровождается острыми септическими проявлениями. Иногда им предшествует короткий продромальный период, при котором ребенок жалуется на общую утомляемость, слабость, головную боль. Температура повышается до 39°С и имеет реммитирующий характер. Через несколько часов от начала заболевания в пораженной конечности возникает боль. Боль распирающая, чрезвычайно интенсивная, ребенок занимает вынужденное положение в кровати, плачет, не может спать. Даже прикосновение к конечности вызывает сильные страдания. Общее состояние ребенка тяжелое. Выражены симптомы токсикоза. Тоны сердца приглушены, тахикардия.
Местные проявления при септико-пиемической форме остеомиелита в первые 2 дня заболевания могут быть неотчетливыми. При этом ребенок еще не локализует боль, реагирует на ощупывание всей конечности. С 3–4 дня появляются более заметные местные признаки воспаления, нарастает отек (больше над очагом поражения), болезненность при пальпации отграничивается и становится отчетливой. Позднее, если больному не оказана помощь, над припухлостью появляются гиперемия и флюктуация. Для септико-пиемической формы остеомиелита характерны метастазирование гнойной инфекции и появление пиемических очагов в других костях или паренхиматозных органах (легкие, печень, почки).
Об этом следует помнить для правильной оценки повторного ухудшения общего состояния. В таких случаях проводят тщательные поиски нового очага гнойного поражения. Для детей раннего возраста, поскольку невозможно локализовать боль и другие болезненные проявления, характерными являются микросимптомы, которые позволяют заподозрить развитие гнойно-деструктивного процесса костной ткани:
- щажение и/или ограничение подвижности пораженной конечности;
- местное повышение температуры мягких тканей;
- пастозность и легкая отечность в проекции гнойно-воспалительного процесса.
Заболевание начинается остро с повышения температуры до 37-38° С и резких болей в пораженной конечности. Пораженная конечность обездвижена, находится в вынужденном положении, на ограниченном участке отечна, мягкие ткани пастозны, горячие на ощупь. Довольно быстро появляются гиперемия над припухлостью и флюктуация. Установление факта внутрикостной гипертензии, при проведении микроостеоперфорации, позволяет подтвердить этот диагноз даже при отсутствии гноя под надкостницей или в костномозговом канале. В сомнительных случаях необходимо использовать диагностическую костную пункцию с последующим цитологическим исследованием пунктата.
При исследовании крови наблюдаются лейкоцитоз (30 - 40 · 10· 9 /л) со сдвигом формулы крови влево и токсическая зернистость нейтрофилов. Отмечается значительное увеличение СОЭ (до 60 мм/ч), которая держится длительное время.Имеются выраженные изменения и в белковом спектре сыворотки крови, которые заключаются в диспротеинемии, увеличении глобулиновых фракций и возникновении гипоальбуминемии. При длительном и тяжелом течении заболевания развивается анемия, обусловленная угнетением костного мозга длительным воздействием токсинов.
Диагностика
Весьма эффективным диагностическим методом является термография, а также УЗИ в сосудистом режиме, позволяющие установить характерные изменения на ранних этапах заболевания. В последние годы для более раннего и точного определения локализации и распространенности воспалительного процесса применяют метод радионуклидного сканирования костей с последующей компьютерной обработкой полученных данных. С этой целью используют короткоживущие радионуклиды, обладающие костной тропностью (технеций). Использование ядерно–магнитно–резонансной томографии (МРТ) в диагностике остеомиелита является перспективным и надежным методом: уже на 4–6 день на снимках видны те изменения, которые на рентгенограммах видны на 14–15 день.
Первый рентгенологический признак ОГО длинных трубчатых костей: рядом с тенью коркового слоя диафиза или метафиза определяется периостит в виде тонкой линейной пластинки, идущей вдоль кости.
Длина периостита зависит от степени отслойки надкостницы экссудатом. Выраженность периостальной реакции зависит от локализации очага. Наибольшая периостальная реакция наблюдается при диафизарном поражении, менее выраженная - при метафизарном и еще менее выраженная - при эпифизарном. Рентгенологические изменения в костях появляются приблизительно через 2–4 недели от начала заболевания. В толще коркового слоя или губчатом веществе метафиза начинают выделяться отдельные светлые очаги разрушения, которые, сливаясь, проявляются рентгенологически остеопорозом. Кость становится прозрачной, трабекулярная сеть широкопетлистой, корковый слой истончен.
Наряду с процессами разрушения выявляются и признаки образования новой кости: появляется утолщение кортикального слоя за счет измененного периоста. При длительном течении заболевания на рентгенограмме преобладают признаки остеосклероза. С переходом острого остеомиелита в хронический на рентгенограммах через 3 – 6 мес выявляются полости, заполненные секвестрами, и значительное утолщение костной ткани.
Лечение
Лечение проводится в соответствии с принципами терапии гнойной хирургической инфекции. При поступлении ребенка в стационар в первую очередь осуществляют детоксикационные мероприятия – внутривенное введение растворов 10% глюкозы, транфузию плазмы, альбумина. С первого дня заболевания начинают введение витаминов группы С и В. Для десенсибилизации организма и нормализации сосудисто-тканевой проницаемости вводят препараты кальция, антигистаминные препараты. Для повышения уровня специфического иммунитета в остром периоде остеомиелита проводят пассивную иммунизацию организма ребенка. С этой целью вводят гипериммунную стафилококковую плазму и антистафилококковый гамма-глобулин, а также неспецифические иммуномодуляторы.
При проведении интенсивной терапии необходимо контролировать электролитный обмен, КЩР и функцию мочевыделительной системы. Курс лечения также включает стимуляцию защитных сил организма. При тяжелых формах заболевания, когда наступает угнетение функции коры надпочечников, возможно применение гормональных препаратов (гидрокортизон, преднизолон) коротким курсом (7 дней). Внутривенные капельные вливания продолжают в течение нескольких дней до ликвидации явлений интоксикации, уменьшения температурной реакции, улучшения аппетита ребенка. Эффективными современными методами детоксикации при септическом течении гнойной инфекции являются гемосорбция и плазмоферез.
Антибактериальная терапия является одним из основных методов лечения ОГО. При первом назначении антибиотиков детям следует отдать предпочтение препаратам широкого спектра действия для внутривенного введения вместе с внутрикостным применением сочетаемых антибиотиков. В дальнейшем антибиотики назначают в соответствии с чувствительностью микрофлоры очага поражения. Эффективность антибактериальной терапии значительно повышается при ее сочетании с протеолитическими ферментами. На последующий курс назначают антибиотики, обладающие костной тропностью (линкомицин), в возрастной дозировке сроком на 2-3 нед.
В ранние сроки развития ОГО, когда нет четких указаний на локализацию гнойно-деструктивного процесса, наиболее эффективным диагностическим и лечебным методом является проведениемикроостеоперфорации с применением оригинального устройства (Пункционный инструмент, 1980. Боков Н.Ф. и соавт.),
Манипуляция проводится под общим наркозом, с учетом преморбидного фона. Устройством, соединенным с электродрелью проводят последовательную перфорацию мягких и костной тканей, и проникают в костно-мозговой канал. Размер иглы для микроостеоперфорации зависит от локализации процесса и толщины мягких тканей ребенка. Это малотравматичное хирургическое пособие позволяет:
- измерить внутрикостное давление,
- визуально оценить содержимое костномозгового канала,
- выполнить забор пунктата для его морфологического и цитологического исследований,
- обеспечить проточное промывание костно–мозгового канала
- выполнить внутрикостное введение антибиотиков.
После остеоперфорации болевой синдром значительно уменьшается или исчезает полностью. Микроостеоперфорация – единственная манипуляция на костях, целесообразная при ОГО.
Иммобилизация конечности при остеомиелите является обязательной и неотъемлемой частью лечения. При иммобилизации создается относительно полный покой конечности, что уменьшает боль, предупреждает патологические переломы пораженной конечности и возможное образование контрактур. В настоящее время при поражении нижних конечностей применяется шина Белера (двойной экстензионный аппарат), а при верхних – косыночная повязка.
Осложнения, возникающие при ОГО, зависят от формы заболевания, иммунобиологической реактивности организма, а также от сроков оказания врачебной квалифицированной помощи. Наиболее тяжелыми осложнениями являются метастазирование инфекции и возникновение гнойных очагов в других органах (абсцедирующая пневмония, перикардит, пиелонефрит и др.). Серьезным осложнением метафизарных и диафизарных остеомиелитов являются патологические переломы, возникающие самопроизвольно или под влиянием незначительного усилия.
При распространении процесса с метафиза на эпифиз,а затем на сустав возможны осложнения, характерные для эпифизарных остеомиелитов (укорочение конечности, артриты, патологические вывихи, стойкие контрактуры и др.). В ряде случаев острый процесс при остеомиелите стихает и переходит в хроническую стадию. Это чаще всего развивается при обширных поражениях, а также в запущенных случаях, когда медицинская помощь оказана поздно или нерационально.
Бычков В.А., Манжос П.И., Бачу М.Рафик Х., Городова А.В.
Читайте также:


