Пересаженная почка и инфекция
Инфекции остаются важнейшей причиной заболеваемости и смертности у больных с пересаженными почками.
1. Бактериальные инфекции после трансплантации почки. Чаще всего встречаются пневмония и инфекции мочевых путей. Последние могут быстро переходить в уросепсис и иногда бывают ошибочно приняты за острое отторжение трансплантата.
2. Вирусные инфекции после трансплантации почки. Особую опасность представляют герпесвирусы (цитомегаловирус, вирус простого герпеса, вирус varicella-zoster и вирус Эпштейна—Барр). У детей младшего возраста первый контакт с этими вирусами часто бывает уже после трансплантации почки, и тогда первичная инфекция на фоне иммунодепрессантов может протекать у них очень тяжело.
Частота этих заболеваний существенно возрастает после лечения антилимфоцитарными препаратами или пульс-терапии большими дозами глюкокортикоидов. В таких случаях показана профилактика герпесвирусных инфекций.
а) Цитомегаловирус. Цитомегаловирусная инфекция может протекать в виде носительства (вирус персистирует в лимфоидной ткани). Серологические пробы на цитомегаловирус положительны приблизительно у 30% детей старше 5 лет и у 60% подростков. Следовательно, чем младше ребенок, тем выше риск первичной цитомегаловирусной инфекции при трансплантации почки от инфицированного донора.
Она может проявляться лихорадкой, лейкопенией, тромбоцитопенией, пневмонией, язвами ЖКТ, гепатитом, гломерулопатией и почечной недостаточностью, острым отторжением трансплантата и подавлением иммунитета. Установлена связь между цитомегаловирусной инфекцией и хроническим отторжением при трансплантации любых органов. Для лечения и профилактики применяют иммуноглобулин против цитомегаловируса, нормальный иммуноглобулин для в/в введения в высоких дозах и противовирусные препараты — ацикловир, валацикловир, ганцикловир и валганцикловир.
Профилактическое лечение ганцикловиром показано серонегативным реципиентам почки от серопозитивного донора.
б) Вирус varicella-zoster. У детей старшего возраста, перенесших трансплантацию почки, вирус varicella-zoster чаще всего вызывает опоясывающий лишай — локальные пузырьковые высыпания в пределах одного дерматома. У детей младшего возраста возможна быстропрогрессирующая тяжелейшая инфекция с энцефалитом, пневмонией, печеночной недостаточностью, панкреатитом и ДВС-синдромом.
Серонегативным детям в течение 72 ч с момента случайного контакта с больным необходимо ввести иммуноглобулин против вируса varicella-zoster, в 75% случаев это существенно облегчает протекание инфекции. До трансплантации ребенка следует вакцинировать против вируса varicella-zoster. При появлении ветряночной сыпи у ребенка с пересаженной почкой необходимо немедленно ввести ацикловир парентерально. Опоясывающий лишай менее склонен к диссеминации, но ацикловир все же показан.
в) Вирус Эпштейна—Барр. Примерно 50% детей серонегативны в отношении вируса Эпштейна— Барр, и приблизительно 75% из них после трансплантации почки инфицируются. Инфекция вирусом Эпштейна—Барр даже на фоне иммунодепрессантов в большинстве случаев протекает бессимптомно. В то же время у 0,5—2% детей после трансплантации почки возникает лимфопролиферативный синдром, часто обусловленный инфекцией вирусом Эпштейна—Барр на фоне интенсивной иммуносупрессивной терапии.
Он может проявляться лихорадкой, потерей веса, гепатоспленомегалией, поносом, увеличением лимфоузлов, а при поражении ЦНС — неврологической симптоматикой. Лечение включает резкое снижение доз иммунодепрессантов, а при наличии очагов высокой степени злокачественности — химиотерапию и антилимфоцитарные средства.
г) Вирус простого герпеса. Типичные герпетические изъязвления около рта при применении иммунодепрессантов встречаются часто и обычно излечиваются при приеме ацикловира внутрь.
3. Пневмоцистная пневмония после трансплантации почки. Для профилактики пневмоцистной пневмонии после трансплантации показан 3—6-месячный курс триметоприма/сульфаметоксазола.
Аннотация научной статьи по клинической медицине, автор научной работы — Барканова О.Н., Перлин Д.В., Шепелева Юлия Борисовна, Реброва Е.В., Ильченко О.В.
Исследована микробная флора в различных биологических средах при инфекционных осложнениях у реципиентов почечного трансплантата. Отмечается незначительное преобладание грамположительной флоры. Выделенные бактерии в большинстве случаев обладали выраженной поливалентной резистентностью к антибиотикам .
Похожие темы научных работ по клинической медицине , автор научной работы — Барканова О.Н., Перлин Д.В., Шепелева Юлия Борисовна, Реброва Е.В., Ильченко О.В.
INFECTIOUS COMPLICATIONS OF EARLY POSTOPERATIVE PERIOD IN PATIENTS AFTER KIDNEY TRANSPLANTATION
We studied the microbial flora in various biological media in infectious complications in renal transplant recipients. There was a slight predominance of gram-positive flora. In most cases, the isolated bacteria showed a pronounced polyvalent antibiotic resistance.
ИНФЕКЦИОННЫЕ ОСЛОЖНЕНИЯ РАННЕГО ПОСЛЕОПЕРАЦИОННОГО ПЕРИОДА У ПАЦИЕНТОВ ПОСЛЕ ТРАНСПЛАНТАЦИИ ПОЧКИ
О. Н. Барканова, Д. В. Перлин, Ю. Б. Шепелева, Е. В. Реброва, О. В. Ильченко
Волгоградский государственный медицинский университет, кафедра клинической фармакологии и интенсивной терапии с курсами клинической фармакологии ФУВ, клинической аллергологии ФУВ, Волгоградский областной уронефрологический центр
Исследована микробная флора в различных биологических средах при инфекционных осложнениях у реципиентов почечного трансплантата. Отмечается незначительное преобладание грамположительной флоры. Выделенные бактерии в большинстве случаев обладали выраженной поливалентной резистентностью к антибиотикам.
Ключевые слова: трансплантация почки, бактериальные инфекции, чувствительность к антибиотикам, резистентность к антибиотикам.
INFECTIOUS COMPLICATIONS OF EARLY POSTOPERATIVE PERIOD IN PATIENTS AFTER KIDNEY TRANSPLANTATION
O. N. Barkanova, D. V. Perlin, Y. B. Shepeleva, E. V. Rebrova, O. V. Ilchenko
Volgograd State Medical University, Department of Clinical Pharmacology and Intensive Care with Clinical Pharmacology courses HFC, clinical allergy HFC, Volgograd Regional Uronephrological Center
We studied the microbial flora in various biological media in infectious complications in renal transplant recipients. There was a slight predominance of gram-positive flora. In most cases, the isolated bacteria showed a pronounced polyvalent antibiotic resistance.
Key words: kidney transplantation, bacterial infection, antibiotic sensitivity, resistance to antibiotics.
Трансплантация почки (ТП) является оптимальным методом лечения больных с терминальной стадией хронической почечной недостаточности. Но серьезной проблемой посттрансплантационного периода являются инфекции. По данным Российского регистра заместительной почечной терапии (отчет за 1998—2011 гг.), в настоящее время в структуре летальности больных с почечным трансплантатом доля инфекционных осложнений составляет 25,4 % [2].
Для развития определенных инфекций после трансплантации характерна специфическая хронология. Наиболее опасный период в плане развития инфекци-онно-воспалительных осложнений — ранний послеоперационный (первые 1—2 месяца). Именно в эти сроки чаще всего развиваются внутрибольничные инфекции дыхательной системы, раневые инфекции, катетер-ассоциированные инфекции и урологические осложнения, которые являются причиной сепсиса [1].
Развиваясь на фоне иммуносупрессии, инфекционные осложнения после ТП часто имеют атипичное течение, что затрудняет их своевременную диагностику и начало этиотропной терапии.
Самые частые ранние инфекционные осложнения у больных после ТП — это инфекции мочевыводящих путей (ИМП), частота их возникновения колеблется — по данным разных авторов — от 26 до 61 °% [4,6]. ИМП, развивающиеся в ранние сроки послеоперационного
периода, являются наиболее частой причиной потери трансплантатов [3].
Наиболее угрожающей жизни инфекцией у реципиентов почки является бактериальная пневмония. Риск развития пневмонии повышен у больных, которым длительно проводили искусственную вентиляцию легких, а также у пациентов с продолжительной назогастраль-ной интубацией, нарушенной функцией диафрагмы.
Частота встречаемости раневой инфекции после ТП колеблется от 2 до 25 °% [5]. Раневая инфекция развивается чаще всего в течение первых 3 недель после трансплантации и связана обычно с техническими осложнениями или сопутствующей патологией у реципиента (ожирение, сахарный диабет).
Данные относительно этиологических агентов, вызывающих инфекционные осложнения у реципиентов ренального трансплантата, отличаются противоречивостью. Обнаруживаемые бактериальные возбудители в раннем посттрансплантационном периоде сходны с теми, которые вызывают нозокомиальные инфекции у нетрансплантируемых хирургических больных. Бактериальные инфекции после ТП имеют поли-этиологичную природу, что делает весьма затруднительным их лечение и диктует необходимость применения комплекса антибактериальных препаратов. При этом потребность в назначении препаратов группы резерва реципиентам ренального трансплантата возникает
чаще, чем в общей популяции хирургических больных. Такие особенности использования антибиотиков приводят к росту резистентности госпитальной флоры в транс-плантологических центрах. Оптимизация антибактериальной терапии невозможна без полноценного своевременного мониторинга, анализа распространенности и эффективности лечения инфекций в подобных центрах.
Данное исследование посвящено анализу спектра микрофлоры в различных биологических средах у пациентов после трансплантации почки и изучению чувствительности флоры к антибиотикам.
Проанализировать микрофлору, выделенную из различных биологических сред у реципиентов ре-нального трансплантата, определить характер антибио-тикочувствительности выделенных штаммов.
Ретроспективно были проанализированы истории болезни пациентов, перенесших аллотрансплантацию почки в 2012—2014 гг. За этот период времени трансплантация была проведена 100 пациентам. Гендерный состав: мужчины — 59 %, женщины—41 % реципиентов. Средний возраст пациентов составил 41,1 (18—61) года.
Материалом для исследования служили образцы мочи, раневое отделяемое, кровь, мокрота. Забор его осуществлялся по общепринятым стандартам. Идентификация и определение чувствительности микроорганизмов к антибиотикам проводились диско-диффузионным методом на среде Мюллер-Хинтон агар.
И ИХ ОБСУЖДЕНИЕ
Инфекционные осложнения в раннем послеоперационном периоде были представлены следующими нозологиями (табл.):
Нозологическая структура инфекционных осложнений у пациентов — реципиентов ренального аллотрансплантата
Нозологическая форма 2012 г. 2013 г. 2014 г. Всего
Инфекции мочевыводящих путей 9 8 6 23
хирургического 6 8 1 15
Нозокомиальные 0 1 1 2
Обращает внимание, что самым частым инфекционным осложнением у пациентов после пересадки почки было развитие инфекции мочевыводящих путей — 57,5 % от всех инфекционных осложнений (23/40), что соответствует общемировой статистике.
Этиологические агенты отличались разнообразием. Было выявлено 50 штаммов возбудителей инфек-
ционных осложнений, из которых самыми распространенными были представители грамположительной флоры: 58 % (29/50). E. coli в 24 % случаев (12/50) была возбудителем всех инфекционных осложнений. Грамотрица-тельная флора высеивалась в 42 % случаев (21/50), самыми распространенными представителями были Enterococcus spp. — 24 % (12/50).
За время наблюдения на основании клинических, лабораторных данных и положительных результатов бактериологических посевов мочи ИМП была выявлена у 23 % пациентов (23/100). В 18 случаях высеивалась монокультура, в 5 случаях — смешанная флора (в четырех случаях ассоциация представлена двумя видами микроорганизмов, в одном — тремя). Преобладала грамотрицательная флора 62,1 % (18/29). Наиболее часто встречались штаммы E. coli—34,5 % (10/29) и Enterobacter aerogenes —10,3 % (3/29). Грамположи-тельные бактерии высеялись в 37,9 % случаев (11/29). Видовой состав был представлен энтерококками: Enterococcus spp., Enterococcus faecalis, Enterococcus faecium. Микробный спектр возбудителей ИМП представлен на рис. 1.
Рис. 1. Этиологическая структура ИМП у пациентов — реципиентов ренального трансплантата
Раневая инфекция развилась у 15 % пациентов (15/100). Ассоциативная флора была выявлена в двух случаях, в 13 случаях высеивались монокультуры. Отмечалось незначительное преобладание грамположительной флоры — 55,5 % (10/18). Самые частые представители — энтерококки — были выделены у 7 пациентов — 38,9 % возбудителей инфекции области хирургического вмешательства. S. aureus был выделен в 16,7 % случаев (3/18). На долю грамотрицатель-ной флоры приходилось 44,5 % возбудителей раневой инфекции (8/18). Видовой состав возбудителей отличался разнообразием. Самыми распространенными штаммами бактерий явились Е. coli и Рseudomonas aeruginosa. Микробный спектр возбудителей раневой инфекции представлен на рис. 2.
За время наблюдения нозокомиальная пневмония была диагностирована у 2 % пациентов (2/100). В одном случае из мокроты была высеяна ассоциация Serratia fonticola с Acinetobacterbaumanii, во втором — Рseudomonas aeruginosa.
Бактериемии не было обнаружено ни в одном случае посева крови на стерильность.
Eiiterococais spp S.aureus E.coli
Ампициллин Амоксициллин Амоксиц.+Клавулан. к-та Цефотаксим Цефтазидим Гентамицин Меропенем
Рис. 2. Этиологическая структура раневой инфекции у пациентов — реципиентов ренального трансплантата
Следующим этапом работы был анализ чувствительности выделенных микроорганизмов к антибиотикам.
Наиболее часто встречаемый представитель гра-мотрицательной флоры, а именно E. coli, были продуцентами бета-лактамаз расширенного спектра, что клинически характеризовалось неэффективностью цефа-лоспоринов всех поколений. Обращает на себя внимание довольно высокая чувствительность E. coli к гентамицину. Все выделенные штаммы были чувствительны к меропенему (рис. 3).
Рис. 3. Уровень чувствительности к антибактериальным препаратам штаммов E. coli, выделенных у реципиентов ренального трансплантата
У выделенных энтерококков наблюдалась крайне высокая резистентность к антибиотикам пенициллино-вого ряда, фторхинолонам, гентамицину. К ванкомици-ну была отмечена 100 % чувствительность (рис. 4).
Штаммы Рseudomonas aeruginosa, которые были высеяны у 3 % пациентов, отличались 100 % резистентностью к цефепиму и цефоперазону. К цефтазидиму устойчивы были 66,6 % штаммов (2/3), у 33,3 % наблюдалась промежуточная чувствительность. Был выявлен штамм, резистентный к меропенему.
Ампициллин Беншлпенпц Ципрофолок Левофлоксщнн Тетрациклин Эритромицин Гентамицин Ванкомицнн
Рис. 4. Уровень чувствительности к антибактериальным препаратам среди различных видов энтерококков,
выделенных у реципиентов ренального трансплантата
1. За три года наблюдения самым часто развивающимся инфекционным осложнением после аллотран-сплантации почки у пациентов в раннем послеоперационном периоде явились инфекции мочевыводящих путей — 57,5 %.
2. Было выделено 13 видов микроорганизмов из различных биологических сред. В общей картине возбудителей инфекций отмечалось незначительное преобладание грамотрицательной флоры (58 °%) над грам-положительной (42 °%).
3. Наиболее этиологически значимыми инфекционными агентами были E. coli и Enterococcus spp.
4. Все выделенные штаммы E. coli были БЛРС-продуцентами.
5. У всех выделенных энтерококков отмечалась низкая чувствительность к антибиотикам пеницилли-нового ряда, фторхинолонам и гентамицину; чувстви-
тельность к ванкомицину была сохранена в 100 % случаев.
6. Данные по антибиотикочувствительности выделенных штаммов отражают общую тенденцию нарастания резистентности госпитальной флоры даже к относительно новым антибиотикам.
1. Данович Г. М. Трансплантация почки / Пер. с англ. под ред. Я. Г. Мойсюка. — М.: ГЭОТАР-Медиа, 2013.
2. Клинические рекомендации по диагностике, лечению и профилактике инфекционных осложнений у пациентов с трансплантированной почкой / Ватазин А. В., Готье С. В., Мойсюк Я. Г., Прокопенко Е. И., Сюткин В. Е., Томилина Н. А. — М., 2014.
3. Becker S., Witzke O., Rubben H., Kribben A. Urinary tract infections after kidney transplantation: Essen algorithm for calculated antibiotic treatment // Urologe A. — 2011. — Vol. 50, № 1. — P. 53.
4. Cervera C., Fernandez-Ruiz M., Valledor A., et al. Epidemiology and risk factors for late infection in solid organ transplant recipients // Transpl. Infect. Dis. — 2011. — Vol. 13 (6). — P. 598—607.
5. Fishman J. A. Infections in organ-transplant recipients // N Engl J Med. — 2007. — Vol. 357. — P. 2601—2614.
6. Iqbal T., Naqvi R., Akhter S. F. Frequency of urinary tract infection in renal transplant recipients and effect on graft function // J. Pak. Med. Assoc. — 2010. — Vol. 60 (10). — P. 826—828.
Повторюсь, что на написание поста натолкнул @Zmeyov своей историей.
В нашем городе есть отделение гемодиализа, к счастью. В краевой городской больнице. 20 аппаратов искусственной почки (сейчас может быть и больше стало) которые могут обслуживать 120 человек. Но даже такое количество не способно было покрыть потребности в нем больных ХПН. Меня поставили в очередь 153-им. Перспектива весьма грустная, поскольку очередь двигалась, если кто-либо умирал, не дождавшись, что происходило чаще всего, либо кому-то делали пересадку, либо переезжал в другой город. Альтернативой сложившейся ситуации могла стать пересадка почки в ближайшие сроки. Тут было несколько вариантов.
2. Пересадка за деньги в Израиле или Германии. 100 000 долларов или евро соответственно. Было невероятно дорого для нас.
3. Пересадка за меньшие деньги, порядка 30 000 долларов в Пакистане или Китае. Там можно найти людей, которые готовы продать свою почку. Но это не совсем законно в Пакистане и совсем незаконно в Китае. Хотя могу ошибаться насчет этого. Почти 10 лет прошло с тех пор.
4. Еще был вариант за 3 000 000 рублей в Москве, но по этому поводу у нас было очень мало информации, поэтому он вообще не рассматривался.
В любом случае нужны были деньги, которых у меня и моих родителей не было.
Несмотря на то, что доход моих родителей едва дотягивал до среднего, у папы, благодаря его харизме и общительности, было очень много весьма влиятельных знакомых. Он был байкером и входил в состав байк-клуба, а там люди разные…
Так мы узнали, что в Новосибирске есть отделение гемодиализа на коммерческой на основе. Одна процедура стоит 5 000 рублей. Там мне впервые сделали гемодиализ. Делают его либо через АВФ (артериовенозная фистула; позже объясню, что это такое), либо через подключичный катетер, если АВФ еще не сформирована. Схема такого катетера выглядит вот так.
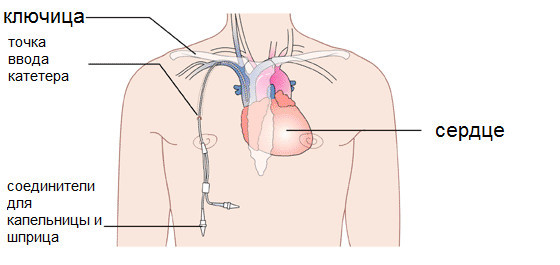
Картинка взята из википедии. Два шланга. Один для забора крови, другой – для возврата.
Пока я находился в Новосибирске, а это примерно две недели, в Барнауле, откуда я сам, отец при помощи своих знакомых уже начал вовсю пробивать мне место в отделении хронического гемодиализа (ОХД). Он узнал, что в той же краевой больнице Барнаула есть отделение токсикологии, у которого есть пара аппаратов искусственной почки. Они их используют, чтобы чистить кровь тем, кто получил отравление или испытывает ОПН (острая почечная недостаточность, которая может быть вылечена).
В итоге я попал в отделение токсикологии нашего города, где мне начали делать гемодиализ уже бесплатно. Токсикология оказалось своего рода перевалочной базой для таких как я. Таким образом я ждал, когда освободится место в ОХД.
Медперсонал в токсикологии был очень дружелюбным по отношению ко мне, а врачи, их квалификация, подход и отношение к делу внушали доверие и чувство надежности. Такие врачи-редкость, а их мне пришлось повидать немало.
Перед диализом на аппарат искусственной почки ставят диализатор. Представлен ниже на картинке.
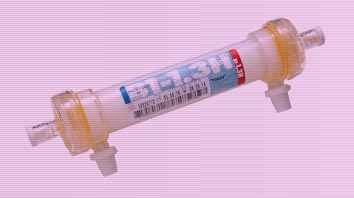
Картинка взята из интернета.
Подключение к аппарату искусственной почки происходит через подключичный катетер. Это такая длинная трубка, один конец которой уходит глубоко в легочную вену, а другой, раздвоенный на конце, торчит из-под ключицы, пришитый к коже, чтобы случайно не выпал. С катетером долго ходить нельзя, не более четырех месяцев, так как есть риск заражения крови, да и не удобно это. Поэтому хирургическим путем у пациента формируют артериовенозную фистулу. Вену, идущую вдоль лучевой кости левой руки, разрезают в районе запястья и подшивают к артерии, другой конец вены пришивают к другой вене. Под силой артериального давления венозное русло расширяется в несколько раз, что позволяет вводить в нее очень толстые иглы. Скорость кровотока в такой вене намного выше. Если дотронуться до неё, то можно почувствовать вибрацию, а если поднести к уху, то слышно, как шумит кровь. Выглядит вот так.
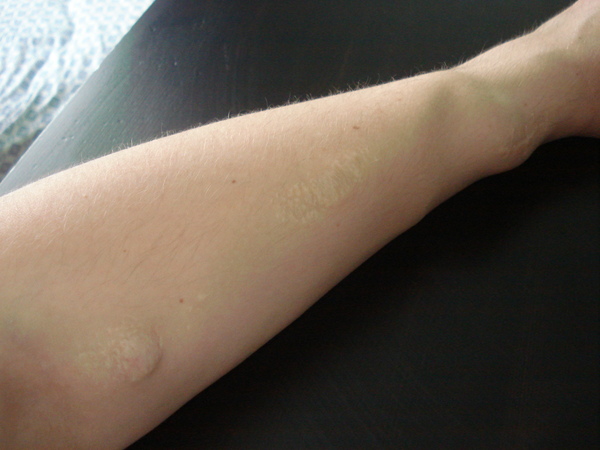
У локтевого сустава и ниже шрамы от иголок. У запястья хирургический шрам. Фото моей руки.
На диализе в Барнауле я был примерно полтора года. За это время мой отец узнал, что в Омске есть очень хороший хирург-трансплантолог. Стоимость операции 832 000 рублей (2009 год), что было намного дешевле по сравнению с остальными вариантами. Львиную долю этой суммы составляла стоимость диализа, рассчитанного на полгода, который необходимо делать реципиенту, пока он ждет своей очереди. То есть эта сумма может варьироваться в зависимости от того, сколько человек будет ждать. А ждать он может и пару недель, и пару лет. Как говорил @Zmeyov в своем посте, что очередная почка пересаживается тому, кому она подходит по медицинским параметрам лучше всего, чтобы свести к минимуму риск отторжения.
Мы начали собирать деньги. Мне помог мой универ собрать часть денег, помогли знакомые отца, а также многие другие. После того, как необходимая сумма была собрана, я, мама и сестра переехали в Омск. Отец остался в Барнауле.
Во втором хирургическом отделении, где и делали операции по трансплантации почек, уже обо мне знали. Меня положили на обследование. Необходимо было взять ряд анализов, чтобы знать, от какого донора почка подойдет лучше всего.
Меня обследовали, взяли ряд анализов и отправили домой ждать. Находясь в Омске, также ходил на гемодиализ, который был, кстати, качественнее, чем в Барнауле. Длилось это примерно полгода.
Накануне нового 2010го года, а точнее 29 декабря 2009го, под конец процедуры гемодиализа, в тот момент, когда мне сбивали самое высокое давление, которое у меня было за 2 года зафиксировано (250/140), ко мне заглянул заведующий вторым хирургическим отделением и сказал, чтобы завтра я зашел к ним в отделение и сдал несколько анализов, при этом ничего с утра не должен есть.
От одного донора реципиенту пересаживается только одна почка. Вторая пересаживается другому донору. Так в одной со мной палате – палате интенсивной терапии (ПИТ) – оказалась девушка. Мы с ней сдружились. Мы пребывали в одинаковом положении: еще вчера нам можно было практически все есть, пить, ходить, сидеть, а сегодня практически ничего нельзя. Можно было только пить не более литра в день, а в пищу употреблять только куриный бульон, творог, кефир. Из-за такого положения дел мы оба были на грани нервного срыва, но я себя утешал тем, что с каждым днем будет только лучше. Так оно и было. Каждый день какое-либо ограничение снималось. На следующий день можно было уже сидеть и есть перетертое куриное мясо. Через день уже можно было стоять и немного ходить. С каждым днем становилось все легче и легче. На третий день после операции у меня убрали уретральный катетер. А поскольку мочевой пузырь был после двух лет диализа сморщен, объем его значительно уменьшился, как итог в туалет я бегал чуть ли не каждые 5 минут. По этой причине я не мог нормально спать. Но с каждым днем перерывы между походами в комнату для раздумий становились длиннее. У моей соседки процесс реабилитации происходил немного хуже. Объяснялось это тем, что она все-таки женщина, а у них процессы заживления происходят гораздо медленнее. Всё то время, пока я находился в больнице, выходить в коридор можно было только в маске, чтобы уберечь себя от какой-либо инфекции. Через неделю после операции меня перевели в общую палату. В ПИТе зеркал не положено, поэтому возможности взглянуть на себя не представлялось возможным. В общей палате оно было. Какого же было моё удивления, когда, стоя перед зеркалом и сняв маску, увидел, что лицо моё покрыто щетиной. До этого лишь под носом рос пушок. Что же? Еще один плюс. Теперь у меня будет борода. Через 18 дней меня отправили домой, хотя все пророчили период реабилитации длительностью не менее месяца. Еще месяц я наблюдался в отделении амбулаторно. То есть ходил сдавать анализы.
Поскольку пересаженная почка, пускай даже от родственника, для организма является телом инородным, и, чтобы избежать отторжения, человеку необходимо принимать препараты, подавляющие иммунитет. Это тоже влечет за собой последствия. Первый период дозировка очень большая, иммунитета нет совсем, болеть нельзя. Но со временем дозировка корректируется, как правило, снижаясь. Если поначалу я принимал 400 мг циклоспорина, то сейчас дозировка составляет 100 мг.
В феврале 2010го года вернулся домой, в Барнаул. Встал под наблюдение компетентного специалиста. Через два года здесь открыли центр трансплантологии на базе краевой больницы.
Сейчас почти шесть с половиной лет прошло с тех пор. Живу обычной жизнью. У меня есть жена, сын. Да, необходимо принимать таблетки и следить за своим здоровьем. Нельзя курить, чего я никогда не делал, нельзя употреблять алкоголь, о чем не жалею. И это лучше, чем быть прикованным к аппарату искусственной почки.
Осложнения трансплантации почки — это расстройства, этиологически связанные с пересадкой нефротрансплантата. В раннем периоде проявляются гипертермией, олигоанурией, артериальной гипертензией, болью в области трансплантата. Поздние осложнения длительно протекают бессимптомно, в последующем превалируют признаки почечной недостаточности и нарушений в работе других органов. Патология диагностируется с помощью исследований крови и мочи, УЗИ, УЗДГ, МРТ почек, пункционной биопсии. Для лечения применяют иммуносупрессоры, антибиотики, антиагреганты, антикоагулянты, проводят хирургическую ревизию раны, оперативные вмешательства на мочеточниках, нефротрансплантатэктомию.
МКБ-10
Общие сведения
Выживаемость пациентов, перенесших трансплантацию почки, на протяжении первого послеоперационного года достигает 94-98%, однако развитие осложнений существенно влияет на функциональность пересаженного органа и качество жизни реципиентов. В раннем и позднем посттрансплантационном периоде могут возникать как урологические заболевания, так и повреждения других органов, способные спровоцировать гибель пациента.
По результатам наблюдений, 33,2% смертей после трансплантации почек вызваны кардиальными причинами, из них 11,3% — острым инфарктом миокарда, 17,8% — инфекционными заболеваниями, 11,9% — опухолевым процессом, 6,9% — нарушением мозгового кровообращения, 30,3% — другими факторами. В течение первых 12 месяцев после вмешательства отторгается от 6 до 12% нефротрансплантатов, что требует возобновления заместительной почечной терапии и проведения повторной пересадки. До 36% реципиентов переносят инфекционные заболевания мочевыделительных органов и оппортунистические инфекции.

Причины
Несмотря на накопленный опыт и внедрение эффективных стандартов проведения операции, техническая сложность ее выполнения и использование аллотрансплантата повышают риск осложненного течения послеоперационного периода. Специалисты в сфере современной урологии, нефрологии и трансплантологии выделяют следующие группы причин, провоцирующих возникновение осложнений после нефротрансплантации:
- Возраст и состояние здоровья реципиента. Кроме абсолютных противопоказаний, при которых проведение трансплантации в большинстве случаев завершается неблагоприятным исходом, существуют относительные, существенно повышающие вероятность осложнений. В группу риска входят пациенты старше 65-70 лет, а также страдающие рядом сопутствующих заболеваний — активным гепатитом, циррозом печени, СКВ, васкулитом, гемолитико-уремическим синдромом, системными заболеваниями в активной фазе, сахарным диабетом, острыми инфекционными процессами, ХСН IIБ ст.
- Особенности трансплантируемой почки. Осложнения чаще возникают при AB0 и HLA-несовместимости тканей, пресенсибилизации реципиента. Приживление органа ухудшается при длительной (более 24 ч) холодовой ишемии почки, по результатам некоторых наблюдений этот фактор оказывается более значимым, чем гистосовместимость. Функциональность трупной почки зависит от причин смерти донора, электролитных нарушений, степени и длительности гипотонии, других особенностей агонального периода. На течение посттрансплантационного периода также влияет техника забора органа.
- Медицинские факторы. Исход трансплантации зависит от полноты предоперационного обследования реципиента и прижизненного донора, правильности оценки выявленных противопоказаний, проведения предтрансплантационной подготовки при обнаружении гистологической несовместимости тканей. На качество приживления почки оказывают влияние техническая точность пересадки, соблюдение требований асептики и антисептики, профилактика ишемического повреждения органа, качество наблюдения за пациентом, выбор оптимального режима иммуносупрессии (ИСТ).
- Иммунодефицит. Ряд постнефротрансплантационных осложнений связан с медикаментозным угнетением иммунитета реципиента. Назначение иммуносупрессивных препаратов — важное условие профилактики отторжения трансплантата. Однако на фоне иммунодефицита повышается вероятность возникновения ранних и отдаленных инфекционных заболеваний. Кроме того, иммуносупрессия является фактором риска онкогенеза. У части пациентов нарушения гуморального и клеточного иммунитета стимулируют возникновение аллергических и аутоиммунных реакций.
Патогенез
Механизм развития осложнений трансплантации почек зависит от этиологических факторов, спровоцировавших патологическое состояние. Зачастую в основе расстройства лежит иммунное или инфекционное воспаление. В первом случае наблюдается отторжение нефротрансплантата вследствие Т-клеточного ответа или гуморальной реакции типа антиген-антитело. При попадании в рану инфекционных агентов воспалительная деструкция тканей происходит под действием бактериальных эндо- и экзотоксинов.
Ситуация часто усугубляется ишемическими нарушениями, возникшими на фоне расстройств микроциркуляции, артериальной окклюзии, венозного тромбоза. Отдельную роль в патогенезе постнефротрансплантационных осложнений играет иммуносупрессия, снижающая или извращающая нормальную защитную реакцию организма на действие повреждающих факторов. В отдаленные сроки преобладают процессы склерозирования почечной паренхимы.
Классификация
Систематизация вариантов осложнений после трансплантации почки создана с учетом времени возникновения, причин, механизма развития и клинической симптоматики расстройства. Такой подход соответствует принципам своевременной диагностики и адекватной этиопатогенетической терапии постнефротрансплантационных нарушений. Осложнения при нефротрансплантации могут быть ранними, возникшими остро в ходе операции или в первые месяцы после пересадки, и поздними, с постепенным нарастанием симптомов. Различают следующие формы патологии:
- Отторжение почечного трансплантата. Применение современной иммуносупрессивной терапии позволило увеличить выживаемость пересаженной почки в течение года после вмешательства до 88-94% с последующим ухудшением показателя на 3-8% в год. Большинство случаев отторжения наблюдается в первые 3-4 посттрансплантационных месяца, связано с реакциями клеточного и гуморального иммунитета.
- Хирургические осложнения. Возникают в процессе трансплантации или раннем послеоперационном периоде. Обычно обусловлены нарушением техники операции, норм асептики, антисептики. Проявляются кровотечениями разной интенсивности вплоть до геморрагического шока, стенозом почечных артерий, тромбозом сосудов пересаженной почки, развитием раневой инфекции, образованием лимфоцеле.
- Урологические осложнения. Наибольшему риску поражения подвержен мочеточник. При его повреждении из-за несоблюдения техники трансплантации возможно развитие полного некроза, обтурации уретерального просвета, обструкции извне швом или лигатурой, точечного некроза с формированием уриномы. В части случаев наблюдается несостоятельность созданного неоуретероцистоанастомоза.
- Сопутствующее поражение других органов. Пересадка почки и назначение иммуносупрессорной терапии могут провоцировать активацию бактериальных, вирусных и грибковых инфекций, желудочно-кишечные кровотечения, нарушения кальциевого обмена, вторичный сахарный диабет, усиление атеросклеротических процессов. У реципиентов возрастает риск образования злокачественных неоплазий.
Симптомы
Ранние острые нарушения обычно отличаются бурной клинической картиной. Вскоре после трансплантации у пациента возникает ярко выраженный интоксикационный синдром с высокой температурой, ознобом, суставными и мышечными болями, тошнотой, рвотой, кожным зудом, резкой слабостью. При внутреннем кровотечении наблюдается головокружение, бледность кожных покровов, возможна потеря сознания.
У большинства реципиентов о появлении осложнений свидетельствует значительное уменьшение мочеотделения вплоть до его полного прекращения в сочетании с высоким артериальным давлением. В области трансплантированной почки может пальпироваться болезненное уплотнение. Распространенным признаком инфекционного воспаления является наличие обильного раневого отделяемого. При вовлечении в воспалительный процесс брюшины и развитии перитонита возникает резкая боль в брюшной полости, живот становится напряженным, доскообразным, отмечается учащение пульса, резкое падение АД, часто отсутствует стул.
Проявлением поздних осложнений обычно становится прогрессирующее снижение фильтрационной способности почек. Клиническая симптоматика длительное время отсутствует. В последующем пациент начинает предъявлять жалобы на быструю утомляемость, снижение работоспособности. Уменьшается суточный диурез. Утром на лице преимущественно в области век появляются отеки, которые по мере развития почечной недостаточности сохраняются в течение дня и распространяются на другие части тела. Часто повышается артериальное давление.
Возникают и нарастают симптомы уремии — заторможенность, апатичность, бледность и сероватый оттенок кожи, интенсивный кожный зуд, жажда, нарушения сна, низкая температура тела, отсутствие аппетита, тошнота, рвота, диарея. При сочетанном поражении других органов и систем отмечается соответствующая симптоматика. Из-за угнетения иммунитета реципиенты часто болеют ОРВИ, у них развиваются тяжелые длительные бронхиты, пневмонии. Возможны различные формы пиодермий.
Нарушение всасывания кальция приводит к остеопорозу, гиперплазии паращитовидных желез. Из-за недостаточного синтеза эритропоэтинов часто формируется анемия. У пациентов, длительно принимающих иммуносупрессоры, могут диагностироваться онкологические заболевания. При этом преобладают новообразования предположительно вирусного происхождения — плоскоклеточная (сквамозная) и базальноклеточная карциномы, лимфопролиферативная болезнь (преимущественно В-клеточная неходжкинская лимфома), аногенитальные неоплазии, в том числе рак шейки матки, саркома Капоши.
Диагностика
Диагностический поиск при подозрении на осложнение трансплантации почки направлен на уточнение характера расстройства, оценку жизнеспособности и функциональной состоятельности почечного трансплантата, выявление критических органных и метаболических нарушений, угрожающих жизни реципиента. Наиболее информативными методами обследования являются:
- Общий анализ крови. Вероятное развитие острых осложнений подтверждается значительным повышением уровня лейкоцитов, падением содержания тромбоцитов, ускорением СОЭ. В отдаленном периоде часто наблюдается снижение концентрации эритроцитов, гемоглобина, на фоне иммуносупрессии возможно возникновение лейкопении.
- УЗИ почечного трансплантата. Эхография почки является безопасным скрининговым методом, позволяющим выявить изменение размеров пересаженного органа, деструкцию паренхимы, наличие патологических изменений в паранефральном пространстве. Исследование дополняют УЗДГ почечных сосудов для комплексной оценки состояния кровотока.
- Биохимический анализ крови. О нарушении фильтрационной функции клубочков свидетельствует нарастание уровней креатинина, остаточного азота, мочевины, калия. Поражение гломерулярного аппарата подтверждается данными пробы Реберга, нефрологического комплекса. Характерен высокий уровень ЛДГ, С-реактивного белка.
В зависимости от типа осложнения в общем анализе мочи может обнаруживаться повышение или снижение удельной плотности, наличие эритроцитов, лейкоцитов, цилиндров, бактерий. Для исключения отторжения нефротрансплантата рекомендовано проведение расширенного комплексного иммунологического исследования, пункционной биопсии с последующим гистологическим анализом полученного материала. Исследования с введением рентгеновского контраста (экскреторная урография, КТ, МСКТ почек) производятся с осторожностью из-за возможного усугубления клинической ситуации за счет развития контраст-индуцированной нефропатии.
В качестве дополнительных методов может назначаться МРТ для выявления возможных структурных нарушений в тканях трансплантата и нефросцинтиграфия, позволяющая уточнить функциональность пересаженной почки. Для мониторинга состояния пациента в раннем посттрансплантационном периоде оценивают волемический статус (гемогидробаланс, уровень ЦВД), электролитное состояние (уровни калия, натрия, кислотно-щелочного равновесия), коагулограмму, обеспечивают контроль диуреза, суточное мониторирование АД, регулярно выполняют ЭКГ.
Дифференциальную диагностику обычно проводят между различными видами осложнений. При поздних урологических последствиях трансплантации исключают развитие возвратного гломерулонефрита, рецидивирующей волчаночной нефропатии, пиелонефрита, гидронефроза. По назначению врача-нефролога или уролога пациента консультирует трансплантолог, анестезиолог-реаниматолог, абдоминальный хирург, инфекционист, ревматолог, иммунолог, онколог.
Лечение осложнений трансплантации почки
Основными врачебными задачами являются скорейшая коррекция возникших расстройств и поддержание основных жизненных функций реципиента. При отсутствии острых хирургических осложнений лечение обычно представлено комплексной медикаментозной терапией. С учетом выявленных нарушений пациентам, перенесшим трансплантацию почки, назначаются:
- Коррекция иммуносупрессорной терапии. Применение пульс-методов, изменение дозировки ингибиторов кальциневрина, антиметаболитов, глюкокортикоидов, ингибиторов интерлейкинов, биологических антилимфоцитарных агентов, замена одних препаратов другими зачастую позволяет купировать эпизод отторжения. Коррекция назначений также может потребоваться при связи осложнений с принимаемыми иммунодепрессантами.
- Лечение ишемии пересаженной почки. При возникновении сосудистых и тромботических нарушений используются дезагреганты, антикоагулянты, антигипоксанты, цитопротекторы, синтетические простагландины. С их помощью удается эффективно улучшить почечный кровоток, микроциркуляцию, перфузию тканей. Для увеличения кислородной емкости крови может назначаться гипербарическая оксигенация.
- Антибактериальные препараты. Показанием к проведению активной антибиотикотерапии служит наличие инфекционно-воспалительных осложнений. Предпочтительны противобактериальные средства с минимальным риском нефротоксического эффекта — хинолоны, комбинации диаминопиримидинов с синтетическими сульфаниламидами. При лечении оппортунистических инфекций учитывается чувствительность микроорганизмов.
Инфузионная терапия под контролем диуреза проводится при возникновении острых, угрожающих жизни состояний, метаболических расстройств. С учетом клинической картины реципиенту почки могут вливаться коллоидные и кристаллоидные растворы, отдельные электролиты, цельная кровь и ее компоненты. При нарастании признаков почечной недостаточности возобновляется заместительная терапия (гемодиализ, перитонеальный диализ, гемофильтрация, гемодиафильтрация). Лечение заболеваний, спровоцированных трансплантацией почки, осуществляется согласно протоколам для соответствующей патологии.
Оперативные методы лечения требуются при выявлении хирургических осложнений, деструкции мочеточника или почечного трансплантата. Объем вмешательств зависит от особенностей осложнения. Может выполняться ревизия и дренирование раны, ушивание поврежденных сосудов, лапароскопическая марсупиализация лимфоцеле. При повреждении мочеточника возможно проведение эндоскопического рассечения уретероцеле, уретеропластики, уретерокутанеостомии, наложение неоуретероцистоанастомоза. Необратимая деструкция трансплантированной почки служит показанием для нефротрансплантатэктомии с последующим назначением ЗПТ и возможной повторной пересадкой органа.
Прогноз и профилактика
Возникновение осложнений ощутимо ухудшает показатели выживаемости пациентов, однако своевременное выявление и грамотная коррекция расстройств делают прогноз более благоприятным. Профилактика возможных осложнений начинается с комплексного обследования больного перед операцией для определения всех абсолютных и относительных противопоказаний, оценки гистосовместимости с донором. При предстоящей AB0-несовместимой трансплантации требуется проведение предоперационной десенсибилизации. По показаниям на предтрансплантационном этапе может назначаться превентивная антибиотикотерапия.
С учетом вероятной компрометации заживления раны на фоне иммуносупрессивной терапии важна прецизионная хирургическая техника, повышенное внимание к деталям, строгое соблюдение правил асептики, тщательный гемостаз. После трансплантации ключевую роль играет правильный выбор индукционной и поддерживающей ИСТ, послеоперационный мониторинг состояния реципиента.
Читайте также:


