Pnet опухоль мягких тканей лечение
Опухоли костей и мягких тканей группы PNET/саркомы Юинга, основные критерии морфологической и дифференциальной диагностики
Буланов Дмитрий Владимирович,
соискатель, врач-патологоанатом Московской городской онкологической больницы №62.
Цель и задачи работы
На основе анализа литературных данных, примерах собственных клинических наблюдений представить морфологическую, иммуногистохимическую характеристику, критерии дифференциальной диагностики примитивных нейроэктодермальных опухолей.
Материалы и методы
Использовали первичные антитела к CD 99 (“ Dako ”), CD 45 (“ Dako ”), CD 20 (“ Dako ”), EMA (“ Dako ”), pan - CK (“ Dako ”), Vimentin (“ Dako ”), Desmin (“ Dako ”), Myogenin (“ Dako ”), Ki -67 (“ Dako ”), p 53 (“ Dako ”). В качестве вторичных антител использовали биотинилированные антитела к иммуноглобулинам мыши и кролика ( EnVision , “ Dako ”).
В 14 случаях проведено молекулярно-генетическое, и цитогенетическое исследование материла с использованием FISH и PCR -реакции ( Institut Ortopedii Rizzoli , Bologna , Italy , Department of Pathology , Prof A . Llombart - Bosh ), морфометрический анализ иммуногистохимических маркеров клеточной пролиферации.
Проведено клинико-морфологическое сопоставление с учётом данных морфологического, иммуногистохимического и молекулярно-генетического анализа материалов. Первоначальный диагноз саркомы Юинга/ PNET в группе пациентов (14 наблюдений), в которой было проведен молекулярно-генетический анализ образцов ткани опухоли был изменен: в 8 случаях был диагностирован классический вариант саркомы Юинга, 1 - крупноклеточный вариант саркомы Юинга, 1 – атипичный вариант саркомы Юинга, 1 – саркома Юинга с эндотелиальным типом дифференцировки, в 2 случаях подтвержден диагноз PNET , в 1 случае – диффузная крупноклеточная В-клеточная лимфома . Иммуногистохимически во всех случаях саркомы Юинга/ PNET обнаружена положительная реакция от умеренной до резко выраженной с CD 99. В большинстве случаев положительная реакция с CD 99 характеризовалась ярким мембранным окрашиванием опухолевых клеток. Маркеров мышечной дифференцировки во всех случаях саркомы Юинга/ PNET не выявлено. Реакция с десмином и миогенином была отрицательна. Эпителиальный мембранный антиген ( EMA ) и цитокератины ( CK ) экспрессировались лишь в 15% случаев, реакция характеризовалась слабым мембранным и dot - like окрашиванием клеток. Ядерная экспрессия мутантного белка гена p -53 была обнаружена в 70% случаев, индекс пролиферативной активности опухолевых клеток с маркером Ki -67 варьировал от 2 до 45,8% (положительное ядерное окрашивание опухолевых клеток). В случае с диффузной крупноклеточной В-клеточной лимфомой установлен характерный иммунофенотип опухолевых клеток CD 45+, CD 20+. В результате молекулярно-генетического и цитогенетического исследования во всех случаях саркомы Юинга/ PNET обнаружена транслокация EWN локуса 22 q 12, гомозиготная делеция гена p 16 была обнаружена в 1 случае эндотелиального типа саркомы Юинга.
Диагностика мелкокруглоклеточных опухолей костей и мягких тканей в ряде случаев представляет определенные трудности и требует тщательного методологического подхода в постановке морфологического диагноза. Проведенное исследование позволило охарактеризовать гетерогенную группу мелкокруглоклеточных опухолей, определить “маркерные” дифференциальные признаки. Использование широкой дифференциально-диагностической панели антител позволяет своевременно поставить правильный диагноз, выделить варианты обширного семейства мелкокруглоклеточных опухолей, что позволяет накапливать материал для проведения дальнейших клинико-морфологических сопоставлений.
1. Веснин А.Г., Семенов И.И. Атлас лучевой диагностики опухолей опорно-двигательного аппарата: Часть 1: Опухоли скелета. – СПб .: Невский диалект, 2003.
2. Галахін К., Лломбарт-Бош А., Мельник М. и др. Диференційна імуногістохімічна діагностика злоякісних пухлин сімейства Ю їнга // Онкология. - 2001. - Т. 3, № 2 -3. - С.146-150.
3. Гальперин Э.Е., Констайн Л.Д., Тарабел Н.Д Лучевая терапия в детской онкологии. - М., 1999. - 539 c .
4. Герштейн Е.С., Кушлинский Н.Е. Тканевые маркеры как факторы прогноза при раке молочной железы // Практическая онкология. - 2002. - № 1.- С 38-44.
5. Головин Д.И. Ошибки и трудности гистологической диагностики опухолей: Руководство для врачей. – Л.: Медицина, 1982. – 304 с .
6. Дурнов Л.А., Голдлбенко Г.В., Курмашов В.И. Детская онкология. - М.,1997. – 305 с.
7. Кешта Расми Ахмад Молекулярно-биологические маркеры как факторы прогноза при саркоме мягких тканей: Автореф. дисс. … канд. мед . н аук. - М.,2002. - 29 с.
8. Киселев Л.П. Молекулярная диагностика и интенсификация химиотерапии прогностически неблагоприятных форм саркомы Юинга у детей: Автореф. дисс. … канд. мед . н аук. - Минск, 2007. - 21 с .
9. Bacci G., Balladelli A., Forni C. et al. Ewing's sarcoma family tumours: Differences in clinicopathological characteristics at presentation between localised and metastatic tumours // J. Bone Joint. Surg. Br . – 2007. – Vol.89, № 9. – P.1229-1233.
10. Barnoud R., Delattre O., Peoc’h M. et al. Desmoplastic small round cell tumor: RT-PCR analysis and immunohistochemical detection of the Wilm’s tumor gene WT1 // Pathol. Res. Pract. – 1998. – Vol. 194. – P.693-700.
11. Bridge R.S., Rajaram V., Dehner L.P. et al. Molecular diagnosis of Ewing sarcoma .primitive neuroectodermal tumor in routinely processed tissue: a comparison of two FISH strategies and RT-PCR in malignant round cell tumors // Mol. Pathol. – 2006. – Vol.19. – P.1-8.
12. Brooks J.S. Immunohistochemistry in the differential diagnosis of soft tissue tumors // Monogr. Pathol. – 1996. – Vol.38. – P.65-128.
13. Brown A.P., Fixsen J.A., Plowman P.N. et al. Local control of Ewing`s sarcoms: analysis of 67 patients // Br. J. Radiol. – 1987. – Vol.60. – P.261-268.
14. Cavazzana A.O., Magnani J.L., Ross R.A. et al. Ewing ’s sarcoma is an undifferentiated neuroectodermal tumor // Prog. Clin. Biol. Res. – 1988. – Vol.271. – P.487-498.
15. Chan J.K. Advances in immunohistochemistry: impact on surgical pathology practice // Semin. Diagn. Pathol. - 2000. – Vol. 17. – P.170-177.
16. Со ffin С h.M., Dehner L.P., O'Shea P.A. Pediatric soft tissue tumors. А clinical, pathological and therapeutic approaches. - Baltimore : Williams а Williams, 1997. - 412 р .
17. Cotterill S.J., Ahrens S., Paulusse M. et al. Prognostic factors in Ewing tumor of bone: analysis of 975 patients from the European intergroup cooperative Ewing sarcoma study group // J. Clin. Oncol. – 2000. – Vol.18 .- P.3108-3114.
18. Craft A., Cotterill S., Malcolm A. et al. Ifosfamide-containing chemotherapy in Ewing sarcoma: the second United Kingdom children’s cancer study group and the medical research council Ewing tumor study // J. Clin. Oncol. - 1998. – Vol.16. – P.3628–3633.
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Саркомы – это группа различных по клиническим и морфологическим признакам злокачественных новообразований, которые происходят из любых неэпителиальных тканей. В этом заключено основное отличие саркомы от рака, ростком которого являются эпителиальные клетки.
Риск возникновения данного заболевания повышается при некоторых генетических патологиях:
- синдром базальноклеточных невусов;
- синдром Вернера;
- синдром Гарднера;
- туберозный склероз;
- кишечный полипоз т.д.
А болезнь Реклингхаузена, или нейрофиброматоз 1 типа, является наиболее распространенным наследственным заболеванием, которое осложняется опухолевыми процессами. При этой патологии нейрофибросаркомы возникают примерно в 15% случаев. Описаны также случаи возникновения саркомы в зоне воздействия ионизированного излучения, как патологического, так и с лечебными целями.
Гистоморфологическая классификация сарком
Зачастую точно определить, из какой именно ткани возникла конкретная опухоль, довольно сложно. Кроме того, выделяется большая группа опухолей, которые имеют неясный гистогенез.
Наиболее часто диагностируются фибросаркомы, липосаркомы и рабдомиосаркомы. Вторыми по частоте встречаемости следует злокачественная гистиоцитарная саркома мягких тканей и саркомы неясного генеза. Ангиосаркомы, синовиальные саркомы, злокачественные шванномы, лейомиосаркомы и прочие типы наблюдаются редко.
Опухоли жировых тканей
Промежуточные (местно-агрессивные) формы:
- атипичный липоматоз;
- высокодифференцированные липосаркомы.
Злокачественные формы:
- недифференцированные липосаркомы;
- миксоидные липосаркомы;
- круглоклеточные липосаркомы;
- полиморфная липосаркома;
- липосаркомы смешанного типа;
- липосаркомы без признаков дифференцировки.
Миофибропластические и фибробластические опухоли
Промежуточные, или местно-агрессивные, формы:
- поверхностные подошвенные или ладонные фиброматозы;
- фиброматозы десмоидного типа;
- липофиброматозы.
Редко метастазирующие формы:
- солитарные фиброзные опухоли;
- гемангиоперицитомы, включая липоматозные гемангиоперицитомы;
- воспалительные миофибропластические опухоли;
- миофибропластические саркомы низкой степени дифференцировки;
- миксоидные фибропластические саркомы;
- инфантильные фибросаркомы.
Злокачественные формы:
- зрелые фибросаркомы;
- миксофибросаркомы;
- медленнорастущие фибромиксоидные саркомы;
- гиалинизирующие веретеноклеточные саркомы;
- склерозирующие эпителиоидные фибросаркомы.
Фиброгистиоцитарные опухоли
Промежуточные, или местно-агрессивные формы:
- плеоморфные фиброгистиоцитарные опухоли;
- гигантоклеточные саркомы мягких тканей.
Злокачественные формы:
- недифференцированные плеоморфные саркомы;
- недифференцированные плеоморфные саркомы с гигантскими клетками;
- недифференцированные плеоморфные саркомы с преобладанием воспаления.
Саркома мышечной ткани
Опухоли скелетных мышц:
- эмбриональные веретеноклеточные и анапластические рабдомиосаркомы;
- альвеолярные солидные и анапластические рабдомиосаркомы;
- плеоморфные рабдомиосаркомы.
Саркома гладких мышц: лейомиосаркома, включая и кожные формы.
Периваскулярные опухоли
- Злокачественные гломусные опухоли;
- миоперицитомы.
Сосудистые опухоли
Промежуточные, или местно-агрессивные формы: гемангиоэндотелиомы типа Капоши.
Редко метастазирующие формы:
- ретиформные гемангиоэндотелиомы;
- папиллярные внутрилимфатические ангиоэндотелиомы;
- смешанные гемангиоэндотелиомы;
- саркомы Капоши.
Злокачественные формы:
- эпителиоидные гемангиоэндотелиомы;
- гемангиосаркома мягких тканей.
Костно-хрящевые опухоли
Опухоль костной ткани, или остеогенная саркома:
- обыкновенные: хондробластические, фибробластические, остеобластические;
- телеангиоэктатические;
- мелкоклеточные;
- центральные, имеющие низкую злокачественность;
- вторичные;
- параоссальные;
- периоссальные;
- поверхностные, имеющие высокую злокачественность.
Опухоли хрящевой ткани (хондросаркомы):
- центральные, первичные и вторичные;
- периферические;
- дедифференцированные;
- мезенхимальные;
- светлоклеточные.
Опухоли неясного происхождения
Редко метастазирующие формы:
- ангиоматоидные фиброзные гистиоцитомы;
- оссифицирующие фибромиксоидные опухоли;
- миоэпителиомы;
- парахондромы.
Злокачественные формы:
- синовиальная саркома;
- эпителиоидные саркомы;
- альвеолярная мягкотканная саркома;
- светлоклеточная саркома мягких тканей;
- внескелетные миксоидные хондросаркомы хордоидного типа;
- примитивные нейроэктодермальные опухоли (PNET);
- внескелетные саркомы Юинга;
- десмопластические мелко- и круглоклеточные опухоли;
- внепочечные рабдоидные опухоли;
- злокачественные мезенхимомы;
- миелоидная саркома;
- новообразования, имеющие периваскулярную эпителиоидно-клеточную дифференцировку (PEComa);
- светлоклеточные миомеланоцитарные опухоли;
- интимальные саркомы.
Каждый из названных гистологических типов отличается не только своими морфологическими признаками и гистогенезом, но также имеет определенное клиническое течение. Конечно, подобное многообразие морфологических форм сарком вызывает значительную трудность в их диагностике.
Еще больше гистологическое типирование сарком осложняется в детском возрасте. Обусловлено это тем, что у детей большая часть опухолей происходит из примитивных эмбриональных клеток (эмбриональная саркома) или клеток, которые еще не завершили свое гистогенетическое становление. Такие опухоли, имея большое разнообразие морфологических форм, зачастую не имеют четких признаков гистотиповой дифференцировки, характеризуются резкой анаплазией и вариабельностью клеточного состава. Вместе с тем часто наблюдается и обратная картина: новообразования различного происхождения часто имеют сходные признаки строения. Все это делает типирование опухолей значимой проблемой.
Распределение основных типов сарком по преобладанию в их составе
клеток определенной формы
Рутинная оценка сарком начинается с оценки общего строения опухоли, которая базируется, прежде всего, на ее "узнаваемости" при микроскопии. Описывается общая картина преобладания клеток определенной формы.
Опухоли, состоящие из округлых клеток:
- нейробластома;
- саркома Юинга/PNET;
- мезенхимальная хондросаркома;
- эмбриональная и альвеолярная рабдомиосаркома;
- десмопластичная круглоклеточная саркома;
- круглоклеточная липосаркома;
- малигнизированная рабдоидная опухоль.
Опухоли, состоящие из веретенообразных клеток:
- фибросаркома;
- веретеноклеточная рабдомиосаркома;
- лейомиосаркома;
- злокачественные опухоли периферических нервных стволов;
- веретеноклеточная ангиосаркома;
- монофазная веретеноклеточная синовиальная саркома.
Опухоли, состоящие из эпителиоидных клеток:
- эпителиоидноклеточная синовиальная саркома;
- эпителиоидноклеточная ангиосаркома;
- эпителиоидноклеточные злокачественные опухоли нервного ствола;
- склерозирующая эпителиоидноклеточная фибросаркома;
- злокачественная фиброзная гистиоцитома;
- эпителиоидноклеточная лейомиосаркома.
Остальные гистоморфологические типы сарком, входящие в классификацию, имеют преимущественно смешанную форму клеток. Кроме того, иногда форма злокачественно перерожденных клеток не поддается описанию и определению. В таких случаях опухоль классифицируется как плеоморфная саркома.
Типирование сарком по степени дифференцировки клеток
После определения гистологического типа саркомы оценивается степень ее дифференцировки (G). При этом учитываются такие критерии, как клеточный полиморфизм, митотическая активность и др.
Степени дифференцировки сарком:
- GX – степень дифференцировки клеток определить невозможно;
- G1 – саркома высокодифференцирована;
- G2 – саркома дифференцирована умеренно;
- G3 – саркома низкодифференцирована;
- G4 – недифференцированая саркома.
Дифференциация клеток определяется возможностью установить, к какому именно виду ткани относится конкретная клетка. Чем ниже степень дифференциации клеток, составляющих опухоль, тем более выраженную злокачественность имеет данная саркома. Это напрямую связано с шансами раннего метастазирования в другие органы и ткани. Кроме этого, чем выше злокачественность саркомы, тем быстрее она увеличивается в размерах, тем большую инфильтративность имеет ее рост и тем стремительнее прогрессирует заболевание.
Иммуногистохимическое (ИГХ) типирование сарком
Иммуногистохимическое исследование позволяет:
- провести гистогенетическое типирование опухоли и определить нозологический вариант новообразования;
- определить органопринадлежность первичной опухоли при метастазах неизвестного происхождения;
- определить степень злокачественной трансформации клеток опухоли;
- прогнозировать течение опухолевого заболевания;
- прогнозировать чувствительность и резистентность опухолевых клеток к химиотерапевтическим препаратам и лучевой терапии;
- определить возможность проведения узконаправленной терапии.
Сегодня при верификации сарком используется несколько десятков основных ИГХ-маркеров. Поскольку практически нет ИГХ-маркеров, которые были бы специфичными только для какого-то конкретного типа опухоли, для типирования новообразования должен использоваться набор из нескольких антител.
1. В группу опухолей, состоящих из мелких округлых клеток, относятся новообразования, наиболее часто встречающихся в детском возрасте. Они обычно имеют низкую дифференцировку и высокую степень злокачественности.
- Бластная нейрогенная саркома. Все ее разновидности экспрессируют нейрональные маркеры, такие как нейронспецифическая энолаза (NSE), синаптофизин, хромогранины (CgA), СD56, СD57.
- Рабдомиосаркома. Все ее виды экспрессируют виментин, десмин и мышечный специфический актин (MA), а также СD99. Основными же ее специфическими маркерами является миогенные ядерные регуляторные протеины – миогенин и МуоD1.
- Основными диагностическими маркерами для саркомы Юинга и примитивной нейроэктодермальной опухоли являются СD99 (продукт гена MIC2) и Fli-1. Также клетки этих опухолей экспрессируют виментин, сравнительно часто - синаптофизин, в редких случаях - цитокератины (CK), CD57.
- Клетки мезенхимальной хондросаркомы экспрессируют виментин, S-100 протеин и, реже, СD57.
- Мелкоклеточная остеосаркома характеризуется экспрессией виментина, остеокальцина, может наблюдаться экспрессия СD57 и СD99.
- Мелкоклеточная низкодиференцированная синовиальная саркома мягких тканей, как и другие типы синовиальных сарком (монофазная веретеноклеточная синовиальная саркома, эпителиоидная синовиальная саркома, дедиференцированная полиморфноклеточная саркома), экспрессируют CK, эпителиальный мембранный антиген (EMA), виментин, коллаген IV типа.
- Десмопластическая мелкокруглоклеточная опухоль - очень редкий вид чрезвычайно агрессивного новообразования. Обычно клетки этой опухоли экспрессируют эпителиальные (СК и ЕМА), мезенхимальные (виментин), миогенные (десмин) и нейральные (СD56, NSE) маркеры.
2. К опухолям, состоящим из веретенообразных клеток, прежде всего относятся новообразования, развивающиеся из производных мезенхимы.
- Фибросаркома и инфантильная фибросаркома не имеют специфического иммунопрофиля, но всегда положительны к виментину, а иногда – и к SMA.
- Клетки лейомиосаркомы, как правило, экспрессируют виментин, десмин, МА, SMA, кальдесмон.
- Злокачественная опухоль оболочки периферического нервного ствола экспрессирует виментин, коллаген IV типа и СD57.
- Сосудистая эпителиоидно- и веретеноклеточная саркома, а также саркома Капоши экспрессируют Fli-1, CD31, CD34 и фактор фон Виллебранта (фактор VIII связывающий протеин).
- Гемангиоперицитома и солитарная фиброзная мягкотканая саркома относятся к новообразованиям, пограничным по своему потенциалу злокачественности. Их клетки обычно экспрессируют CD34, CD99, а также bcl-2.
3. Опухоли, состоящие из эпителиоидных клеток, характеризуются признаками, присущими специализированным клеточным элементам соединительной ткани (миофибробластам, эпителиоидным клеткам сосудов, миоэпителиальным клеткам).
- Злокачественная воспалительная миофибробластическая опухоль (воспалительная фибросаркома) демонстрирует иммунореактивность с кальпонином, SMA и десмином.
- Злокачественная фиброзная гистиоцитарная саркома характеризуется коэкспрессией виментина, EMA и CD68, в некоторых случаях наблюдается экспрессия MA, однако не экспрессируются миогенин и МиоD1.
- Периваскулярные эпителиоидноклеточные опухоли (PEC-омы) – это группа опухолей, к которым относятся: ангиомиолипома почек (и других локализаций), светлоклеточная саркома легких ("сахарная" опухоль), лимфангиолейомиоматоз и др. Клетки этих опухолей демонстрируют меланоцитарный иммунофенотип (положительны к: Мелан-А, НМВ45, тирозиназе) с коэкспрессией SMA.
- Эпителиоидная саркома коэкспрессирует виментин и СК.
Помимо гистогенетического типирования опухолей, принципиально важной задачей ИГХ является определение степени злокачественности опухоли и выявление прогностических маркеров. Это позволяет намного более обоснованно и достоверно прогнозировать течение болезни, а также чувствительность опухоли к лечебным средствам.
Незрелая периферическая нейроэктодермальная опухоль ( Аскина )
А.Н.Махсон , М.С.Попов, И.В.Кузьмин, М.С.Бурлаков, К.К.Пугачев, М.И.Попов
(Московская городская онкологическая больница № 62)
Незрелая * периферическая нейроэктодермальная опухоль (НПНО) - недифференцированная высоко злокачественная саркома, развивающаяся скорее всего из мигрирующих эмбриональных клеток неврального гребешка ( peripheral primitive neuroectodermal tumor - PNET ). Описана в различных органах и системах под разными названиями. Синонимы: мелкоклеточная недифференцированная опухоль грудной стенки, злокачественная мелкоклеточная торакопульмональная опухоль, примитивная нейроэктодермальная опухоль, эктомезенхимома , эпендимобластома , “ нейробластома ”, нейроэпителиома .
Терминология . Злокачественные нейроэпидермальные опухоли – это целая группа новообразований из мелких круглых клеток, включающая нейробластому , рабдомиосаркому , лимфомы и саркому Юинга . Эти опухоли развиваются из нейроэктодермы головного и спинного мозга, автономной нервной системы и частично из нейроэндокринных образований. Соответственно различают центральные и периферические злокачественные нейроэпидермальные опухоли ( cPNET и pPNET ). По определению НПНО никогда не возникают из симпатической нервной системы и локализуются вне позвоночника ( Dehner L . P .,1986 и 1993; Coffin C . M ., 1989; Schmidt D et al ., 1991).
Наиболее часто первичный очаг локализуется в костях и мягких тканях грудной клетки, в брюшной полости, в тазу и нижних конечностях, однако описаны и изолированные поражения легкого, и других органов. Встречается в основном у больных 3-38 лет в основном у подростков и молодых людей, преимущественно у лиц женского пола. Некоторые авторы отмечают преимущественное правостороннее расположение опухоли. Описаны НПНО, возникшие из периферических нервов. Подобное наблюдение, по-видимому первым описал A . P . Stout еще в 1918 г. Злокачественную “ мелкокруглоклеточную ” опухоль торакопульмональной зоны как особую клинико-морфологическую нозологическую форму впервые выделил в 1979 г. крупный современный американский морфолог F . B . Askin . Он считал, что опухоль может исходить только из грудной стенки. В отличие от других форм НПНО она чаще встречалась у девочек и вызывала системные симптомы: лихорадку, потерю аппетита и массы тела, кашель, одышку. В настоящее время в основном пользуются термином “НПНО грудной стенки”. Другими словами, “опухоль Аскина ” – это атипичная форма саркомы Юинга с невральными признаками дифференцировки. Иммуногистохимически обычно удается доказать нейроэктодермальную принадлежность опухоли, а цитогенетически – связь с саркомой Юинга (см табл № 1).
Клинически НПНО проявляется быстро растущей болезненной опухолью с локальным инфильтрирующим ростом. Довольно долго считали, что незрелая опухоль малочувствительна к химиотерапии и облучению. Иногда первичный очаг проявляется множественными узлами, поражающими плевру.
До 1999 г. описано около 280 наблюдений НПНО ( Inada K . et al .1994, Shamberger R . C . et al .,1994, Sabana th an S et al .,1997) . В отечественной литературе этой опухолью заинтересовались сравнительно недавно. До лечения никто из отечественных онкологов ее не диагностировал, хотя давно опубликованы прекрасные обзоры зарубежной литературы по этому вопросу (Юрин А.Г., Иванова А.Ю., 1994 (?)., Смирнов А.В., Соловьев Ю.Н., 1995).
Наше сообщение представляет интерес, как с диагностической точки зрения, так и в отношении выбора метода лечения, а также его результатов. Подробный анализ возникающих при этом проблем поможет в онкологических клиниках выработать оптимальную схему диагностических и лечебных мероприятий в каждом индивидуальном случае.
Больной Б., студент 21 года . ( и /б 2001) поступил в больницу № 62 5.02.98 г. с жалобами на боли в области грудины и увеличение опухоли в области тела грудины.
В ноябре 1997 г. через 4 месяца после ушиба заметил небольшую опухоль в области грудины, которая стала быстро увеличиваться. Периодически появлялись боли в зоне 4-5 ребер справа и слева, отмечалось повышение температуры до 37,5 0 С. Больной подчеркивал , что опухоль периодически уменьшалась в размерах без лечения. Обратился к врачу в декабре 1997 г. В январе 1998 г. направлен к онкологу, затем в Московскую городскую больницу № 62.
В анамнезе - пролапс митрального клапана. Наследственность не отягощена. Ранее отмечал аллергическую реакцию на пенициллин.
В нижней трети грудины на уровне 4-5 ребер справа и 5 ребра слева определяется опухоль размерами 6 х 4 см, плотно-эластической консистенции с флюктуацией в центре.
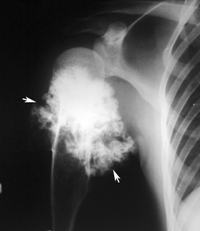
Рентгенологически в средней трети переднего средостения определяется узловое образование, прилегающее к передней грудной стенке 9х4 см. А этом же уровне по передней поверхности грудной стенки определяется мягкотканный компонент 2х7 см полуовальной формы без четких границ. Заключение: опухоль грудной стенки с прорастанием в средостение.
На рентгенограммах черепа - признаки повышенного внутричерепного давления и увеличение турецкого седла 1,5х 1 см. В затылочно-теменной области справа определяется округлая тень 1,7 см в диаметре с плотной капсулой (киста).
При КТ начиная с уровня бифуркации трахеи определяется мягкотканное многоузловое образование размерами 9х7,5х6,6 см неоднородной структурой, плотность +50 Ед Хаунсфильда . Инфильтрирующая грудину (деструкция нижней трети тела). Имеется деструкция в нижней трети тела грудины, прилежащие реберные хрящи, подкожную клетчатку, прорастает в переднее средостение, интимно прилежит к передним отделам сердца и скорее всего прорастает перикард. Клетчатка верхнего отдела средостения неравномерно уплотнена с наличием увеличенных лимфатических узлов на этом фоне. Заключение: картина злокачественной опухоли грудной стенки, прорастающей в переднее средостение и, вероятно, перикард.
При эхокардиографии отмечен пролапс митрального клапана. Полости сердца и аорта – без особенностей. Умеренная гипертрофия миокарда левого желудочка. Параметры центральной гемодинамики – в пределах возрастной нормы. В надключичной области слева выявлен один уплощенный лимфатический узел диаметром до 1,8 см гиперпластического характера. Патологии почек, печени, селезенки, поджелудочной железы не выявлено.
ЭКГ - синусовая тахикардия, вертикальное положение электрической оси сердца. Повышенная нагрузка на правые отделы сердца.
Белковые фракции от 06.02.98 г. - слабо выраженная альбуминемия и умеренная гипергаммаглобулинемия . Коэффициент А /Г 1,29.
Сывороточные онкомаркеры : РЭА, СА 125, Cifra 21-1, в2- MG и Са 19-9 - в пределах нормы. Несколько повышен уровень нейронспецифической енолазы - 12 нг /мл
Аспирационная биопсия тонкой иглой № 2365-78: в большинстве препаратов - большое количество “ бластных ” клеток, принадлежащих скорее всего злокачественной опухоли (рис. 1).
12.02.98 г. - открытая биопсия: удалены фрагменты опухоли грудины. Создается впечатление, что опухоль прорастает все ткани до кожи. Гистология № 416/3937-41 от 12.02.98: кусочки мышечной и жировой ткани с воспалительным процессом. Элементов опухоли не обнаружено.
23.02.98 - повторная биопсия ( инцизионная первичного очага и прескаленная ): вертикальный разрез кожи над опухолью. Грудина разрушена, в нижней ее трети имеется опухоль типа “рыбьего мяса”. Вырезаны небольшие кусочки опухоли спереди и в области загрудинного пространства. В опухолевой массе имеются полости распада, содержащие детрит.
Гистологическое исследование № 503/4663-74 от 23.02.98 (препараты консультированы проф. И.Г.Ольховской и Ю.Н.Соловьева) фрагменты белесовато-розовой ткани до 1 см в диаметре - мелкоклеточная опухоль типа Аскина , лимфатические узлы с явлениями гиперплазии.
Иммуногистохимическое исследование препаратов с использованием реагентов фирмы “ DAKO ”: изучена экспрессия маркеров эпителиальной дифференцировки ( цитокератинов широкого спектра) АЕ 1 /АЕ3 – отрицательная реакция во всех препаратах. Общий лейкоцитарный антиген – отрицательная реакция в клетках опухоли и интенсивная в лейкоцитах паренхимы и стромы. SP -1 и ЭПА-1 (эмбриональный преальбумин ) – отрицательная реакция. Маркер глиальных клеток S -100 – положительная реакция приблизительно в 30% клеточных структур. Положительная реакция средней и слабой интенсивности на синаптофизин (маркер нейроэндокринных клеток) отмечена внутри примерно в 60% злокачественных элементов. Заключение: опухоль из мелких круглых клеток с признаками нейроэндокринной и гистиоидной дифференцировки
Диагноз: незрелая периферическая нейроэктодермальная опухоль грудной стенки с поражением тела грудины (опухоль Аскина ).
С 6 марта по май 1998 г. проведено 3 курса полихимиотерапии : суммарно винкристин 6 мг, циклофосфан 2,4 г, фарморубицин 340 мг, платидиам 150 мг. Переливалась кровь, плазма. Клинически отмечена положительная динамика, после первого курса химиотерапии опухоль уменьшилась на 1 см. При КТ размеры, форма и структура основной массы опухоли остались прежними. Однако по сравнению с данными предыдущего исследования экстраторакальный компонент образования существенно уменьшился в размерах.
24 июня 1998 г. выполнена резекция тела грудины, хрящевых отрезков 4-6 ребер с обеих сторон, пластика дефекта правосторонним кожно-мышечно-реберным торакодорзальным лоскутом. S -образным разрезом кожи от 3 ребра слева до реберной дуги справа, окаймляющим опухоль, рассечены кожа, подкожная клетчатка и мышцы. Произведена поднадхрящничная резекция хрящевых отрезков 2-6 ребер с обеих сторон. В области 2-го межреберья перевязаны внутригрудные сосуды. Внутригрудной компонент опухоли справа спаян с медиастинальной плеврой. Этот участок плевры резецирован. Средостенный компонент опухоли (без признаков инфильтрирующего роста) острым путем выделен с клетчаткой средостения. Резецированы межреберные мышцы 2-6 ребер с перевязкой межреберных сосудов. Дефект правой плевры ушит непрерывным швом. Плевральная полость дренирована двумя трубками. Больной повернут на левый бок. Справа выкроен торако-дорзальный кожно-мышечно-реберный лоскут на питающей ножке. Реберный фрагмент выделен из расщепленного 8 и 10 ребер. 9 ребро выделено поднадкостнично . Костно-мышечный дефект в области донорского лоскута ушит узловыми швамии с предварительной установкой дренажей. Фрагменты ребер донорского лоскута фиксированы проволокой к хрящевыми отрезками 3-5 ребер. Переднее средостение дренировано. Правая и левая реберные дуги фиксированы между собой атравматической нитью ( пролен ). Лоскут подшит отдельными узловыми швами к окружающим мышцам и коже.
Через 8 месяцев после операции рецидива и метастазов опухоли не обнаружено. Продолжает учебу в институте. Легочной недостаточности не отмечено. Косметический эффект хороший (рис. 3).
Диагностика НПНО трудна даже при использовании современных методов. Уже при обращении к врачу у 14-50% больных имеются отдаленные метастазы.
Рентгенологически обычно выявляется объемное образование грудной стенки, разрушающее ребра. Иногда НПНО проявляется медиастинальным образованием или в области позвоночника. В редких случаях очаг опухоли содержит обызвествление ( Askin 1979; Saifuddin A . et al . 1991)
Магнитно-резонансное исследование дает возможность получить на Т1-взвешенном изображении НПНО сигнал той же интенсивности, как и от мышц. Иногда видны участки кровоизлияний и некрозов. Большие опухоли выглядят как гетерогенные образования. НПНО небольших размеров обычно гомогенны . При контрастировании опухоли отмечается быстрое усиление контраста изображения ( Sabate J . M . et al .,1994).
Эхограф ия иногда выявляет кистозный компонент опухоли. Редко удается выявить участки обызвествления. При значительном распространении опухоли часто обнаруживается выпот в плевре.
При сцинтиграфии очаги НПНО накапливает 67 Ga и 201 Tl . В целях прослеживания эффекта лучевой и химиотерапии терапии более рационально использовать в качестве маркера 201 Tl ( Howman-Giles R. et al ., 1995).
Как правило, пункционную биопсию тонкой иглой приходится повторять в связи с недостаточным количеством материала или его неинформативностью . То же можно сказать и о трепан-биопсии . Даже открытая биопсия опухоли далеко не всегда позволяет уточнить морфологический диагноз. Во многих случаях гистологические препараты приходится посылать в крупные онкологические центры. Наиболее частый предположительный диагноз “ нейроэктодермальная опухоль карциноидного типа”.
Тем не менее, некоторые авторы имеют опыт цитологической диагностики НПНО. Цитологическая картина опухоли довольно подробно описана. Она мало отличается от клеточной структуры саркомы Юинга , а иногда и нейробластомы . Только иммуноцитохимический анализ и электронная микроскопия пунктата тонкой иглой дает возможность точно установить гистогенез опухоли ( Silverman J . F ., 1988; Kumar P . V ., 1993; R av insk y E . et al .,1997).
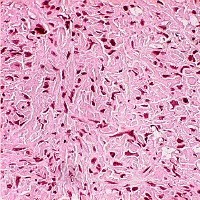
Макроскопическая картина НПНО не имеет специфических особенностей. Обычно выявляют мягкую беловато-серую опухоль 9-15 см в диаметре с очагами некроза. Как и при нейробластоме или саркоме Юинга для НПНО характерна высокая клеточность с относительно мономорфным рисунком из незрелых мелких круглых клеток, в основном без явных признаков нейродифференцировки . со скудной цитоплазмой и пузырьковидным гиперхромным ядром. Клетки образуют дольчатый рисунок среди фиброзно-сосудистой стромы в виде перегородок. Нередко клеточные скопления образуют плотные листки с альвеолярным рисунком и с полями некроза. Каждая из описанных структур повторяется в отдельных новообразованиях с разной частотой в зависимости от индивидуальных особенностей НПНО. Митозы встречаются с различной частотой. В отдельных участках препарата мелкие овальные злокачественные клетки располагаются радиально вокруг узких пространств, образуя розеткоподобные структуры.
Диагностический алгоритм строится на методе исключения. Классические псевдорозетки ( Хомер-Райта ) на гистологических срезах удается выявить с трудом, однако при тщательном просмотре всего препарата эти образования можно обнаружить. Иногда встречаются и истинные розетки Флекснера .
Уточняющее иммуногистохимическое исследование обычно включает окраски на нейроэндокринные маркеры ( нейрон-специфическая енолаза , хромогранин и синаптофизин ) для исключения карциноидной опухоли. Иногда отмечается слабо положительная реакция на специфический маркер саркомы Юинга HPA -71. При этом характерно отсутствие кератина и других признаков эпителиального происхождения опухоли. Большинство клеток имеют полигональную форму. Равномерное распределение хроматина. Ядра - с 1-4 ядрышками (см. табл. № 1). В нашем наблюдении отмечено некоторое повышение уровня нейронспецифической енолазы , а клетки опухоли содержали синаптофизин (эт от маркер может содержать также карциноид ). Аналогичные данные получили и другие исследователи ( Wick M . R . et al .,1988).
На ультраструктурном уровне удается выявить анастомозирующие отростки цитоплазмы, могут определяться плотные нейросекреторные гранулы, нейротубулы и нейрофиламенты в хорошо выраженном аппарате Гольджи . Значительное количество рибосом и полирибосом . Митохондрии разного размера собираются у одного полюса клетки, грубый эндоплазматический ретикулум проявляется в небольшом количестве. Плотные гранулы достигают 300-500 нм в диаметре.
В первую очередь следует исключить рабдомиосаркому , опухоль Юинга , метастазы недифференцированной нейробластомы , злокачественную лимфому . Известно, что эктопическая нейробластома может локализоваться в грудной стенке. Особое внимание следует уделять исключению этой патологии при паравертебральном и медиастинальном расположении НПНО. С другой стороны описана изолированная первичная НПНО легкого ( Cevallaro Catalan R . L ., Murphy Th .,1997).
H . Jurgens et al .( 1988) пересмотрели препараты всех НПНО из 23 учреждений. НПНО подтверждена в 42 наблюдениях. В 24 из них пришлось изменить диагноз. Прежнее заключение: у 16 больных – опухоль Юинга , у 5 – нейробластома , у 2 – рабдомиосаркома , у 1 – лимфома . Приблизительно в 2/3 наблюдений в клетках НПНО определяется нейрон-специфическая енолаза и положительная ШИК-реакция. D . Schmidt et al .( 1991) нейроэпителиальное происхождение опухоли считали доказанным, если получена положительная реакция на два разных маркера или при наличии розеток Homer - Wright ’ a . В случае затруднений удобно использовать диагностические параметры из таблицы № 1.
Таблица № 1 Дифференциальная диагностика сарком грудной стенки из мелких круглых клеток
Читайте также:


