Пульс капельницы при волчанке
Н.С. Подчерняева
Программа лечения клинических вариантов системной красной волчанки у детей
Московская медицинская академия им. И.М. Сеченова
Системная красная волчанка (СКВ) — одно из наиболее тяжелых и часто встречающихся заболеваний из группы диффузных болезней соединительной ткани, при котором вследствие образования широкого спектра аутоантител к клеткам и их компонентам и развития иммунного воспаления поражаются многие системы и органы.
Цель лечения больных с СКВ заключается в подавлении активности воспалительного процесса, индукции и поддержании клинико-лабораторной ремиссии, предупреждении рецидивов. Конечным итогом терапии должно быть улучшение качества жизни больного и прогноза заболевания.
Основные принципы лечения детей с СКВ следующие:
1) индивидуальный подход при выборе наиболее рациональной схемы лечения с учетом клинических проявлений, степени активности и характера течения заболевания, а также конституциональных особенностей и ответа организма ребенка на лечение;
2) соблюдение последовательности применения всех компонентов выбранной для лечения терапевтической схемы (программы);
3) своевременный переход от интенсивной к поддерживающей иммуносупрессивной терапии;
4) постоянный контроль за эффективностью и безопасностью проводимой терапии;
5) длительность и непрерывность лечения;
Предлагаемая программа — результат обобщения многолетнего опыта лечения более 600 больных в возрасте от 4 до 15 лет с различными клиническими вариантами СКВ, наблюдавшихся в специализиро ванном отделении клиники детских болезней ММА им. И.М. Сеченова за период с 1961 по 1999 г.
Этиология СКВ окончательно не установлена, поэтому терапия должна быть в первую очередь патогенетической.
Основные группы препаратов и методы патогенетической терапии СКВ
Глюкокортикостероиды (ГКС; преднизолон, метипред) остаются препаратами первого ряда, используемыми при СКВ. Дозу препарата и способ его введения определяют в зависимости от тяжести состояния больного, ведущих клинических синдромов и активности заболевания. При низкой (I степень) активности процесса доза преднизолона для перорального применения составляет 0,3—0,5 мг/кг/сут; при умеренной (II степень) — 0,7—1 мг/кг/сут; при высокой (III степень) активности и во время кризов — 1—1,5 мг/кг/сут (но не более 65—70 мг/сут).
Лечение с применением максимальной подавляющей дозы преднизолона продолжают в течение 4— 8 нед, при снижении активности заболевания ее постепенно уменьшают вначале на 5 мг, затем на 2,5 мг в неделю, а в последующем на 2,5 мг в 2—4 нед, так чтобы через 6—9 мес от начала лечения снизить дозу до поддерживающей, которую определяют индивидуально. В первые 2—3 года после начала болезни поддерживающая доза преднизолона не должна составлять менее 12,5—15 мг/сут.
При необходимости более активного лечения, например при тяжелом полиорганном поражении или волчаночном кризе, применяют пульс-терапию (ПТ) — внутривенное введение больших доз метилпред низолона (МП) из расчета 10—15 мг/кг/сут (но не более 1000 мг/сут) обычно в течение 3 дней.
Побочные эффекты ГКС: ожирение, образование striae atrophicae, развитие артериальной гипертонии, остеопороза, гиперлипидемии, пептических язв, задержка роста, катаракта, нарушение толерантности к глюкозе.
Цитотоксические иммунодепрессанты (ЦИ). В целях более быстрого достижения лечебного эффекта и с учетом тяжести побочных проявлений применения ГКС в лечении СКВ у детей широко используют ЦИ. Показания к их назначению следующие: 1) высокая или кризовая активность СКВ; 2) наличие выраженного нефрита; 3) тяжелое поражение ЦНС; 4) отсутствие явного эффекта от предшествующей терапии; 5) необходимость уменьшить дозу ГКС или невозможность ее повысить из-за побочного действия препаратов данного класса; 6) нестойкость ремиссии и частые рецидивы заболевания.
Препаратом выбора для лечения волчаночного нефрита и тяжелых полиорганных форм СКВ является циклофосфамид (ЦФ), а методом его введения — пульс-терапия, позволяющая уменьшить частоту осложнений по сравнению с ежедневным пероральным приемом препаратов.
При интермиттирующей пульс-терапии (ИПТ) ЦФ сверхвысокие дозы препарата вводят внутривен но периодически. ЦФ в дозе 15—20 мг/кг (но не более 1000 мг) вводят вначале 1 раз в месяц в течение 6—12 мес до достижения ремиссии, а затем 1 раз в 3 мес еще в течение 6—12 мес. В течение первого месяца лечения предпочтительно вводить ЦФ дробно (1 раз в 2 нед или 1 раз в неделю), разделяя указанные дозы на 2—4 приема. При нарушении функции почек дозу препарата необходимо уменьшить. Общая продолжительность ИПТ ЦФ должна составлять не менее 18 мес.
Побочные эффекты ЦФ: лейкопения, тромбоцитопения, алопеция, диспептические проявления (тошнота, рвота, диарея, боли в животе), развитие инфекционных осложнений, редко — геморрагический цистит.
Ввиду того, что влияние ЦФ и ГКС на механизмы иммунного воспаления различно, на начальном этапе лечения (в течение 1—1,5 мес) патогенетически оправдана комбинация пульс-тера пии ЦФ с пульс-терапией МП, а в последующем — длительное использование монотерапии ЦФ в сочетании с ежедневной базисной терапией ГКС. Пульс-терапия ЦФ и МП позволяет добиться значительного улучшения или ремиссии в более короткие сроки при одновременном использовании относительно меньших доз преднизолона, принимаемого перорально.
При наиболее тяжелых вариантах СКВ, осложняющихся развитием волчаночного криза (почечного или полиорганного), или резистентности к традиционной терапии, в схемы лечения включают плазмаферез (ПФ), синхронизируя его проведение с пульс-терапией ЦФ. Применение ПФ направлено на удаление из крови циркулирующих иммунных комплексов (ЦИК), криопреципитинов, различных антител, медиаторов воспаления, продуктов метаболизма и др. При плазмаферезе активируется эндогенный фагоцитоз ЦИК, в результате чего уменьшается выраженность поражений различных органов, повышается чувствительность рецепторов клеток к воздействию иммунодепрессантов.
Схема синхронной терапии — одновременного применения ПФ и пульс-терапии ЦФ (или ЦФ и МП) љ— состоит из трех сеансов ПФ (забор крови из общего расчета 10—15 мл/кг), осуществляемых в 1-й, 2-й и 3-й дни лечения; через 6 ч после третьего сеанса ПФ проводят пульс-терапию ЦФ (или ЦФ и МП), которую повторяют в 4-й и 5-й дни лечения. Доза ЦФ должна составлять 10—12 мг/кг массы тела больного (при уровне креатинина более 0,400 ммоль/л дозу ЦФ следует уменьшать вдвое).
Азатиоприн менее эффективен при лечении волчаночного нефрита, его используют при выраженном и распространенном поражении кожи, а также для снижения дозы ГКС. Азатиоприн назначают перорально в дозе 2,0 мг/кг/сут в течение 1,5—2 мес, а затем дозу уменьшают до поддерживающей 0,5—1 мг/кг/сут), которую при хорошей переносимости препарата рекомендуется принимать в течение многих месяцев.
Побочные эффекты азатиоприна: лейкопения, диспептические проявления, развитие инфекционных осложнений.
Препараты группы аминохинолинов (плаквенил, делагил) применяют при хронической СКВ с низкой активностью или при снижении доз ГКС для поддержания ремиссии. Плаквенил назначают в дозе 0,1—0,4 г/сут, а делагил — в дозе 0,125—0,25 г/сут в течение длительного времени.
Побочные эффекты: диспептические проявления, высыпания на коже, офтальмологические осложнения, нарушение пигментации кожи, волос и ногтей, редко лейкопения.
Антикоагулянты и антиагреганты широко используют при лечении волчаночного нефрита и СКВ с проявлениями тромботической ангиопатии. При нефрите лечение проводят вначале гепарином (в дозе 200—300 ЕД/кг в сутки и более под контролем показателей коагулограммы и времени свертывания крови) в течение 4—6 нед, а затем антикоагулянтами непрямого действия (синкумар, фенилин).
Для профилактики тромбозов назначают антикоагулянты непрямого действия или антиагреганты (курантил в дозе 75—200 мг/сут, аспирин в дозе 50—100 мг/сут).
Иммуноглобулины для внутривенного применения (ИГВВ; ИмБИО, пентаглобин, интраглобин, биавен) показаны при высокой активности и во время кризов (в частности при гематологических кризах) и/или возникновении инфекционных осложнений. ИГВВ назначают в курсовой дозе 0,5—2,0 г/кг массы тела. Эту дозу вводят в 2—3 приема в течение 2—3 последовательных дней или через день, в дальнейшем — по показаниям ежемесячно в меньшей дозе.
Схемы лечения при различных клинических вариантах СКВ
СКВ отличается чрезвычайным многообразием клинических проявлений и вариабельностью характера течения и может быть представлена как одним доминирующим синдромом, так и поражениями многих органов (так называемые полиорганные варианты).
Преимущественно кожный вариант хронического течения и низкой активности СКВ: преднизолон в небольших дозах в сочетании с препаратами группы аминохинолинов.
Преимущественно суставной и кожно-суставной варианты: преднизолон в средних дозах в сочетании с препаратами группы аминохинолинов; при недостаточном эффекте необходимо добавлять азатиоприн.
Хроническая СКВ с ведущим синдромом Рейно: низкие дозы ГКС в комбинации с препаратами группы аминохинолинов, антиагрегантами и вазодилататорами.
Моносиндромный вариант, представленный тромбоцитопенической пурпурой: ГКС в средних и больших дозах, ИГВВ; при тромбоцитопеническом кризе — пульс-терапия МП; при резистентности к стероидам — ИПТ ЦФ.
Полиорганные варианты без поражения почек или ЦНС: ГКС в больших дозах.
Полиорганные варианты с поражением ЦНС: ГКС в больших дозах в комбинации с ИПТ ЦФ:
Волчаночный нефрит выраженной формы: применяют 4-компонентную схему (пероральный прием ГКС; интермиттирующая пульс-терапия ЦФ; гепарин; антиагреганты).
Волчаночный криз (моно- или полиорганный): большие дозы ГКС, одновременное применение ПФ с пульс-терапией ЦФ и МП (в дальнейшем — пульс-терапия ЦФ в интермиттирующем режиме), ИГВВ, антикоагулянты и антиагреганты (исключение составляет гематологический криз, при котором проведение ПФ сопряжено с возможным развитием осложнений).
Вариант СКВ с тромботической ангиопатией: средние дозы ГКС в сочетании с длительной антикоагулянтной и антиагрегантной терапией, при высокой активности заболевания — с цитостатическими иммунодепрессантами.
Наряду с базисной терапией при лечении СКВ по показаниям используют антибиотики, гипотензивные средства, диуретики, а также препараты, назначаемые для профилактики и лечения остеопороза.
Лечение больных СКВ представляет собой сложную задачу и предполагает наличие у врача определенных знаний и опыта, позволяющих добиться эффекта и избежать развития тяжелых осложнений. Современные методы терапии способствуют достижению ремиссии СКВ у большинства больных и обеспечению достаточно высокого качества жизни.
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.
- 18222
- 14,3
- 4
- 4
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
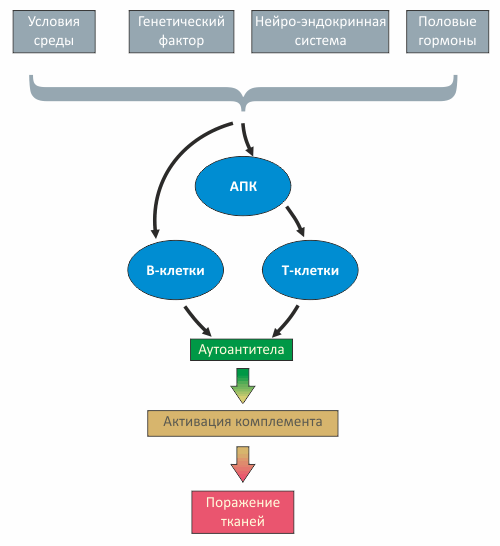
Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
Для лечения СКВ применяют также препарат моноклональных антител, селективно действующий на CD20 + В-лимфоциты, — ритуксимаб, зарегистрированный FDA для лечения неходжкинской лимфомы. Впрочем, высокая цена этого препарата не позволила ему получить широкого применения при лечении СКВ в нашей стране.
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди
Лечение системной красной волчанки (СКВ) обычно комплексное, включает активную противовоспалительную и иммуносупрессивную терапию, а также реабилитационные мероприятия. Для индивидуализации терапии важнейшее значение имеет оценка начала и течения болезни, ее активности к моменту госпитализации или амбулаторного обследования больных. Необходимо исключить воздействие провоцирующих факторов: инсоляцию, инфекцию, вакцинации, стрессы, переохлаждение, физиотерапевтические процедуры. С осторожностью следует назначать лекарственные средства, провоцирующие развитие лекарственной волчанки (гидрализин, изониазид, антибиотики, витамины, метилдопа).
Лекарственными средствами первого ряда являются глюкокортикоиды и цитостатические иммунодепрессанты, самостоятельно или в сочетании.
Препаратом выбора в группе глюкокортикоидов является преднизолон (могут назначаться преднизолон, метилпреднизолон (медрол, урбазон), триамцинолон (полькортолон), дексаметазон (дексазон), бетаметазон) — 40-50 мг в сутки при остром и подостром течении (III степень активности), 60 мг и более при наличие нефротического синдрома и менингоэнцефалита; при остром и подостром течении II степени активности и хроническом течение II и III степени активности доза уменьшается до 30-40 мг в сутки, при I степени — до 15-20 мг в сутки. Продолжительность гормонотерапии — до уменьшения клинических признаков, в среднем составляет 3-6 месяцев, затем переход на поддерживающие дозы — 5-10 мг в сутки годами или пожизненно.
В тяжелых случаях при наличии нефротического синдрома, тяжелого церебрального васкулита, цитопении, системного васкулита как метод интенсивной терапии применяют пульс-терапию. При проведении пульс-терапии метилпреднизолон показан внутривенно капельно по 1000 мг на физиологическом растворе 3 дня подряд. В капельницу целесообразно добавить одновременно 5000 ЕД гепарина и 10 мл 10% хлористого калия. В настоящее время для проведения пульс-терапии практически не используется преднизолон, значительно чаще вызывающий побочные действия в сравнении с метилпреднизолоном или бетаметазоном. После больные продолжают принимать ту пероральную дозу кортикостероидных гормонов, которую принимали до процедуры.
С целью усиления противовоспалительного и иммунодепрессивного эффектов возможно проведение комбинированной пульс-терапии. При проведении комбинированной пульс-терапии в первый день внутривенно капельно вводится 1000 мг метилпреднизолона и 600-1000 мг (в зависимости от массы тела больного) циклофосфана. В последующие 2 дня больные получают капельно только по 1000 мг метилпреднизолона. Из побочных явлений комбинированной пульс-терапии следует отметить тошноту, неприятные ощущения в области сердца, тахикардию, редко лейкопению и выпадение волос.
Комбинированная пульс-терапия должна назначаться по строгим показаниям. Она может проводиться только у больных с торпидным и прогрессирующим люпус-нефритом, а также генерализованным васкулитом. При достижении терапевтического эффекта следует перейти к постепенному снижению дозы кортикостероидных гормонов. Принцип таков: чем выше исходная доза гормонального препарата, тем быстрее вначале можно ее уменьшать, и наоборот, чем ниже доза преднизолона, тем более медленным должен быть темп ее дальнейшей отмены. К примеру, если больной принимает 60 мг преднизолона в сутки, то начинать снижение дозы препарата можно по 5 мг в неделю до суточной дозы 50 мг, а затем продолжать снижение дозы в темпе 2,5 мг в неделю до суточной дозы 30-40 мг. В последующем темп снижения еще более замедляется — по 2,5 мг в 2 недели, а при суточной дозе 15-20 мг — по 2,5 мг в 3-4 недели. При этом систематически контролируются состояние больного и лабораторные данные (общий анализ крови и мочи).
Выбор поддерживающей дозы глюкокортикоидного гормона является одним из важных этапов лечения. Оптимальная поддерживающая доза позволяет контролировать течение заболевания на уровне клинико-лабораторной ремиссии или минимальной активности патологического процесса.
Поддерживающая доза преднизолона составляет обычно от 5 до 25 мг в сутки. Чем ниже величина этой дозы, тем надежнее состояние больного и глубже клинико-лабораторная ремиссия. Сравнительно высокая поддерживающая доза (15-25 мг) свидетельствует о сохранении активности процесса и возможности развития рецидива заболевания. Поддерживающую дозу кортикостероидных гормонов должны принимать годами или неопределенно долгий период.
При длительном приеме кортикостероидных гормонов, особенно в избыточной дозировке, развиваются побочные действия препаратов. Для уменьшения побочного действия кортикостероидов рекомендуется особый суточный ритм приема преднизолона, когда максимальная доза препарата (до 2/3 от суточной дозы) назначается в утренние часы, а оставшаяся доза распределяется на день и вечер. Целесообразно также, если необходимо, использовать одновременно препараты калия, кальция, анаболические гормоны.
Кроме кортикостероидных гормонов, большинству больных назначаются аминохинолиновые препараты (делагил, плаквенил, хингамин, хлорохин и др.). Делагил принимается вечером после еды по 1-2 таблетки (0,25-0,5 г в сутки), плаквенил — по 0,2-0,4 г в сутки. Они необходимы в течение многих месяцев или лет. Аминохинолиновые препараты наиболее показаны больным СКВ с поражением кожи и при хроническом течении заболевания.
Основными показаниями к назначению иммунодепрессантов являются: высокая активность и быстрое прогрессирование волчаночного процесса, активные нефротический и нефритический синдромы, недостаточная эффективность глюкокортикоидов, их плохая переносимость и развитие побочных реакций. Наиболее часто у больных системной красной волчанкой применяется азатиоприн (имуран) или циклофосфан (циклофосфамид) в дозе 2-3 мг/кг в сутки. В лечебной дозе препарат назначается на 3-4 месяца, а затем следует перейти на прием поддерживающих доз (50-100 мг в сутки в течение многих месяцев и даже лет. Азатиоприн принимается внутрь, а циклофосфан — парентерально (внутримышечно или внутривенно). При высокой иммунологической активности системной красной волчанки можно начать лечение с парентерального применения циклофосфана для получения более быстрого терапевтического эффекта, а спустя 2-3 недели перейти на прием азатиоприна.
Антиметаболиты (азатиоприн) лучше назначать ежедневно, а для алкилирующих препаратов (циклофосфан) предпочтительнее использовать альтернирующий способ введения. Циклофосфан, как правило, применяется по 200 мг внутривенно струйно через день или по 400 мг 2 раза в неделю.
Абсолютными противопоказаниями для назначения цитостатиков являются беременность и сопутствующий инфекционный процесс в активной фазе. Относительные противопоказания: далеко зашедшая стадия болезни, нарушение функции печени и почек, выраженная гемоцитопения, наличие очагов хронической инфекции, отсутствие возможности для последующего тщательного контроля над больным.
Наличие у больного системной красной волчанкой нефрита любой степени выраженности или признаков генерализованного васкулита является показанием для включения в комплексную терапию гепарина и дипиридамола. Гепарин, будучи антикоагулянтом прямого действия, подавляет внутрисосудистую коагуляцию, кроме того, снижает активность комплемента, оказывает противовоспалительное действие, уменьшает сосудистую проницаемость. На фоне его применения снижается артериальное давление, увеличивается диурез.
Гепарин назначается по 20000-30000 ЕД в сутки. Предпочтительнее вводить его под кожу живота по 5000 ЕД 4 раза в сутки или по другой схеме: вначале вводится 10000 ЕД внутривенно капельно, а оставшаяся суточная доза под кожу живота — в 2-3 инъекциях. Продолжительность курса гепаринотерапии должна составлять 3-10 недель. Гепарин вводится под контролем времени свертывания крови или толерантности плазмы к гепарину.
Дипиридамол (курантил) как дезагрегант препятствует агрегации тромбоцитов, благодаря чему повышается эффективность применения гепарина. Он назначается в суточной дозе 150-400 мг в течение 3-8 месяцев.
Курсы лечения с использованием гепарин-курантиловой схемы у больных с люпус-нефритом рекомендуется проводить 2-3 раза в год. Это позволяет на долгое время сохранить функцию почек в удовлетворительном состоянии.
При агрессивном течении болезни применяют методы экстракорпорального очищения (плазмоферез, лимфоцитоферез, гемосорбция, иммуносорбция), способствующие выведению из организма белковых и белково-липидных комплексов, аутоантител, циркулирующих иммунных комплексов, продуктов метаболизма клеток и других веществ. Плазмоферез проводится через день (3 сеанса в неделю), курс лечения — 3-6 процедур. Гемосорбция — еженедельно, курс лечения — 3-5 сеансов. Плазмоферез и гемосорбция проводятся на фоне терапии глюкокортикоидами и цитостатиками.
Существует несколько методик синхронной интенсивной терапии : 1) серия плазмаферезов из 3-6 последовательных процедур с дальнейшим коротким курсом мегадоз циклофосфамида внутривенно; 2) начальная серия процедур плазмофереза (обычно 3) синхронно с внутривенным введением циклофосфамида (1 г) и метилпреднизолона (3 г) и в дальнейшем по одной процедуре плазмофереза в 1-3 месяца в течение года, синхронно с 1 г циклофосфамида и 1 г метилпреднизолона. Вторая схема синхронной интенсивной терапии представляется более убедительной, так как обеспечивает программный контроль в течение года. Программное назначение комбинации плазмофереза и пульс-терапии метилпреднизолоном и циклофосфамидом показано в первую очередь больным с неблагоприятным жизненным прогнозом, обусловленным началом заболевания в подростковом и молодом возрасте, быстрым развитием нефротического синдрома, быстропрогрессирующим типом нефрита, стойкой артериальной гипертензией и с развитием угрожающих жизни состояний (церебральный криз, поперечный миелит, геморрагический пневмонит, тромбоцитопения и др.).
При поражении суставов при подостром и хроническом течении применяют нестероидные противовоспалительные препараты: диклофенак — 50 мг 2-3 раза в сутки, индометацин — 25-50 мг 2-3 раза в сутки, бруфен — по 400 мг 3 раза в сутки. У больных с поражением кожи и суставов и при умеренной активности патологического процесса применяют аминохинолиновые производные: делагил (0,25-0,5 г в сутки) или плаквенил (0,2-0,4 г в сутки).
Возможно лечение стволовыми клетками, которое основано на способности значительно укреплять иммунитет и направлено на восстановление соединительной ткани, внутренних органов и кожи. При лечении красной волчанки стволовые клетки останавливают прогрессирующее воспаление органов. Попадая в зону гибели клеток, замещают рубцовую ткань, восстанавливая функциональную способность органов.
В настоящее время разрабатывается новая методика лечения с применением подкожных инъекций пептида Р140. Было показано, что пептид не вызывает никаких побочных эффектов. Эффективность Р140 была подтверждена снижением в крови пациентов количества антител к ДНК, которые всегда обнаруживаются у больных системной красной волчанкой. Новый препарат имеет существенное преимущество перед другими препаратами, которые затрагивают работу всей иммунной системы. Р140 не приводит к снижению сопротивляемости организма вирусным инфекциям.
Климатобальнеологическое и физиотерапевтическое лечение противопоказано, возможно санаторно-куротное лечение в ревматологических и кардиологических санаториях.
Прогноз зависит от тяжести заболевания и наличия антифосфолипидного синдрома, при котором прогноз в отношении продолжительности жизни значительно снижается.
"Ревматология"
Т.Н. Бортная
Читайте также:


