Рал это в инфекциях
Историческая справка
Впервые метод реакции латекс-агглютинации (РЛА) был предложен в 1956 году и использован для определения ревматоидного фактора с помощью полистирольных латексных микросфер с узким распределением частиц по размеру, покрытых гамма-глобулином человека. Сообщалось, что взаимодействие антигенов, находящихся в сыворотке крови пациента, с гамма-глобулином, адсорбированным на поверхности гидрофобных микросфер суспензии, привело к агглютинации полимерных частиц и образованию крупных агломератов, легко различимых невооруженным глазом. В последующие годы метод РЛА получил широкое распространение, как в клинических диагностических тестах, так и в биохимических и иммунологических исследованиях. Особенно широкое применение РЛА наблюдается в инфекционной патологии.
Описание метода реакции латексной агглютинации
Реакция латексной агглютинации используется в клинической химии в течение многих лет как простой, быстрый и недорогой метод определения белков, гормонов и других биологически активных соединений. Белки, являясь поливалентными антигенами, вступают в реакцию с антителами с образованием иммунных комплексов, или агглютинатов. Как правило, иммунные комплексы слабо визуализируются не только невооруженным глазом, но и с помощью фотометрических методов. Использование дисперсионных полимеров (латексов), сенсибилизированных антителами или антигенами, позволяет значительно облегчить детекцию реакции агглютинации, которая в этом случае называется реакцией латексной агглютинации.
Носители для метода реакции латексной агглютинации
Наиболее часто для получения диагностических препаратов используют полистирольные микросферы, несущие на своей поверхности различные функциональные группы (карбоксильные, эпоксидные, альдегидные и др.) и полиакролеиновые микросферы, содержащие на своей поверхности альдегидные функциональные группы, способные вступать в реакцию с первичными аминогруппами, образуя основание Шиффа Применение инертных синтетических носителей для иммобилизации антител (или антигенов) является широко распространенным методическим подходом в иммуноанализе.
Полимерные микросферы с узким распределением частиц по размерам и функциональными группами на поверхности представляют большой интерес для биологии и медицины, в частности для использования в качестве носителей биолигандов вместо эритроцитов при создании диагностических тест-систем на различные виды заболеваний. Замена эритроцитов на полимерные микросферы является решением проблем, связанных с недостатками эритроцитарных диагностикумов, а именно:
- 1) эритроциты получают из крови животных, содержание которых трудоемко и дорогостояще
- 2) эритроциты содержат много антигенных детерминант, которые реагируют с компонентами сывороток человека и животных, что обуславливает протекание неспецифических реакций и приводит к ложноположительным результатам
- 3) свойства эритроцитов часто зависят от источника и способа их выделения
- 4) диагностикум на основе клеток одних и тех же животных не дает постоянный титр и после длительного хранения не сохраняет прежнюю степень агглютинации.
Для замены эритроцитов, полимерные микросферы должны обладать определенными свойствами: скорость седиментации 3 – 8 мм/час, диаметр частиц порядка 5 мкм., агрегативная устойчивость в воде и буферных растворах высокой ионной силы, наличие в поверхностном слое функциональных групп, доступных для ковалентного связывания с функциональными группами белков.
Одним из преимуществ применения полимерных микросфер в качестве носителей биолигандов является возможность получения полимерных частиц с заданным комплексом свойств. Для устранения проблем, связанных с применением эритроцитов, используются полимерные микросферы с определенными свойствами:
- 1) монодисперсное распределение по размерам
- 2) сферическая форма
- 3) устойчивость к электролитам в широком интервале pH
- 4) способность присоединять биологические макромолекулы без значительного изменения их функциональной активности
- 5) воспроизводимые свойства и характеристики
Однородность частиц по размерам позволяет достаточно точно определить площадь поверхности носителя и установить степень ее покрытия биолигандом, кроме того, она обусловливает сходный характер их поведения во время агглютинации, что облегчает “прочтение” результатов реакции латекс-агглютинации(РЛА). Впервые, для создания диагностических тест-систем были использованы полистирольные микросферы. Полистирол, благодаря своей оптической прозрачности, высокой адсорбционной способности, прочности и хорошей воспроизводимости свойств, успешно используется в качестве носителя.
Главной проблемой полимерных микросфер, используемых при создании диагностикумов является неспецифическая агглютинация(частицы отрицательного контроля образуют ореол из частиц вокруг центра дна лунки) , причины которой и факторы ее вызывающие во многом еще не ясны. Наибольшее распространение в качестве способов уменьшения неспецифического связывания нашли значительное разбавление образцов, добавление детергентов, экранирование поверхности частиц низкомолекулярными белками. Однако применение данных методов чаще всего приводит к уменьшению чувствительности и точности реакции латексной агглютинации.
При тщательной отработке методики получения латексных диагностикумов, соблюдении оптимальных условий их приготовления и постановки самой реакции, РЛА может приближаться к самым современным иммунологическим методам.
РЛА сходна с РНГА по принципу сорбции антител на поверхности более крупных частиц.
Преимущества метода РЛА
Реакция РЛА — экспресс-метод диагностики инфекционных болезней (время проведения — до 10 мин, возможно обнаружение антигена в небольшом объёме исследуемого материала). Для постановки РЛА используют стеклянные или темнопольные пластины.
РЛА в качестве сигнального экспресс-теста для выявления антигенов микроорганизмов удобна при использовании в практических лабораториях, а также при проведении массовых обследований. К преимуществам РЛА, как метода серологической диагностики бактериальных и вирусных инфекций, можно отнести следующие моменты:
- - высокую специфичность и чувствительность;
- - отсутствие необходимости в сложной аппаратуре для постановки и реакции и регистрации результатов;
- - сведение до минимума количества компонентов реакции;
- - возможность получения инертных носителей с заданными характеристиками.
Относительная дешевизна метода реакции латексной агглютинации (РЛА), простота и возможность постановки теста практически в любых условиях делают его очень удобным как при одиночных, так и при массовых исследованиях даже в небольших клинических мало оборудованных лабораториях.
Применение метода реакции латексной агглютинации
РЛА применяют для индикации антигенов Streptococcus pneumoniae, Haemophilus influenzae типа b( Neisseria meningitidis в СМЖ, выявления стрептококков группы А в мазках из зева, в диагностике сальмонеллёзной инфекции, иерсиниозов и других заболеваний. Чувствительность метода — 1-10 нг/мл (103-106 бактериальных клеток в мл). Недостаток метода — возможность получения артефактов, особенно в присутствии ревматоидных факторов и продуктов фибринолиза плексы с участием комплемента — преципитаты. Простейший пример качественной реакции преципитации — образование непрозрачной полосы преципитации в пробирке на границе наслоения антигена на иммунную сыворотку (реакция кольцепреципитации). Реакцию преципитации проводят в гелях агара, агарозы. Их используют для выявления и изучения свойств разнообразных антигенов и антител.
Материалы и реагенты для метода реакции латексной агглютинации
Реакция латекс-агглютинации (РЛА) является одним из видов реакции агглютинации, в которой в качестве носителя антигена или антитела используются синтетические полимерные (латексные) частицы.
Обычно иммунологически активный компонент адсорбируется на полимерных частицах (микросферах) за счет физического взаимодействия между молекулами антигенов (или антител) и поверхностью частиц, но может быть использовано и ковалентное связывание через соответствующие активные группы.
Такие сенсибилизированные латексные носители в присутствии гомологичного иммунореагента образуют агглютинат, хорошо видимый невооруженным глазом.
Впервые метод реакции латекс-агглютинации (РЛА) был предложен Severin V. и соавт. в 1956 г. и использован для определения ревматоидного фактора при помощи полистирольных латексных микросфер с узким распределением но размеру частиц, сенсибилизированных иммуноглобулином человека. Сообщалось, что взаимодействие антигенов, находящихся в сыворотке крови пациента, с иммуноглобулином, адсорбированным на поверхности гидрофобных микросфер суспензии, привело к агглютинации полимерных частиц и образованию крупных агломератов, легко различимых невооруженным глазом. В последующие годы метод РЛА получил широкое распространение как в клинических диагностических тестах, так и в биохимических и иммунологических исследованиях.
В настоящее время РЛА применяют как для определения количества антител к конкретному возбудителю, так и для диагностики наличия в биологических жидкостях бактериального, паразитарного или вирусного агента (антигена).
Для получения диагностических препаратов используют полистирольные латексные частицы, несущие на своей поверхности различные функциональные группы (карбоксильные, эпоксидные, альдегидные и др.) и полиакролеиновые, имеющие на своей поверхности альдегидные функциональные группы, способные вступать в реакцию с первичными аминогруппами. Все латексные диагностикумы (ЛД) по принципу работы делятся на две большие группы: антигенные и антительные. Антигенные ЛД на поверхности частиц латекса несут антигены возбудителя, антительные—антитела к конкретному возбудителю или группе возбудителей и используются для обнаружения последних в любых биологических жидкостях.
В нашей стране и за рубежом в настоящее время выпускают латексные коммерческие диагностические тест-системы, предназначенные как для обнаружения и идентификации микроорганизмов, так и для определения растворимых антигенов в биологических жидкостях.
Объектами исследования РЛА могут быть сыворотка крови, слюна, молозиво, моча, фекалии и др.
Многими исследователями отмечается высокая чувствительность и специфичность диагностических латексных тест-систем — перекрестные реакции, по опубликованным данным, составляют не более 1-3%. Имеются сообщения об успешном использовании латексных диагностикумов при выявлении антигенов пневмококка, гемофильной палочки и менингококка непосредственно в биологических жидкостях, стрептококков, золотистого стафилококка, антигенов синегнойной палочки, холеры, Clostridium difficile — в фекалиях, а также антигенов вируса краснухи, ротавирусов, адено- и герпесвирусов.
РЛА с использованием латексных диагностикумов ставятся как в планшетах для иммунологических реакций, так и на предметном стекле. Последние занимают мало времени и легко учитываются; они незаменимы при работе в полевых условиях и чаще всего используются для быстрого скрининга на наличие какого-либо заболевания.
РЛА особенно удобна для применения в качестве сигнального экспресс-теста для выявления антигенов в первые дни заболевания, когда еще не успел развиться иммунный ответ организма, и серологическая диагностика не дает положительного результата. К преимуществам РЛА можно отнести следующие:
— простота и быстрота выполнения;
— высокая специфичность и чувствительность;
— отсутствие необходимости в сложной аппаратуре для постановки и визуальный учет результатов;
— сведение к минимуму количества компонентов реакции;
— возможность получения инертных носителей с заданными характеристиками.
а) Постановка РЛА на предметном стекле с целью обнаружения антигена. На чистую обезжиренную стеклянную пластинку наносят по 1 капле (10-20 мкл) латексного диагностикума и исследуемого материала. В качестве контроля используют:
• культуру бактерии + гомологичный латексный диагностикум (положительный контроль);
• питательную среду для культивирования возбудителя + латексный диагностикум (отрицательный контроль);
• предметные стекла или специальные тест-пластины.
Компоненты в каждой капле тщательно перемешивают углом предметного стекла, используя каждый раз новый угол.
Учет результатов реакции проводят визуально через 2-3 мин после смешивания компонентов. В случае положительной реакции отмечают образование агглютинатов и просветление фона. При отрицательном результате реакции суспензия остается гомогенной, без хлопьев агглютината и без просветления фона.
Появление агглютината позднее, чем через 7-10 мин после постановки реакции, расценивают как неспецифический результат.

Результаты реакции латекс-агглютинации на предметном стекле:
а — положительная реакция; б — отрицательная реакция (контроль).
б) Постановка РЛА с целью выявления антител в планшетах для иммунологических реакций. Для постановки реакции необходимы:
— диагностикум латексный антигенный;
— сыворотка крови обследуемых лиц;
— фосфатно-солевой буферный раствор (ФСБ), pH 7,2-7,4 или изотонический раствор натрия хлорида в качестве электролита;
— планшеты для иммунологических реакций с 96 лунками с круглым дном;
— микропипетки.
В один ряд лунок планшета (с первой по шестую) вносят по 0,05 мл ФСБ. Затем в первую лунку добавляют равное количество (0,05 мл) исследуемой сыворотки больного в разведении 1:25 (0,1 мл цельной сыворотки + 2,4 мл ФСБ), перемешивают и путем последовательных переносов титруют до пятой лунки. Из последней удаляют 0,05 мл смеси, чтобы количество разведенной сыворотки было одинаковым во всех лунках. Затем вносят по 0,05 мл 0,05% раствора известного латексного диагностикума в лунки 1-6. Контролем диагностикума на отсутствие спонтанной агглютинации служит шестая лунка, в которой содержится только диагностикум и ФСБ. Схема постановки такой реакции представлена в таблице ниже.
Планшет осторожно встряхивают и оставляют при комнатной температуре на 18-20 ч.
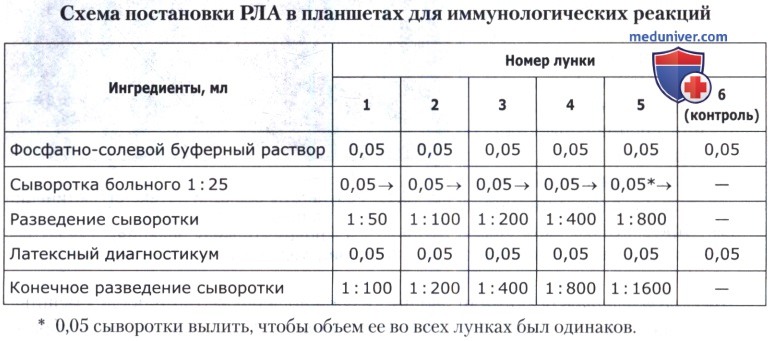
Учет результатов начинают с контролей. Затем оценивают диагностические реакции по четырехплюсовой системе:
++++ резко положительная реакция (полная агглютинация); все частицы латекса равномерно выстилают дно лунки в виде перевернутого зонтика с неровными краями;
+++ положительная реакция с неполной агглютинацией; частицы латекса покрывают дно лунки в виде слегка спавшегося перевернутого зонтика, в центре которого просматривается небольшое кольцо частиц, не вступивших в реакцию;
++ частичная агглютинация. Агглютинат в виде широкой зоны вокруг четкого кольца частиц латекса, не вступивших в реакцию;
+ слабая сомнительная агглютинация; частицы латекса, не вступившие в агглютинацию, оседают на дно лунки в виде широкого кольца, вокруг которого узкий ободок агглютината;
- отрицательная реакция; осадок частиц латекса в центре лунки в виде компактного диска (пуговки).
Титром антител считают разведение сыворотки, в котором РПГА положительна не менее чем на +++ в самом большом разведении при полном отсутствии агглютинации в отрицательном контроле.
Редактор: Искандер Милевски. Дата публикации: 17.08.2019
Реакция агглютинации латекса (РАЛ), или реакция латекс-агглютинации, разработана давно, однако она не нашла достаточно широкого применения в медицине и в ветеринарии.
Тем не менее усиливающаяся тенденция использовать в качестве носителей антигенов и антител инертные синтетические материалы привела к оживлению интереса к РАЛ и широкому изучению возможностей ее применения.
Принцип метода. Механизм РАЛ аналогичен РИГА, в которой используют сенсибилизированные антигенами или антителами эритроциты человека или животных. Для постановки РАЛ применяют сенсибилизированные частицы полистирольного латекса, которые в присутствии гомологичного реагента склеиваются. Обычно эта реакция проходит очень быстро (3…8 мин), что позволяет применить ее в качестве экспресс-метода для выявления антигенов и антител.
Преимущества РАЛ в том, что частицы латекса в отличие от эритроцитов не имеют перекрестно реагирующих антигенов, поэтому она специфичнее РИГА.
Материалы и реагенты. 1. Суспензия латекса. Для приготовления диагностикумов обычно используют частицы латекса диаметром 0,81…1 мкм. При применении более крупных частиц диаметром 0,22…0,3 мкм затруднен учет реакции и технологический процесс получения диагностикумов резко усложняется, а частиц более 1 мкм хотя не влияет на активность латексных диагностикумов, но существенно увеличивает частоту неспецифических реакций.
Для постановки РАЛ лучше использовать очищенные латексы с гомогенными частицами правильной сферической формы. Густота суспензии латекса обычно составляет 1 %, но может достичь в отдельных случаях 1,3…1,4 %.
3. Антитела. Для сенсибилизации частиц латекса пригодны гипериммунные сыворотки, полученные при иммунизации лабораторных животных (кроликов, крыс, мышей и др.). Повышению специфичности РАЛ и уменьшению числа ложноположительных и перекрестных реакций способствует применение очищенных иммуноглобулиновых фракций.
Методика исследования. Основные этапы постановки РАЛ. В настоящее время РАЛ обычно ставят на стеклянных или полистироловых пластинках, используя коммерческие диагностикумы или препараты. Реже применяют пластинки с лунками для постановки РИГА или пробирочный вариант реакции. Манипуляции выполняют в определенной последовательности.
1. Делают ряд серийных разведений исследуемого материала. Сыворотки крови необходимо предварительно прогреть в течение 30 мин при 56 °С или 20 мин при 60 °С. При постановке РАЛ на пластинках для РИГА при разведении материала используют петли микротитратора. На плоские ровные пластины наносят по одной капле соответствующих разведений.
2. Добавляют к каждому разведению равный объем суспензии сенсибилизированного латекса. Смешивают 1 каплю исследуемого материала и диагностикум, в лунки вносят по 15, 25 или 50 мкл ингредиентов реакции.
При постановке РАЛ в пробирочном варианте используют 0,25 мл исследуемого материала и 0,05 мл (или 0,1 мл) диагностикума.
3. Помещают пластинки на вращающийся столик или в шуттель-аппарат на 3…5 мин, после чего производят регистрацию результатов реакции.
Учет результатов. Независимо от вида диагностикума и количества антител (антигена) в исследуемом материале результаты РАЛ могут быть учтены уже через несколько минут после смешивания реагентов. При наличии в исследуемом образце искомого микроорганизма склеивающиеся частицы латекса образуют агглютинат, хорошо видимый невооруженным глазом. Можно использовать лупы с небольшим увеличением. При отрицательных результатах реакции суспензия латекса остается гомогенно-мутной, без глыбок агглютината и участков просветления. При малой или низкой активности диагностикума, а также невысокой концентрации антигена пластинки лучше инкубировать при 37 °С, что несколько ускоряет образование агглютината.
Результат реакции оценивают по трехбалльной системе:
Ставят несколько контролей: 1) исходное разведение исследуемого материала + суспензия несенсибилизированного латекса (отрицательный контроль); 2) нормальная сыворотка, не содержащая антител + суспензия сенсибилизированного латекса (проверка специфичности диагностикума); 3) гомологичная иммунная сыворотка + суспензия сенсибилизированного латекса (проверка активности диагностикума).
При постановке РАЛ с антительными латексными диагностикумами в контрольных положительной и отрицательных реакциях используют соответствующий антигенсодержащий материал.
Техника приготовления диагностикумов. Сенсибилизация латекса антигенами. Для приготовления антигенного латексного диагностикума желательно иметь в распоряжении растворимые антигены. В этом случае хорошие результаты получают при использовании буферных растворов (например, глицинового или боратного с pH 8,2). В таком буфере готовят раствор антигена в концентрации 2,5…5,0 мг/мл к 1 объему суспензии латекса. Если раствор антигена приготовлен на изотоническом растворе натрия хлорида, то буфер добавляют к смеси латекс — антиген.
Сенсибилизацию проводят в течение 2 ч при 37 °С в термостате или (лучше) на водяной бане. По истечении этого времени сенсибилизированный латекс осаждают центрифугированием в течение 5…10 мин при частоте оборотов 2000…2500 мин -1 и ресуспензируют в этом же буферном растворе до получения 1%-й суспензии.
Сенсибилизация латекса антителами. Суспензию латекса смешивают с равным объемом иммунной сыворотки или очищенной гамма-глобулиновой фракции в соответствующем буферном растворе. Смесь инкубируют в течение 30 мин при комнатной температуре или при 37 °С, центрифугируют в течение 30 мин при частоте оборотов 3…5000 мин -1 и дважды промывают осадок 0,01 М трис-солянокислым буфером с добавлением 200 мг/л поливинилпирролидона. Сенсибилизированный латекс ресуспензируют в этом же буферном растворе с поливинилпирролидоном и 0,05 % азида натрия и хранят в холодильнике при 2…4 °С.
При выборе оптимальной дозировки антител для сенсибилизации латекса следует учитывать, что одна его частица диаметром 0,8 мкм может адсорбировать на своей поверхности до 7,5 ∙ 10 4 молекул гамма-глобулина.
Необходимо отметить, что во многом требуется предварительно эмпирическим путем подбирать оптимальные условия для получения высококачественного латексного диагностикума. Режим сенсибилизации зависит от сорта и размера частиц латекса, pH и вида буферных растворов и ряда других факторов.
Для уменьшения частоты ложноположительных результатов рекомендуется к готовой суспензии сенсибилизированных частиц латекса добавлять нормальную сыворотку того вида животного, который был использован для приготовления гипериммунной сыворотки.
Получение латексных диагностикумов с помощью белка А стафилококка. Применение для изготовления диагностикумов на основе частиц латекса, покрытых белком А стафилококка, позволяет использовать для сенсибилизации латекса любые иммунные сыворотки без какой-либо их предварительной обработки.
Раствор белка А (1 мг/мл) готовят на дистиллированной воде с добавлением 0,05 % азида натрия. Перед применением его разводят в 200 раз 0,1 М глициновым буфером (pH 8,2), содержащим 1 % хлорида натрия. Стандартную коммерческую суспензию латекса разводят в 15 раз изотоническим раствором хлорида натрия, смешивают с равным объемом разведенного раствора белка А, инкубируют при постоянном перемешивании в течение 2…4 ч при 20 °С, а затем 16…18 ч при 4 °С. Частицы латекса, покрытые белком А, осаждают центрифугированием при частоте вращения 6000 мин -1 в течение 30 мин и дважды промывают половинным объемом глицинового буфера с добавлением 0,02 % поливинилпирролидона. Полученную суспензию после добавления 0,05 % азида натрия можно хранить при 4 °С в течение 4 мес.
Иммунную сыворотку разводят до титра глициновым буфером и смешивают с равным объемом суспензии латекса, покрытого белком А. Инкубацию и промывку сенсибилизированного антителами латекса проводят по методике, описанной выше.
Эту же методику можно использовать и для сенсибилизации латекса гамма-глобулиновыми фракциями, выделенными из иммунных сывороток посредством их насыщения сульфатом аммония. В этом случае продолжительность сенсибилизации антителами частиц латекса, покрытых белком А, можно сократить до 2 ч, исключив длительный 2-й этап, проводимый при 4 °С. Приготовленный таким образом диагностический препарат в 4…16 раз активнее обычного антигельного латексного диагностикума.
Практическое использование. К сожалению, в практических ветеринарных лабораториях РАЛ практически не используют, несмотря на то что она по чувствительности и специфичности превосходит многие классические серологические методы.
В настоящее время имеются сообщения об успешном применении РАЛ для диагностики туляремии, бруцеллеза, ряда вирусных инфекций. При использовании данных диагностикумов чувствительность РАЛ на стекле составляет 10 6 м. т./мл, а при постановке в полистироловых пластинках — 1,8 ∙ 10 4 м. т./мл (бруцеллез) и 1,25 ∙ 10 5 м. т./мл (туляремия). Кроме того, разработаны латексные диагностикумы для выявления возбудителей иерсиниоза, псевдотуберкулеза, листериоза, сальмонеллеза. Имеются также сведения об успешных испытаниях специально разработанного для ветеринарии латексного антигенного диагностикума для выявления антител к возбудителю туберкулеза.
Безусловные преимущества РАЛ: 1) простота постановки; 2) отсутствие какого-либо специального оборудования; 3) достаточно высокие чувствительность и специфичность.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Статья рассказывает о международном цветовом стандарте RAL (РАЛ), его появлении, развитии, использовании и его особенностях на сегодняшний день. Кто его придумал? Что нового принес в нашу жизнь этот стандарт? Как он облегчает нам жизнь? В каких областях он используется, применяется и совершенствуется. Что такое РАЛ? Полезен ли он? Можем ли мы использовать его в нашей повседневной жизни? Мы постарались найти даже вариации различных названий цветов в палитре RAL(РАЛ). Вот об этом наша статья.
Для чего была введена шкала РАЛ
Трудно представить себе что-то более субъективное, чем ощущение. И цвет в этом не является исключением. Наименование цветов традиционно разное, даже для художников и веб-дизайнеров. Что такое РАЛ и как он был разработан?
Стандартизация — неотъемлемый элемент технического прогресса, предназначенный для регулирования производства. Расширение производства неизбежно связано с утверждением стандартов. Поэтому в 1927 году впервые был введен РАЛ (RAL) — немецкий цветовой стандарт. Он был разработан по просьбе столкнувшихся с этой проблемой производителей лаков и красок. Вот почему все промышленные производства, для которых важен правильный подбор цветовой гаммы (лакокрасочное, производство пластмасс и др.), очень хорошо знают, что такое РАЛ. Стандартизация позволяет, в первую очередь, говорить на одном и том же языке и понимать друг друга производителям разных стран, т. к. вместо сложного, длинного и зачастую малопонятного определения цвета вводятся определенные буквы и цифры. Стандартизация цветовой гаммы включает оттенок, яркость и интенсивность.

Первое появление РАЛ
РАЛ был впервые разработан немецким Государственным комитетом по условиям поставок. В соответствии с ним все цвета были разделены на диапазоны, определенный цвет получил однозначный цифровой индекс. С тех пор эта компания (Reichsausschuß für Lieferbedingungen und Gütesicherung) постоянно занимается разработкой и введением дополнительных цветов, как этого требует рынок. Пояснения, которые дополнительно при этом даются, устанавливают полную ясность в вопросах цвета, необходимую многим отраслям производства. Разработанная РАЛ универсальная система обозначения цветов является языком коммуникации во многих промышленных областях для уточнения цветовых оттенков и их интенсивности.
Шкалы РАЛ в мире сегодня
RAL CLASSIC, RAL Design, RAL Digital, RAL Effect, RAL Plastics, RAL Books - на сегодня в мире используется несколько шкал (цветовых коллекций).
Что такое РАЛ сейчас? Новейший стандарт RAL включает в себя множество цветов и оттенков. В таблице приведены лишь наиболее часто используемые цвета. Таблица носит только справочный характер, так как отображаемые цвета могут отличаться от настоящих цветов из каталога RAL.
Шкала RAL CLASSIC

Шкала RAL Design
Год появления этой шкалы – 1993-й. Изначально шкала включала 1688 оттенков, в дальнейшем была ограничена 1625 оттенками. Шкала систематизирована для профессионалов, занимающихся дизайном. Ее разработчиками учитывались тон, яркость и степень цветовой насыщенности, упрощался подбор цветов-партнеров для различных цветовых гамм. Нумеровались цвета в соответствии со значениями оттенка (принимались во внимание также яркость и насыщенность) семизначными номерами. В 2017 году появилась новая палитра - RAL Design, состоящая из 1625 единиц оттенков цвета.

RAL Digital
RAL Digital это дополнительная версия раскладок. Она используется дизайнерами при работе с программами, включающими и системы автоматического проектирования. Эта программная версия дает доступ к названиям оттенков и цветов из коллекций Classic, Effect и Design.
В 2015 году в линейке RAL Digital было представлено новейшее считывающее устройство (колориметр), способное определять цвета практически с любой поверхности и подбирать необходимый оттенок в каталогах RAL. Колориметр имеет еще целый ряд вспомогательных деталей и устройств, среди которых цифровая лупа и множество других важных сегодня функций промышленной колориметрии.
RAL Effect
Чтобы удовлетворить потребности промышленности, РАЛ в 2007 году выпустил дополнительную коллекцию из матовых и глянцевых оттенков, 420 и 70 единиц соответственно. Первые предназначены для красок на водной основе, вторые – для красок металлизированных покрытий. Нумерация включает три цифры тона и букву М для металликов и Х для водоэмульсионных красок.

RAL Plastics
Специально для пластмассовых изделий RAL выпустил основанный на классической версии цветов новый стандарт-каталог. Он включает 100 самых востребованных цветов классического дизайна, выполненных в полипропиленовых прямоугольных эталонах.
RAL Books
Специалисты компании РАЛ совместно с бюро Global Color Research (Великобритания) составляют ежегодники для профессиональных дизайнеров, которые включают наборы согласованных цветовых соотношений из полнейшей шкалы цветов всех РАЛ-коллекций.
В каждой коллекции используется 32 цвета в разных сочетаниях. Полная коллекция включает альбом, подвижный цветовой веер и СД-диск.
Таблица цветов в соответствии с RAL Classic в стандартной сортировке по цветным группам отмеченна лидирующей позицией (1000 с = желтые тона, 2000 с = оранжевые тона, 3000 с = красные и т. Д.).
Так, компания РАЛ удовлетворяет актуальные запросы промышленного рынка по определению цветовых стандартов и их согласованных сочетаний.
Технические характеристики таблиц и терминология
Цвета, связанные с системой RAL, в официальном использовании могут называться по-разному.
- Лимонно-желтый: RAL 1018 - цинково-желтый для телекоммуникационной команды.
- Золотисто-желтый: RAL 1028 - желтая дыня для армейского разведывательного отряда.
- Малиновый: RAL 3027 - малиново-красный для воротника и полосок офицерского цвета в Генеральном штабе.
- Бордо красный: RAL 4004 - бордо фиолетовый для оборонительного подразделения.
- Средний синий: RAL 5010 - синий цвет для армейского подразделения логистики.
- Темно-синий: RAL 5013 - кобальтово-синий для медицинского обслуживания.
- Зеленый охотник: RAL 6029 - зеленый мятный цвет для охотников: отряда охотников, отряда десантников, отряда горных охотников и отряда танковой гренадерской армии.
- Светло-серый: RAL 7037 - пыльно-серый для армейских авиационных войск.
- Белый: RAL 9010 - чистый белый для военной музыкальной службы.
- Черный: RAL 9011 - графитовый черный для пионерской группы.
Читайте также:


