Ревматические пороки сердца при эхо-кг
Во время систолы движения створок аортального клапана в норме выглядят в виде "коробочки"; во время диастолы - в виде прямой линии; расхождение створок аортального клапана при систоле 1,8-2 см.
Характерные симптомы сердечных пороков:
- недостаточность аортального клапана:
- несмыкание створок клапана в диастолу;
- снижение скорости диагностического прикрытия передней створки митрального клапана;
- значительная дилатация полости левого желудочка;
- увеличение толщины стенки левого желудочка и межжелудочковой перегородки;
- в систолу и диастолу увеличение амплитуды и скорости движения задней стенки левого желудочка и межжелудочковой перегородки.
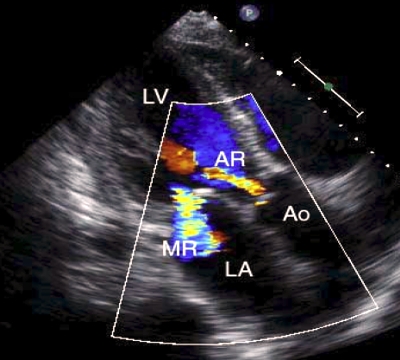
![]()
Рис. ЭхоКГ недостаточности аортального клапана. - стеноз устья аорты:
- более интенсивное отражение сигнала от створок, степень их расхождения снижается;
- утолщение створок клапана;
- явное снижение амплитуды расхождения створок клапана во время систолы;
- добавочный эхо-сигнал между передней створкой митрального клапана и межжелудочковой перегородкой, заметное расширение восходящей аорты, говорят в пользу выраженного дегенеративного перерождения створки клапана с возможным ее отрывом;
- застойные явления в малом круге кровообращения с увеличением левого предсердия, после чего начинают увеличиваться и правые отделы, наблюдаются на поздних стадиях патологии.
- сочетанного аортальный порок (плюс к описанным выше признакам):
- выраженное увеличение объема левого желудочка в систолу и диастолу;
- увеличение толщины стенки левого желудочка и массы миокарда;
- умеренное снижение ударного объема и фракции выброса.
- атеросклеротическое поражение аорты:
- расширение просвета аорты;
- утолщение стенки аорты.
- аневризма аорты:
- резкое увеличение диаметра аорты при смещении датчика вверх и медиально от уровня аортального клапана;
- парадоксальное выпячивание стенки аорты вкупе с диффузным снижением амплитуды ее движения в области аневризмы;
- расслаивающая аневризма характеризуется удвоением одной (обеих) стенок сосуда с формированием истинного и ложного просвета, при этом ложная стенка аорты, которая находится внутри просвета, тоньше истинной и амплитуда ее движения меньше.
- недостаточность митрального клапана:
- несмыкание его створок в систолу;
- увеличение левого предсердия с повышением амплитуды сокращения его стенки;
- дилатация полости левого желудочка с повышением сокращения его задней стенки и межжелудочковой перегородки;
- гипертрофия миокарда левого желудочка;
- возрастание ударного объема.
- стеноз митрального клапана:
- кровоток из левого предсердия в желудочек приобретает линейный характер;
- в конце диастолы фиксируется явное снижение амплитуды пика А;
- между скоростью прикрытия передней створки митрального клапана и степенью стенозирования левого АВ-узла существует корреляция;
- задняя створка митрального клапана движется в одном направлении с передней (в норме они движутся противоположно);
- с увеличением фиброза и кальциноза отражение створок становится все более утолщенным, интенсивным и слоистым; ударный объем умеренно снижен, фракция выброса на нижней границе нормы; переднезадний размер левого предсердия резко увеличивается; объем левого желудочка в норме; диаметр аорты при стенозе левого АВ-отверстия в норме; в систолу створки митрального клапана сомкнуты, но отражение от них явно утолщено; в диастолу степень расхождения створок клапана заментно снижается.
- стеноз правого АВ-отверстия:
- значительное снижение скорости диастолического прикрытия передней створки трикуспидального клапана;
- отсутствие (резкое снижение) амплитуды амплитуды передней волны;
- движение задней створки в одном направлении с передней.
- ревматическое поражение трикуспидального клапана:
- значительное утолщение от створок ТК;
- отчетливое изменение конфигурации кривой при язвенной деформации.
- трикуспидальная недостаточность:
- значительное увеличение правых отделов сердца;
- расширение правого предсердия в момент систолы желудочка.
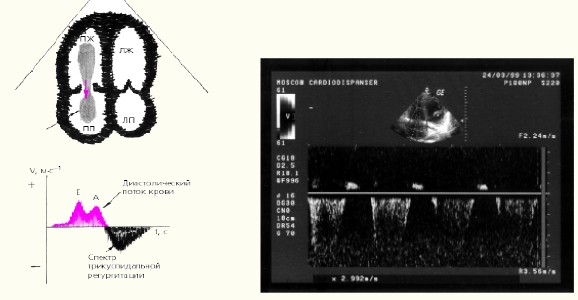
Рис. ЭхоКГ недостаточности трикуспидального клапана.
Ревматическое поражение сердца прежде всего отражается на изменения митрального клапана (МК). Как это уже указывалось ранее, ревматизм часто является причиной органической клапанной митральной недостаточности. На эхокардиографии (ЭхоКГ) ревматические изменения клапана проявляются сочетанием признаков утолщения и склерозирования митральных створок. Неплотное смыкание деформированных створок МК сопровождается митральной недостаточностью разной степени выраженности – от минимальной до тяжелой. При этом растяжение фиброзного митрального кольца еще более усугубляет недостаточность МК. Дисфункция папиллярных мышц может усугублять выраженность митральной недостаточности. При ревматическом поражении сердца они часто утолщаются, укорачиваются и становятся малоподвижными.
Полость левого желудочка дилатируется, а хорды, идущие к створкам МК при ревматизме, укорачиваются. Это еще больше нарушает герметичность смыкания в систолу утолщенных митральных створок. Эхокардиографическое исследование у больных с ревматической митральной недостаточностью демонстрирует также такие косвенные ЭхоКГ признаки порока, как расширение полости левого желудочка и левого предсердия, увеличение амплитуды движения стенок желудочка и МЖП, что отражает перегрузку его объемом. Следует учитывать, что при острой митральной недостаточности косвенные ее признаки в виде дилатации ЛЖ и ЛП могут быть неотчетливыми на эхокардиографии.
Допплер ЭхоКГ диагностика митральной недостаточности при ревматизме
Допплер эхокардиографическое исследование в цветном, импульсном и непрерывно-волновом режимах позволяет наглядно продемонстрировать митральную недостаточность в цветовом изображении и в виде спектральной допплеровской кривой, а также оценить степень тяжести клапанной регургитации. При митральной недостаточности, развивающейся вследствие несмыкания передней створки клапана из-за ревматизма, поток крови в ЛП обычно становится направленным к боковой стенке предсердия. При деформации задней створки клапана митральный регургитационный поток чаще бывает направленным в сторону межпредсердной перегородки. При поражении обеих митральных створок струя регургитации скорее всего будет ориентирована по центру левого предсердия.
Наиболее частыми причинами митрального стеноза являются ревматическое поражение митрального клапана и кальциноз клапана у пожилых людей. Эта патология редко развивается при системной красной волчанке и также редко встречается в сочетании с дефектом межпредсердной перегородки (синдром Лютембаше). После острого ревмокардита до появления первых признаков митрального стеноза обычно проходит не менее двух-трех лет. Анатомические изменения при ревматическом митральном стенозе включают сращивание комиссур между передней и задней створками клапана и укорочение митральных хорд. В результате фиброза створок и нарушения их подвижности уменьшается активная площадь митрального отверстия, возникает обструкция диастолическому кровотоку из ЛП в ЛЖ, нарушается наполнение ЛЖ. Нормальная площадь МК у взрослых лиц составляет 4 см кв. Необходимо учитывать, что сужение митрального отверстия до 2 см кв. не вызывает существенных нарушений гемодинамики, и лишь при дальнейшем прогрессировании порока он становится гемодинамически значимым.
С момента появления и внедрения в практику метода эхокардиографии его информативность в диагностике митрального стеноза при ревматизме завоевала у специалистов всеобщее и безоговорочное признание. Вследствие сращения и неполного раскрытия створок МК при его стенозе нарушается диастолическая траектория движения створок клапана на ЭхоКГ. Значительно снижается или полностью исчезает регистрируемое в норме позднее диастолическое раскрытие передней створки МК, что является следствием сокращения ЛП. Это документируется на M-ЭхоКГ снижением амплитуды или исчезновением предсердного пика А, из-за чего Двухмерная ЭхоКГ при митральном стенозе обнаруживает увеличение левого предсердия, небольшой левый желудочек, куполообразное диастолическое выбухание передней митральной створки. В начале диастолы, с момента наполнения левого желудочка передняя створка МК прогибается к МЖП, а ее сечение по форме становится похожим на хоккейную клюшку. Вследствие комиссуральных сращений передняя митральная створка подтягивает в том же направлении заднюю створку клапана в полости ЛЖ.
Структурные изменения МК при ревматизме, утолщение его хорд и атриомегалия обычно отчетливо видны на двухмерной ЭхоКГ, зарегистрированной из парастернального подхода в сечениях по длинной и короткой осям левого желудочка. Эти признаки можно также увидеть при ЭхоКГ исследовании из верхушечного и субкостального доступов. Как известно, митральный стеноз часто осложняется нарушениями ритма сердца, в частности, мерцательной аритмией. Сочетание мерцания ЛП и увеличения его размеров при митральном стенозе создает благоприятные условия для тромбообразования в ЛП.
Следует отметить, что при тяжелом кальцинозе митральных створок, после проведения операции комиссуротомии и балонной вальвулопластики результаты планиметрического определения площади митрального отверстия могут быть искаженными из-за нечеткости регистрации внутренних контуров митрального отверстия на двумерных ЭхоКГ изображениях.
В суммированном виде ЭхоКГ признаки митрального стеноза по данным одно- и двухмерного исследований включают:
Как указывалось выше, причиной митрального клапанного стеноза может быть кальциноз структур клапана у пациентов в преклонном возрасте. Диффузный кальциноз структур митрального клапанного аппарата сердца может иногда вызывать весьма значительное сужение митрального отверстия. Среди других причин, способных вызывать обструктивные нарушения характера диастолического митрального кровотока, следует также отметить сужение приносящего тракта левого желудочка, обусловленное, например, так называемым парашютным митральным клапаном при наличии единственной папиллярной мышцы, трехпредсердным сердцем, миксомой левого предсердия.
При обнаружении у больного РА митрального стеноза всегда необходимо исключать его ревматическую этиологию, так как сочетание РА с предшествующим ревматическим пороком признается многими авторами. Патогмоничным признаком ревматоидного артрита являются рев
Ревматоидный артрит (РА) — хроническое системное воспалительное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу симметричного эрозивно-деструктивного полиартрита с частыми внесуставными проявлениями, среди которых поражение сердца, по данным вскрытия, отмечается в 50-60% случаев [1, 4, 7]. Изменения в сердце при РА в недавнем прошлом выделяли в суставно-сердечную форму заболевания. При поражении суставов, когда заметно снижается физическая активность, сердечная патология часто маскируется, что требует от врача более внимательного и тщательного обследования больного. При этом клинические изменения со стороны сердца, как правило, минимальные и редко выходят на первый план в общей картине основной болезни. Системные проявления РА, в том числе и поражение сердца, определяют прогноз в целом, поэтому важно их раннее распознавание и целенаправленное лечение.
 |
| Рисунок 1. Интерстициальный миокардит, умеренный васкулит. Окр. гематоксилином и эозином. Х 150 |
Частота поражения миокарда при РА в форме миокардита не выяснена. Это обусловлено, с одной стороны, трудностью диагностики миокардита у лиц с ограниченной двигательной активностью, с другой — отставанием клинических проявлений от морфологических изменений сердца [6, 7]. Патология миокарда носит полиморфный характер в связи с наличием различной давности сосудистых поражений [7]. В одних сосудах имеется васкулит, в других — гиалиноз, в третьих — склероз. Характер васкулита может быть пролиферативным и редко пролиферативно-деструктивным. В воспалительном инфильтрате преобладают лимфогистиоцитарные элементы как в периваскулярном пространстве (рис. 1), так и в стенке сосудов. Следует отметить, что при активации основного процесса наблюдается сочетание старых и свежих сосудистых изменений. Наряду с этим встречается очаговый, или диффузный, интерстициальный миокардит, заканчивающийся развитием мелкоочагового кардиосклероза. У больных ревматоидным артритом нередко развивается бурая атрофия миокарда с накоплением липофусцина в кардиомиоцитах (рис. 2). Эти изменения могут являться причиной стенокардии. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца. В исходе узелка развивается склероз, вызывающий формирование недостаточности клапанов. Миокардит проявляется и диагностируется, как правило, на высоте активности основного ревматоидного процесса, то есть при очередном выраженном обострении суставного синдрома.
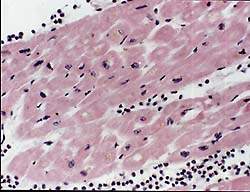 |
| Рисунок 2. Интерстициальный миокардит. Отложения липофусцина в перинуклеарных пространствах. Окр. гематоксилином и эозином. Х 400 |
Ведущей жалобой при миокардите в дебюте поражения сердца являются неприятные ощущения в области сердца (кардиалгии), невыраженные, длительные, разлитые и без четкой локализации, как правило, без иррадиации и не купирующиеся нитратами. К основным жалобам относятся сердцебиение, перебои и реже одышка при физической нагрузке. Быструю утомляемость, повышенную потливость и субфебрилитет врачи обычно связывают с очередным обострением РА, а не с кардиальной патологией [3].
При аускультации физикальные данные выявляют тахикардию и ослабление I тона с систолическим шумом, нередко удается выслушать III тон. Как правило, миокардит при РА не склонен к прогрессированию, признаки сердечной недостаточности отсутствуют [4].
При обычном ЭКГ-исследовании могут отмечаться снижение зубцов Т, опущение интервалов ST, небольшие нарушения внутрижелудочковой проводимости. Эти изменения неспецифичны и могут сопровождать различные заболевания. Более характерное для миокардитов замедление атриовентрикулярной проводимости бывает редко.
В литературе описано значительное число наблюдений, когда нарушение ритма сердца служит единственным патологическим симптомом поражения коронарных артерий. Нарушение ритма и проводимости при активном РА существенно чаще определяется при суточном мониторировании ЭКГ и чреспищеводном электрофизиологическом исследовании, чем при обычной ЭКГ. Так,
И. Б. Виноградова [2] при исследовании больных РА с использованием вышеуказанной методики выявила нарушение ритма и проводимости у 60% больных, в том числе предсердную (18%) и желудочковую (10%) экстрасистолию, пароксизмальную тахикардию (4%), мерцательную аритмию (6%), проходящую блокаду правой ножки пучка Гиса (20%) и атриовентрикулярную блокаду II степени (2%). Также было высказано предположение, что депрессия ST, выявляемая при чреспищеводном электрофизиологическом исследовании, является косвенным признаком изменения коронарной микроциркуляции вследствие ревматоидного васкулита. Поэтому у данных больных отмечены высокие уровни циркулирующих иммунных комплексов, ревматоидного фактора, антител к кардиолипину Ig M. Важно отметить, что в этой же группе больных имелись другие признаки васкулита: дигитальный артериит, сетчатое ливедо, синдром Рейно и ревматоидные узелки. Следовательно, если рутинные клинические методы исследования не выявляют достаточно убедительных признаков ревматоидного миокардита, то современные электрофизиологические исследования обнаруживают факты нарушений функции сердца, что указывает на связь этих изменений с активностью ревматоидного процесса. Подтверждением этому может служить положительная динамика изменений под влиянием адекватного лечения основного заболевания, обычно отмечаемая при регрессе суставного синдрома.
Дифференциальная диагностика миокардита и миокардиодистрофии, нередко проводящаяся у больных РА, длительно получающих массивную лекарственную терапию, затруднена, т. к. клинические проявления в том и другом случае близки [5, 6]. Наличие миокардита подтвердит положительная динамика его проявлений под влиянием правильно подобранного и назначаемого в адекватных дозах противоревматического лечения.
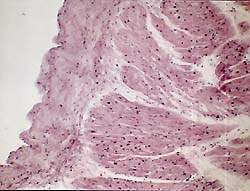 |
| Рисунок 3. Утолщение перикарда. Склероз. Окр. гематоксилином и эозином. Х 150 |
Перикардит является наиболее характерным поражением сердца при РА [1]. Патологоанатомически он выявляется в подавляющем большинстве случаев в виде фиброзного, реже геморрагического перикардита; нередко обнаружение характерных ревматических гранулем. Отличительной особенностью перикардита при ревматоидном артрите является участие в воспалении крупных базофильных гистиоцитов под зоной фибринозных наложений. Глубже формируется грануляционная ткань, содержащая лимфоциты и плазматические клетки, с утолщением перикарда и формированием грубого склероза (рис. 3).
Больной может предъявлять жалобы на боли в области сердца разной интенсивности и длительности. Частота клинической диагностики перикардита различна (20-40%) и зависит в основном от тщательности клинического изучения больного и уровня компетентности клинициста. В большинстве случаев анатомически определяются спайки в полости перикарда и утолщение последнего за счет склеротического процессса, нередко рецидивирующего. Выпот обычно небольшой, без признаков тампонады. Подтверждается, как правило, данными рентгенологического исследования, указывающими на нечеткость и неровность контуров сердца. Шумы трения перикарда непостоянны, выслушиваются далеко не у всех больных, хотя в некоторых случаях остаются длительно в виде перикардиальных щелчков в различные фазы сердечного цикла, что фиксируется качественным ФКГ-исследованием. ЭКГ-изменения у большинства больных неспецифичны для перикардита. Но в случае появления даже умеренного экссудата можно наблюдать снижение вольтажа QRS с положительной динамикой при уменьшении выпота. Перикардиты при РА склонны к рецидивированию. В части случаев перикардиты сопровождаются появлением конкордантных отрицательных зубцов Т на многих ЭКГ-отведениях, что может приводить к постановке ошибочного диагноза инфаркта миокарда. Большое значение в обнаружении РА-перикардитов имеет эхокардиография, позволяющая выявлять изменения перикарда (его уплотнение, утолщение, наличие жидкости) и динамику этих изменений при повторных исследованиях. Во многих случаях ЭХО-изменения перикардита являются неожиданной находкой как для больного, так и для лечащего врача [8].
Эндокардит при РА отмечается значительно реже, чем перикардит. Патологоанатомические данные свидетельствуют о нередком вовлечении в процесс эндокарда, в том числе клапанного, в виде неспецифических воспалительных изменений в створках и клапанном кольце, а также специфических гранулем. У большинства больных вальвулит протекает благоприятно, не приводит к значительной деформации створок и не имеет ярких клинических проявлений. Однако у некоторых больных течение вальвулита может осложняться деформацией створок и сопровождаться выраженной недостаточностью пораженного клапана, чаще митрального, что диктует необходимость хирургической коррекции порока. Обычно эндокардит сочетается с миокардитом и перикардитом. В литературе обсуждается возможность образования стенозов митрального и аортального клапанов, но единого мнения по этому вопросу нет [6]. При обнаружении у больного РА митрального стеноза всегда необходимо исключать ревматическую этиологию его, т. к. сочетание РА с предшествующим ревматическим пороком признается многими авторами [4].
С целью изучения характера клапанной патологии сердца при РА проанализированы результаты лечения 297 больных с достоверным РА по критериям АРА. Анализ показал, что чаще всего — в 61,6% случаев — имеет место митральная регургитация. При этом у 17,2% больных она была умеренной или выраженной. У 152 (51,2%) больных полипроекционное ЭХО-КГ-исследование структурных изменений створок клапанов не выявило. Более детальный анализ позволил выделить в отдельную группу 14 больных, которые имели в анамнезе ревматизм и ревматический порок сердца. РА эти больные заболели за 1–24 года до исследования (в среднем через 8,9 года). 7 человек из них имели характерные признаки ревматического митрального стеноза (у 3 — выраженного) в сочетании с митральной регургитацией разной выраженности и признаки аортального порока, который у 1 больной был диагностирован как сочетанный. У 2 больных митральный порок был в виде умеренной митральной недостаточности и комбинировался с недостаточностью аортального клапана. У 3 больных выявлены признаки ревматической недостаточности митрального клапана. У 2 больных отмечался выраженный сочетанный аортальный порок в комбинации с относительной недостаточностью митрального клапана.
Таким образом, наши данные подтверждают возможность заболевания РА лиц, ранее болевших ревматизмом и имеющих ревматические пороки сердца.
В отдельную группу были выделены 38 больных (средний возраст 58,7 года, давность РА 12,8 года) с наличием структурных изменений клапанного аппарата сердца в виде тотального краевого утолщения створок или отдельных очагов утолщения, нередко достигающих больших величин (13х6 мм), признаков кальциноза и ограничения подвижности створок. Створки митрального кольца оказались измененными у 19, аортального — у 33, трикуспидального — у 1 больной, причем у 16 пациентов были сочетанные изменения митрального и аортального клапанов, у 1 — митрального и трикуспидального. У 17 из 19 больных структурные изменения митральных створок сопровождались митральной регургитацией.
У 17 из 33 больных с изменениями аортальных створок диагностировалась аортальная регургитация, при этом у 12 она была умеренной или выраженной. У 16 больных, в том числе у 2 с признаками кальциноза, имел место склероз аортальных створок без нарушения функции клапана, что нашло свое подтверждение и неизмененным трансаортальным кровотоком. У 1 больной со значительным утолщением створок и умеренной аортальной регургитацией имелось ограничение открытия их (1-2 см) и повышение трансаортального градиента давления, т. е. признаки аортального стеноза. И еще у 1 больной 33-летнего возраста был диагностирован врожденный двухстворчатый аортальный клапан с признаками умеренной аортальной регургитации. Выраженная трикуспидальная регургитация была диагностирована у 3 больных с очаговым утолщением трикуспидальных створок, причем у 1 из них было диагностировано легочное сердце как осложнение ревматоидного поражения легких.
Возникает вопрос: все ли обнаруженные изменения у этой группы, состоящей из 33 больных, являются следствием РА? Анализ наших данных показал, что большинство больных этой группы были в возрасте 51–74 лет. У 19 из них диагностировалась артериальная гипертензия, имелись признаки ишемической болезни сердца, 4 больных перенесли инфаркт миокарда, 1 — острое нарушение мозгового кровообращения. Результаты исследования показали, что у лиц с высокими цифрами артериального давления изменения клапанного аппарата были более выраженными, и только у них диагностировался кальциноз митрального клапана и/или аортального клапана, признаки аортальной регургитации, гипертрофия стенки левого желудочка и межжелудочковой перегородки, а также утолщение стенок аорты с признаками дилятации и диастолическая дисфункция левого желудочка. Выявленные ЭХО-КГ-изменения в этой группе больных не отличаются от таковых при атеросклеротическом кардиосклерозе, атеросклерозе аорты и являются классическими. Поэтому в этой группе больных не представляется возможным исключить атеросклеротический генез пороков сердца. Вместе с тем вполне вероятно, что собственно ревматоидное поражение клапанов может служить тем благоприятным фоном, на котором в дальнейшем развиваются выраженные структурные изменения створок, патология которых доминирует как в клинической, так и в ЭХО-КГ-картине атеросклеротического поражения клапанов сердца. В каждом случае вопрос о генезе порока при РА требует учета всех имеющихся клинических данных.
1. Балабанова Р. М. Ревматоидный артрит. В кн.: Ревматические болезни (руководство по внутренним болезням)/ Под ред. В. А. Насоновой и Н. В. Бунчука. — М.: Медицина, 1997. С. 257-295.
2. Виноградова И. Б. Нарушение сердечного ритма и проводимости у больных ревматоидным артритом// Автореф. дис. . канд. мед. наук. М., 1998. С. 21.
3. Елисеев О. М. Амилоидоз сердца// Тер. арх. 1980. № 12. С. 116-121.
4. Котельникова Г. П. Поражение сердца при ревматоидном артрите// В сб.: Ревматоидный артрит. — М.: Медицина, 1983. С. 89-90.
5. Котельникова Г. П., Лукина Г. В., Муравьев Ю. В. Кардиальная патология при вторичном амилоидозе у больных ревматическими заболеваниями// Клин. ревматол. 1993. № 2. С. 5-8.
6. Немчинов Е. Н., Каневская М. З., Чичасова Н. В. и др. Пороки сердца у больных ревматоидным артритом (результаты многолетнего проспективного клинико-эхокардиографического исследования)// Тер. арх. 1994. № 5. С. 33-37.
7. Раденска-Лоповок С. Г. Морфологические методы исследования и диагностики в ревматологии В кн.: Ревматические болезни (руководство по внутренним болезням) под ред. В. А. Насоновой и Н. В. Бунчука. М.: Медицина, 1997. С. 80-94.
8. Цурко В.В. Асептический некроз головок бедренных костей при ревматоидном артрите и системной красной волчанке. Клинико-инструментальная диагностика и исходы: Автореф. дис. . д-ра мед. наук. М., 1997. С. 50

Ревматический порок сердца – это группа приобретенных хронических дегенеративных заболеваний сердечных клапанов, характеризующаяся прогрессирующим поствоспалительным фиброзом и разрушением клапанных створок.
Болезнь развивается в течение 1-3 лет с момента перенесения острой ревматической лихорадки. Частота встречаемости – 2 случая на 100 000 населения.
Что это такое?
В первую очередь ревматические пороки сердца сопровождаются гемодинамическими значимыми нарушениями сердечных клапанов — аортального, митрального или трикуспидального. Вторичным признаком считаются изменения в камерах сердца. Аутоиммунные антитела — причина нарушения соединительной ткани створок в клапанах.
После такой дезорганизации створки клапана уже не в состоянии закрыть клапанное отверстие. Усиленный ток крови в систолу увеличивает левое предсердие, что приводит к застою крови сначала в малом, далее в большом круге кровообращения.
Среди взрослых такие пороки распространены у женщин 40–60 лет, чуть меньший показатель заболеваемости у мужчин того же возраста. Чаще же ревматизм проявляется у детей от 6 до 16 лет.
Здесь большое значение имеет наследственная и конституциональная предрасположенность к заболеванию. Ревматизм у детей имеет инфекционно-аллергическую природу, он невозможен без предшествующей стрептококковой инфекции (фарингита, скарлатины, ангины).
Больше полезного о ревматическом пороке сердца узнайте из видео Елены Малышевой:
Осложнением каких заболеваний выступает ревматизм, провоцирующий пороки сердца?
Ревматизм — это осложнение острых инфекционных заболеваний горла, кожи, почек и других органов, вызываемых бета-гемолитическим стрептококком группы А.
| Причинное заболевание | Частота, % |
| Тонзиллит (ангина) | 33 |
| Острый гломерулонефрит | 23 |
| Рожистое воспаление кожи | 7 |
| Стрептодермия | 7 |
| Фарингит | 5.2 |
| Скарлатина | 3.3 |
| Менингит | 2.1 |
| Эндокардит | 1.3 |
| Пневмония | 1.2 |
К развитию пороков сердца при ревматизме приводят:
- Ревматический миокардит — воспаление мышечной оболочки сердца, чаще всего не приносящее серьезных осложнений.
- Ревматический эндокардит — воспалению подверглась внутренняя оболочка. Часто является причиной недостаточности митрального клапана.
- Ревматический перикардит — воспаляется внешняя оболочка. Характерен для тяжелого течения ревмокардита.
- Панкардит — наиболее сложный случай, при котором воспалены все слои сердца, и оно не в состоянии нормально сокращаться. Является причиной серьезных осложнения и нарушений кровообращения, а также может привести к остановке сердца.
Классификация, клиника и осложнения
Коды по МКБ-10
- I05.0 — стеноз;
- I05.1 — недостаточность;
- I05.2 — сочетанное поражение.
- I06.0 — стеноз;
- I06.1 — недостаточность;
- I06.2 — сочетанное поражение.
- I07.0 – стеноз;
- I07.1 — недостаточность;
- I07.2 — сочетанное поражение.
- I08.0 – аортально-митральный;
- I08.1 — митрально-трикуспидальный;
- I08.2 – аортально-трикуспидальный;
- I08.3 – аортально-митрально-трикуспидальный.
- I09.8 — поражение легочного клапана.
Частота встречаемостиу
| Митральный | 48.3% (70-85% больных — женщины) |
| Аортальный | 32.3% (60-75% больных — мужчины) |
| Трикуспидальный | 14.7% |
| Сочетанные пороки | 4.1% |
| Комбинированные | 2.8 % |
Преобладающее поражение митрального клапана связано с особенностями его анатомического строения. Клапан состоит из двух створок, поддерживаемых тонкими и растяжимыми волокнами (хордами). В момент сокращения желудочка кровь оказывает на хорды выраженное давление, что приводит к прогибанию створок (пролапсу).
Пролапс в большинстве случаев не имеет клинических проявлений, но является фактором задержки в этой области аутоиммунных комплексов, образующихся при ревматизме, что и вызывает более частое поражение митрального клапана.
Средний возраст развития патологии – 35-45 лет. При естественном течении болезни пятилетняя выживаемость составляет 50%.
Данное заболевание является приобретенным (полученным в течение жизни). У плода вследствие генетических мутаций могут развиться только врожденные аномалии, в образовании которых ревматизм принимает косвенное участие (если обнаруживается у беременной).
У плода ревматизм развиться не может благодаря наличию плацентарного барьера и отсутствию антител против стрептококка.
Методы диагностики
Как выявляются ревматические пороки сердца? Подтвердить ревматическую природу болезни позволяют:
- Опрос и изучение медицинской документации (наличие стрептококковой инфекции в анамнезе);
- Определение уровня антистрептолизина-О в крови (уровень АСЛ-О повышен);
- Выделение стрептококка из зева (мазок);
- Биопсия с последующей гистологией (в микропрепарате сердца выявляют иммунные комплексы).
Cначала врач проводит осмотр и опрос пациента. Обращают внимание на неестественную бледность кожи, доходящую в некоторых местах на лице до синюшности, одышку и отеки. Прослушивание сердца проводится для выявления аритмии и посторонних шумов, природу которых определяют дальнейшие исследования.
Опрос нужен для обозначения возможных причин ревматизма и следующих за ним пороков, больной рассказывает врачу о перенесенных инфекционных заболеваниях и болезнях близких родственников.
При подозрении на ревматические пороки врачи берут у пациента кровь на общий, биохимический и иммунологический анализ. Эти исследования информируют о наличии воспаления и инфекций в организме.
Среди инструментальных исследований самым простым является электрокардиограмма (ЭКГ), которая проверяет ритм сердца и выявляет вид аритмии, блокады, признаки ишемии. С помощью фонокардиографии (ФКГ) определяется наличие шумов в сердце и их отношение к порокам. Размеры сердца проверяют с помощью рентгена грудной клетки.

Главным обследованием, благодаря которому зачастую подтверждается или опровергается гипотеза о наличии порока, является эхокардиограмма (ЭхоКГ, по-другому — УЗИ сердца).
С помощью него диагностируют понижение сократительной способности сердца и нарушения в его структуре.
Большинство методов диагностики могут проводиться на первичном осмотре, когда диагноз еще не подтвержден, или же в диспансерных группах при уже обнаруженном ревматическом пороке.
Применяемые схемы лечения
Консервативное (нехирургическое) лечение направлено на снижение риска осложнений ревматизма, а также на коррекцию сердечного ритма и профилактику недостаточности. Принимать меры рекомендуется сразу же после обнаружения ревматизма. В лихорадочный период больной лечится стационарно, необходим строгий постельный режим.
Прописываются антибактериальные и противовоспалительные препараты. После последней ревматической атаки проводится обязательная профилактика рецидивов в течение следующих пяти лет.
Все пациенты с приобретенными пороками направляются на прием к кардиохирургу, который определяет актуальные сроки для хирургического вмешательства.
Больным со стенозом делается комиссуротомия, сопровождающаяся разъединением створок клапана — это обеспечивает нормальный ток крови. При недостаточности операция сводится к протезированию пораженных клапанов. Сочетанный порок лечится заменой поврежденного клапана на искусственный, изредка вместо этого делают протезирование вместе с комиссуротомией.
Знание причин развития гранулематоза Вегенера — опасного и трудноизлечимого васкулита — поможет предохранить себя от факторов риска.
Последствия
- Мерцательная аритмия;
- Трепетание и фибрилляция желудочков;
- Острая лево- или правожелудочковая недостаточность;
- Хроническая сердечная недостаточность;
- Отек легких.
Меры первичной и вторичной профилактики при стрептококковых заболеваниях
Своевременные профилактические мероприятия позволяют предупредить развитие ревматизма и поражение сердца.
- Гигиена и закаливание;
- Санация очагов инфекции (лечение ангины, рожистого воспаления и других стрептококковых инфекций) препаратами пенициллинов, макролидов;
- Ежегодные врачебные осмотры со взятием мазком на определение стрептококка.
Вторичная профилактика показана людям с перенесенной инфекцией и проводится с помощью антибиотиков пенициллинового ряда (бициллинопрофилактика):
- Экстенциллин 2,4 млн ЕД внутримышечно;
- Бензатин-бензилпенициллин – 0.6-2.4 млн ЕД внутримышечно.
Незначительные преобразования в клапанном аппарате без нарушений в миокарде поначалу остаются в фазе компенсации и не отражаются на трудоспособности больного. Переход в фазу декомпенсации и прогнозы определяются многими обстоятельствами: инфекциями, перенапряжением, повторными атаками, беременностью и родами. Усиливающиеся поражения клапанов — причина развития недостаточности, а наиболее острая декомпенсация часто приводит к летальному исходу.
Условно положительный прогноз в большинстве случаев возможен только при условии качественного хирургического лечения. При этом нередко полностью излечиваются изменения гемодинамики.
При ревматических пороках рекомендуется отказаться от вредных привычек и стараться уменьшить физическую активность, соблюдать особую диету, заниматься лечебной физкультурой и проходить курсы лечения на кардиологических курортах.
Сердце — один из главных органов человека, и даже небольшие нарушения его работы приводят к серьезным последствиям. Ревматизм и сопровождающие его пороки сердца могут развиться неожиданно, после перенесенных инфекционных заболеваний, но в наибольшей группе риска — люди, расположенные к кардиологическим заболеваниям генетически.
Чтобы избежать осложнений, нужно своевременно обратиться к врачу при первых подозрениях. Современные методы диагностики и лечения позволяют частично или полностью избавиться от приобретенного ревматического порока.
Читайте также: