Серологические методы диагностики и мониторинга дифтерийной инфекции
1.1. В методических рекомендациях (далее - МР) представлена рациональная и эффективная тактика использования серологических методов диагностики и мониторинга иммунитета к дифтерийной инфекции.
1.2. В настоящих МР описаны используемые в последние годы международные и отечественные методы определения противодифтерийных антител, а также предложен наиболее надежный и перспективный метод иммуноферментного анализа (далее - ИФА) для определения суммарных и высокоавидных антител, его стандартное применение, в том числе предложены надежные критерии оценки защитных уровней, необходимые для выявления среди детей и взрослых групп повышенного риска и оценки напряженности индивидуального и коллективного иммунитета к дифтерийной инфекции.
1.3. Настоящие МР предназначены для врачей-эпидемиологов и микробиологов и носят рекомендательный характер.
2.1. Несмотря на высокие показатели привитости населения от дифтерии в разных регионах России периодически регистрируются случаи заболевания дифтерией или носительства Corynebacterium diphtheria, особенно среди лиц в закрытых коллективах [3, 4, 8].
2.2. В настоящее время, спустя 15 лет после прошедшей эпидемии дифтерии, повсеместно отмечается снижение внимания клиницистов к этой инфекции. Профилактические и диагностические обследования проводятся, но не в полном объеме [12].
2.3. Как известно, защищенность от дифтерии в нашей стране определяется с помощью реакции прямой гемагглютинации (РПГА) [13]. Однако результат реакции, выражаемый в титрах, не позволяет точно определить количество антитоксических антител (АТ-АТ), а, значит, и оценить состояние иммунитета против дифтерии. Разработка и повсеместное внедрение в практику оценочной шкалы защищенности от дифтерии на основании определения количества АТ-АТ позволили контролировать качество вакцинации 1 [14]. Однако информация о количестве вырабатываемых противодифтерийных антител не всегда дает достоверный ответ на вопрос о степени защищенности от дифтерии. Это было продемонстрировано во время последней эпидемии дифтерии в России и после нее, когда у заболевших (до 40 % случаев) находили в крови АТ-АТ зашитых уровней [9, 10]. Проведенными исследованиями установлена определяющая роль высокоавидных АТ-АТ в защите от дифтерии, которые могут быть определены наряду с количеством суммарных АТ-АТ в иммуноферментном анализе [2, 5, 6, 16]. При этом была показана динамика формирования и утраты АТ-АТ, равно как и показателя их авидности, изучены особенности специфического иммунитета к дифтерии среди различных групп населения [1, 7, 11, 15]. Тем не менее, отсутствие программ и схем исследования при диагностике дифтерии и изучении напряженности иммунитета у населения, содержащих новые аргументированные данные, не позволяют полноценно и качественно проводить бактериологический и иммунологический контроль в отношении защищенности к дифтерии на местах.
0,01 МЕ/мл - минимальная степень защиты,
0,01 - 0,09 МЕ/мл - некоторая степень защиты,
0,1 - 0,9 МЕ/мл - защитный уровень антител,
1,0 и > МЕ/мл - стойкая длительная невосприимчивость к дифтерии.
3.2. Список оборудования и материалов, необходимых для проведения исследования, представлен в прилож. 1.
4.1. Серологический контроль состояния иммунитета
у детей и подростков
4.1.1. Серологический контроль иммунитета в различных группах позволяет представить иммунологическую структуру населения и выявить группы повышенного риска, определить состояние вакцинального иммунитета как в ранние, так и в отдаленные сроки после вакцинации.
4.1.2. Серологический контроль состояния и длительности сохранения вакцинального иммунитета необходимо осуществлять систематически методом выборочного серологического обследования (мониторинга) различных групп населения в городах и сельских районах каждой области, края.
4.1.3. Обследованию подлежат привитые против дифтерии дети и подростки от 3 до 18 лет каждой возрастной группы (3 года, 4 года, 5 лет и т.д., особое внимание следует обратить на детей 9 - 13 лет).
4.1.4. Серологический контроль следует проводить, начиная с групп детей 3 лет не ранее, чем через 6 месяцев после последней прививки. К этому возрасту должен быть закончен первичный вакцинальный комплекс против дифтерии, включающий вакцинацию и первичную ревакцинацию (V и RV).
4.1.5. В случае отсутствия материально-технических возможностей обследования каждой возрастной группы детей и подростков можно отобрать возрастные группы, подлежащие очередной ревакцинации (4 - 5 лет, 9 - 10 лет, 14 - 15 лет).
4.1.6. При получении неудовлетворительных иммунологических показателей в этих группах контроль за иммунитетом следует провести в каждой возрастной группе.
4.2. Серологический контроль состояния иммунитета у взрослых
4.2.2. Особое внимание должно уделяться лицам в закрытых коллективах.
5.1. Реакция пассивной гемагглютинации (РПГА)
Для постановки реакции используется диагностикум дифтерийный эритроцитарный антигенный. Поскольку срок годности эритроцитарных диагностикумов составляет 1 год, необходимо перед каждым проведением серологического исследования сывороток проверять активность препарата. Проверка проводится с контрольным антитоксином, приложенным к комплекту, либо используется национальный препарат дифтерийного антитоксина, очищенного ферментолизом и специфической сорбцией, диагностический сухой. Допускается исследование контрольной сыворотки (лабораторный образец) с известным титром дифтерийных антител. Если диагностикум выявляет в сыворотке антитела в концентрации на 2 - 3 разведения ниже, чем они в ней содержатся, то такой препарат не пригоден для дальнейшего исследования.
РПГА ставят в два этапа согласно инструкции, прилагаемой к препарату: 1-й - подготовка к реакции; 2-й - основной опыт. Ответ может быть получен на 2-е сутки с момента получения исследуемого материала лабораторией.
Однако ряд зарубежных исследователей отмечает возможность получения ложноположительных данных и несовпадение результатов, полученных в реакции нейтрализации in vivo и методах in vitro. По данным ряда авторов коэффициент корреляции между результатами, полученными в РПГА и PH, составляет всего 0,6.
5.2. Реакция нейтрализации (PH) в культуре клеток Vero
Поэтому в качестве второго стандарта была принята реакция нейтрализации (PH) в культуре клеток Vero, поскольку она лишена недостатков биологического теста, более стандартна и наглядна. Коэффициент корреляции результатов, полученных в PH в культуре клеток Vero, с результатами, полученными в классическом методе (на лабораторных животных), составляет 0,98. Этот метод гораздо экономичнее, быстрее и проще в постановке. Однако достоверность результатов PH во многом определяется стандартностью культуры клеток и всех контролей (токсинов и антитоксинов).
В реакции используется цветная проба, основанная на способности токсина изменять метаболическую активность зараженных клеток, что определяют по цвету индикатора, содержащегося в питательной среде. В не пораженных токсином культурах клеток под влиянием выделяющихся продуктов клеточного метаболизма pH питательной среды сдвигается в кислую сторону, вызывая изменение цвета индикатора. В пораженных токсином культурах в результате дегенерации клеток их метаболическая активность подавляется, и цвет фенолового красного не изменяется или изменяется частично.
В реакции используется токсин 0,0002 Lf/мл и антитоксин 0,032 МЕ/мл (National Collection of Type Cultures Diphtheriae Reference Laboratory, Central Health Laboratory (CPHL), London, UK). При постановке реакций применяют культуру клеток Vero, получаемую из лаборатории детских вирусных инфекций НИИЭМ им. Пастера, в концентрации 2,5 ⋅ 10 5 клеток/мл. Содержание антитоксических антител определяют от 0,000125 МЕ/мл и выше,
5.3. Иммуноферментный анализ (ИФА)
Тест-система для ИФА представляет собой набор, предназначенный для определения суммарных антитоксических антител, и включает следующие реагенты: иммуносорбент 1-96-луночный полистироловый или хлорвиниловый планшет для иммунологических реакций, в лунках которого сорбирован анатоксин дифтерийный очищенный; конъюгат - иммуноглобулины (F(аb')2-фрагменты) диагностические против IgG человека, аффинноочищенные, меченные пероксидазой; контрольный положительный образец (К+) - сыворотка или плазма крови человека с известным титром дифтерийных антител; контрольный отрицательный образец (К-) - сыворотка или плазма крови человека, не содержащая дифтерийных антител; концентрат фосфатно-солевого буферного раствора с твином (ФСБ-Т×25); блокатор - белково-солевой раствор (Б); цитратно-фосфатный буферный раствор с перекисью водорода (ЦФБР); хромоген - тетраметилбензидин (ТМБ); стоп-реагент (СР) - 5 %-ый раствор серной кислоты. Специальная компьютерная программа, прилагаемая к набору, дает возможность производить перерасчет показателей оптической плотности в показатели антитоксических международных единиц.
Для определения индекса авидности противодифтерийных антитоксических антител в сыворотке (плазме) крови человека разработано дополнение к набору, которое включает в себя следующие ингредиенты: контрольный положительный образец высокоавидных антител (КА+) - сыворотка крови человека с известным индексом авидности противодифтерийных антитоксических антител (индекс авидности сыворотки указан на этикетке флакона); контрольный отрицательный образец низ-коавидных антител (КА-) - сыворотка крови человека, содержащая противодифтерийные антитоксические антитела низкой авидности; фосфатно-солевой буфер, содержащий 3М калия роданистого для определения авидности противодифтерийных антитоксических антител (ФСБ-3МКрод). Набор рассчитан на исследование 29 образцов сыворотки (плазмы) крови для определения индекса авидности противодифтерийных антитоксических антител.
Тест-система укомплектована национальным стандартом антитоксина, измеряемым в МЕ/мл. Расчет концентрации АТ проводится с учетом коэффициента по калибровочной кривой, что делает результаты более достоверными. Сравнительный анализ нейтрализующего эффекта испытуемых сывороток людей в клеточной культуре Vero и других линиях показал хорошую корреляцию (r = 0,91) с результатами, полученными в модифицированных вариантах ИФА, что подтверждает адекватность применения ИФА для измерения уровня антитоксического иммунитета к дифтерии у здоровых людей.
5.3.1. Определение уровня противодифтерийных АТ
с помощью тест-системы ИФА
1. Приготовить разведения исследуемых сывороток 1:20, 1:200, 1:2000 на буферном растворе № 1 (содержимое флакона концентрата ФСБ-Т×25 развести в 600 мл дистиллированной вода, содержимое флакона с блокатором растворить в 5,0 мл дистиллированной воды, полученный раствор добавить в емкость с раствором ФСБ-Т и тщательно перемешать) в макропланшете непосредственно перед использованием.
2. Приготовить непосредственно перед использованием рабочие разведения: отрицательной сыворотки - 1:20, добавляя в содержимое флакона (0,2 мл) 3,8 мл буферного раствора; положительной сыворотки - 1:200 (отмерить 0,01 мл растворенного К+ и добавить 2,0 мл раствора № 1), из которого затем приготовить отдельно каждое разведение - 1:2, 1:4, 1:8 и 1:16 (в итоге получить пять разведений К+ - 1:200, 1:400, 1:800, 1:1 600 и 1:3200).
3. Полистироловые планшеты с иммунобилгоированным антитоксином трижды отмыть буферным раствором (в объеме 0,3 мл в каждую лунку), удалить буферный раствор, постукивая по сложенной в несколько слоев фильтровальной бумаге, помещенной на поддон.
7. Удалить жидкость из лунок, планшеты промыть, как указано в пункте 5.
8. Внести в каждую лунку планшета по 0,2 мл раствора ТМБ (готовят непосредственно перед внесением в лунки планшетов). Для этого содержимое флакона с ТМБ перенести во флакон с ЦФБР и тщательно перемешать. Раствор готовить в защищенном от прямых солнечных лучей месте. Планшет выдержать при температуре (20 ± 2) °С в течение 20 мин в защищенном от света месте.
9. Реакцию остановить добавлением в каждую лунку по 0,1 мл стоп-реагента (СР).
5.3.2. Определение индекса авидности противодифтерийных
антитоксических антител
1. Внести контрольные и исследуемые образцы. После внесения контролем К+, К- и раствора № 1 добавить КА+, КА- и все испытуемые сыворотки в двух повторностях (одну повторность КА+, КА- и рабочие сыворотки промыть раствором № 1, а вторую - 3М раствором калия роданистого). Планшет герметично закрыть и выдержать (60 ± 5) мин при температуре (37 ± 1) °С. следуя инструкции к набору дата ИФА. Затем содержимое лунок собрать в сосуд с дезинфицирующим раствором (5 - 6 % раствор монохлорамина).
2. Первая промывка планшета.
Контроли К+, К- и первую повторность КА+, КА- и рабочих сывороток промыть 5 раз раствором № 1, вторую повторность КА+, КА- и рабочих сывороток промыть 4 раза 3МКрод, а 5-й раз - раствором № 1.
3. Далее все этапы реакции выполнить согласно основной инструкции к набору.
Регистрация и оценка результатов
Результаты ИФА регистрируют на спектрофотометре при двух длинах волн 450/620 нм.
Индекс авидности (ИА) рассчитывают по формуле:
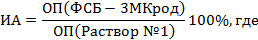
ОП(ФСБ - 3МКрод) - оптическая плотность в лунках, обработанных раствором детергента (ФСБ-3МКрод), ОП(Раствор № 1) - оптическая плотность в лунке, обработанной обычным промывочным раствором, используемым в тест-системе (раствор № 1).
КА+ должен содержать высокоавидные противодифтерийные антитоксические антитела с индексом авидности не менее 90 %. КА- должен содержать низкоавидные противодифтерийные антитоксические антитела с индексом авидности не более 10 %.
Индекс авидности рабочих сывороток более 30 % соответствует вероятности защиты от заболевания дифтерией на 95 %, а индекс авидности 10 % является показателем критического уровня, ниже которого вероятность заболевания возрастает до 99 %.
1. Показатель ОП рабочей сыворотки в лунке, обработанной ФСБ-3МКрод, равен 0,24, а в лунке, обработанной раствором № 1, равен 0,37. Индекс авидности, рассчитанный по приведенной формуле, равен 65 %, что соответствует высокой степени защиты от дифтерии (более 30 %).
2. Показатель ОП рабочей сыворотки в лунке, обработанной ФСБ-3МКрод, равен 0,05, а в лунке, обработанной раствором № 1, равен 0,62. Индекс авидности, рассчитанный по приведенной формуле, равен 8 %, что соответствует низкой степени защиты от дифтерии (менее 10 %).
6.1. Оценка индивидуальной защищенности
от дифтерийной инфекции
Этап 1. Отобрать кровь у обследуемого в пробирку с активатором свертывания. Внести в систему баз данных информацию об обследуемом по форме (табл. 1).
Профессия или учебное заведение
Наличие хронического или острого заболевания
Есть или нет подозрение на дифтерию
Этап 2. Определить с помощью ИФА тест-системы и 3М роданистого калия количество противодифтерийных антитоксических антител, выраженное в МЕ/мл, и индекс авидности антител, выраженный в %. Количество антител рассчитать по данным оптической плотности в лунках планшета с помощью компьютерной программы, входящей в качестве приложения к тест-системе. Индекс авидности (ИА) антител рассчитать по формуле;
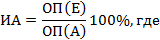
ОП(Е) - оптическая плотность в лунке, обработанной детергентом, ОП(А) - оптическая плотность в лунке, обработанной обычным промывочным раствором, используемым в тест-системе.
Этап 3. Сделать прогноз защищенности обследуемого на будущее. Поскольку авидность антител, защищающая от заболевания дифтерией, снижается быстрее, чем количественный показатель суммарных антител, то в прогнозе необходимо ориентироваться на индекс авидности антител. Для этого найти на графике (рис. 1) значение, наиболее приближенное к полученному индексу авидности антител (с учетом прошлой вакцинации, если она была проведена в ближайший год), и определить по графику, через сколько месяцев индекс авидности снизится до критической отметки (10 %). Очередную ревакцинацию (или повторное исследование) рекомендуется пройти до этой даты.
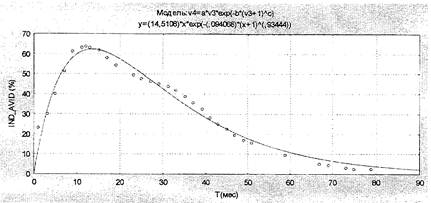
Рис. 1. Математическая модель из исходных данных
о динамике индексов авидности после ревакцинации
Примечания. IND_AVID (%) - индексы авидности (%), Т (мес.) - время после ревакцинации (месяцы). Средняя погрешность модели = 5 %.
6.2. Оценка коллективной защищенности
от дифтерийной инфекции
Этап 1. Определить контингент для изучения напряженности иммунитета к дифтерии с учетом групп риска. Исследование лучше проводить спустя 3 - 5 лет после очередной ревакцинации. Отобрать кровь для исследования. Заполнить индивидуальную информацию в базе данных для каждого обследуемого
Этап 2. Определить индивидуальные показатели защищенности от дифтерии и рассчитать вероятность заболевания на момент обследования. Затем определить средние показатели для всей группы обследованных.
Этап 3. Определить прогноз для всего коллектива в отношении динамики авидности антитоксических антител. Рассчитать сроки очередного обследования или вакцинации.
Все рекомендуемые мероприятия не идут в разрез с нормативными документами по вакцинопрофилактике и контролю иммунитета, а предполагают индивидуальный подход ко всем обследуемым лицам и повышенное внимание к представителям из групп риска.
1. Стандартное оборудование клинических лабораторий для взятия крови.
2. Стандартное оборудование для проведения серологических реакций.
3. Ламинарный или настольный бокс, ТУ 9452003-215-04087-5.
4. Фотометр микропланшетный (ридер).
1. Алексеева Е.А. Оптимизация мониторинга противодифтерийного иммунитета детей в Вологодской области/Е.А. Алексеева, Д.А. Краева, Г.Я. Ценева, Г.И. Беспалова//Материалы X Съезда ВНПОЭМП, Инфекция и иммунитет. Москва, 2012. № 2. С. 77 - 78.
2. Алексеева Е.А. Эффективность высокоавидных антитоксических антител в оценке невосприимчивости к дифтерийной инфекции/Е.А. Алексеева, Л.А. Краева. Г.Я. Ценева, А.М. Николаева//Профилактическая и клиническая медицина. 2011. № 1. С. 38.
4. Краева Л.А. Качественные показатели антитоксических антител в оценке противодифтерийного иммунитета/Л.А. Краева, Ф.С. Носков, Г.Я. Ценева//Ж. мед. иммунол. С.-Пб., 2005. Т. 7. № 2 - 3. С. 274.
7. Краева Л.А. Роль высокоавидных антитоксических антител в оценке невосприимчивости к дифтерийной инфекции/Л.А. Краева, Г.Я. Ценева, А.М. Николаева, Е.А. Алексеева//Эпидемиология и инфекционные болезни. 2011. № 4. С. 20 - 24.
12. Ценева Г.Я. Уровень антитоксического противодифтерийного иммунитета у населения Северо-Западного окрута РФ и пути оптимизации мониторинга инфекции/Г.Я. Ценева, Л.А. Краева, Е.Е. Щедеркина//Эпидемиология и вакцинопрофилактика. 2010. № 5 (54). С. 51 - 54.
14. Efsltatiou A., Maple Р.А.С. Manual for the laboratory diagnosis of diphtheria. Copenhagen//The Expanded Programme on Immunization in the European Region of WHO. 1994 (ICP/EPI038).
[youtube.player]Инфекционные болезни — это заболевания, вызванные проникновением в организм бактерий, грибков или вирусов. Самая важная часть диагностики инфекций — это определение возбудителя и его концентрации. Для этих целей используются разнообразные лабораторные методы, которые позволяют выяснить, чем именно и как давно атакован организм, а в некоторых случаях — спрогнозировать эффективность лечения тем или иным препаратом.
Особенности диагностики инфекционных заболеваний
В клинической практике данный тип заболеваний встречается очень часто. Именно они, по данным Всемирной организации здравоохранения, становятся причиной 26% всех смертей. В список самых распространенных инфекционных заболеваний входят инфекционная пневмония и другие воспалительные заболевания дыхательных путей, гепатит, ВИЧ, туберкулез, малярия, воспаления органов половой системы и мочевыводящих путей, гистоплазмоз, ротавирусные инфекционные заболевания, ветряная оспа, герпес, вирус папилломы человека и еще несколько десятков болезней. Хотя бы раз в жизни каждый из нас сталкивается с инфекционными заболеваниями и необходимостью быстрой постановки диагноза.
Все инфекционные болезни делятся на пять типов — прионные, вирусные, бактериальные, протозойные и грибковые поражения. Далее будут рассмотрены последние четыре типа как наиболее распространенные. Разные возбудители иногда могут вызывать одно и то же заболевание. В частности, пневмония может быть результатом как вирусной, так и бактериальной инфекции. Лечение зависит не от проявлений, а от возбудителя болезни. Противовирусные препараты бесполезны в борьбе с бактериями и грибками, антибиотики не действуют на вирусы. Поэтому основная задача лабораторной диагностики инфекционных заболеваний — выявление типа возбудителя.
Способы лабораторной диагностики инфекционных болезней можно разделить на два типа: неспецифические и специфические методы.
К неспецифическим относятся общий анализ крови и исследование соотношения ее белковых фракций, печеночные пробы, общий анализ мочи и кала. Эти методы не дают информации о виде возбудителя, но позволяют узнать, в какой мере болезнь затронула органы и системы организма, что именно в их работе нарушено и насколько далеко зашел процесс.
Специфические — вирусологический и бактериологический методы, микроскопическое исследование возбудителей, анализы на антигены и антитела — направлены непосредственно на обнаружение возбудителя.
Современная медицина располагает множеством методов выделения возбудителей бактериальной инфекции:
Бактериоскопический . Исследуется окрашенный специальным образом мазок.
Бактериологический . Биоматериал высеивается в питательную среду, и через некоторое время специалист исследует колонию бактерий, выросшую в ней.
Биологический . Направлен на определение патогенности микроорганизмов.
Серологический . Выявляет антитела и антигены в сыворотке крови — особые вещества, которые вырабатываются организмом при контакте с возбудителем определенной болезни.
Чаще всего для исследований используют кровь или сыворотку крови, реже — слюну, мочу, кал, клетки эпителия (мазок и соскоб) и другой биоматериал.
В лабораторной диагностике вирусных заболеваний используются:
Вирусологическое исследование . Световая и электронная микроскопия дает возможность выявить наличие вирусных включений и сами вирусы и идентифицировать их.
Серологическое исследование для обнаружения антител и антигенов. Этот метод дает возможность быстро выявить агрессора, как и в случае с бактериальными инфекциями. Для диагностики используются разнообразные способы исследования материала — реакции гемадсорбции, гемагглютинации или метод непрямой иммунофлюоресценции. Имунноблоттинг, в частности, позволяет выявлять антитела сразу к нескольким инфекциям и считается современным и точным диагностическим методом.
Молекулярно-генетические методы . Последнее слово в лабораторной диагностике. Позволяют обнаружить вирус даже тогда, когда его концентрация ничтожно мала — то есть на самых ранних стадиях. Самым известным из этих методов является ПЦР, при которой фрагмент вируса многократно копируется до тех пор, пока специалист не получит достаточно материала для определения типа вируса и его изначальной концентрации.
Для выявления вирусов обычно требуется сделать анализ крови.
Так называют инфекции, вызванные простейшими паразитами, например, амебами. Малярия, амёбиаз, токсоплазмоз, лямблиоз, трихомониаз, сонная болезнь — вот неполный список самых распространенных протозойных инфекций. Лабораторная диагностика таких заболеваний включает в себя следующие методы:
Микроскопический . Простейшие паразиты выявляются путем исследования под микроскопом окрашенных образцов биоматериала. Самый простой и надежный метод для многих возбудителей.
Культуральный . Посев биоматериала в питательную следу для дальнейшего исследования размножившихся простейших. У этого метода есть существенный недостаток: результатов нужно ждать долго, сам процесс может занять не менее 5-6-ти дней.
Серологический . Используют редко ввиду малой информативности.
Аллергический . Также не является распространенным. Кожные аллергопробы делают для того, чтобы подтвердить лейшманиоз и токсоплазмоз. Это вспомогательный диагностический метод.
В качестве биоматериала для исследований в основном используется кровь, иногда — – кал или моча.
Микроскопическое исследование . Препарат окрашивается и рассматривается под мощным микроскопом. Посредством иммунофлюоресцентной микроскопии исследуется проба, помеченная флюоресцеинами — специальным красителем. Наиболее быстрый способ выявления грибка по сравнению с другими методами.
Культуральный . Происходит посев пробы на питательную среду и дальнейшее исследование полученной в результате колонии грибков.
Серологический . Используется для выявления грибковых поражений, однако для микозов он считается не особенно точным.
Гибридизация нуклеиновых кислот . Самый современный способ выявления грибковых инфекций, его применяют для идентификации основных возбудителей системных микозов. Из культуры извлекается РНК и вносится особым способом помеченная молекула ДНК. Если в пробе наличествует один из основных патогенных грибков, ДНК объединится с его РНК, создав легко различимую структуру. Несомненным преимуществом метода является возможность определить инфекцию на самых ранних стадиях.
Биоматериалом для исследований являются клетки кожи, волос и ногтей, клетки слизистых оболочек (мазок или соскоб), мокрота, моча, секрет простаты, сперма, грудное молоко.
Современные методики диагностики инфекций позволяет выявить их на начальном этапе, Чем раньше болезнь будет обнаружена, тем проще ее вылечить. Поэтому сдавать анализы на инфекции желательно регулярно, даже если вы ни на что не жалуетесь и не замечаете никаких перемен в самочувствии.

Перед сдачей биоматериала для исследований иногда требуется определенная подготовка. Так, кровь обычно сдают с утра, натощак, а перед забором мазка не рекомендуется принимать душ. Эти требования очень важны: они обеспечивают точность результата, поэтому узнайте у врача заранее о подготовительных мерах и точно следуйте всем его рекомендациям.
[youtube.player]
Что такое серологическое исследование крови?

Объект серологии — антигены и антитела
Серологическое исследование (СИ) основано на способности антигенов и антител связываться друг с другом. СИ позволяет с точностью выявить наличие у пациента определённого вируса либо бактерии, группу крови и резус, реактивность организма к антибиотикам, аутоиммунные заболевания, гормональные нарушения, индивидуальную специфичность белков, определить эффективность терапии.
Система иммунитета борется с проникающими в организм болезнетворными микробами (антигенами) при помощи антител, при этом создавая к каждому из вирусов, паразитов либо бактерий свой определённый тип защиты.
Способность иммунитета вырабатывать особые вещества, нейтрализующие вредоносные частицы, была известна учёным давно. Но увидеть реакцию антиген-антитело в лабораторных условиях удалось только в конце XIX века. Было обнаружено, что в результате образования связки, комплексы выпадают в осадок, образуя хлопья либо помутнение. Такие реакции получили названия агглютинации и преципитации. В XX веке серология — наука о свойствах сыворотки, стремительно развивалась, обнаруживались новые методы диагностирования на основе реакций антиген-антитело. На сегодняшний день существует множество способов выявления иммунных комплексов, а СИ являются незаменимым звеном в диагностике, лечении, создании новых медицинских препаратов и вакцин.
Показания к проведению анализа.

Серологические исследования широко применяется в акушерстве
Серологические исследования сопровождают современного человека на протяжении всей жизни. Первые анализы на выявление определённых антител проводятся, когда малыш находится ещё в утробе. Беременная женщина сдаёт кровь на различные СИ для определения возможного резус-конфликта либо инфекций, способных навредить вынашиваемому плоду. Когда ребёнок появляется на свет, его ожидают серологические исследования, позволяющие диагностировать врождённые заболевания. Впоследствии анализы сдаются по следующим причинам:
- вирусные, бактериальные, паразитарные инфекции;
- выявление активности, стадии развития болезни;
- гормональные патологии;
- бесплодие;
- аутоиммунные заболевания;
- нарушение обмена веществ;
- аллергии;
- онкологические заболевания;
- планирование беременности, период вынашивания, патологии беременных;
- выявление ревматоидного фактора;
- определение группы крови и резус-фактора;
- эффективность терапии при различных болезнях;
- эффективность вакцинации;
- предоперационный и постоперационный период при необходимости оценки уровня некоторых антител;
- изучение иммунного состояния организма.
Подготовка к исследованию.

Прием препаратов желательно отменить накануне теста
Так как серологические исследования охватывают широкий спектр анализов, в каждом конкретном случае может понадобиться определённая подготовка, но существуют общие правила сдачи серологического теста:
- За сутки до исследования следует ограничить в рационе жирное и жареное, исключить алкоголь.
- Последний приём пищи должен завершиться за 10 — 12 часов до анализа.
- В день сдачи крови не следует употреблять кофе, чай либо иные напитки. Можно в небольшом количестве пить чистую воду.
- Лекарственные средства перед анализом исключаются. Если приём отменить невозможно, необходимо предоставить врачу полный перечень препаратов, в том числе витаминов, пероральных контрацептивов.
- Все другие исследования либо медицинские манипуляции проводятся после СИ.
- Курение рекомендуется прекратить за 12 часов до взятия образца крови.
- В предыдущий день следует избегать физических и эмоциональных нагрузок, а перед исследованием желательно 15 минут посидеть в полном покое.
- СИ назначаются на утреннее время и сдаются натощак.
Методы проведения серологического исследования.

В серологии может применяться большое число методов
Все методики определения комплексов антиген-антитело (Аг-Ат) основываются на использовании известного Аг либо Ат в поиске неизвестного. Если необходимо обнаружить Аг, необходимы диагностические иммунные сыворотки с содержанием специфических Ат. Если целью СИ является выявление Ат, используются диагностикумы — взвеси, содержащие определённые Аг.

Непрямая гемагглютинация — один из методов диагностики
Методы серологических исследований:
- Агглютинация. Связывание Ат с Аг с последующим формированием хлопьев либо осадка. Применяются прямые, непрямые, развёрнутые, ориентировочные реакции, позволяющие выявить антитела в сыворотке.
- Гемагглютинация. Используются эритроциты с адсорбированными на них Аг либо Ат, которые склеиваются с соответствующими Ат и Аг. Образуемые комплексы выпадают в виде фестонного осадка.
- Преципитация. Образование комплекса Аг-Ат с последующим осаждением в виде помутнения, именуемого преципитатом.
- Коагглютинация. Выявление Аг при помощи Ат, адсорбированных на белке клеток стафилококка.
- Торможение гемагглютинации. Ат иммунной сыворотки подавляют вирусные Аг, в итоге вирусы теряют способность склеиваться с эритроцитами.
- Непрямая реакция Кумбса. Определяются Ат к поверхностным Аг эритроцитов.
- Кольцепреципитация. Проводится на основе иммунной сыворотки с наслоением растворимого Аг.
- Двойная радиальная иммунодиффузия. Реакция основана на диффундировании компонентов антисыворотки и Аг в лунках агара либо агарозы.
- Реакция связывания комплемента. Связь Аг и Ат сопровождается адсорбцией комплемента, в качестве индикатора используются эритроциты барана и Ат к ним в составе гемолитической сыворотки.
- Нейтрализация. Основана на нейтрализации вирусного агента антителами.
- Реакции, основанные на маркировании Ат и Аг флуоресцентным либо ферментным составом — иммунофлюорисцентный (РИФ) и иммуноферментный (ИФА) методы.
Иммунофлюорисцентный метод.

Данный метод основан на использовании Ат, меченных флуоресцентным веществом. Чаще всего в качестве метки используется флуоресцеинизотиоционат, обладающий зелёным свечением в лучах ультрафиолета. Результат анализа оценивается по степени яркости свечения. Может быть использован ручной метод определения при помощи люминесцентного микроскопа, оптического микроскопа с люминесцентной насадкой, а также автоматический способ с применением микрочипового цитомера, проточного цитомера либо роботизированного флуоресцентного микроскопа.
РИФ проводится прямым и непрямым методом. Прямой способ означает непосредственное связывание сорбированного Аг с меченым Ат. Непрямой метод подразумевает использование немаркированных Ат для связки с Аг, а затем добавление меченых Ат, что позволяет избежать неспецифических реакций.
Иммуноферментный анализ.

Иммуноферментный анализ как метод серологической диагностики
ИФА основан на выявлении комплексов Аг-Ат при помощи маркирования одного из компонентов. В качестве метки используются различные ферменты, которые в результате ферментативной реакции образуют окрашивание. Существуют разнообразные методы ИФА, их можно классифицировать как гомогенные и гетерогенные методы.
Гомогенные означают, что все этапы реакции происходят в растворе.
Гетерогенные методы включают разделение на фазы с использованием твёрдого носителя.
Гомогенно-гетерогенные способы основываются на том, что комплексы Аг-Ат формируются в растворе, а затем для разделения используется твёрдая фаза.

Существует множество вариаций методов ИФА, некоторые из них представлены ниже.
- Сэндвич-метод. К иммобилизованным Ат добавляется раствор с Аг, после образования комплексов носитель отмывают от лишних компонентов и добавляют маркированные Ат. В результате, Аг оказываются зажатыми иммобилизованными и мечеными Ат, откуда и произошло название метода.
- Неконкурентный непрямой ИФА. К иммобилизованным Аг присоединяют исследуемую сыворотку с Ат. Когда образуются комплексы, лишние Ат смывают и добавляют маркированные Ат, способные связаться с прикреплёнными к поверхностям лунок иммунными комплексами.
- Конкурентный прямой ИФА. К иммобилизованным Аг вносят исследуемую сыворотку и конъюгат, содержащий маркированные Ат. Формируются комплексы Аг-Ат нескольких видов: с мечеными Ат и с немаркированными Ат, которые вступают между собой в конкуренцию за связь с Аг.
Какие инфекции помогает выявить серологическое исследование.

Серологическая диагностика позволяет выявить возбудителя
Если у пациента присутствует определённая симптоматика либо иные исследования указывают на заболевание, назначается серологический анализ.
Серологические исследования используют для диагностики следующих инфекций:
- вирус гепатита А, В, С, D, Е;
- сифилис;
- ВИЧ;
- герпес;
- цитомегаловирус;
- краснуха;
- корь;
- паротит;
- Эпштейн-Барр;
- хеликобактер;
- хламидии;
- микоплазмы;
- токсоплазмы;
- лямблии;
- гельминты;
- уреаплазмы;
- парвовирус;
- вирус ветряной оспы;
- вирус клещевого энцефалита;
- вирус Денге;
- коклюш;
- боррелии;
- легионеллы.
Преимущества серологического метода исследования в диагностике инфекций.

Серологическая диагностика — быстро и доступно
- Высокая чувствительность и специфичность.
- Широкий спектр определяемых инфекций.
- Ранняя диагностика инфицирования.
- Возможность мониторинга развития заболевания.
- Быстрота и удобство в исполнении.
- Возможность использования минимального объёма исследуемого материала.
- Безопасность исследования.
Читайте также:


