Серологические методы диагностики риккетсиозов
План
1. Общая характеристика методы культивированиия риккетсий.
2. Классификация риккетсиозов.
3. Эпидемический и эндемический сыпной тиф.
4. Особенности возбудителей, механизм заражения.
РИККЕТСИИ
Общая характеристика и классификация.
Риккетсии (Rickettsia) включены в порядок Rikettsiales,семейство Rickettsiaceae, род Rickettsia.
Общая характеристика.
Все риккетсии являются облигатными внутриклеточными паразитами, т.е. живут и размножаются (как и вирусы), только в клетках (цитоплазме и ядре) тканей животных, человека и переносчиков. И не растут на искусственных питательных средах.
Это полиморфные микроорганизмы, имеющие следующие формы:
1. кокковидные – мелкие овоидные, d = 0,5 мкм, часто в виде диплококков;
2. палочковидные – изогнутые короткие, тонкие палочки 1-1,5 мкм с зернами на концах, или длинные 3-4 мкм;
3. нитевидные (мицелярные) – 10-40 мкм, изогнутые, иногда многозернистые нити.
Не образуют спор, капсул, неподвижны!
Хорошо окрашиваются по Романовскому-Гимзе, Цилю-Нильсену, грамотрицательны (грам -).
Электронной микроскопией и цитохимическими исследованиями у риккетсий установлено наличие внутренней и наружной оболочки, выполняющей функции стенки состоящей из 3-ех слоев. В цитоплазме риккетсий обнаружены, гранулы типа рибосом (20-70) и вакуолеобразные структуры (6-8 нм в диаметре).
Риккетсии размножаются путем деления кокковидных и палочковидных форм с образованием гомогенных популяций соответствующего типа, а также в результате дробления нитевидных форм с последующим развитием кокковидных и палочковидных образований.
Большая часть риккетсий относится к безвредным микроорганизмам. Около 50 различных видов риккетсий найдено в кишечнике и слюнных железах тлей, клопов, клещей.
Патогенные риккетсии поражают различные виды животных и человека; заболевания, вызываемые риккетсиями, носят название риккетсиозов.
Классификация риккетсий и риккетсиозов:
| Группа | Возбудители | Особенности паразитирования | Переносчики возбудителей | Источник инфекции | Наименование заболевания |
| Сыпные тифы | R.prowazekii R.typhi | Размножаются в цитоплазме и эн-дотелии сосудов Там же | Платяная и головная вши Крысиные блохи и вши | Больной человек Крысы, мыши | Эпидемический сыпной тиф Эндемический сыпной тиф |
| Клещевые пятнистые лихорадки | R.conorii R.sibirica R.akari | Размножаются в цитоплазме и ядре Там же Там же | Собачий клещ Иксодовые клещи Гамазовые клещи | Южный собачий клещ Грызуны (мыши, суслики) Домовая мышь, черная и серая крысы | Марсельская лихорадка Североазиатский (сибирский) риккетсиоз Везикулезный (осповидный) риккетсиоз |
| Риккетсиозы цуцуга-муши | R.tsutsuga-mushi | Размножаются в цитоплазме | Краснотел-ковые клещи | Грызуны, сум-чатые, насекомые | Лихорадка цуцу-гамуши |
| Пароксизма-мальный риккетсиоз | Rochalimae quintana | Внеклеточный паразитизм | Платяная вошь | Больной человек и носитель | Волынская (пяти-дневная) лихорад-ка |
| Ку-риккет-сиоз | Coxiella burnetii | Размножаются в вакуолях и цито-плазме макрофагов | Иксодовые и гамазовые клещи | Многие виды диких и домаш-них животных | Ку-лихорадка (пневмориккет-сиоз) |
Возбудитель сыпного тифа
В 1909-1910 гг. Г. Риккетс и Р. Уайллер нашли в крови больных мексиканским сыпным тифом и в зараженных вшах неподвижные мелкие биполярные микроорганизмы. В 1913 г. Чешский ученый С. Провачек обнаружил в плазме и лейкоцитах людей, больных сыпным тифом, овальные и продолговатые тельца, окрашенные по Романовскому-Гимзе. В 1916 г. Г. Х. Роша-Лима на основании своих многолетних исследований пришел к выводу, что сыпной тиф вызывают мелкие полиморфные микроорганизмы, обнаруживающиеся в крови больных и в кишечнике зараженных вшей. В честь первооткрывателей он их назвал риккетсиями Провачека.
Риккетсии Провачека – гантелевидные микроорганизмы, описание - смотри общую характеристику. Средние размеры их 0,3-0,6 мкм. Они хорошо окрашиваются феноловым фуксином в красный цвет. В электронном микроскопе у них выявлена микрокапсула (толщиной 10-12нм).
Хорошо размножаются при t 25°С в желточном мешке куриного эмбриона.
Используют и другие методы:
1. В куриных эмбрионах по Коксу: материал содержащий риккетсии, вводят в полость желточного мешка → яйца в термостат при 36-37°С на 6-7 дней;
2. Интраназально заражают белых мышей, в легких которых накапливаются риккетсии;
3. По методу Вейгля и Мосинга – платяных вшей заражают взвесью риккетсий путем введения в кишку через анальное отверстие с помощью специальных капилляров.
4. А. В. Пшеничков и Б. И. Райхер – метод культивирования риккетсий на личинках вшей, которых кормят через мембрану кожи трупа дефибринированной кровью.
5. И можно, как вирусы, путем заражения тканевых культур (об этом методе более подробно мы поговорим на следующей лекции).
Методы культивирования риккетсий используют при изготовлении сыпнотифозной вакцины и для получения антигенов для серодиагностики риккетсиозов.
Токсинообразование:термолабильный токсин (эндотоксин), который разрушается при 66°С.
I Аг:термолабильный, спефический для риккетсий Провачека, корпускулярный, поверхностный растворимый, не обладает видовой специфичностью.
II Аг:термостабильный, общий для риккетсий Провачека и крысиного сыпного тифа. Общий с риккетсиями полисахаридный гаптен имеет протей – ( Proteus OXI9, OX2, OXK, OXL). Этот Аг липидополисахаридопротеиновый комплекс.
В высушенных и неповрежденных вшах риккетсии сохраняются до 30 суток, в сухих фекалиях вшей – до 6 суток. От t 50°C гибнут через 15' и при 100°C – через ½ минуты. Губительное действие на них оказывают все применяемые дезинфицирующие средства.
Патогенность для животных:
Восприимчивы обезьяны, морские свинки, белые мыши.
Сыпной тиф – антропонозное заболевание, источником его всегда является больной человек. Носительства нет. Восприимчивость к заболеванию всеобщая. Дети младшего возраста переносят тиф легче, чем пожилые люди. Характерна сезонность заболевания: февраль-май. Развитию болезни способствуют скученность, антисанитарные условия.
В 1876 г. О. О. Мочутковский опытами на себе впервые доказал заразность крови людей, больных сыпным тифом. Он высказал предположение, что сыпной тиф передают кровососущие насекомые. В 1909 г. Ш. Николь и соавторами подтвердили это положение на обезьянах и установили передачу сыпного тифа через платяную вошь(Pediculus humanus).
Источник болезни – больной человек, переносчик – платяная вошь. Насосавшись крови сыпнотифозного больного, платяная вошь на 3-10е, чаще 4-5е сутки становится заразной. Риккетсии развиваются при 30°C в кишечнике вшей (в клетках эпителия слизистой оболочки кишечника). В результате накопления риккетсий клетки разрушаются, и возбудители вместе с испражнениями попадают на кожу, платье и т.д. Заражение сыпным тифом происходит не через укус вшей, а при втирании риккетсий, которые выделяются при дефекации на кожу и слизистые оболочки.
Риккетсии Провачека вызывают у людей сыпной тиф, который протекает в виде лихорадочного состояния с розеолезно-петехиальной сыпью. Сыпной тиф относится к кровяным инфекциям. Возбудитель в период лихорадки находится в лейкоцитах, эндотелии сосудов кожи, мозга и других органов. Множественный тромбоз артериальной системы приводит к нарушению питания ткани, гибели клеток, особенно ЦНС. На 1 см 2 поверхности мозга насчитывается несколько тысяч гранулем.
Патологический процесс обусловлен паразитированием риккетсий Провачека в эндотелии мелких кровеносных сосудов и образованием в них специфических гранулем.
Инкубационный период 12-14 дней, с колебаниями от 1 до 3 недель.
Осложнения при сыпном тифе встречаются редко. Иногда возможны гипостатическая пневмония, пролежни, отиты.
Иммунитет: постинфекционный – прочный!
В последние годы количество повторных случаев возросло. Повторные случаи сыпного тифа представляют собой эндогенные рецидивы первичного заболевания. Повторные случаи сыпного тифа называют болезнью Брилля-Цинссера. Рецидивы наступают после различных неблагоприятных воздействий (заболевания, хирургическое вмешательство, переохлаждение, психические и физические травмы, переутомление, голод), на организм, который в течение длительного времени являлся носителем риккетсий в покоящихся формах в состоянии персистирования.
Болезнь Брилля-Цинссера характеризуется более легким клиническим течением с сохранением наиболее типичных признаков сыпного тифа при отсутствии вшивости.
Материалом для выделения возбудителя при всех видах риккетсиозов служит кровь, взятая у больного из вены в возможно раннем периоде лихорадки.
Обычно используют цитратную кровь или взвесь из растертого сгустка свернувшейся крови. Кроме того, материалом могут служить переносчики, органы зараженных животных.
1. Серологический – основной метод;
Алгоритм
микробиологического исследования при риккетсиозных инфекциях
§ Реакция агглютинации риккетсий (РАР);
§ РН риккетсий сывороткой больного с последующей биопробой.
Биопроба: заражение самцов морских свинок в/брюшинно или интрацеребрально.
а) Введение материала в желточный мешок куриного эмбриона;
б) Заражение тканевых культур.
1. Вскрытие животных → препараты из органов, окраска по Здрадовскому, ответ.
2. Препараты из зараженных эмбрионов и тканевых культур, окраска по Здрадовскому и иммунофлюоресцентный метод → ответ.
РАР– в пробирках по 0,5 мл объем: 0,25 мл разведения сыворотки + 0,25 мл соответствующих антигенов, → +37°C 18 часов → учет результата, не встряхивая пробирки. Положительной считается реакция не менее, чем на ++ (незначительное просветление, зернистый осадок) в разведениях 1:40 – 1:80.
РСК– по общепринятой методике; реакция считается положительной при задержке гемолиза не менее чем ++. Условно-диагностический титр 1:160 и выше.
РПГА– с разведениями сывороток от 1:250 до 1:64000 по обычной схеме. Условно-диагностический титр 1:250.
Серологическое дифференцирование первичного (эпидемического) и повторного сыпного тифа (болезнь Брилля):
При 1-ом и повторном сыпном тифе формируются качественно различные иммуноглобулины (Ig): при первичном – Ig М (19 S), при повторном – Ig G (7 S). Дифференцирование Ig М и Ig G антител основано на их различной чувствительности к действию редуцирующих веществ, содержащих свободные сульфгидридные группы (2-меркаптоэтанол, цистеин и др.) Эти вещества вызывают разрыв дисульфидных связей в молекулах
Ig М и их распад на субъединицы, лишенные активности антител. Ig G при этом не изменяются. Параллельно ставят РСК с испытуемой исходной сывороткой и обработанной 2-меркаптоэтанолом или цистеином (см. табл. № 95). В случае первичного сыпного тифа наблюдается снижение титра антител в обработанной сыворотке не менее, чем в 4 раза по сравнению с необработанной исходной сывороткой. При повторном сыпном тифе титр антител в обеих сыворотках должен быть одинаковым (допускается снижение титра не более чем в 2 раза).
Антибиотики. Чаще тетрациклины, левомицетин, рифампицин.
В последние годы летальность совсем не регистрировалась.
· Ранняя диагностика, изоляция и госпитализация больных.
· Санитарная обработка в очаге (дезинсекция).
· Учет и наблюдение за контактировавшими с больными.
· Осмотры на педикулез, санпросвет работа среди населения.
· Вакцинация сухой живой сыпнотифозной вакциной, изготовленной из авирулентного штамма Е. В связи со значительным улучшением санитарного состояния населения иммунизации подлежат только отдельные контингенты.
Благодаря значительному улучшению условий жизни людей и проведению профилактических мероприятий эпидемический сыпной тиф на большей части территории Беларуси ликвидирован. Сухая живая комбинированная сыпнотифозная вакцина Е(ЖКСВ – Е) – смесь живой яичной культуры риккетсий Провачека вакцинного штамм Е, выращенной в курином эмбрионе, с растворимым антигеном вирулентного штамма риккетсий Провачека. Применяется для активной иммунизации против сыпного тифа. Есть химическая сыпнотифозная вакцина.
Риккетсии Музера.
Возбудитель открыт в 1928 г. Х. Музером. По своим биологическим свойствам во многом сходен с риккетсиями Провачека.
Морфология.
Менее полиморфны, чем R.prowazekii. Это - мелкие палочки и кокковидные клетки длиной 0,7-1,3 мкм и шириной 0,35-0,6 мкм, редко образуют нитевидные клетки. Грам -, по Здрадовскому окрашиваются в красный цвет.
Культуральные свойства.
Хорошо размножаются в курином эмбрионе и некоторых культурах клеток, образуя, как и риккетсии Провачека бляшки, t° optim 35°C.
1) Термостабильный Аг, общий с риккетсиями Провачека;
2) Термолабильный Аг, видоспецифический, он позволяет дифференцировать от других видов риккетсий.
Этиопатогенез.
Эндемический, или крысиный, сыпной тиф – остролихорадочная зоонозная инфекция, встречающаяся среди крыс, серых и черных мышей, которые и являются источником инфекции. Передается их паразитами: крысиными блохами, способными нападать на человека, крысиными вшами, не нападающими на людей, и гамазовыми клещами. Эктопаразиты заражаются при кровососании, риккетсии размножаются у них в кишечнике и выделяются с фекалиями. Циркуляция риккетсий происходит по цепи крыса или мышь → крысиная блоха или вошь → крыса или мышь.
Ø путем втирания в кожу при расчесах фекалий блох;
Ø аэрогенно при попадании фекалий на слизистые оболочки верхних
Ø алиментарным путем при загрязнении пищевых продуктов мочой грызунов.
Эндемический сыпной тиф распространяется повсеместно, особенно в зонах большого количества крыс (морские порты), а так же в тех местах, где имеются случаи эпидемического сыпного тифа. Патогенез сходен с эпидемическим сыпным тифом.
Постинфекционный иммунитет стойкий и продолжительный (пожизненный), при этом создается невосприимчивость и к эпидемическому сыпному тифу.
1) Серодиагностика – РАР и РСК со специфическими антигенами, позволяет ставить диагноз крысиного сыпного тифа и дифференцировать его от эпидемического сыпного тифа;
2) Биопроба – заражение самцов морских свинок (у них развивается лихорадка и периорхит при эндемическом, и только лихорадка при эпидемическом сыпном тифе).
Специфическая терапия – антибиотики тетрациклинового ряда, средств специфической профилактики нет.
Коксиеллы Бернета.
Coxiella burnetii – относится к роду Coxiella, семейству Rickettsiaceae. Являются возбудителем Ку-лихорадки (от англ. query – неясный, неопределенный). Болезнь впервые была описана в 19 веке в Австралии, а затем в других странах. Возбудителя впервые идентифицировали как риккетсии Ф. Бернет и М. Фриман.
Грам - , неподвижные, мелкие кокковидные или палочковидные образования размером 0,25 х 1,5 мкм. По Романовскому-Гимзе → в иссиня-пурпурный цвет, по Здрадовскому → в красный.
Облигатные внутриклеточные паразиты с автономным, в отличие от вирусов обменом веществ. Культивируются в желточных мешках куриного эмбриона или в культуре клеток (куриных и мышиных фибробластов), размножаясь почти исключительно в вакуолях.
Довольно устойчивы к воздействию физических и химических факторов. До 90°C выдерживают больше часа. Длительно сохраняются в окружающей среде.
Два Аг – Ι фазы и ΙΙ фазы. Аг Ι фазы является поверхностным полисахаридным, Аг ΙΙ фазы глубоко в клетке, его химическая природа неизвестна. Способность к образованию токсина у риккетсий Бернета пока не доказана.
Ку-лихорадка встречается повсеместно, не зарегистрирована только в Финляндии, Швеции, Норвегии, Дании, некоторых странах Западной Африки и Южной Америки). Ку-лихорадка – зоонозная инфекционная болезнь, характеризующаяся полиморфной клинической картиной с преимущественным поражением легких. Паразитирование C. burnetii выявлено у многих видов млекопитающих, птиц, членистоногих. Установлено носительство их у 92 видов диких млекопитающих, 72 видов птиц, 73 видов клещей. Особенно опасны домашние животные (лошади, рогатый скот, собаки) и грызуны. В природных очагах передача возбудителя происходит трансмиссивным путем (клещи).В сельскохозяйственных очагах источником возбудителя является крупный и мелкий рогатый скот, лошади и верблюды. Передача возбудителей происходит воздушно-пылевым (при обработке шерсти, кожи зараженных животных) и пищевым(при употреблении молока и молочных продуктов), контактным и трансмиссивным путями.
Заражение здорового человека от больного не наблюдается.! Возбудитель → в кровь (виремия) → поражает многие органы и ткани, чаще легкие. Протекает как лихорадочное заболевание, с развитием аллергии.
Постинфекционный иммунитет – прочный и длительный, повторно редко.
Материал:кровь, мокрота, моча.
Морских свинок заражают материалом от больного → из селезенки морских свинок возбудителей выделяют путем культивирования на курином эмбрионе. Для серодиагностики применяют РАР, РСК, разработан ИФА.
Для диагноза может быть использована кожно-аллергическая проба с Аг.
Специфическая терапия: антибиотики тетрациклинового ряда и левомицетин.
Специфическая профилактика: П. Ф. Здродовский и В. А. Гениг разработали эффективную живую вакцину из штамма М-44 для профилактики Ку-лихорадки.








ВОЗБУДИТЕЛЬ И ЛАБОРАТОРНАЯ ДИАГНОСТИКА РИККЕТСИОЗОВ СОБАК
Риккетсиоз собак является зооантропонозным заболеванием, что обуславливает актуальность выбранной мной темы. Клещевой риккетсиоз описан в Восточной Сибири и на Дальнем Востоке (Приморский, Хабаровский, Красноярский края, Читинская и Иркутская области, Бурятия и Тува), в Западной Сибири (Кемеровская, Томская, Новосибирская, Омская, Тюменская, Курганская области, Алтайский край), Азербайджане, Казахстане, Туркмении, Таджикистане, Кыргызстане и Армении, в Монгольской Народной Республике и Пакистане. В Европейской части России (Тульская и Харьковская области, Башкирия) установлена циркуляция возбудителя в антропургических очагах, заболевания людей не описаны.
Цель исследования: изучить возбудителя и лабораторную диагностику риккетсиоза собак.
Характеристика заболевания. Риккетсиоз собак – острое лихорадочное заболевание собак и других видов животных семейства Canidae с генерализованным поражением лимфоидной системы, сопровождающаяся резким обезвоживанием, рвотой, депрессией, полным отсутствием аппетита, иногда сыпью в области живота, абортами. Летальность достигает 90%.
Клинические признаки: острый энтерит, диарея, рвота, отсутствие аппетита, увеличение лимфатических узлов, высока температура тела, иногда ринит, аборты, бесплодие, пневмония, сыпь на животе (рисунок 1) /1, 8/.
Рисунок 1 Сыпь на животе собак
Характеристика возбудителя.
Исследования этой группы микроорганизмов были начаты в 1906 Х. Риккетсом (рисунок 2) в Чикагском университете.
Морфология возбудителя.
Вид Neorickettsia helminthoeca
Строение риккетсий аналогично строению прочих бактерий. Риккетсии полиморфны. Все многообразие их форм может быть сведено к четырем основным морфологическим типам:
Тип а. Кокковидные риккетсии, это наиболее патогенный тип.
Тип в. Палочковидные, биполярные.
Тип с. Бациллярные, удлиненные, обычно изогнутой формы, выделяются в начальном периоде болезни.
Тип d. Нитевидные, полизернистые риккетсии имеют вид длинных причудливо прогнутых нитей.
Рисунок 2 Риккетс Ховард Тейлор
Риккетсии окрашиваются грамотрицательно (рисунок 3).
Рисунок 3 Окраска риккетсий по Граму
Лабораторная диагностика заболевания. Особенности взятия и пересылки материала. При риккетсиозах у животного берту 5 мл венозной крови и дефибринируют, также берут мочу, мокроту, смывы с объектов внешней среды. Собирают вшей и отправляют их в лабораторию в закрытой пробирке, заклеенной лейкопластырем /2/. Бактериологическая диагностика. Большое значение для морфологического их изучения имеют специальные методы окраски риккетсии, среди которых отличается своей информативностью метод Д.Л. Романовского с использованием красящего раствора Гимзы. Этот метод позволяет обнаружить все виды и формы вне- и внутриклеточных риккетсии, а также выявить их микроструктуру. Кроме метода Романовского, используют методы импрегнации серебром по М.А. Морозову, окраску по Маккиавелло в модификации П.Ф. Здродовского и др.
Результат окраски по Романовскому-Гимзе: бактерии окрашиваются в фиолетово-красный цвет, цитоплазма клеток — в голубой, ядра — в красный (рисунок 4).
Рисунок 4 Микроскопическая картина риккетсий, окрашенных по Романовскому-Гимзе
По Здродовскому риккетсии окрашиваются в рубиново-красный цвет, клеточные элементы – в голубой (протоплазмы) или синий (ядро) цвет. По Макиавелло риккетсии окрашиваются в красный цвет на синем фоне /4/.
Культуральные свойства. Патогенным риккетсиям свойственен внутриклеточный паразитизм. Риккетсии не культивируются на обычных питательных средах. Их репродуцируют на развивающихся куриных эмбрионах (рисунок 5), в культуре клеток или в организме лабораторных животных /3,6,7/.
Рисунок 5 Электронная фотография риккетсий, выращенных в желточном мешке куриного эмбриона
В настоящее время для накопления риккетсии широко используется метод культуры тканей. Оптимальная реакция среды рН 7,4-7,8. Обильное размножение риккетсии происходит в аэробных условиях при 35-37 °С /10/.
Биохимические и токсигенные свойства возбудителя. Риккетсии - аэробы, поглощают О² и выделяют СО², образуют гемолизины, активно окисляют глутаминовую кислоту, выделяя углекислый газ, но индифферентны к глюкозе, образуют эндотоксины /8,9/. Антигенное строение возбудителя. Бактерии имеют группоспецифический К-антиген, видоспецифический корпускулярный О-антиген /8/. Серологическая диагностика. В клинической практике применяют реакцию агглютинации, реакцию связывания комплемента, реакцию гемагглютинации. В лабораторной диагностике риккетсиозов важное место занимают люминесцентная микроскопия и люминисцентно-серологичский метод, а также электронная микроскопия /2,3/. Биопроба. Внутрибрюшинное или интратестикулярное (в толщу яичек) заражение исследуемым материалом морских свинок самцов, куриных эмбрионов в желточный мешок. Обнаружение риккетсий осуществляется в мазках-отпечатках внутренних органов, окрашенных по Романовскому-Гимзе или Здродовскому /1/.
Устойчивость возбудителя.Риккетсии являются малоустойчивыми к разным условиям окружающей среды: при нагревании до 50°С они погибают уже спустя 10 минут, а до 80°С — спустя 1 минуту.
При воздействии на риккетсий различных дезинфицирующих средств в обычных концентрациях их гибель наступает через 5 мин.
Риккетсии чувствительны к тетрациклину, дибиомицину, синтомицину, левомицетину и сульфаниламидам /3,6/.
Особенности специфической профилактики и иммунитет. Лечение антибиотиками тетрациклинового ряда.
Профилактика сводится к истреблению переносчиков инфекции - насекомых и грызунов, специфическая профилактика разработана только для нескольких видов риккетсий - живая сыпнотифозная вакцина.
У переболевших риккетсиозами животных развивается стойкий антитоксический, антибактериальный и перекрестный иммунитет к другим возбудителям риккетсиозов /5/.
Заключение
Риккетсиоз собак относится к природно-очаговым зоонозам. Основной источник инфекции – грызуны, собаки и другие животные, а переносчиками являются кровососущие членистоногие. Риккетсиозы – широко распространенные заболевания, регистрируемые на всех континентах. В развивающихся странах они составляют 15-25% всех лихорадочных заболеваний неясной этиологии. У собак при злокачественном течении риккетсиоза при отсутствии полноценно лечения летальность может достигать 90%. Для людей настоящее время риккетсиозы не представляют большой опасности, так как при своевременном лечении в подавляющем большинстве случаев наступает полное выздоровление.
Библиографический список
Аркадьева-Берлин, Н. Г. Лечение собак : справочник / Н. Г. Аркадьева-Берлин. – М.: Агропромиздат, 2005, 188 с.
Бессарабов, Б. Ф. Инфекционные болезни животных : учебник / Б. Ф. Бессарабов, Е. С. Воронин. – М.: КолосС, 2007. – 671 с.
Воробьев, А. А. Медицинская и санитарная микробиология : учеб. пособие / А. А. Воробьев, Ю. С. Кривошеин, В. П. Широкобоков. – М.: Медицина, 2003. – 487 с.
Данилов, А. Д. Болезни собак : справочник / А. Д. Данилов. – М.: Агропроимздат, 2000. – 368 с.
Еремеева, М. Е. Современные подходы к лабораторной диагностике риккетсиозов [Текст] / М. Е. Еремеева, С. Н. Шпынов, Н. К. Токаревич // Инфекция и иммунитет. – 2014. - №2. – С. 17.
Красинкова, Л. В. Микробиология : учеб. пособие / Л. В. Красинкова. – 3-е изд. – М.: Медицина, 2012. – 262 с.
Масимов, Н. А. Инфекционные болезни собак и кошек : учебник / Н. А. Масимов, С. С. Лебедько. – М.: Лань, 2009. – 128 с.
Рэмси, Я. К. Инфекционные болезни собак: практ. Руководство / Я. К. Рэмси, Д. Эдди, Б. Теннат. – М.: Аквариум-Принт, 2015. – 304 с.
Сутер, П. Болезни собак : учебник / П. Сутер, Б. Кон. – М.: Аквариум-Принт, 2008. – 816 с.
Шуляк, Б. Ф Руководство по бактериальным инфекциям собак. Грамотрицательные бактерии : учеб. пособие / Б. Ф. Шуляк. - 2-й том. – М.: ОЛИТА, 2003. – 608 с.
Лабораторная диагностика сыпного тифа и других риккетсиозов включает выделение возбудителя, определение его антигенов и ДНК, выявление антител к риккетсиям соответствующих видов. Чаще осуществляется серологическими (РСК, РНГА, РНИФ, ИФА) и молекулярно-генетическими (ПЦР, определение нуклеотидных последовательностей фрагментов генов) методами.
Выделение возбудителей риккетсиозов от больных наиболее эффективно в острый лихорадочный период, до начала антибиотикотерапии. Основные риккетсиоло-гические методы включают заражение, чаще интраперитонеальное, чувствительных животных (морские свинки, хомячки, хлопковые и белые крысы, белые мыши), развивающихся куриных эмбрионов (в желточный мешок по Коксу), перевиваемых культур клеток (Vero, HeLa, Hep-2, L929), клеток членистоногих.
Животным и в куриные эмбрионы вводят дефибринированную кровь или суспензию растертых в физиологическом растворе сгустков крови, биопсийного материала кожи, а также других тканей больного в зависимости от формы поражений.
При заражении клеточных культур используют плазму, гепаринизированную (или обработанную ЭДТА) кровь, биопсийный материал. Целесообразно выделение возбудителя не только от больного, но и из переносчиков (клещей, блох, вшей).
Эффективно риккетсиологическое обследование снятых с человека переносчиков классическими (выделение возбудителя) и экспресс-методами (метод флюоресцирующих антител, ИФА, РИГА с иммуноглобулиновыми диагностикумами для выявления антигенов риккетсий групп СТ и КПЛ).
Для биопробы используют молодых, весом 300-350 г, морских свинок-самцов. Заражение проводят путем внутрибрюшинного введения 3-5 мл крови или 10%-ных суспензий материалов, содержащих риккетсии (сгустки крови и органы человека и животных, членистоногие). Животным ежедневно измеряют температуру ректально. После инкубационного периода (от нескольких дней до нескольких недель) у морских свинок развиваются различные формы риккетсиозов (лихорадочные, лихорадочно-скротальные, бессимптомные). При заражении R. rickettsii, реже О. tsutsugamushi и С. burnetii у морских свинок может возникать летальная инфекция.
Наиболее характерным проявлением экспериментальных риккетсиозов у морских свинок-самцов при внутрибрюшинном заражении является скротальный феномен — периорхит с накоплением риккетсий во влагалищных оболочках яичка. В ряде случаев может возникать специфический перитонит; риккетсии накапливаются в эндотелиальных клетках кровеносных сосудов различных органов и тканей (тести-кулы, мозг, селезенка, надпочечники). При всех формах инфекционного процесса у биопробных животных выявляют антитела к антигенам риккетсий в различных серологических реакциях (РСК, РНИФ, ИФА) через 2-3 нед. после заражения.
При пассажах штаммов риккетсий на морских свинках наиболее часто используют 10%-ные суспензии мозга и яичек, в ряде случаев также селезенок, надпочечников, реже — печени и почек (Ку-лихорадка, крысиный сыпной тиф). При лихорадке цуцугамуши, крысином и осповидном риккетсиозах, коксиеллезе для изоляции возбудителя можно применять белых мышей. Их заражают внутрибрюшинно 10%-ными суспезиями риккетсиальных материалов в объеме 0,5 мл. Летальность у мышей чаще наблюдается при заражении О. tsutsugamushi, R. akari, реже — R. typhi.
При подкожном заражении морских свинок и белых мышей С. burnetii характерно образование подкожного инфильтрата на месте введения, где накапливаются коксиеллы.
В ряде случаев при экспериментальных риккетсиозах воспроизводят тестикулярные, легочные, перитонеальные и глазные формы инфекционного процесса.
Культивирование в желточных мешках развивающихся куриных эмбрионов более эффективно в отношении накопления риккетсий. Первичное выделение штаммов риккетсий на этой модели проводят редко в связи с высокой вероятностью контаминации посторонней микрофлорой, преимущественно при получений гемокультур.
По результатам овоскопии для заражения отбирают нормально развившиеся куриные эмбрионы с характерным сосудистым рисунком. Заражение проводят со строгим соблюдением правил асептики в специальном стерильном боксе. После дезинфекции спиртом, затем йодной настойкой с последующей обработкой смоченной спиртом поверхности куриного яйца пламенем через пробуравленное в скорлупе отверстие над вершиной воздушной камеры проводят заражение риккетсиальной суспензией в объеме до 0,5 мл проколом в полость желточного мешка. Отверстие в скорлупе заливают расплавленным стерильным парафином. Для контроля на стерильность суспензии для заражения параллельно ее высевают на специальные среды (сахарный бульон, тиогликолевую среду, среды для микоплазмы.
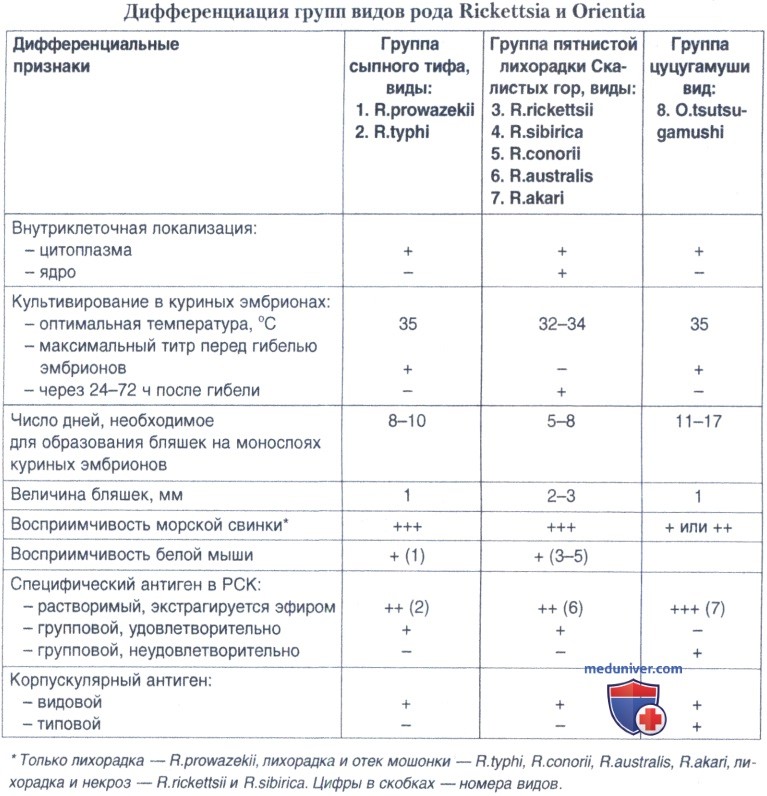
Для культивирования риккетсий группы КПД используют 4-5-суточные эмбрионы, для риккетсий группы сыпного тифа и ориенций — 6-7-суточные, для коксиелл Бернета — 7-8-суточные. Зараженные яйца помещают в термостат при влажности 45-60% и инкубируют при оптимальной для каждой группы риккетсий температуре до массовой гибели эмбрионов. Оптимальной температурой для накопления риккетсий группы сыпного тифа, ориенций и R. akari является 35°С, риккетсий группы клещевых пятнистых лихорадок — 33°С.
При культивировании учитывают сроки гибели зараженных эмбрионов, видимые изменения (геморрагические поражения), интенсивность накопления риккетсий. Погибшие в течение 3 сут. после заражения эмбрионы отбраковывают (неспецифические проявления, чаще — гибель, связанная с травматизацией). При дальнейшей ежедневной овоскопии отбирают для вскрытия погибшие эмбрионы (отсутствие подвижности, утрата сосудистого узора).
Гибель эмбрионов при культивировании риккетсий группы сыпного тифа наступает в более поздние сроки (6-10-е сутки после заражения, иногда и позже), чем риккетсий группы КПД (4-6-е сутки), сопровождается более интенсивным накоплением риккетсий при менее выраженных изменениях геморрагического характера. Заражение куриных эмбрионов коксиеллами Бернета вызывает относительно позднюю гибель эмбрионов (6-8-е сутки) при интенсивном размножении возбудителя без выраженных изменений самого эмбриона.
Для культивирования риккетсий могут быть использованы как первично трипсинизированные, так и перевиваемые культуры клеток. Большинство видов риккетсий размножаются в культурах клеток почечного эпителия, мезотелия, перевиваемых линиях клеток Vero, HeLa, Hep-2, L929. Коксиеллы Бернета хорошо размножаются также в культурах фибробластов куриного эмбриона и морских свинок, макрофагов и ретикулярных клеток костного мозга и селезенки. Получены данные о возможности культивирования на культурах клеток Vero и Нер-2 риккетсий, не культивируемых на традиционных моделях — морских свинках и куриных эмбрионах (R. tarasevichiae, риккетсии подгруппы R. massiliae).
Для пассирования культуры клеток подвергают версенизации по стандартной методике. Культуры клеток Vero и Нер-2 выращивают в стеклянных флаконах, засев проводят в концентрации 150 тыс. клеток на 1мл. В качестве питательной среды используют среду Игла М ЕМ с двойным набором аминокислот, к общему объему добавляют до 10% эмбриональной сыворотки. Подготовленные флаконы заражают 10%-ной риккетсиальной суспензией в объеме 0,5 мл на флакон. Флаконы с зараженным содержимым центрифугируют при 800 об/мин при температуре 22°С в течение 30 мин. После центрифугирования во все флаконы добавляют среду поддержки (Игла МЕМ с добавлением эмбриональной сыворотки до 1%) в объеме 1,5 мл на флакон. Флаконы с зараженными клетками культивируют в углекислотном термостате при температуре 35,6°С в течение 8 сут.
После завершения инкубации все флаконы подвергают замораживанию в низкотемпературном холодильнике на -20°С, а потом оттаиванию для разрушения клеток и максимального выхода из них микроорганизмов. После оттаивания материал центрифугируют 10 мин при 3000 об/мин, супернатант в объеме 0,5 мл берут на следующий пассаж, а из 0,2 мл делают мазки. Остатки супернатанта хранят в криопробирках в низкотемпературном холодильнике. Инфицированность и стерильность культуры клеток определяют в мазках, окрашивая их по Романовскому-Гимзе и методом флюоресцирующих антител. Отсутствие посторонней микрофлоры в пассажах контролируют также посевом на питательные среды (сахарный бульон, тиогликолевая среда, среда Сабуро, среды на микоплазмы).
Развитие инфекции в клеточных культурах у различных видов родов Rickettsia и Orientia отличается. Для риккетсий Провачека и ориенций цуцугамуши характерно накопление микроорганизмов в больших количествах в отдельных клетках. Дегенеративные изменения клеток вследствие перепроизводства возбудителя сопровождаются их разрывом и освобождением микроорганизмов с распространением инфекции на соседние клетки.
У риккетсий группы КПЛ накопление возбудителя в отдельных клетках не сопровождается их переполнением, риккетсии еще на ранней стадии выходят из клеток без существенных их повреждений с быстрым распространением инфекции клеточной культуры. Дегенеративные изменения клеток обусловлены преимущественно токсическим действием риккетсий.
Методы выделения и последующей идентификации риккетсий требуют специальной подготовки, соблюдения режимных требований (возбудители 2-3-й группы патогенности). К возбудителям 2-й группы патогенности относят R. prowazekii, Coxiella burnetii, R. rickettsii. Их культивирование можно осуществлять в специализированных риккетсиологических лабораториях или лабораториях особо опасных инфекций, что ограничивает возможности использования методов выделения риккетсий в диагностических целях.
При изучении штаммов риккетсий придерживаются общей схемы дифференциации, предложенной П.Ф. Здродовским и Е.М. Голиневич (1972), которая включает:
а) изучение морфологии;
б) характеристику размножения при культивировании в желточных мешках куриных эмбрионов;
в) воспроизведение экспериментальной инфекции на лабораторных животных;
г) иммунологическую характеристику в опытах перекрестного иммунитета;
д) серологический анализ антигенной структуры.
Дальнейшая идентификация проводится в перекрестной РСК с сыворотками мышей СВА и набором антигенов риккетсий, в реакции непрямой иммунофлюоресценции (РНИФ) — с моноклональными антителами к риккетсиям, а также при помощи генетических методов (рестрикционный анализ ДНК, ДНК-зондирование, ПЦР с использованием праймеров области гена цитратсинтазы и белкового антигена 190 кД и др.).
а) Серологическая диагностика. У риккетсий и ориенций выявлено наличие перекрестно реагирующих эпитопов с протеями. Реакция агглютинации Вейля-Феликса с протеями была первым тестом, использованным для серодиагностики риккетсиозов. Антигены из клеточных стенок Proteus vulgaris ОХ-2 реагируют в реакции агглютинации с сыворотками больных риккетсиозами группы КПЛ, за исключением пятнистой лихорадки Скалистых гор, Proteus vulgaris OX-19 - с сыворотками крови больных риккетсиозами группы СТ и пятнистой лихорадки Скалистых гор. Сыворотки больных болезнью Брилля-Цинссера и осповидного (вызываемого R. akari) риккетсиоза обычно не вступали в реакцию агглютинации Вейля-Феликса. Ориенции не имеют антигенных связей с риккетсиями групп СТ и КПЛ, однако имеют общие антигенные детерминанты с Proteus mirabilis ОХК, выявляемые в реакции Вейля-Феликса.
В течение многих десятилетий реакция связывания комплемента (РСК) являлась базовым методом серологической диагностики риккетсиозов. Метод обладает высокой групповой специфичностью даже при низких (1:10 — 1:20) разведениях сывороток, однако недостаточно чувствителен в ранней фазе заболевания. Комплементсвязываюшие антитела при большинстве риккетсиозов групп СТ и КИЛ выявляют в конце первой — начале второй недели инфекции, в некоторых случаях — в более поздние сроки. Наличие группоспецифического полисахаридного комплекса в составе препарата растворимого антигена для РСК приводит к отсутствию четкой видовой дифференциации внутри групп СТ и КПЛ, хотя титры антител обычно бывают выше к гомологичному антигену.
Иммуноферментный анализ (ИФА) применяют для серодиагностики риккетсиозов групп СТ и КПЛ, лихорадки цуцугамуши. Используют различные варианты ИФА с ренографин-очищенными антигенами для сенсибилизации планшет. По чувствительности и специфичности ИФА сопоставима с РНИФ, однако имеет некоторые преимущества при выявлении низких титров антител (у вакцинированных, в период поздней реконвалесценции), что можно использовать при ретроспективном эпидемиологическом анализе. В России выпускают тест-системы ИФА для выявления антигенов коксиелл Бернета и антител к ним (Санкт-Петербургский НИИЭМ им.Пастера).
Реакция непрямой иммунофлюоресценции (РНИФ) считается золотым стандартом серологической диагностики риккетсиозов, используемым в большинстве лабораторий. Метод обладает высокой специфичностью и чувствительностью, воспроизводимостью, позволяет выявлять IgM- и IgG-антитела как вместе, так и раздельно в зависимости от применяемых конъюгатов. При риккетсиозах группы КПЛ и лихорадке цуцугамуши диагностически значимые титры IgM-антител выявляют в конце первой недели, IgG-антител — в конце второй недели заболевания. В России корпускулярных антигенов для РНИФ не выпускают, экспериментальные серии производят НИИЭМ им.Гамалеи РАМН, Омский НИИ природноочаговых инфекций, Санкт-Петербургский НИИЭМ им.Пастера.
Методом подтверждения стандартных серологических методов диагностики является иммуноблоттинг. Показано, что перекрестно реагирующие антитела направлены против ЛПС и относятся к IgM-антителам, IgG-антитела образуются как к ЛПС, так и к белковым антигенам риккетсий. Коммерческие наборы для им-муноблоттинга находятся в стадии разработки.
Диагноз коксиеллеза вследствие полиморфизма клинического течения невозможен без лабораторного подтверждения. Основной метод — РСК. Наряду с ним используют более чувствительные методы — РНИФ и ИФА. У больных преобладают антитела к антигену С. burnetii фазы 2; антитела к антигену фазы 1 преобладают при формировании хронического течения.
б) Генетические методы. Генетические методы находят все более широкое применение для изучения и идентификации риккетсий. Среди них используют анализ полиморфизма длин рестрикционных фрагментов ДНК (ПДРФ), метод геномной дактилоскопии (ДНК-зонды), анализ полиморфизма длин рестрикционных фрагментов амплифицированной в полимеразной цепной реакции ДНК (ПДРФ аДНК ПЦР), пульсовый гелевый электрофорез, метод сравнения нуклеотидных последовательностей.
Рестрикционный анализ требует для своего осуществления большого количества ДНК, что на первых этапах генетического изучения риккетсий требовало накопления биомасс риккетсий на чувствительных моделях (желточные мешки куриных эмбрионов, культуры клеток). Использование методов, основанных на полимеразной ценной реакции, является более рациональным. При этом не только не требуется длительное культивирование микроорганизмов, но часто эти варианты генетического анализа оказываются более чувствительными и специфичными.
Несмотря на высокую перспективность, особенно для диагностики новых риккетсиозов и анаплазмозов, эти методы не нашли широкого применения в практике ввиду сложности и трудоемкости, а также в связи с методическими проблемами взятия и исследования клинического материала от больных. Тем не менее при помощи методов генодиагностики в последние годы доказана этиологическая значимость возбудителей ряда новых риккетсиозов — вызываемого R. slovaca синдрома TIBOLA (англ. — tick borne lymphoadenopathy — лимфоаденопатия после присасывания клеща), вызываемого R. heilongjiangii клещевого риккетсиоза и др.
в) Определение чувствительности к антибактериальным препаратам. С учетом внутриклеточного цикла жизни риккетсий определение их антибиотикочувствительности классическими микробиологическими методами невозможно. Для этих целей используют лабораторных животных, развивающиеся куриные эмбрионы и различные модели клеточных культур.
Редактор: Искандер Милевски. Дата публикации: 17.2.2020
Читайте также:


