Статьи научные о лечении дорсопатий
Что такое дорсопатия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Тихонов И. В., мануального терапевта со стажем в 12 лет.

Определение болезни. Причины заболевания
Дорсопатии — группа заболеваний костно-мышечной системы и соединительной ткани, ведущим симптомокомплексом которых является боль в туловище и конечностях невисцеральной этиологии. [9] [10]
Дорсопатия нижней части спины — поражения пояснично-крестцового отдела позвоночника, спинного мозга и паравертебальных структур данной области.
По данным ряда отечественных и зарубежных авторов [2] [4] [6] [14] около 80% случаев возникновения боли в спине вызвано мышечными дисфункциями. С наибольшей вероятностью это связано со значительными погрешностями рационального двигательного режима, несоблюдением эргономических особенностей профессии, игнорированием регулярных физических упражнений, восполняющих дефицит движений.
Специфические причины, такие как злокачественные новообразования, спондилоартропатии, инфекции, переломы позвонков, грыжи межпозвонковых дисков, зарегистрированы в менее чем в 20% случаев при боли в спине. [13] [14]
Симптомы дорсопатии
Патогенез дорсопатии
Патогенез дорсопатии нижней части спины до 80% обусловлен биомеханическими нарушениями позвоночника (растяжение, функциональное блокирование), примерно 10% случаев патогенез заключается в возрастных изменениях фасеточных суставов и межпозвонковых дисков, в 4% —в грыже межпозвонкового диска, в 4% — в остеопорозе, вызывающим перелом позвонков, в 3% — стенозе поясничного отдела позвоночника. Остальные причины патогенеза дорсопатии нижней части спины составляют суммарно 1% случаев. [2]

Классификация и стадии развития дорсопатии
По Международной классификации болезней десятого пересмотра (МКБ-10) дорсопатии делятся на:
1. деформирующие дорсопатии, вызванные деформацией позвоночника, дегенерациями межпозвонковых дисков без их протрузии, спондилолистезами;
2. дегенерации межпозвонковых дисков с протрузиями, сопровождающиеся болевыми синдромами;
3. симпаталгические дорсопатии;
Дорсопатии нижней части спины также можно классифицировать на:
1. первичные:
- дегенеративные изменения в межпозвонковых дисках, дугоотростчатых связках, мышцах;
2. вторичные:
- врожденные аномалии (spina bifida);
- травмы;
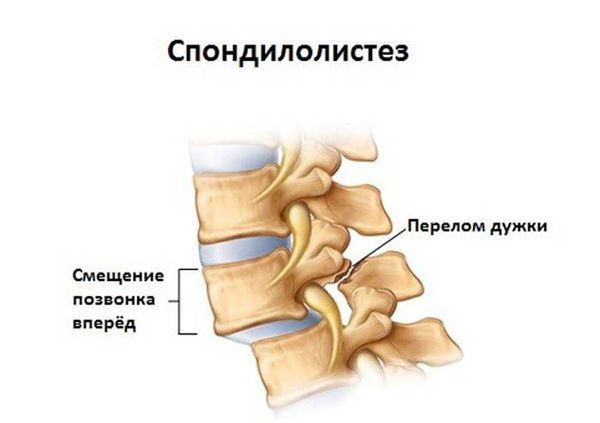
- спондилолистез;
- артриты;
- висцеральная патология;
- заболевания мочеполовой системы;
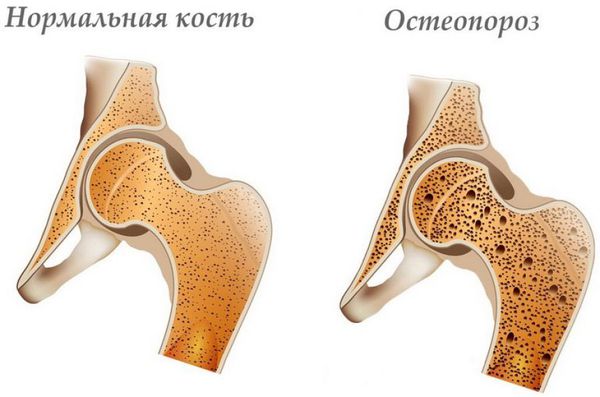
- другие болезни (остеопороз, опухоли, инфекции, психические заболевания). [10]
В зависимости от продолжительности заболевания разделяют три стадии: [2]
1. острое течение (до 6 недель);
2. подострое течение (от 6 до 12 недель);
3. хроническое течение (более 12 недель).
По локализации дороспатия нижней части спины делится на:
1. люмбалгию — боль в поясничном отделе позвоночника;
2. люмбоишиалгию — боль в пояснице, распространяющаяся в ногу;
3. сакралгию — боль в крестцовом отделе;
4. кокцигодинию — боль в области копчика. [6]
Осложнения дорсопатии
В случае несвоевременного и/или неквалифицированного лечения осложнениями дорсопатии нижней части спины могут являться: [8] [11] [12]
- увеличение продолжительности (хронизация) болевого синдрома;
- прогрессирование дистрофических изменений позвоночника (спондилоартроз; пролапс, протрузия, экструзия межпозвонкового диска; остеопороз);
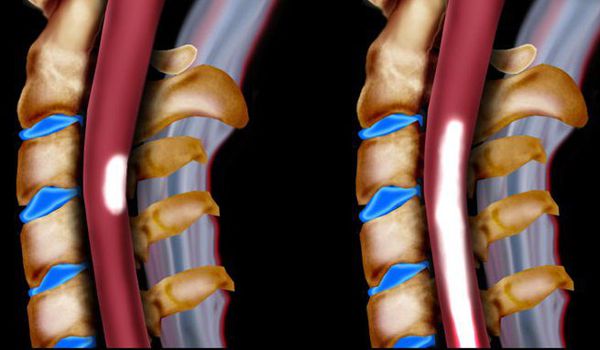
- поражение спинного мозга (миелопатия) и нервных корешков пояснично-крестцового уровня с развитием сенсорных, моторных, смешанных неврологических нарушений в нижних конечностях (корешковые синдромы);
- усиление гипертонуса паравертебральных мышц нижней части спины с возможным формированием вторичного функционального сколиоза;
- возникновение вторичных психоэмоциональных нарушений (тревога, депрессия) при продолжительности болевого синдрома от 1-3 месяцев.
Диагностика дорсопатии
Классическим подходом к первичной диагностике дорсопатии является: [2] [6] [9] [11]
- сбор жалоб и анализ анамнестических данных пациента;
- нейроортопедическое обследование (мануальная диагностика);
- нейровизуализационные методы (рентгенография, МРТ пояснично-крестцового отдела позвоночника);
- нейрофизиологические исследования (стимуляционная, игольчатая электромиография; мигательный рефлекс; Н-рефлекс; соматосенсорные вызванные потенциалы и др.);
- использование шкал, тестов и опросников (визуальная аналоговая шкала, индекс мышечного синдрома, Освестровский опросник при болях внизу спины, опросник Роланда–Морриса; шкала пятибалльной оценки вертеброневрологической симптоматики; самооценка уровня тревожности Спилбергера–Ханина; шестибалльная оценка мышечной силы; опросники нейропатической боли DN4 и PainDETECT и многие другие).
Лечение дорсопатии
Консультация нейрохирурга с возможным оперативным лечением межпозвонковой грыжи должна проводиться в случае неэффективности консервативного лечения, прогрессировании неврологических осложнений, возникновении компрессионной миелопатии, радикулопатии с развитием нарушения функции мочеиспускания, дефекации.
1. Медикаментозное лечение. Как правило, применяется симптоматически. При выраженном болевом синдроме — селективные ЦОГ-2 нестероидные противовоспалительные препараты коротким курсом в виде внутреннего, парентерального, ректального применения с учетом противопоказаний. Центральные миорелаксанты — при выраженном миофасциальном синдроме.
3. Физиотерапевтическое лечение. Самым эффективным методом является чрескожная электронейростимуляция, которая назначается на паравертебральную область нижней части спины в анальгетическом и/или миорелаксирующем режиме.
5. Психологическая коррекция. В случае сопутствующих психоэмоциональных нарушений назначается когнитивно-поведенческая терапия. Проводится клиническим психологом/психотерапевтом индивидуально и в группах.
Прогноз. Профилактика
Самой действенной профилактикой дорсопатий является соблюдение рационального двигательного режима, регулярное выполнение физических упражнений (под контролем тренера), избегание переохлаждений, лечение сопутствующих заболеваний, своевременное обращение к квалифицированному специалисту — врачу-вертеброневрологу, мануальному терапевту. [5] [12]
Диагностика и лечение скелетно-мышечной дорсопатии (или боли в спине) – один из самых актуальных вопросов современной медицины, интересующий неврологов, ревматологов, ортопедов, хирургов, реабилитологов и врачей общей практики.
Актуальность проблемы дорсопатии состоит в морфологической многоликости форм, включенных в это собирательное понятие, а также в высокой встречаемости среди населения. Многоликость проблем этиопатогенеза различных форм дорсопатии и наличие сопутствующих заболеваний нисколько не исключают, а наоборот предполагают поиск универсального лечения болей в спине.
Дорсопатия – наиболее распространенный синдром среди заболеваний костно-мышечной системы во всем мире. Она является одной из основных причин инвалидности, значительно снижает качество жизни и работоспособность и остается ведущей причиной обращения за медицинской помощью в любом возрасте, в т. ч. и пожилых пациентов [1, 2]. В течение жизни хотя бы один эпизод боли в спине переносят 70–80% населения. По данным эпидемиологических исследований, распространенность боли в спине достигает 40–80%. В течение жизни частота дорсопатии может достигать 80%, а годовой показатель колеблется от 25 до 60% в разных этнических группах [3–5]. Дорсопатии отмечаются у разных возрастных групп населения – как у молодых, так и пожилых пациентов [6].
Особенность диагностики состоит в том, что параклинические и лабораторные данные не всегда помогают в постановке диагноза. Часто рентгенологические заключения, данные компьютерной и магнитно-резонансной томографии отражают лишь возрастные особенности позвоночного столба, а постановка диагноза остается прерогативой лечащего врача-клинициста. Для установления причины развития и формы дорсопатии полезно рассмотреть данные состояния с учетом возрастного аспекта – возникновения дорсопатий в зависимости от возраста пациента.
В детском возрасте, по бытующему мнению, страдания позвоночника встречаются нечасто, но, тем не менее, они есть и характеризуются болями, усталостью в спине, нарушением конфигурации и функции позвоночного столба.
Во многом это связано с врожденной патологией – синдромом недифференцированной дисплазии соединительной ткани (ДСТ), частным проявлением которой является гипермобильность суставов. Мезенхимальные дисплазии представляют собой группу заболеваний, характеризующихся врожденным дефектом соединительной ткани. Поскольку при ДСТ имеется патология различных компонентов соединительной ткани, проявления данного состояния различны и включают в себя аномалии скелета, кожи и подкожной клетчатки, нарушение структуры соединительнотканного компонента стенок сосудов различного калибра, изменения со стороны многих внутренних органов и систем. ДСТ – генетически детерминированное нарушение развития соединительной ткани в эмбриональном и постнатальном периодах, характеризующееся дефектами волокнистых структур и основного вещества, приводящее к расстройству гомеостаза на тканевом, органном и организменном уровнях в виде различных морфофункциональных нарушений висцеральных и локомоторных органов с прогредиентным течением [7].
Синдром гипермобильности суставов ведет к хрусту, синовитам, периартритам, подвывихам, нарушениям осанки, плоскостопию, раннему или посттравматическому артрозу, межпозвонковому остеохондрозу и сочетается с пролапсом митрального клапана, дистопией и опущением внутренних органов, патологией внутренних органов и систем организма.
К частному проявлению ДСТ можно отнести подростковую болезнь Шермана Мау (Sheuermann Mau) – прогрессирующую кифотическую деформацию грудного отдела позвоночника, возникающую в период быстрого роста ребенка. Патология встречается у 1% подростков независимо от пола и характеризуется нарушением осанки, тяжестью, усталостью в спине, невыраженными болями. Помимо ДСТ среди причин развития болезни Шермана Мау выделяют наследственную предрасположенность, неравномерное окостенение центров окостенения позвонков, оsteochondritis dissecans – рассекающий остеохондрит, сопровождающийся некрозом костей.
Спондилолистез может протекать бессимптомно, но чаще является причиной возникновения болей, компрессии спинного мозга, тяжелых неврологических нарушений. Появление неврологических расстройств связано с сужением и деформацией смещаемыми позвонками центрального и корешкового каналов, межпозвоночных отверстий. Возможно развитие симптоматики, сходной с нейрогенной хромотой, компрессией корешков и спинномозговых нервов, чаще на уровне LIV-LV.
В возрасте 18–40 лет обычно дебютируют спондилоартриты (СПА) – большая группа воспалительных ревматических заболеваний, объединенных на основании общих клинических признаков (воспалительная боль в спине, сакроилеит, спондилит, моно- или асимметричный олигоартрит; склонность к развитию энтезитов, воспалительные изменения со стороны глаз, кишечника, урогенитального тракта, кожи), а также генетических особенностей (высокая частота наличия антигена гистосовместимости HLA-B27) [10].
Центральную позицию среди СПА занимает идиопатический первичный анкилозирующий спондилит, или болезнь Бехтерева, – воспалительное ревматическое заболевание неизвестной этиологии, при котором обязательно симметрично поражаются крестцово-подвздошные суставы (сакроилеит) и позвоночник (спондилит), что приводит к их анкилозу – центральная (осевая) форма с вовлечением периферических суставов (периферическая форма). К другим заболеваниям этой группы относят реактивный и псориатический артриты, артриты, связанные с хроническими воспалительными заболеваниями кишечника, а также недифференцированный СПА [11, 12].
Клинически СПА характеризуются как общими симптомами (слабость, астения, лихорадка, похудание и др.), так и болями с тугоподвижностью в позвоночнике и периферических суставах. Функциональная недостаточность позвоночника определяется при СПА простыми симптомами, перечисленными ниже.
Симптом Томайера – способность доставать кончиками пальцев кистей пола при несогнутых коленях. В норме пол достается пальцами пациента.
Симптом Шобера – расстояние между точками пересечения оси позвоночника с линией, соединяющей боковые углы ромба Михаэлиса, и точкой на 10 см выше. При максимальном наклоне пациента вперед это расстояние увеличивается до 14 см.
Симптом Отта – расстояние в 30 см вниз от остистого отростка 7-го шейного позвонка (vertebera prominens). При максимальном наклоне вперед данное расстояние увеличивается до 35 см.
Уменьшение в сантиметрах данных объемов движений показывает степень ограничения сгибательной функции позвоночника как при спондилоартритах, так и других дорсопатиях.
В целом боли при СПА носят воспалительный характер. Воспалительные боли характеризует: начало до 40 лет, продолжительность более 3 мес., постепенное начало болевых ощущений, утренняя скованность, уменьшение болей после физических упражнений. Боли считаются воспалительными при наличии любых 4 признаков [13].
Механический характер болей характеризуется возникновением и/или усилением их при динамических или статических нагрузках и специфичен для миофасциального синдрома (МФС) – варианта соматогенной боли, источником которой являются скелетные мышцы и прилегающие фасции, в частности в области позвоночника. МФС может встречаться в любом возрасте, самостоятельно как вариант дорсопатии, а также при наличии другой патологии в позвоночнике [14].
В понятие МФС при дорсопатиях можно включить патологию энтезисов, которая нередко отмечается в местах прикрепления: шейных мышц к затылочному гребню, надостной мышцы к ости лопатки, ромбовидных мышц к внутреннему углу лопатки и др. В.О. Маркс (1978 г.) отмечал болевые точки в местах прикрепления к костям m. sacrospinales, m. gluteus maximus, перехода длинной мышцы спины в сухожилие, в области перехода m. tensor fasciae latae в ягодичную фасцию, в местах повреждения над- и межостных связок [16]. МФС характеризуется локальным болевым синдромом скелетной мышцы и сопутствующим спазмом, которые взаимно усиливают друг друга.
Остеохондроз позвоночника как проявление дегенеративно-дистрофических изменений позвоночного столба включает в себя: артроз фасеточных суставов, дегенеративную болезнь межпозвонковых дисков (проявляется межпозвонковыми грыжами) с реактивными изменениями тел позвонков (спондилез).
Спондилез – хроническое заболевание позвоночника, сопровождающееся деформацией позвонков за счет разрастания костной ткани на их поверхности в виде выступов и шипов, а также дегенерацией с возможным последующим сужением позвоночного канала и межпозвонковых отверстий, что оказывает давление на нервные корешки. Находясь преимущественно под передней продольной связкой позвоночника, остеофиты раздражают ее, что вызывает болевой синдром. Появление этих выростов является защитной пролиферативной реакцией организма на дегенерацию межпозвонковых дисков. Разрастание остеофитов по краям позвонков вызывает как болевое, так и механическое ограничение подвижности позвоночника.
Спондилез фиксирует участок, подвергающийся механической и статической перегрузке, вызывая раздражение нервных окончаний продольных связок. Пациенты испытывают тупую, ноющую локальную боль и тяжесть в позвоночнике. Спондилез сопровождается напряжением мышц вокруг двигательного сегмента, и тогда эти два фиксирующих механизма не только усугубляют боль, но и ухудшают амортизационную функцию позвоночника, выпрямляя его физиологические изгибы. Спондилезом, как правило, заболевают люди среднего и пожилого возраста.
Межпозвонковые грыжи отмечаются у людей немолодого возраста и являются проявлением дегенеративной болезни межпозвонковых дисков, состоящих из фиброзного кольца и пульпозного ядра, что характеризуется истончением, разволокнением, разрыхлением структур диска со снижением его прочности [22, 23]. Принято различать грыжу диска по следующим стадиям. Протрузия – выпячивание всего фиброзного кольца или его части с сохранением его целостности, когда ядро диска находится по центру. Пролапс характеризуется тем, что вещество ядра смещено от центра кзади и проникает в трещины фиброзного кольца. Об экструзии говорят тогда, когда вещество ядра проникает через фиброзное кольцо, но удерживается задней продольной связкой. Секвестр (свободный фрагмент) – проникновение поврежденного диска через заднюю продольную связку в позвоночный канал.
Наиболее часто встречаются парамедиальные грыжи, формирующиеся в местах, где продольные связки слабые, однако наибольшую опасность представляют фораменальные грыжи со сдавлением нервного корешка. В целом, появление межпозвонковых грыж является стигмой дегенеративного заболевания межпозвонковых дисков.
Клиника грыжи диска включает в себя: боль в спине и, возможно, в ноге; усиление боли при кашле, чихании, смехе; антальгический сколиоз; усиление боли при вертикальном положении, при подъеме выпрямленной ноги. Болевой синдром может наблюдаться длительное время. Ремиссия болевого синдрома при межпозвонковой грыже может возникнуть при фиброзном анкилозе (самопроизвольной иммобилизации позвонкового сегмента), уменьшении реактивного отека сдавливаемого корешка, адаптации корешка к новой анатомической ситуации, гибели нервного корешка, уменьшении отека и набухания диска, высыхании пролапса диска [24].
Идиопатический анкилозирующий гиперостоз скелета (старческий лигаментоз, гиперостоз позвоночника) – заболевание лиц пожилого возраста, характеризующееся ограничением подвижности за счет окостенения в местах прикрепления к костям сухожильно-связочного аппарата (окостенение сухожилий и связок). При этом не наблюдается поражений со стороны внутренних органов, суставов и хрящей. Окостенение чаще встречается в передней продольной связке, обычно в шейном и грудном отделах позвоночника.
Заболевание впервые описано в 1950 г. французским неврологом J. Forestier и носит имя автора – болезнь Форестье. В англоязычной литературе заболевание называется Diffuse Idiopathic Skeletal Hyperostosis (DISH). Причины болезни Форестье до конца не выяснены. Есть предположения, что заболевание может быть связано со старением соединительных тканей.
Клиническая картина характеризуется скованностью и затрудненностью движений при поворотах тела и наклонах. Возможны слабые боли в позвоночнике. Симптомы наиболее отчетливо наблюдаются после сна, длительного нахождения в одной позе, после физической нагрузки, к концу дня. Симптомы могут носить как периодический, так и постоянный характер. Степень их выраженности может быть различной.
При дифференциальной диагностике дорсопатий в любом возрасте необходимо помнить о специфических заболеваниях позвоночника: септические процессы, туберкулез, опухоли и др.
Метастатическое поражение структур позвоночника встречается чаще, чем первичные опухоли. Метастазы в позвоночник обнаруживаются у 70% пациентов с первичными опухолями. Среди опухолей, которые наиболее часто метастазируют в структуры позвоночника, – опухоли молочных желез, легких, предстательной железы, почек, лимфома, меланома и опухоли желудочно-кишечного тракта (ЖКТ). Боль в спине, которая будит пациента ночью, может также указывать на опухоль [27].
Многоликость проблем этиопатогенеза различных форм дорсопатий, наличие сопутствующих заболеваний нисколько не исключают, а наоборот предполагают поиск универсального лечения болей в спине. Эпизоды болей в спине полностью обратимы – следовательно, лечение не должно вызывать побочных эффектов. При подходе к лечению боли в спине автор основывался на нескольких положениях.
Для лечения дорсопатий был выбран Амелотекс (международное непатентованное название мелоксикам) – нестероидный противовоспалительный препарат, относящийся к классу оксикамов, производных энолиевой кислоты, обладающий анальгетическим, противовоспалительным и жаропонижающим действием. Амелотекс селективно ингибирует ферментативную активность ЦОГ-2, подавляет синтез простагландинов в области воспаления в большей степени, чем в слизистой оболочке желудка или почках. Реже вызывает эрозивно-язвенные поражения ЖКТ по сравнению с обычными НПВП. Амелотекс зарекомендовал себя как препарат с равной клинической эффективностью и безопасностью в сопоставлении с оригинальным препаратом мелоксикама, особенно при локальном введении их в триггерные зоны при нижнепоясничном болевом синдроме [39].
Амелотекс выпускается в различных фармацевтических формах: в ампулах по 1,5 мл в виде раствора для внутримышечного введения, где одна ампула содержит в качестве активного вещества 15 мг мелоксикама; в таблетированной форме по 7,5 и 15 мг; в свечах по 7,5 и 15 мг мелоксикама, а также в виде 1% геля для наружного применения по 30,0 г или 50,0 г в алюминиевых тубах.
Для профилактики хронизации боли, коррекции нарушений метаболического характера и воздействия на проводники боли был выбран поливитаминный препарат с нейротропной направленностью Комплигам В – комбинированный продукт, содержащий витамины группы В (пиридоксин, тиамин, цианокобаламин), а также лидокаин. Витамины группы В оказывают благоприятное действие при воспалительных и дегенеративных заболеваниях двигательного аппарата и нервов. Они применяются для устранения дефицитных состояний, а в больших дозах обладают анальгезирующими свойствами, способствуют усилению кровотока, нормализуют работу нервной системы и процесс кроветворения. Тиамин (витамин В1) играет ключевую роль в процессах углеводного обмена, имеющих решающее значение в обменных процессах нервной ткани. Пиридоксин (витамин В6) участвует в метаболизме белков и частично в метаболизме углеводов и жиров. Физиологической функцией обоих витаминов (В1 и В6) является потенцирование действия друг друга, проявляющееся в положительном влиянии на нервную, нейромышечную и сердечно-сосудистую системы. Цианокобаламин (витамин В12) участвует в синтезе миелиновой оболочки, стимулирует гемопоэз, сокращает болевые ощущения, связанные с поражением периферической нервной системы, стимулирует нуклеиновый обмен через активацию фолиевой кислоты. Лидокаин – местноанестезирующее средство, вызывает все виды местной анестезии.
В начале и в конце 10-дневной терапии проводился общеклинический осмотр пациентов, определялась выраженность боли в спине (по 100-миллиметровой визуальной аналоговой шкале – ВАШ), функциональное состояние позвоночника (тест Шобера, Томайера, Отта в см), оценивались переносимость и эффективность исследуемого препарата.
Таким образом, при назначении больным дорсопатией 10-дневного курса препаратов Амелотекс и Комплигам В отмечено их симптом-модифицирующее действие, проявившееся в уменьшении болевого синдрома в спине, увеличении объема движений в позвоночнике, улучшении общего самочувствия. Полученные результаты позволяют констатировать хорошую переносимость данных препаратов и их клиническую эффективность при лечении дорсопатий.
Шостак Н.А.
Кафедра факультетской терапии им. акад. А. И. Нестерова, РГМУ
В настоящее время боли в спине (БС) широко распространены, а в развитых странах, по данным экспертов ВОЗ, достигли размеров неинфекционной эпидемии, что в большинстве случаев связано с возрастающими нагрузками на человека. Высокая инвалидизация лиц трудоспособного возраста вследствие поражений опорно-двигательного аппарата возводят проблему лечения БС в ранг актуальной (13).
Широкое распространение БС, в том числе у лиц молодого и среднего трудоспособного возраста, обусловливают большое социально-экономическое значение данной проблемы. Поэтому в число приоритетных направлений, рекомендованных ВОЗ к детальному изучению в рамках "Декады костей и суставов" (The Bone and Joint Decade 2000-2010 гг.) отнесены и боли в спине (WHO, 1999).
Вместе с тем многие вопросы диагностики и лечения БС не решены и находятся на стадии обсуждения и изучения. Анализ отечественной и международной литературы показал, что ни мануальная терапия, ни физиотерапия, ни тракция позвоночника, а также другие методы лечения БС, рекомендованные ВОЗ, не решили проблему. Хирургическая стабилизация с декомпрессией позвоночника является дорогостоящим методом лечения, применяемым лишь у небольшого числа больных с осложненным течением заболевания (грыжи дисков, стеноз позвоночного канала и др.).
В связи с этим, разработка новых методов консервативного лечения болей в спине является перспективной и актуальной.
В МКБ-10 дегенеративные заболевания позвоночника включены в класс "болезни костно-мышечной системы и соединительной ткани (МОО-М99)", при этом выделены:
- Артропатии (МОО-М25)
- Системные поражения соединительной ткани (МЗО-М36)
- Дорсопатии (М40-М54)
- Болезни мягких тканей (М60-М79)
- Остеопатии и хондропатии (М80-М94)
- Другие нарушения мышечной системы и соединительной ткани (М95-М99).
Под термином "дорсопатия" понимают болевые синдромы в области туловища и конечностей невисцеральной этиологии и связанные с дегенеративными заболеваниями позвоночника.
По мнению профессора Федина А.И., термин "дорсопатии" в соответствии с МКБ-10 должен постепенно заменить до сих пор применяющийся в нашей стране термин "остеохондроз позвоночника", типичными проявлениями которого является дегенерация межпозвоночного диска и сегментарная нестабильность позвоночника (6).
Дорсопатии делятся на 3 основные группы: деформирующие дорсопатии, спондилопатии, дорсалгии. В разделе "спондилопатии" наиболее распространенными дегенеративными изменениями является спондилез. в который включены артроз и дегенерация фасеточных (дугоотростчатых) суставов (спондилоартроз).
Под дорсалгией следует понимать болевой синдром в спине, обусловленный дистрофическими и функциональными изменениями в тканях опорно-двигательного аппарата (дугоотростчатые суставы, межпозвонковые диски (МПД), фасции, мышцы, сухожилия, связки) с возможным вовлечением смежных структур.
Большинство авторов придают важное значение в происхождении болей в спине артрозу дугоотросчатых суставов (6, 9). Спондилоартроз — это разновидность остеоартроза с локализацией дегенеративного процесса, локализация в межпозвоночных суставах, являющихся обычными синовиальными суставами с двумя суставными поверхностями, покрытыми гиалиновым хрящом. В настоящее время доказано, что процессы дегенерации хряща при остеоартрозе и спондилоартрозе развиваются по однотипному сценарию (5).
Спондилоартроз — самая частая причина болей в пояснице у лиц пожилого возраста. При артрозе Фасеточных суставов боль обычно двухсторонняя, локализуется, в отличие от дискогенной, паравертебрально, а не по средней линии, усиливается при длительном стоянии и разгибании и уменьшается при ходьбе и сидении.
Рентгенологические признаки спондилоартроза.
-
1. Субхондральный склероз суставных поверхностей;
2. Сужение суставной щели вплоть до ее полного исчезновения;
3. Костные разрастания в зоне суставов и деформации суставных отростков
В зарубежных исследованиях рентгенологические параметры при спондилоартрозе часто оцениваются по классификации Kellgren, согласно которой выделяются 4 градации — от 1 (отсутствие остеофитов) до 4 (большие осеофиты, склероз замыкательных пластинок, снижение высоты МПД вплоть до его исчезновения) (9).
Имеются 2 основных звена патогенеза болевых синдромов в области позвоночника при дорсопатии. I механизм связан с раздражением ноцицепторов (болевых рецепторов), расположенных в капсулах суставов,
связок, мышцах позвоночника, в периосте позвонков, в наружной трети фиброзного кольца межпозвоночного диска, в стенках артериол, вен, а также в сосудах паравертебральных мышц, с образованием очагов миоостеофиброза, играющих роль пусковых зон боли, то есть триггерных зон, формирующих миофасциальный синдром. Раздражение триггерных точек (мышечный стресс, переутомление, неудобная поза, охлаждение, стресс, подъем тяжестей и т.д.) вызывает локальную, либо отраженную боль и локальное мышечное уплотнение.
Именно локальное воздействие на указанные триггерные точки является главным патогенетическим подходом к лечению спондилогенных и невертеброгенных проявлений дорсопатии.
Второй механизм обусловлен развитием неврогенного асептического воспаления в зоне раздражением позвоночнодвигательного сегмента (ПДС) (9) (см. схему).
Схема.
Механизмы асептического неврогенного воспаления при спондилоартрозе (Borenstein D., 2000).
Поражение позвоночно-двигательного сегмента (ПДС)
Раздражение ноцицепторов в сухожилиях, фасциях, мышцах, по периферии фиброзного кольца
Возбуждение через синапсы в спинной мозг
Синтез провоспалительных питокинов (ИЛ-1, ИЛ-6, ТНФ-?), лейкотриенов, простагландинов (пг) в синапсах
Активация интактных нейронов с распространением на неноцицептивные зоны
Активация нервных клеток в ядрах таламуса, коры головного мозга, синтез цитокинов лейкотриенов непосредственно в нервных окончаниях
"Неврогенное асептическое воспаление" на ультраструктурном уровне с хемотактическими "приманками" для провоспалительных цитокинов
Новообразование коллагена на месте пораженных воспалением аксонов
Как видно из представленной схемы, в процессе дегенерации межпозвонкового диска и активации ноцицепторов возникают биохимические и иммунные реакции, которые завершаются формированием асептического нейрогенного воспаления в результате "цитокинового каскада" на разных уровнях.
Лечение спондилоартроза, осложненного болями в спине с позиций доказательной медицины включает основные положения по режиму труда и отдыха и лекарственной терапии (2):
1. Режим труда и отдыха.
- Больному рекомендуют продолжать обычную повседневную деятельность или как можно скорее возобновить ее.
- Больному рекомендуется избегать постельного режима.
- Если симптоматика сохраняется в течение более 2 недель, следует начать упражнения, укрепляющие мышцы туловища и нижних конечностей.
- Достоверных доказательств эффективности ношения поддерживающего корсета не существует.
2. Лекарственные препараты.
- При болях в спине доказана эффективность НПВП (2).
Нестероидные противовоспалительные препараты
(НПВП) должны включаться в программу лечения как можно раньше, в 1-2-ой день от начала заболевания. Противоспалительный эффект НПВП обусловлен их способностью ингибировать ЦОГ-2 — провоспалительный изофермент. Развитие побочных реакций, присущих большинству НПВП, связано с одновременным подавлением физиологического фермента — ЦОГ-1. Противовоспалительная и анальгетическая активность НПВП связана с уменьшением продукции простагландинов (3).
Вместе с тем, накапливаются данные о том, что противовоспалительное и анальгетическое действие НПВП объясняется не только подавлением ЦОГ. Предполагают, что НПВП ингибируют активацию и хемотаксис нейтрофилов и уменьшают продукцию токсических кислородных радикалов в стимулированных нейтрофилах, тормозят активность фактора транскрипции NF-kB, ингибируя стимуляцию синтетазы оксида азота (3,4).
Показано, что НПВП обеспечивают длительную (включая ночную) аналгезию без развития зависимости, как при применении наркотических аналгетиков. Однако надо отметить, что до настоящего времени применение НПВПне решило проблему борьбы с БНС. Это связано, в частности, с тем, что необходимость использования препаратов в течение длительного времени, особенно при хроническом варианте БНС, ставит вопрос о поиске эффективного и безопасного НПВП из-за недостаточной клинической эффективности большинства НПВП и частого развития НПВП — гастропатий, являющихся одним из самых частых осложнений НПВП и развивающихся у 45-60 % больных (3,4). Преодоление такого серьёзного осложнения стало возможным благодаря разработке нового класса НПВП-селективных ингибиторов ЦОГ-2 (Таблица 2).
Таблица 2.
Классификация НПВП.
Механизм действия
Препараты
Селективные ЦОГ-1 ингибиторы
низкие дозы аспирина
Неселективные ингибиторы ЦОГ-1 и ЦОГ-2
диклофенак, кетопрофен, ибупрофен
Преимущественно селективные ингибиторы ЦОГ-2
мелоксикам (мовалис), нимесулид
Селективные ингибиторы ЦОГ-2
целекоксиб и другие
Мелоксикам (Мовалис) компании Boehringer Ingelheim — новый НПВП, обладающий высокой селективностью в отношении ЦОГ-2, что подтверждено с использованием различных стандартных методов in vitro in vivo и объясняет высокий профиль гастроинтестинальной безопасности (10). Клиническая эффективность изучена более чем в 230 клинических исследованиях, в которых принимали участие более 30000 пациентов. Международный и российский опыт изучения Мовалиса показал его высокую эффективность при остеоартрозе, в т.ч. спондилоартрозе при низком числе побочных реакций (4, 12). Селективное ингибирование ЦОГ-2 позволяет использовать препараты этой группы и при хроническом варианте течения БС.
В отечественных и зарубежных исследованиях были показаны высокая эффективность и безопасность мовалиса, применяемого в таблетках (в суточной дозе 15 мг) при лечении спондилеза (спондилоартроза) с синдромом БС (7, 8). По данным ДА. Шеметова эффективность мовалиса составила 80%, безопасность — 88% (7).
В настоящее время важным является появление первого ЦОГ-2 селективного ингибитора в инъекционной форме, который содержит 15 мг мелоксикама/1,5 мл раствора для глубоких инъекций.
В.В. Алексеев использовал Мовалис в инъекционной форме у 20 больных с люмбоишалгией. Мовалис вводился внутримышечно 15 мг 1 раз в день в течение 3 дней с последующим переходом на оральное применение препарата в дозе 15 мг в сутки в течение 2 недель. Автор показал высокую эффективность инъекционной формы мелоксикама, закрепляемую последующим 2-недельным применением препарата (1).
Сравнение внутримышечного и перорального применения мелоксикама в общей сложности у 68 здоровых добровольцев и более чем у 800 пациентов, страдающих артритом, люмбаго, показало, что при острых воспалительных ревматических заболеваниях действие мелоксикама при в/м введении начинается быстрее по сравнению с приемом внутрь (10,11).
Результаты контролируемых исследований подтверждают высокую эффективность и очень хорошую локальную и общую переносимость внутримышечной формы мелоксикама, сравнимую с пероральной формой (8).
Известно, что уровень КФК в плазме является чувствительным индикатором повреждения скелетных мышц и важным критерием местной переносимости внутримышечных инъекций, которые могут приводить к ферментопатии вследствие прямого повреждения мышц, хемотоксичности или стимуляции выброса гистамина. Некоторые НПВП, которые можно использовать в виде инъекций, вызывают некроз мышечных волокон, что видно по повышению уровня КФК. В исследовании В. Combe и соавт. получено подтверждение ранее полученных данных о том, что мелоксикам при внутримышечном введении (15 мг) не вызывает статистически достоверного увеличения содержания в плазме КФК (11).
Таким образом, мелоксикам доказал себя эффективным и хорошо переносимым как при внутримышечных инъекциях, так и при пероральном приеме.
Эффективность и безопасность Мовалиса официально признана в России. Мовалис — единственный ЦОГ-2 селективный препарат, включенный в перечень жизненно необходимых и важнейших лекарственных средств, утвержденный постановлением Правительства РФ №425 от 04.04.2002
Наличие инъекционной формы Мовалиса позволяет использовать принцип ступенчатой терапии болевых синдромов при дегенеративных заболеваниях позвоночника (спондилезе, спондилоартрозе): в остром периоде показано внутримышечное введение мовалиса в суточной дозе 15 мг (в течение 3 дней) с последующим переходом на пероральную терапию Мовалисом в той же дозе в течение 2 недель.
Важным элементом лечения БС является также локальная терапия, которая зарекомендовала себя эффективным дополнительным методом лечения, в ряде случаев имеющим отчетливые преимущества перед пероральными формами препаратов. Для лечения БС рекомендуюся мазевые, кремовые и гелевые формы НПВП, а при упорных болевых симптомах, связанных с механическими факторами — препараты, способные глубоко проникать в кожу и подкожную клетчатку, блокируя болевые рецепторы. Хорошо зарекомендовал себя препарат Финалгона, представляющий собой комбинацию из двух сосудорасширяющих веществ — нонивамида и никобоксила. Первый обладает болеутоляющим действием в результате непосредственной стимуляции чувствительных нервных окончаний, а никобоксил приводит к расширению капилляров и создает ощущение тепла. Под действием Финалгон активизируются обменные процессы, расширяются кровеносные сосуды, усиливается местный кровоток, снижается тонус мышц. Финалгон применяется местно на суставы и мягкие ткани позвоночника. Финалгон действует как эффективное раздражающее средство и как тепловой пластырь, при этом отмечается уменьшение выраженности мышечного спазма, миалгий и артралгий. Препарат хорошо переноситься больными, в редких случаях возможны аллергические кожные реакции.
Препарат Финалгель (пироксикам гель) не только уменьшает боль, но и купирует воспаление. Он хорошо проникает в подкожную жировую клетчатку, мышцы, связки и синовиальную жидкость, обладая анальгетическим, противовоспалительным, противоотечным и охлаждающим действием, что позволяет использовать его в остром периоде болевого синдрома при спондилоартрозе.
Таким образом, в настоящее время лечение болей в спине оптимизировано использованием ступенчатой терапии с помощью внутримышечной и пероральной форм МОВАЛИСА — селективного ингибитора ЦОГ-2 в силу его высокой эффективности и безопасности, а также препаратов местнорефлекторного (Финалгон) и противовоспалительного (Финалгель) действия в связи с отчетливо выраженной положительной динамикой на течение спондилоартроза с регрессом болевого синдрома.
Список литературы.
1. Алексеев В.В. Применение мелоксикама в лечении люмбоишиалгического синдрома. Русс. Мед. Журнал т. 11, №7, 2003, с. 416-418.
2. Клинические рекомендации для практических врачей, основанные на доказательной медицине. Изд. дом "ГЭОТАР-МЕД", 2001, с. 606-611.
3. Насонов Е.Л. Нестероидные противовоспалительные препараты (перспективы применения в медицине). М., 2000, 262.
4. Насонов Е.Л., Цветкова Е.С. Селективные ингибиторы циклооксигеназы-2: новые перспективы лечения заболеваний человека. Тер. Архив, 1998; 5:8-14.
5. Павлов В.Н., Копьева Т.Н., Слуцкий Л.И., Павлов Г.Г. Хрящ. М., Медицина, 1988, с. 209.
6. Федин А.И. Дорсопатии (классификация и диагностика). Атмосфера.Нервные болезни, 2002, №2, 2-8.
7. Шеметов Д.А. Клинико-гемодинамические показатели при спондилезе (спондилоартрозе), осложненном болями в нижней части спины, и их динамика в процессе терапии. Автореферат дисс. канд. мед. наук, Москва, 2001, с. 1-24.
8. Auvinet В., Ziler R., Appelboom T. et al. Comparison of the onset and intensity of action of intramuscular meloxicam and oral meloxicam in patients with acute sciatica. Clinical Therapeutics. 1995; 17;6: 78-90.
9. Borenstein D. "Эпидемиология, этиология, диагностическая оценка и лечение поясничной боли". Междун. Медиц. Журнал, 2000, №35, с. 36-42.
10. Bosch H., Sigmund R., Hettich M. Efficacy and tolerability of intramuscular meloxicam and oral meloxicam in patients with acute lumbago: comparison with intramuscular and oral piroxicam. Curr. Med. Res. Opin. 1997; 14; 1:29-38.
11. Combe В., Velicitet P., Garson N. et al. Comparison of intramuscular and oral meloxicam in rheumatoid arthritis patients. Inflamm. Res. 2001; 50; 1: 10-16.
12. Euller-Ziegler L., Velicitat P., Bluhmki E. et al Meloxicam: a review of its pharmacokinatics, efficacy and tolerability following intramuscular administration. Inflamm. Res. 2001; 50; 1: 5-9.
13. WHO. Department of noncomunicable disease menagement. Low back pain iniciative. Geneve. 1999.
Читайте также:


