Суставной синдром при онкологии
Сустав – это сложная анатомическая структура, обеспечивающая подвижное соединение двух костей скелета, поэтому его также называют диартрозом. Каждый сустав – своеобразный соединительный узел костной структуры скелета. Опорно-двигательная функция тела человека обеспечивается согласованной работой костно-мышечного аппарата и диартрозов. Болезни диартрозов многочисленны и разнообразны, в связи с чем, подразделены на группы. Одна из групп представлена онкологическими болезнями.
Разновидности новообразований
Диартрозы образованы соединительнотканными структурами костей, хрящей, связок, сухожилий, стенок кровеносных сосудов и костного мозга. Клетки соединительной ткани способы к перерождению, с возникновением рака.
По гистологическому признаку различают до тридцати видов злокачественных новообразований диартрозов. Фиброзный компонент соединительнотканных структур – источник формирования хордомы, фибросаркомы, гистиоцитомы, ангиосаркомы. Из клеток костей способны развиваться остеосаркомы и опухоль Юинга, из клеток хряща – хондросаркомы. При атипичном перерождении клеток костного мозга возникает миелома.
Частота встречаемости, возрастные категории
Наиболее часто встречаются миеломы, остеосаркомы, хондросаркомы, опухоли Юинга. Остальные виды онкологических болезней суставов встречаются реже.
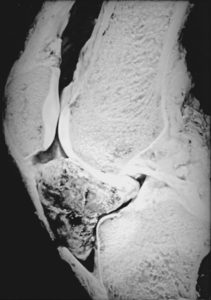
Остеосаркома чаще встречается у подростков 15-17 лет и у взрослых старше 65 лет. Саркома Юинга характерна для подросткового возраста.
Частота заболевания хондросаркомой возрастает с увеличением возраста. Поэтому люди пожилого возраста составляют группу риска по этому заболеванию.
Причины возникновения и типичная локализация
Причинами развития новообразований суставов являются травмы или хронические болезни, остеосинтез или эндопротезирование в анамнезе, наследственность, снижение иммунитета.
Преобразование структуры тканей в атипичную может также происходить под воздействием ионизирующего излучения.
Область колена – излюбленная локализация остеосаркомы. Частота возникновения – около пятидесяти процентов случаев. Поражается бедренная или большеберцовая кость, с вовлечением в патологический процесс коленного сустава. Следующее место, по частоте встречаемости, занимает область плеча. При локализации в области лицевого скелета опухоль чаще располагается в нижней, а не в верхней челюсти. Опухоли пальцев кистей нетипичны для этого заболевания.
Саркома Юинга локализуется преимущественно в бедренной кости и тазобедренном суставе. Встречаются редкие случаи поражения рёбер, лопатки, ключицы.
Хондросаркома – злокачественное новообразование, возникающее в результате перерождения хрящевой ткани. Различают первичную хондросаркому и образовавшуюся из первоначально доброкачественной опухоли хряща. Излюбленной локализацией является плечевой, локтевой и тазобедренный сустав. Также может располагаться в рёбрах и позвоночнике.
Фиброзная гистиоцитома – злокачественная опухоль мягких тканей. Может происходить из забрюшинного пространства, но также может поражать туловище, области рук и ног, в том числе – и структуры диартрозов.
Рак первичный и метастатический
- Первичный рак. Все перечисленные разновидности онкологических заболеваний относятся к первичному раку. Это означает, что перерождение нормальных соединительнотканных клеток в атипичные происходит непосредственно в пределах поражённого сустава.
- Метастатический рак. Является самым частым в ортопедической онкологии. Первично поражается другой орган. Чаще – это лёгкие, молочные железы, предстательная железа, кишечник. Перенос атипичных клеток в диартроз осуществляется вместе с током лимфы и крови.
Симптоматика
Первичный рак характеризуется следующей симптоматикой.
Общие симптомы характерны для всех злокачественных новообразований. К ним относятся снижение массы тела, общая слабость, отсутствие аппетита, тошнота, нарушения вкуса, периодическое повышение температуры тела. Такая симптоматика появляется, как правило, уже на поздних стадиях заболевания.
Местные симптомы относятся к диартрозу, вовлечённому в онкологический процесс. Различия касаются только локализации. Симптоматика одинакова. К ней относятся ноющая боль в области сустава в покое и при движениях, припухлость, болезненность при прикосновении, нарушение сгибания и разгибания в диартрозе, деформация костей. Характерный симптом – ночной характер болей, резистентных к применению анальгетиков. Болевой синдром прогрессивно нарастает.
Иногда наблюдаются боли в животе, тошнота и рвота. Это признаки гиперкальциемии, возникающей из-за разрушения костной структуры и поступления кальция в кровоток.
При поражении кости нередки патологические переломы.
Симптоматика метастатического и первичного рака различна. Первые симптомы характерны для поражённого органа – источника метастазирования. Проявление общей симптоматики наступает раньше. Из-за множественного характера метастазирования поражаются несколько суставов. Увеличиваются близлежащие лимфатические узлы, так как именно с током крови и лимфы происходит распространение атипичных клеток.
Признаки рака и методы диагностики
Метастазирование в кости или лёгкие сопровождается симптомами, характерными для поражения соответственных органов.
Диагностика онкологических болезней невозможна без дополнительных инструментальных и лабораторных исследований. К необходимым инструментальным методам относятся рентгенография сустава, взятие биопсии ткани поражённого участка. Различают пункционную и оперативную биопсию. К лабораторным методам относится цитологическое и гистологическое исследование участка, полученного при биопсии. Также информацию, подтверждающую диагноз, можно получить при биохимическом исследовании крови.

Для выявления наличия метастазов в другие органы проводится рентгенография, компьютерная томография, остеосцинтиграфия.
Лечение
Патология диартрозов – сфера деятельности ортопедов, а лечением рака суставов занимается ортопедическая онкология. Терапия обязательно должна быть комплексной. Комплекс мероприятий включает химиотерапию, лучевую терапию и операцию.
Чувствительность злокачественного новообразования к лучевой терапии или химиотерапии позволяет выбрать подходящий метод для первого и третьего этапа.
Стандартное лечение проходит в три этапа.
Проведение предоперационной химиотерапии или лучевой терапии. Цель – уменьшение опухоли и подавление мелких метастазов.
Включает операции по удалению опухоли, лимфатических узлов и реконструктивные операции.
Оперативное лечение – основное звено в комбинированной терапии опухолей диартрозов, направленное на удаление опухоли. Большинство операций имеют функционально-щадящий, органосохраняющий характер. К примеру: резекции поражённого участка кости, с последующим замещением этого участка искусственным или органическим имплантатом.
Производят также удаление лимфатических узлов околосуставной области.
Включает послеоперационную химиотерапию или лучевую терапию. Терапия третьего этапа направлена на подавление опухолевых клеток в местах краевой резекции опухоли и оставшихся метастазов.
Основными методами лечения метастатического рака костей и диартрозов является гормонотерапия, химиотерапия и лучевая терапия. Операции проводятся при патологических переломах, не способных срастаться и вызывающих выраженный болевой синдром.
Специализированная терапия сопровождается реабилитационными мероприятиями, проведение которых начинают с раннего послеоперационного периода. Для восстановления функций суставов используют лечебную физкультуру и физиотерапию.
Прогноз
Факторы, влияющие на прогноз до начала лечения:
- Месторасположение и величина опухоли.
- Стадия заболевания и наличие метастазов в другие органы.
- Общее состояние и возраст пациента.

Прогноз будет благоприятным при раннем выявлении, меньшей величине опухоли, отсутствии метастазов, относительно удовлетворительном состоянии пациента.
Факторы, влияющие на прогноз после проведения специализированной терапии:
- Эффективность химиотерапии и лучевой терапии.
- Эффективность операции.
При эффективном лечении происходит уменьшение размера опухоли и числа метастазов. Если операция проведена радикально, это также улучшит прогноз.
В неблагоприятных случаях наступает рецидив. Самая частая причина проявления рецидива – недифференцированный тип опухоли и позднее обращение пациента за медицинской помощью. В месте локализации предыдущего новообразования повторно возникает опухоль. Возможно метастатическое поражение костей и лёгких. Рецидив чаще происходит через два-три года после проведённого лечения.
Следствием увеличения продолжительности жизни становится рост числа онкологических болезней. Но рак суставов способен поражать даже детей и подростков. Поэтому информированность и настороженность относительно онкологических заболеваний особенно важна.
Прогресс в развитии ортопедической онкологии сделал возможным полное излечение пациентов. Обращение к врачу при появлении суставных болей способствует раннему выявлению патологии. А своевременная и правильно подобранная схема лечения – это надёжная гарантия выздоровления.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Паранеопластический артрит относится к паранеопластическим реакциям – неонкологическим заболеваниям и синдромам, возникающим в организме под влиянием опухолевого роста. Причем этот рост происходит не вследствие прямого локального действия неоплазмы или ее метастазов на органы и ткани либо побочного действия химиотерапии и сопутствующих инфекций, а в результате влияния на метаболизм, иммунную, эндокринную и другие системы организма.
В целом тот или иной паранеопластический синдром диагностируют у 7–10% больных со злокачественными новообразованиями. Связь злокачественных новообразований с паранеопластической реакцией подтверждается быстрой регрессией или полным исчезновением последней после радикального удаления опухоли и появлением вновь тех же ревматических симптомов при рецидиве неоплазмы или метастазировании [1].
Паранеопластические ревматические реакции возникают преимущественно при низкодифференцированных злокачественных новообразованиях эпителиального происхождения (рак различной локализации) и опухолевом поражении иммунной системы (тимомы, лимфомы). Ревматические паранеопластические синдромы (РПНС) часто сочетаются с другими органными и системными паранеопластическими проявлениями. Наиболее часто РПНС сопровождают бронхогенный рак легкого, рак молочной железы, нефрокарциному, рак яичников, предстательной железы, матки, реже – рак пищевода, поджелудочной железы, яичек, надпочечников [2].
У разных больных один и тот же РПНС может быть признаком опухоли различной локализации и неодинакового морфологического строения и, наоборот, при опухолях одной и той же локализации и сходного морфологического строения могут быть сходные ревматические проявления. Более того, у одного и того же больного последовательно возникающие на протяжении жизни (метахронные) опухоли разной локализации способны вызывать различные РПНС. Для рецидивирующих и метастазирующих опухолей характерна однотипность ревматических симптомов и исходной опухоли [3].
Неопластический процесс может стать причиной как острой, так и хронической воспалительной реакции с патологическим изменением соединительной ткани и сосудов в различных органах и системах. Спектр РПНС самый разнообразный – от локальной (в виде артралгии, артрита) до системной воспалительной реакции. В одних случаях они развиваются одновременно с неопластической трансформацией, в других – на фоне уже имеющегося опухолевого процесса, иногда предшествуют возникновению его местных симптомов за несколько месяцев и даже лет [4].
В патогенезе паранеопластических реакций могут принимать участие:
- иммунные реакции;
- прямое токсическое действие опухолевых субстанций;
- обменные нарушения, вызываемые опухолью: гиперкальциемия, гиперурикемия, потребление растущей опухолью компонентов, необходимых для нормального функционирования и структурной целостности здоровых тканей;
- эктопическая продукция гормонов и гормоноподобных субстанций, например адренокортикотропного или антидиуретического гормона, рилизинг-фактора, гормона роста, паратгормона, инсулиноподобного фактора роста, эритропоэтина;
- активация латентной вирусной инфекции, роль которой не исключается в развитии ревматических воспалительных реакций у больных со злокачественными новообразованиями [4, 5].
Обсуждается также роль общности этиологических факторов и генетической предрасположенности в развитии ревматических заболеваний и неопластического процесса, по меньшей мере опухолевых заболеваний иммунной системы, в пользу чего свидетельствуют данные о трансформации синдрома Шегрена в В-клеточную лимфому [6, 7].
Определенную роль в развитии РПНС, вероятно, играет непосредственное действие биологически активных веществ, выделяемых опухолевыми клетками. Полагают, что иммунологические сдвиги в организме могут быть на самой ранней стадии злокачественной трансформации тканей, когда новообразование ввиду незначительного размера при исследовании еще не определяется. Описаны злокачественные образования у больных, в течение многих лет страдавших хроническими ревматическими воспалительными заболеваниями, например, ревматоидным артритом или системными заболеваниями соединительной ткани. Считается, что эти случаи могли быть связаны с длительной предшествующей иммуносупрессивной терапией, развившимися в результате ревматического воспаления фиброзом и эпителиальной перестройкой органов, а также генетической предрасположенностью к заболеваниям обоих типов.
Клинические проявления РПНС весьма разнообразны. Поражение суставов у онкологических больных иногда проявляется лишь упорной артралгией, которая в ряде случаев сочетается с тендинитом, оссалгией и миалгией. В других случаях возникает манифестный артрит, механизм развития которого и клиническая картина у разных больных могут быть неодинаковыми.
Чаще возникает артрит, обусловленный иммунным синовитом. При этом клиническая картина суставного синдрома может напоминать таковую при ревматоидном артрите, реактивном артрите. В первом случае развивается симметричный полиартрит мелких суставов кистей и стоп, во втором – асимметричный олиго- или моноартрит крупных суставов преимущественно нижних конечностей. У некоторых больных наблюдаются ревматоидные узелки и ревматоидный фактор в сыворотке крови, а при затяжном течении артрита – эрозивные изменения суставных поверхностей эпифизов. Изредка РПНС протекает с поражением позвоночника по типу анкилозирующего спондилоартрита. Воспалительные изменения суставов, в т. ч. возникающие раньше манифестации злокачественного новообразования, сопровождаются общей интоксикацией, увеличением СОЭ, повышением острофазовых показателей [9].
В большинстве случаев причиной паранеопластического синдрома Мари – Бамбергера является рак легких, реже – другие интраторакальные опухоли, в частности доброкачественные новообразования легких: мезотелиома плевры, тератома, липома средостения. Изредка синдром встречается при раке ЖКТ, лимфоме и лимфогранулематозе с метастазами в лимфатические узлы средостения. Иногда гипертрофическая остеоартропатия бывает единственным проявлением РПНС. При этом помимо основного синдрома наблюдаются симптомы общей интоксикации, нарастающее исхудание, значительное увеличение СОЭ [1, 3, 10].
У некоторых больных паранеопластический артрит сочетается с апоневрозитом – узелковым утолщением ладонного апоневроза и болезненной сгибательной контрактурой пальцев, напоминающей таковую при системной склеродермии. Сходство с системной склеродермией придает также наличие типичного для данного заболевания синдрома Рейно.
Помимо паранеопластического артрита иммунного генеза у больных со злокачественными новообразованиями возможно развитие моно- или олигоартрита вследствие метастатического поражения синовиальной оболочки опухолевыми клетками либо вторичной подагры на фоне гиперурикемии в результате быстрого распада опухоли под влиянием цитостатиков.
У некоторых больных с онкологическими заболеваниями наряду с поражением суставов наблюдаются экстраартикулярные паранеопластические ревматические проявления: лихорадка неправильного типа, не поддающаяся терапии антибиотиками и глюкокортикоидами, лимфаденопатия, гепато- и спленомегалия, выпотной серозит (плеврит, перикардит), миопатия, периферическая нейропатия, энцефалопатия, узловатая эритема, рецидивирующая крапивница, геморрагическая сыпь, панникулит, синдром Стивенса–Джонса, поражение слизистых оболочек, выраженное увеличение СОЭ, гипергаммаглобулинемия, повышение в крови уровня циркулирующих иммунных комплексов, наличие антинуклеарных антител, LE-клеток, ревматоидного фактора, анемия, лейкопения и тромбоцитопения [1, 2, 11].
Диагностика паранеопластического артрита и других РПНС нередко трудна. Вместе с тем определенные признаки, выявляемые у больных с ревматическими симптомами и синдромами, должны вызвать у врача-онколога настороженность. К числу таких признаков относятся:
- возникновение ревматической патологии у лиц старше 50 лет, т. е. в более позднем возрасте, чем это характерно для большинства ревматических заболеваний, либо, напротив, появление в молодом возрасте признаков болезни Хортона, ревматической полимиалгии, свойственных пожилым и старикам;
- отсутствие полового деморфизма, типичного для многих ревматических заболеваний;
- острое или подострое течение артрита;
- несоответствие тяжести артрита общему тяжелому состоянию больного и высоким показателям активности воспалительного процесса;
- лихорадка, устойчивая к лечению антибактериальными и противовоспалительными препаратами;
- отсутствие отдельных клинических и лабораторных признаков, типичных для того или иного ревматического заболевания;
- упорное течение артрита, нередко опережающее клиническую манифестацию злокачественного образования;
- появление новых, не свойственных данному ревматическому заболеванию симптомов, обусловленных локальным ростом опухоли или развитием ее метастазов [11, 12].
Существенную роль в постановке диагноза играют полноценное объективное обследование, а также результаты инструментальных и лабораторных тестов.
Необходимо учитывать, что у онкологических больных иногда возникают поражения внутренних органов неревматического генеза: бронхоспастический синдром, неинфекционный эндокардит клапанов сердца, тромбоэмболии ветвей легочной артерии, рецидивирующий мигрирующий тромбофлебит, нефротический синдром, тромбоцитопеническая пурпура. В некоторых случаях, чаще при опухоли легкого и почки, наблюдаются признаки эктопической гормональной активности опухолей, в частности акромегалия, гинекомастия, галакторея, синдром Иценко–Кушинга. Может быть также паранеопластический дерматоз, возникновение которого у лиц старше 40 лет в большинстве случаев указывает на наличие злокачественного новообразования. К числу таких дерматозов относятся:
- черный акантоз;
- кольцевидная эритема Гаммела;
- акрокератоз Базе;
- гипертрихоз пушковых волос;
- приобретенный ихтиоз;
- кольцевидная эритема Дарье.
Метастатическое поражение костного мозга, особенно на фоне раковой интоксикации, может приводить к гипопластической анемии, нередко в сочетании с лейкопенией и тромбоцитопенией [5, 7].
Таким образом, РПНС – это актуальная проблема, требующая со стороны врача внимания к пациенту, знания клиники, возможностей диагностики ревматических паранеопластических проявлений.
Только для зарегистрированных пользователей
Паранеопластические синдромы развиваются редко, но могут иметь огромное влияние на диагностику и исход онкологических заболеваний. Ревматолог должен быть знаком с несколькими типичными костно-мышечными манифестациями злокачественных новообразований, чтобы иметь возможность рано постановить диагноз и своевременно начать противоопухолевое лечение. В данном обзоре описываются характерные черты различных паранеопластических артритов и васкулитов, ассоциированного с опухолями миозита, гипертрофической остеоартропатии и опухоль-индуцированной остеомаляции. В дополнение к этому обсуждаются текущие представления о механизма, лежащих в основе данных синдромов.
1. Введение
Ревматические симптомы могут быть связаны со злокачественными заболеваниями различными способами. Опухоли могут возникать из мезенхимальных клеток костей, хрящей, мышц или соединительной ткани. Также костно-мышечная система может подвергнуться инвазии метастазами опухолей других локализаций или инфильтрации клетками гематологических опухолей. Кроме того, некоторые варианты противоопухолевой терапии могут вызывать множество ревматических проявлений. Особый интерес для ревматолога представляют скелетно-мышечные симптомы, вызванные ингибиторами ароматазы, БЦЖ-индуцированный реактивный артрит при карциноме мочевого пузыря, а в последнее время к этому списку также добавились различные аутоиммунные проявления и симптомы, связанные с лечением ингибиторами контрольных точек иммунного ответа. Этот обзор фокусируется на третьем возможном механизме, который связывает рост злокачественных клеток и аутоиммунитет: паранеопластический ревматический синдром.
Паранеопластические синдромы редки, но имеют характерные черты, которые могут быть чрезвычайно значимы для раннего выявления и терапии скрытого злокачественного заболевания. Они не вызываются напрямую опухолью или метастазами, но опосредуются растворимыми факторами, такими как гормоны и цитокины, или гуморальными и клеточными иммунными механизмами, направленными против опухолевых клеток. Поэтому клинические проявления паранеопластических синдромов могут наблюдаться в удалении от основной опухоли и включать поражение суставов, фасций, мышц, сосудов и костей.
Чтобы классифицировать ревматическое заболевание как истинно паранеопластическое, должна быть продемонстрирована причинная связь между злокачественной опухолью и костно-мышечной патологией. Для обоснования подобной связи и отличия от простого совпадения более 50 лет назад были предложены критерии Брэдфорда Хилла. В случае паранеоплазии, помимо силы и специфичности ассоциации между диагнозом опухоли и ревматическими симптомами, их временные отношения являются критическим вопросом. Синдром обычно считается паранеопластическим, если костно-мышечная манифестация возникла одновременно или не более, чем за год (в некоторых исследованиях — два года) до обнаружения злокачественного новообразования. Лучшее доказательство причинности устанавливается ретроспективно, в том случае, когда возможно полностью устранить опухоль, а ревматические симптомы претерпевают полную ремиссию.
Исходя из этих соображений будет представлен обзор клинических характеристик и текущего патофизиологического понимания различных форм паранеопластического полиартрита, миозита, ассоциированного с раковыми опухолями, паранеопластического васкулита, гипертрофической остеоартропатии и остеомаляции, вызванной опухолью. Для других ревматических расстройств, таких как ревматическая полимиалгия или болезнь Стилла взрослых, потенциальная связь с лежащим в основе злокачественным заболеванием была признана недостаточно сильной, чтобы отнести их к истинным паранеоплазиям.
2. Паранеопластический артрит (ПА)
В прошлом было описано множество клинических случаев, а также их серий, в которых возникший de novo синовит с активным воспалением предшествовал или приводил к выявлению лежащей в основе злокачественной опухоли. Недавно была описана группа из 65 пациентов с ПА и их клинические и демографические характеристики сравнили с таковыми у 50 пациентов с впервые выявленным ревматоидным артритом (РА). Средний возраст начала паранеопластического артрита составил 50 лет, преобладание мужчин составило 65 %, что резко контрастирует с РA. Синовит обычно начинается как острый асимметричный (91 %) поли- (34 %), олиго- (48 %) или моноартрит (18 %) с высоким уровнем лабораторных маркеров воспаления. Диагностическая дилемма при ПА возникает из-за того, что 23 % пациентов имеют положительный результат исследования на ревматоидный фактор и 11 % на антитела против цитруллинированных белков (АЦЦП). Поэтому в отдельных случаях диагноз затруднен и часто единственным клиническим намеком на необходимость поиска опухоли остается несколько атипичное вовлечение суставов и плохой ответ на стандартную противоревматическую терапию, особенно на кортикостероиды. До сих пор не была выдвинута последовательная теория, способная объяснить патогенез. Только в одном случае рака почки ученым удалось определить клоны Т-клеток с идентичными реаранжировками рецепторов среди инфильтрировавших опухоль иммунных клеток и в синовиальных тканях, что указывает на кросс-реактивность злокачественных клеток и синовиальных антигенов при ПА. Недавно цитруллинированный виментин был признан важным опухолевым антигеном злокачественных опухолей эпителиального происхождения. Также был определен Т-клеточный иммунный ответ против раковых клеток, экспрессирующих цитруллинированный виментин, который запускал противоопухолевый ответ. Следовательно, по крайней мере некоторые формы ПА, особенно те, которые ассоциированы с положительным тестом на АЦЦП, могут быть основаны на иммунных ответах против цитруллинированных опухолевых антигенов.
3. Пальмарный (ладонный) фасциит и синдром полиартрита (Palmar fasciitis and polyarthritis syndrome, PFPAS)
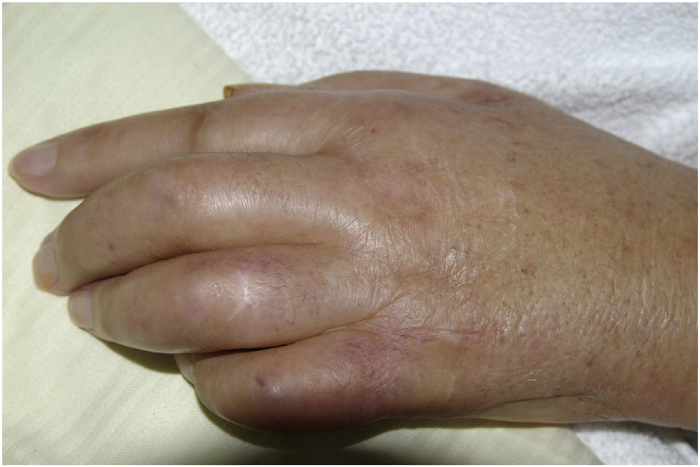
Рисунок 1. Сгибательная контрактура из-за ладонного фасциита у пациента с PFPAS и карциномой яичников.
4. Ремиттирующий серонегативный симметричный синовит с мягкими отеками
Этот артрит, начинающийся в пожилом возрасте, характеризуется симметричным отеком тыльной поверхности кистей и стоп, обычно не чувствителен к кортикостероидам и имеет хороший общий прогноз. Однако в объединенных данных из различных европейских и американских исследований частота злокачественных новообразований у таких пациентов составила 31 %. В японской группе из 33 пациентов с данным синдромом, у восьми развились раковые заболевания в течение двух лет от начала артрита. У этих пациентов наблюдалось значительное повышение уровня металлопротеиназы 3 в сыворотке. В целом, у любого пациента серонегативный симметричный синовит с мягкими отеками и плохим ответом на кортикостероиды следует считать красным флагом и склоняться к поиску скрытой злокачественной опухоли.
5. Панкреатический панникулит и полиартрит (ППП)
Полиартрит в сочетании с панникулитом, напоминающим узловатую эритему, неоднократно описывался у пациентов с панкреатитом и высоким уровнем сывороточной липазы. Такие же проявления можно наблюдать и при ацинарно-клеточном раке поджелудочной железы, который также приводит к чрезвычайно высоким концентрациям липазы в кровотоке (Рис. 2). Это вызывает обширные некротические поражения подкожной жировой клетчатки с окружающей воспалительной реакцией. Полиартрит чаще всего поражает голеностопные, коленные, лучезапястные и пястно-фаланговые суставы. В более чем 130 публикациях ППП ассоциируется с неблагоприятным прогнозом.
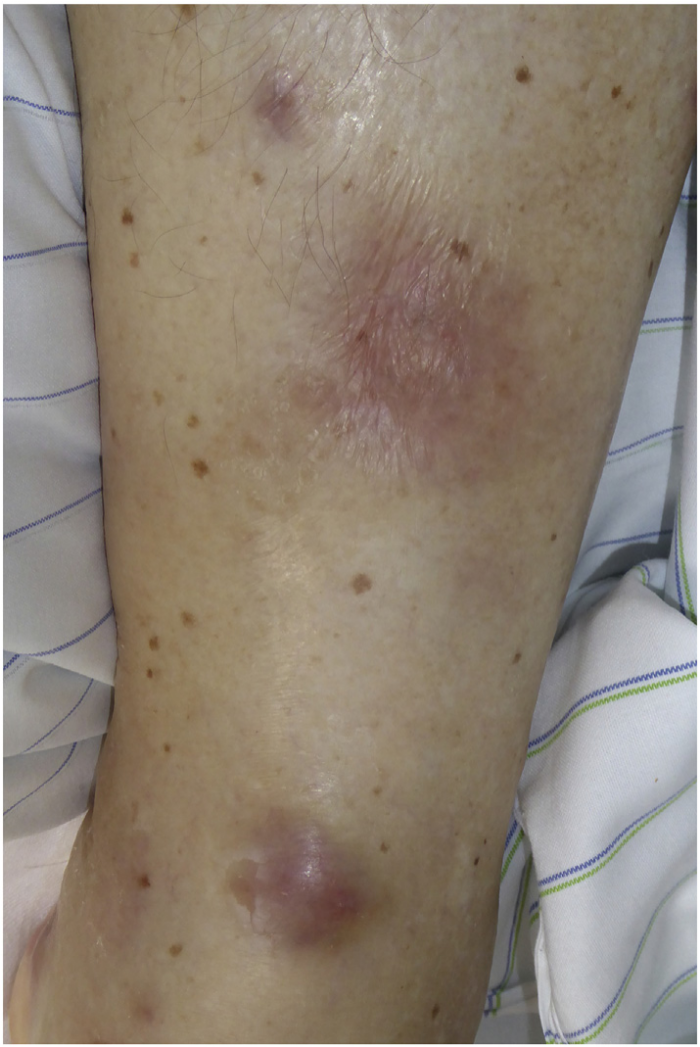
Рисунок 2. Узелковое воспаление подкожной клетчатки у пациента с панкреатическим панникулитом и полиартритом и ацинарно-клеточным раком поджелудочной железы.
6. Паранеопластический васкулит
Хотя для различных васкулитов сообщалось о временной связи со злокачественными заболеваниями, наиболее распространенной манифестацией является кожный лейкоцитокластический васкулит. Гематологические выступают причиной этого васкулита в более чем половине случаев, при этом наиболее частыми диагнозами являются миелодиспластический синдром и неходжкинские лимфомы. Среди солидных опухолей наиболее распространенными причинами паранеопластического васкулита являются рак легких, молочной железы и урогенитальные опухоли. В недавнем ретроспективном анализе 421 взрослого пациента с клинически явным или подтвержденным биопсией кожным васкулитом 16 (3,8 %) были паранеопластическими (9 гематологических, 7 солидных злокачественных новообразований). У четырех были дополнительные суставные симптомы, у двоих из них были желудочно-кишечные поражения или нефропатия. В таком контексте представляется интересным, что у взрослых пациентов с гистологически подтвержденной пурпурой Шенлейна-Геноха неоднократно были диагностированы злокачественные опухоли. При этом в качестве возможного патогенетического механизма предлагается отложение иммунных комплексов, содержащих опухолевые антигены и IgA.
7. Миозит, ассоциированный со злокачественными опухолями (Cancer-associated myositis, CAM)
В многочисленных эпидемиологических исследованиях проанализирована взаимосвязь между воспалительными заболеваниями мышц и злокачественными новообразованиями. Мета-анализ подтвердил, что дерматомиозит связан с неоплазией примерно в 24 % случаев. Стандартизованное отношение заболеваемости (SIR) варьирует от 3,8 до 7,7. Для полимиозитов ассоциация значительно слабее (SIR 1,7–2,2) и в случае клинических признаков overlap-синдрома при сочетании с другими заболеваниями соединительной ткани (например, интерстициальное поражение легких, феномен Рейно) риск наличия опухоли не возрастает. Аналогичным образом, наличие различных аутоантител, указывающих на заболевание соединительной ткани (таких как антисинтетазные, анти-Ro52 или антитела, ассоциированные с системным склерозом), снижает риск развития ассоциированного с опухолями миозита. Однако существует один тип аутоантител, четко связанный с данным миозитом. Сывороточные аутоантитела к внутриклеточному белку с массой 155 кДа (anti-p155) были первоначально описаны при ювенильном дерматомиозите, но также обнаружены у одного из шести взрослых пациентов с дерматомиозитом. Из этих взрослых пациентов с анти-p155 антителами у 65 % злокачественное заболевание развилось в течение трех лет после начала миозита. Эта связь была подтверждена в ряде других групп с миозитом. В дальнейшем аутоантиген p155 идентифицировали как промежуточный фактор транскрипции-1γ (TIF-1γ), член семейства белков, участвующих в различных функциях (убиквитинирование опухолевого супрессора р53, апоптоз), связанных с канцерогенезом. Таким образом, противоопухолевый иммунный ответ может приводить к образованию антител против TIF-1γ и способствовать развитию ассоциированного с опухолями миозита путем перекрестной реакции с тканевыми антигенами мышц. Еще одно аутоантитело (анти-MJ), которое связывает белок ядерной матрицы NXP2, было описано у пациентов с CAM, но число пациентов все еще слишком мало, чтобы уверенно делать выводы.
8. Гипертрофическая легочная остеоартропатия (ГЛО)
ГЛО, или синдром Мари-Бламбергера, представляет собой классическую костно-мышечную паранеоплазию и часто описывается в ревматологической литературе. Синдром характеризуется двумя отличительными симптомами: одним из них является утолщение дистальных фаланг пальцев рук и/или пальцев ног в виде барабанных палочек, а другой — воспалительный пролиферативный периостит, вызывающий костные и суставные боли, а иногда и синовит с выпотом в полости сустава. Преобладающими локализациями являются большеберцовая и малоберцовая кости, коленные и голеностопные суставы (Рис. 3). Это периостальное воспаление вызывает активацию остеобластов, что легко обнаруживается благодаря усиленному поглощению контраста при остеосцинтиграфии и оссификации надкостницы вдоль трубчатых костей при обычной рентгенографии. При ретроспективном анализе частота ГЛО при первичном раке легкого была близка к 1 %, однако ГЛО иногда также может возникать и при других типах злокачественных новообразований (преимущественно внутригрудных). Из-за характерной акральной активации фибробластов и периостальной активации остеобластов этот синдром первоначально считался вариантом акромегалии. Сегодня стало ясно, что тромбоцитарный фактор роста (PDGF) или фактор роста эндотелия сосудов (VEGF), продуцируемые опухолевыми клетками, могут способствовать развитию ГЛО.
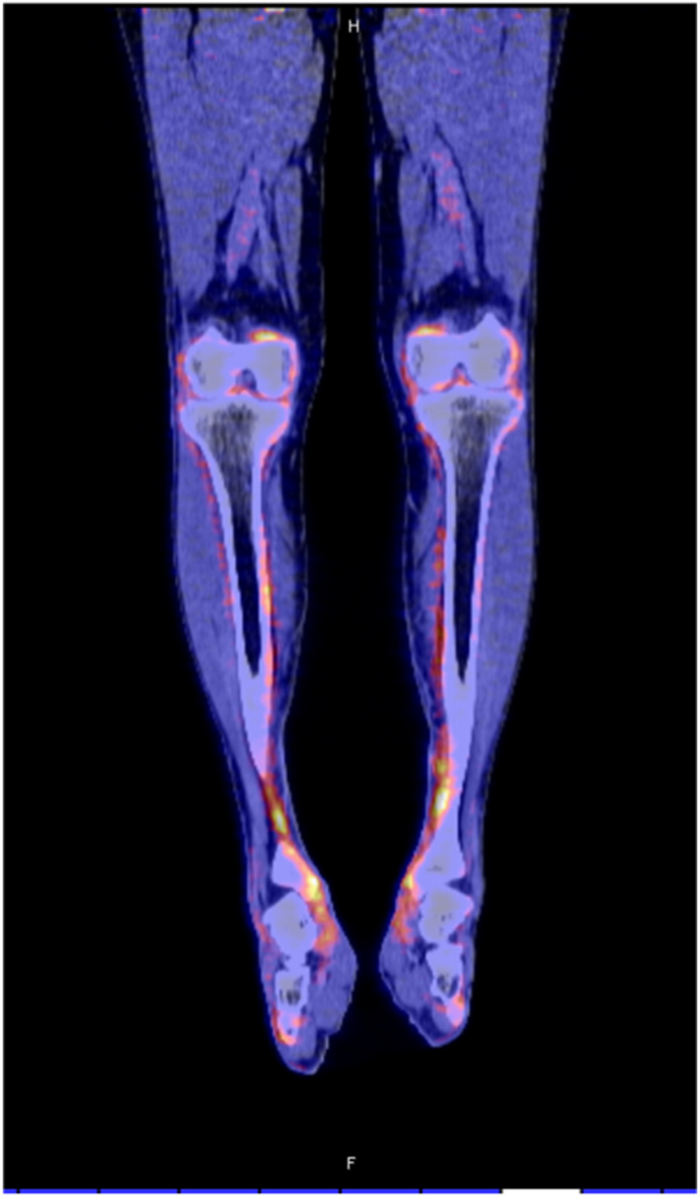
Рисунок 3. ПЭТ КТ показывает значимое поглощение 18 F-флюородеоксиглюкозы вдоль контуры большеберцовой кости у пациента с ГЛО и аденокарциномой бронхов.
9. Опухоль-индуцированная остеомаляция
Паранеопластическая остеомаляция клинически неотличима от других форм остеомаляции с прогрессирующей костной болью, спонтанными переломами, мышечной слабостью и усталостью. Биохимическая картина состоит из гипофосфатемии, гиперфосфатурии, нормального уровня кальция и паратиреоидного гормона, нормального или сниженного уровня кальцитриола и повышенной щелочной фосфатазы. Причиной дисбаланса в фосфатно-кальциевом обмене является значимая потеря фосфата почками из-за высоких концентраций циркулирующего фактора роста фибробластов 23 (FGF23, фосфатонин). FGF23 ингибирует реабсорбцию фосфата в проксимальных канальцах и подавляет дифференцировку остеобластов и минерализацию матрикса в кости. В большинстве случаев FGF23 продуцируется мезенхимальными опухолями (смешанный соединительнотканный вариант), опухолями с другими гистологическими типами (гемангиоперицитома, гигантоклеточная опухоль, остеосаркома) —значительно реже. Из 300 случаев опухоль-индуцированной остеомаляции внутрикостная опухоль была обнаружена в 40 % случаев, в 55 % новообразование было в мягких тканях. Только 8 % опухолей были злокачественными. Успешная локализация и удаление новообразования обычно приводят к полному устранению всех симптомов.
10. Заключение
Костно-мышечные паранеоплазии имеют важное клиническое значение по ряду причин: они часто предшествуют другим клиническим проявлениям новообразований и могут способствовать своевременной диагностике и потенциальному излечению от злокачественного заболевания. После успешного удаления злокачественных клеток паранеопластические симптомы обычно стихают, но повторное появление симптомов со стороны опорно-двигательного аппарата может указывать на рецидив или метастазирование, хотя клинически это не является надежным критерием. Паранеопластические симптомы также могут оказывать значительное влияние на качество жизни, заболеваемость и смертность пациентов с опухолями. В последние годы выяснены некоторые из основных механизмов паранеопластических синдромов, что улучшает наше понимание патогенеза ревматических и неопластических заболеваний.
Читайте также:


