Светлый диск в мышечном волокне
Каждое мышечное волокно представляет собой гигантскую многоядерную клетку – симпласт, образованную в процессе эмбрионального развития организма путем слияния множества отдельных клеток – миобластов.
Строение мышечного волокна существенно отличается от строения других клеток. Важнейшие отличительные особенности - это размеры, форма, многоядерность, наличие сократительного аппарата. Строение мышечного волокна представлено на рис. 60.
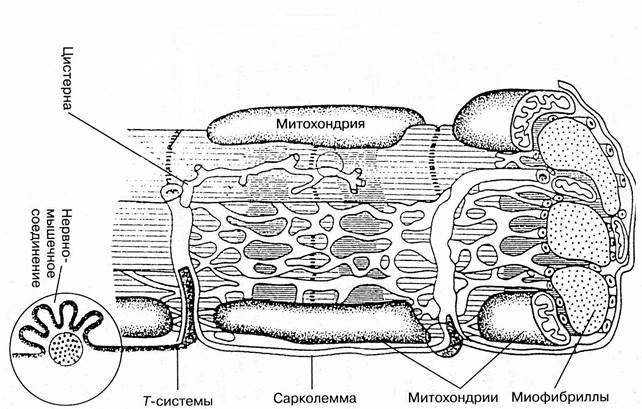
Рис. 60. Важнейшие структурные элементы мышечного волокна
Остановимся на важнейших структурных элементах мышечного волокна.
Сарколемма.Снаружи мышечное волокно окружено оболочкой – сарколеммой, обладающей высокой прочностью и эластичностью. Эти свойства сарколеммы обеспечиваются присутствием в ней большого количества эластичных волокон белков коллагена и эластина, образующих густую сеть.
Сарколемма обладает избирательной проницаемостью, пропуская внутрь клетки преимущественно те вещества, для превращения которых там имеются условия – ферментные системы. В сарколемме присутствуют специальные транспортные системы, с помощью которых поддерживается, в частности, разница в концентрации ионов Na + , К + , Сl ‾ внутри и снаружи мышечного волокна, что обеспечивает формирование на его поверхности мембранного потенциала.
К каждому мышечному волокну подходит окончание двигательного нерва. Место прикрепления нервного окончания к мышечному волокну называется нервно-мышечным синапсом..
Внутри мышечного волокна находятся многочисленные клеточные органеллы, важнейшими из которых являются ядра, митохондрии, рибосомы и др. Функции указанных органелл описаны в главе 2 (2.5.1). Пространство между органеллами заполнено внутриклеточной жидкостью – саркоплазмой. Среди структурных элементов мышечного волокна наибольший объем занимают сократительные нити– миофибриллы.
Миофибриллы. Миофибриллы представляют собой длинные тонкие нити, расположенные вдоль мышечного волокна. Количество миофибрилл в мышечных волокнах может колебаться в диапазоне от нескольких десятков до полутора и более тысяч. Под влиянием систематической мышечной тренировки, особенно скоростно-силовой направленности, количество миофибрилл может увеличиваться. Напротив, ограничение двигательной активности сопровождается уменьшением количества миофибрилл. Строение мышечных миофибрилл представлено на рис. 61 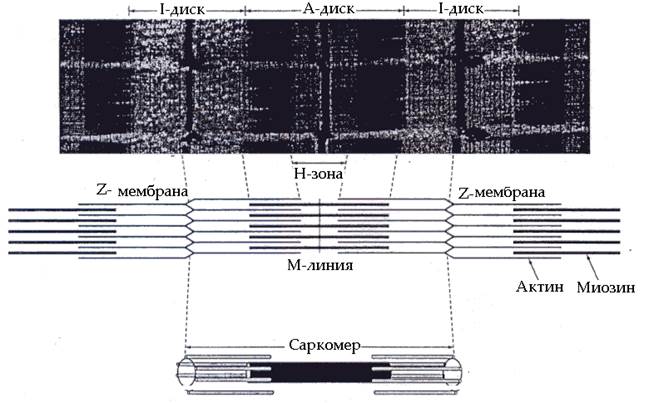
Рис. 61. Строение миофибрилл
При рассмотрении в оптический микроскоп видно, что миофибриллы имеют повторяющуюся поперечную исчерченность – темные и светлые полосы (диски). Темные диски (А-диски) в центральной части имеют более светлую полосу (Н-зону). Светлые диски (I-диски) в центре пересекаются узкой темной полосой (линией Z). Участок миофибрилл между двумя линиями Z получил название саркомера. Количество саркомеров в миофибрилле зависит от длины мышечного волокна и может достигать нескольких сотен. Длина саркомеров у разных людей может различаться.
Исследование срезов мышечных волокон в электронном микроскопе показали, что каждая миофибрилла состоит из большого числа параллельно расположенных толстых и тонких нитей (филаментов), которые характеризуются строгим взаимным распределением. Толстые нити находятся в зоне А-дисков. Они построены из белка миозина. Миозин является важнейшим сократительным белком, на его долю приходится около 55% от общего количества сократительных белков. Молекула миозина имеет длинную фибриллярную (удлиненную) часть и глобулярную (округлой формы) головку. Фибриллярная часть имеет двухспиральную полипептидную конфигурацию. Функция фибриллярной части молекулы миозина связана с формированием структуры толстой миозиновой нити.
Глобулярные головки миозиновых нитей имеют два активных центра, один из которых обладает АТФ-азной активностью (способностью расщеплять молекулы АТФ), другой – способностью связываться с активными центрами на актиновых нитях (актинсвязывающий центр). Головки молекул миозина располагаются на поверхности миозиновых нитей, образуя выпячивания (отростки). При этом они строго ориентированы в пространстве – располагаются шестью продольными рядами. Толстая миозиновая нить состоит как бы из двух частей, зеркально повторяющих друг друга. Если ее разрезать по- середине, то образуются два совершенно одинаковых фрагмента.
Молекулы миозина обладают способностью связывать ионы Са 2+ и Мg 2+ . Ионы кальция являются кофактором фермента АТФ-азы (в его отсутствии фермент не активен). Ионы магния обеспечивают миозину способность связывать молекулы АТФ и АДФ.
В зоне светлых дисков (I-дисков) расположены тонкие нити, построенные из белков актина, тропомиозина и тропонина. Актин – второй в количественном отношении сократительный белок, составляющий основу актиновых нитей. Тропомиозин – структурный белок актиновых нитей, имеющий фибриллярную форму. Сдвоенные молекулы тропомиозина обвивают актиновые нити. Тропонин является регуляторным белком актиновых нитей. Он существует в трех формах, одна из которых блокирует взаимодействие актина с миозином. Другая форма способна связывать ионы кальция, благодаря чему изменяется конформация молекул первой формы тропонина и открывается центр взаимодействия актина с миозином. Третья форма тропонина обеспечивает крепление первых двух форм на актиновой нити. Кроме того, в составе тонких актиновых нитей имеется белок актинин. Он содержится в зоне линии Z, выполняющей роль своеобразной перегородки, и обеспечивает прикрепление к ней концов актиновых нитей.
К числу важнейших структурных элементов мышечного волокна относится саркоплазматический ретикулум. Саркоплазматический ретикулум - это внутриклеточная система взаимосвязанных пузырьков и канальцев (цистерн), пронизывающих клетку и особенно плотно концентрирующихся в зоне соприкосновения актиновых и миозиновых нитей.
Саркоплазматический (в клетках других органов и тканей – эндоплазматический) ретикулум имеется в каждой клетке организма человека. Но в мышечном волокне он выполняет несколько необычные по сравнению с другими клетками функции. Основная его роль в мышечном волокне заключается в регуляции содержания ионов кальция возле актиновых и миозиновых нитей. В состоянии расслабления ретикулум связывает ионы Са 2+ , их концентрация в саркоплазме составляет примерно 10 -7 моль·литр -1 . Под воздействием двигательного импульса ионы кальция освобождаются из ретикулума и их концентрация повышается до 10 -5 моль·литр -1 .
Способность саркоплазматического ретикулума связывать и высвобождать в цитоплазму ионы Са 2+ связана с локализацией на его внутренней поверхности особых кальций связывающих белков. На поверхности ретикулума располагаются также рибосомы – особые внутриклеточные образования, в которых осуществляется синтез белков.
Мышечное волокно имеет также систему трубчатых выпячиваний сарколеммы (Т-систему), направленных внутрь мышечного волокна и располагающихся между миофибриллами и саркоплазматическим ретикулумом. Т-система обеспечивает быстрое распространение волны возбуждения от сарколеммы вглубь волокна.
Мышечное волокно содержит не одно, а несколько ядер, которые располагаются не в центральной части волокна, а по периметру, непосредственно под сарколеммой
Типы мышечных волокон
В скелетных мышцах выделяют несколько типов мышечных волокон, различающихся по своим двигательным характеристикам, соотношению различных химических и структурных компонентов, особенностям структурной организации. К основным типам мышечных волокон относятся медленносокращающиеся (МС) и быстросокращающиеся (БС). Медленносокращающиеся волокна в связи с более высоким содержанием в них миоглобина называют еще красными (или тип I). Быстросокращающиеся, для которых характерно более низкое содержание миоглобина, называют белыми (или тип II). Следует сразу оговориться, что различить эти два типа волокон по цвету практически невозможно. Цвет у одних и у других красный.
Бытрые и медленные волокна более чем в два раза различаются по максимальной скорости сокращения. Так, время одиночного сокращения МС достигает 110 мс, а БС – 50 мс. Кроме того, БС более чем в два раза превышают МС по своим силовым характеристикам.
Существенно различаются разные типы волокон по уровню развития различных механизмов преобразования энергии. МС волокна имеют хорошо развитый механизм аэробного ресинтеза АТФ, что обеспечивается большим количеством митохондрий и высоким содержанием ферментов аэробного биологического окисления, а также большими запасами субстратов аэробного окисления: гликогена, жиров. В МС волокнах содержится больше белка миоглобина, благодаря которому они имеют больший запас кислорода и более благоприятные условия для перехода кислорода из крови внутрь волокна.
В БС волокнах значительно больше миофибрилл, выше АТФ-азная активность, больше концентрация ионов кальция.
Внутри БС волокон различают два подтипа: БСа и БСб. Эти два подтипа отличаются, главным образом, разным уровнем развития важнейших механизмов преобразования энергии. У волокон БСа более хорошо развит анаэробный гликолиз и несколько слабее, чем у МС волокон - аэробный путь ресинтеза АТФ. Они являются ведущими при выполнении упражнений т.н. субмаксимальной мощности, продолжительность которых колеблется в диапазоне от 30 сек до 2-3 мин, при условии выполнения работы с максимальной для данной продолжительности интенсивностью.
У волокон БСб, наряду с анаэробным гликолизом хорошо развит креатинфосфатный механизм ресинтеза АТФ. Они подключаются при выполнении упражнений максимальной и околомаксимальной интенсивности: бег на 100 м, упражнения с большими отягощениями и т.п.
При повышении интенсивности упражнения в пределах каждой зоны мощности увеличивается участие в ее обеспечении волокон всех типов, но в наибольшей степени тех, которые подключаются к работе в данном диапазоне мощности.
Различные типы мышечных волокон различаются и условиями иннервации. Мотонейроны, иннервирующие БС мышечные волокна, более толстые, они имеют более разветвленную сеть нервных окончаний (ветвей аксонов), благодаря чему иннервируют значительно большее количество мышечных волокон (от300 до 500). У БС волокон больше зона прилегания нервного окончания к мышечному волокну, что создает более благоприятные условия для иннервации и возникновения потенциала действия.
Гистологический препарат №24
Поперечнополосатая сердечная мышечная ткань.
Окраска гематоксилином и эозином. Увеличение большое.
Необходимо отыскать более светлый участок и найти:
- кардиомиоциты, и в них
- ядра,
- миофибриллы;
- вставочные диски,
- анастомозы.
Дополнительный материал
Гладкая (неисчерченная) мышечная ткань (textus muscularis nonstriatus) развивается из мезенхимы. Она составляет двигательный аппарат внутренних органов, кровеносных и лимфатических сосудов. Ее сокращения имеют медленный,тонический характер. Структурной единицей гладкой мышечной ткани является клетка удлиненной веретенообразной формы — гладкий миоцит, Она покрыта плазмолеммой, к которой снаружи примыкает базальная мембрана и соединительнотканные волокна. Внутри клетки в ее центре, в миоплазме, имеется вытянутой формы ядро, вокруг которого расположены митохондрии и другие органеллы.
В миоплазме миоцитов под электронным микроскопом обнаружены сократительные белковые нити — миофиламенты. Различают филаменты актиновые, миозиновые и промежуточные. Актиновые и миозиновые миофиламенты обеспечивают сам акт сокращения, а промежуточные предохраняют гладкие миоциты от их избыточного расширения при укорочении. Миофиламенты гладких миоцитов не образуют дисков, поэтому эти клетки не имеют поперечной исчерчевности, и получили название гладких, неисчерченных. Гладкие миоциты хорошо регенерируют. Они делятся митозом, могут развиваться из малодифференцированных соединительнотканных клеток, способны к гипертрофии. Между клетками располагается опорная строма гладкой мышечной ткани — коллагеновые и эластические волокна, образующие плотные сети вокруг каждой клетки. Гладкие мышечные клетки синтезируют сами волокна этой стромы.

Поперечнополосатые (исчерченные) мышечные ткани в эту группу поперечнополосатых мышечных тканей включают скелетную и сердечную мышечные ткани. Эти ткани объединяют прежде всего по признаку поперечной исчерченности их специальных оранелл — миофибрилл. Однако по своему происхождению, общему плану строения и функциональным особенностям, эти два вида поперечнополосатых мышечных тканей существенно отличаются.
Поперечнополосатая скелетная мышечная ткань (textus muscularis striatus sceletalis) развивается, из сегментированной мезодермы, точнее из ее центральных участком, получивших название миотомов. Структурно-функциональной единицей этой ткани являются многоядерные миосимпласты.
Поперечнополосатые мышечные волокна. С поверхности они покрыты сарколелмой — сложным образованием, состоящим из трехслойной плазмолеммы мышечного волокна, базальной мембраны и прилежащей к ней снаружи сети соединительнотканных волокон. Под базальной мембраной, прилегая к плазмолемме мышечного волокна, располагаются особые камбиальные мышечные клетки — миосателлиты. Внутри мышечного волокна, в его саркоплазме, по периферии, расположены многочисленные ядра, а в центре, вдоль волокна, находятся специальные органеллы — миофибриллы. Митохондрии и другие общие органеллы в мышечном волокне расположены вокруг ядер и вдоль миофибрилл. Под электронным микроскопом миофибриллы состоят из нитей — миофиламентов — актиновых, более тонких (диаметром около 5-7 нм) и более толстых — миозиновых (диаметром около 10-20 нм).
Актиновые миофиламенты, содержащие белок актин, образуют изотропные диски (I). Это светлые, не обладающие двойным лучепреломлением диски. В центре дисков проходит Z-линия — телофрагма. Эта линия делит диск I на два полудиска. В области Z-линий расположены так называемые триады. Триады состоят из трубчатых элементов — Т-трубочек, образованных вдавлением плазмолеммы внутрь мышечного волокна. По этим трубочкам нервный импульс поступает к миофибриллам. В каждой триаде одна Т-трубочка контактирует с двумя терминальными цистернами саркоплазматической сети, что обеспечивает выброс ионов кальция, необходимых для сократительного акта. В области Z-линий диска I сходятся концы актиновых миофиламентов. Миозиновые миофиламенты, содержащие белок миозин, образуют анизотропные (А) темные диски, обладающие двойным лучепреломлением. В центре диска А проходит М-линия — мезофрагма. В М-линии сходятся концы миозиновых миофибрилл и обнаружена сеть канальцев саркоплазматическойг сети. Чередование в миофибриллах темных и светлых дисков придает мышечному волокну поперечную исчерченность. Структурной единицей миофибрилл является миомер (саркомер)- это участок миофибрилпы между двумя Z-линиями. Его формула — А+2,5I. По современным представлениям в каждом мышечном волокне различают:
- сократительный аппарат, состоящий из миофибрилл, включающих актиновые и миозиновые миофиламенты;
- трофический аппарат, в который входит саркоплазма с ядрами и органеллами;
- специальный мембранный аппарат триад;
- опорный аппарат, включающий сарколемл у с эндомизием и мембранными структурами линий Z и М;
- нервный аппарат, представленный двигательными нервно-мышечными окончаниями — моторными бляшками чувствительными нервными окончаниями- нервно-мышечными веретенами.
В скелетной мышечной ткани под световым микроскопом различают белые и красные мышечные волокна. Белые мышечные волокна содержат мало саркоплазмы и миоглобина и много миофибрилл. На поперечном срезе в белых мышечных волокнах хорошо видны плотно расположенные миофибриллы. Они обеспечивают сильное, но непродолжительное сокращение. Красные мышечные волокна содержат много саркоплазмы и, следовательно, много миоглобина и мало миофибрилл. На поперечном срезе в таких мышечных волокнах миофибриллы расположены рыхло в виде групп, образуя многоугольники, получившие название полей Конгейма. Эти поля разделены друг от друг прослойками саркоплазмы. Красные мышечные волокна содержат много митохондрий, они способны к длительному сокращению. По гистохимическому профилю, по активности АТФ-азы, по окислительным ферментам различают несколько типов мышечных волокон. Так, гликолитические или белые мышечные волокна имеют низкую активность митохондриальных окислительных ферментов (СДГ) и высоких гликолитических аэробного типа (ЛДГ), они содержат много гликогена. Окислительные или красные мьшечные волокна характеризуются высоким уровнем окислительных митохондриальных ферментов(СДГ). В каждой скелетной мышце, как органе, имеются и белые, и красные мышечные волокна.
Однако их соотношение в разных мышечных группах неодинаково.Каждое мышечное волокно окружено снаружи прослойкой рыхлой волокнистой соединительной ткани, получившей название эндомизия (endomysium). Группы мышечных волокон окружены перимизием (peremysium), а сама мышца — плотной соединительнотканной оболочкой — эпимизием (epimysium).
Поперечнополосатая скелетная мышечная ткань способна к регенерации. Сокращение мышечной ткани трактуется с позиции теории скольжения: актиновые миофиламенты вдвигаются, скользят между миозиновыми.
Сердечная мышечная ткань (textus тuscularis cardiacus) Это поперечнополосатая (исчерченная) мышечная ткань. Однако она имеет ряд существенных в своем строении отличий от скелетной мышечной ткани. Развивается эта ткань из висцерального листка мезодермы, точнее, из так называемой миоэпикардиальной пластинки. Структурной единицей сердечной мышечной ткани являются поперечнополосатые клетки — сердечные миоциты или кардиомиоциты (miocyti cardiaci) с одним или двумя ядрами, расположенными в центре. По периферии цитоплазмы в кардиомиоцитах расположены миофибриллы, имеющие такое же строение, как и в скелетном мышечном волокне. Вокруг ядра и вдоль миофибрилл располагается большое количество митохондрий (саркосом). Кардиомиоциты отделены друг от друга вставочными дисками (disci iniercalati), образованными десмосомами и щелевыми контактами. Кардиомиоциты посредством этих дисков объединяются конец в конец в сердечные мышечные волокна, анастомозирующие между собой и сокращающиеся как единое целое. В сердечной мышечной ткани различают кардиомиоциты,- сократительные или типичные и проводящие или атипичные, составляющие проводящую систему сердца. Проводящие кардиомиоциты более крупные, содержат меньше миофибрилл и митохондрий. Их ядра часто расположены эксцентрично. В них понижена активность энзимов аэробного окисления (СДГ) и достаточно высокая активность ферментов аэробного гликолиза (ЛДГ), они содержат много лабильного гликогена.
Методичка МГМСУ в формате PDF — скачать и читать со страницы 34 (Сердечно-сосудистая система.)
Методичка МГМСУ. Частная гистология.
Методичка МГМСУ в формате PDF — скачать и читать со страницы 48 (Мышечные ткани.)
Методичка МГМСУ. Общая гистология.
Скелетная мышечная ткань
Дефекты миграции и дифференцировки клеток миотома . Клетки–предшественницы мышц конечностей выселяются из миотомов и образуют скопления на дорсальной и вентральной поверхностях зачатков конечностей. При мутации Pax3 и с-Met блокируется миграция клеток в зачатки конечностей. Инактивация генов MyoD и Myf5 блокирует дифференцировку клеток миотома в миобласты.
Маркёры миогенного клеточного типа
Скелетное мышечное волокно
Рис. 7-1. Скелетная мышца состоит из поперечнополосaтых мышечных волокон . Значительный объём мышечного волокна занимают миофибриллы. Расположение светлых и тёмных дисков в параллельных друг другу миофибриллах совпадает, что приводит к появлению поперечной исчерченности. Структурная единица миофибрилл — саркомер, сформированный из толстых (миозиновых) и тонких (актиновых) нитей. Расположение тонких и толстых нитей в саркомере показано слева и слева внизу. G–актин — глобулярный, F–актин — фибриллярный актин. [26]
Рис. 7-2. Скелетная мышца в продольном и поперечном разрезе. А — продольный разрез; Б — поперечный разрез; В — поперечный срез отдельного мышечного волокна. [17]
Рис. 7-2А. Скелетная мышца . В продольном сечении мышечные волокна имеют цилиндрическую форму (1), чередование тёмных и светлых дисков обеспечивает хорошо выраженную поперечную исчерченность. В поперечном сечении (2) мышечные волокна имеют многоугольную форму. Ядра (3) располагаются под сарколеммой по периферии мышечного волокна. Окраска гематоксилином и эозином.
Рис . 7 - 3 . Саркомер содержит один А-диск (тёмный) и две половины I-диска (светлого). Толстые миозиновые нити занимают центральную часть саркомера. Титин соединяет свободные концы миозиновых нитей с Z-линией. Тонкие актиновые нити одним концом прикреплены к Z-линии, а другим направляются к середине сaркомера и частично входят между толстыми нитями . [17]
à Миозин (рис. 7-4). В молекуле миозина различают тяжёлый и лёгкий меромиозины. Тяжёлый меромиозин имеет два субфрагмента (S). S1 содержит глобулярные головки миозина, S2 — эластический компонент, допускающий отхождение S1 на расстояние до 55 нм. Концевую часть хвостовой нити миозина длиной 100 нм образует лёгкий меромиозин. Миозин имеет два шарнирных участка, позволяющих молекуле изменять конформацию. Один шарнирный участок находится в области соединения тяжёлого и лёгкого меромиозинов, другой — в области шейки молекулы миозина (соединение S1 - S2). Лёгкий меромиозин лежит в толще толстой нити, тогда как тяжёлый меромиозин (благодаря шарнирным участкам) выступает на её поверхность (рис. 7-5).
Рис. 7-4. Молекула миозина. Лёгкий меромиозин обеспечивает агрегацию молекул миозина, тяжёлый меромиозин имеет связывающие актин участки и обладает активностью АТФазы . [17]
Рис . 7 - 5 . Толстая нить . Молекулы миозина способны к самосборке и формируют веретенообразный агрегат диаметром 15 нм и длиной 1,5 мкм. Фибриллярные хвосты молекул образуют стержень толстой нити, головки миозина расположены спиралями и выступают над поверхностью толстой нити . [17]
à Титин — наибольших размеров полипептид (из известных) с Mr 3000 кД — работает наподобие молекулярной пружины, обеспечивая структурную целостность миофибрилл во время сокращения. Один конец молекулы проникает в Z-линию и через a - актинин связывается с молекулой титина соседнего саркомера, другой конец приближается к М-линии и при помощи миомезина (М-белок) прикрепляется к свободному концу молекулы титина второй половины саркомера. В I -диске титин ассоциирован с тонкими нитями, а в А-диске этот белок связывается с толстыми нитями. Контактируя в области Z-линии и М-линии, молекулы титина образуют непрерывную цепь.
à С-белок стабилизирует структуру миозиновых нитей. Влияя на агрегацию молекул миозина, обеспечивает одинаковый диаметр и стандартную длину толстых нитей.
à Креатинфосфокиназа ассоциирована с толстыми нитями в середине тёмного диска, способствует быстрой регенерации АТФ из АДФ при сокращении.
Рис . 7 - 6 . Тонкая нить — две спирально скрученные нити F–актина. В канавках спиральной цепочки залегает двойная спираль тропомиозина, вдоль которой располагаются молекулы тропонина . [17]
à Актин. Молекулы глобулярного актина (G–актин) полимеризуются и образуют фибриллярный актин (F–актин). В состав тонкой нити входят две спирально закрученные цепочки F–актина.
à Тропомиозин состоит из двух полипептидных цепей и имеет конфигурацию двойной спирали. Полярные молекулы тропомиозина длиной 40 нм укладываются конец в конец в желобке между двумя спирально закрученными цепочками F–актина. Существует как минимум четыре гена, кодирующих мышечные и немышечные изоформы тропомиозина.
Немалиновая миопатия — мутация гена тропомиозина-3, передающаяся по аутосомно-доминантному типу. При биопсии в саркоплазме мышечных волокон I типа обнаруживаются палочковидные включения, формирующиеся из материала Z-линий.
à Тропонин (Tn) — комплекс, образованный тремя глобулярными СЕ: TnT, TnI, TnC. ТnT имеет участки для связи с тропомиозином. TnC — Ca 2+ -связывающий белок. TnI препятствует взаимодействию актина с миозином. Тропониновый комплекс прикреплён к молекулам тропомиозина с интервалами 40 нм.
à Небулин — фибриллярный белок, ассоциированный с тонкими нитями. Небулин проходит от Z-линии до свободного конца тонких нитей и контролирует их длину.
à a –Актинин, десмин и виментин — входят в состав Z-линии, в которую вплетён один конец тонкой нити.
Рис . 7 - 7 . Фрагмент скелетного мышечного волокна . Цистерны саркоплазматического ретикулума окружают каждую миофибриллу. Т-трубочки подходят к миофибриллам на уровне границ между тёмными и светлыми дисками и вместе с терминальными цистернами саркоплазматического ретикулума образуют триады. Между миофибриллами залегают митохондрии . [17]
Сопряжение возбуждения и сокращения
Рис. 7-8. Сопряжение возбуждения и сокращения в скелетном мышечном волокне . Тетрада Са 2+ -каналов L-типа в мембране Т-трубочки прямо контактируют с четырьмя СЕ Ca 2+ - канала в мембране терминальных цистерн саркоплазматического ретикулума. Потенциалозависимые Са 2+ -каналы L-типа регистрируют деполяризацию плазмолеммы и активируют Ca 2+ - каналы в мембране саркоплазматического ретикулума, обеспечивающие выход Ca 2+ в саркоплазму. [114]
Рис. 7-9. Иннервация экстрафузальных и интрафузальных мышечных волокон . Экстрафузальные мышечные волокна скелетных мышц туловища и конечностей получают двигательную иннервацию от a -мотонейронов передних рогов спинного мозга. Интрафузальные мышечные волокна в составе мышечных веретён имеют как двигательную иннервацию от g -мотонейронов, так и чувствительную (афферентные волокна I а и II типов чувствительных нейронов спинномозгового узла. [ 74]
Рис. 7-10. Элиминация полинейронной иннервации . В плодном периоде мышечные волокна иннервируются 2-6 аксонами. В постнатальном периоде конкурентное взаимодействие нервных терминалей (в т.ч. за нейротрофические факторы, продуцируемые мышечными волокнами) устраняет неактивные аксоны и только один наиболее активный аксон сформирует дефинитивный нервно-мышечный синапс. [74]
Рис. 7-11. Образование нервно-мышечного синапса . А . В мышечных трубочках ещё до установления контакта с аксоном экспрессируется эмбриональная форма холинорецепторов ( a 2 bgd ), которые равномерно распределены по плазмолемме миотубы. Б . Через несколько часов после подрастания аксона к мышечной трубочке происходит агрегация холинорецепторов в месте контакта аксона и миотубы. В . Через двое суток в результате электрической активности аксона ингибируется экспрессия g СЕ холинорецепторов и начинается синтез e СЕ. Г . В постнатальном периоде под нервной терминалью образуются складки плазмолеммы и агрегаты из ядер мышечного волокна. [74]
Рис. 7-12. Роль аксона в созревании постсинаптической мембраны . Из нервной терминали в синаптическую щель секретируются нейрогенные молекулы. Нейрегулин ( ARIA ) стимулирует экспрессию генов дефинитивной формы холинорецепторов ( a 2 bed ), а агрин, активируя MuSK , способствует кластеризации рапсина, взаимодействующего с холинорецепторами и белками цитоскелета постсинаптической мембраны. [74]
Рис. 7-13. Мозаичное распределение мышечных волокон разных нейромоторных единиц . Мышечные волокна одного типа (1, 2 a , 2 b ), принадлежащие одной нейромоторной единице, находятся между волокон других нейромоторных единиц. [77]
Сокращение и расслабление
Деполяризация постсинаптической мембраны
à d-Тубокурарин — классический антагонист холинорецепторов — обратимо связывается с a –СЕ н-холинорецепторов и таким образом препятствует деполяризующему действию ацетилхолина, вызывая миопаралитический эффект.
à Сукцинилхолин — классический агонист холинорецепторов — конкурирует с ацетилхолином за связывание с н-холинорецепторами. Сукцинилхолин обладает устойчивостью к ферменту ацетилхолинэстеразе, гидролизующей ацетилхолин, что приводит к пролонгированной активации холинорецепторов, сопровождающейся деполяризацией мембраны. Первоначально деполяризация приводит к повторяющимся сокращениям скелетной мускулатуры (тремор). Далее в результате инактивации Na + -каналов наступает миопаралитический эффект.
Злокачественная гипертермия . Применение сукцинилхолина и галотана в анестезиологии может стать причиной злокачественной гипертермии — редкое осложнение при наркозе (смертность до 70%). В результате массированного выхода Ca 2+ из саркоплазматического ретикулума появляется мышечная ригидность, повышенный гидролиз АТФ усиливает мышечные сокращения, уровень метаболизма и теплообразование. Температура тела быстро поднимается до 43 °C и выше, происходит генерализованный рабдомиолиз. Лечение включает охлаждение тела больного, ингаляция 100% кислорода, введение препаратов, блокирующих выход Са 2+ из саркоплазматического ретикулума.
à Физостигмин (растительный алкалоид) и его синтетический аналог простигмин (неостигмин) — обратимые ингибиторы ацетихолиэстеразы — применяются при лечении myasthenia gravis.
à Фосфорорганические соединения. Синтетический препарат диизопропилфлуорофосфат ( DFP ) и нейротоксин [анатоксин-а( s )] сине-зелёных водорослей ( Anaebena flos - aquae ) необратимо инактивируют ацетилхолинэстеразу. Отравление домашних животных происходит при употреблении воды из контаминированного сине-зелёными водорослями пруда.
à Фасцикулин — токсин яда змеи мамба — высокоспецифический ингибитор ацетихолиэстеразы.
Плазмолемма и потенциал действия
Триады и передача сигнала на саркоплазматическую сеть
Саркоплазматический ретикулум и выброс Ca 2+
Взаимодействие тонких и толстых нитей
Рис . 7 - 14 . Ca 2+ -зависимый механизм регуляции взаимодействия актина с миозином . В покое миозинсвязывающие участки тонкой нити заняты тропомиозином. При сокращении ионы Ca 2+ связываются с TnC, а тропомиозин открывает миозинсвязывающие участки. Головки миозина присоединяются к тонкой нити и вызывают её смещение относительно толстой нити [17]
Рис. 7-15. Цикл скольжения тонких нитей относительно толстых . Тяжёлый меромиозин выступает над поверхностью толстой нити ( 1 ). Благодаря шарнирному участку между тяжёлым и лёгким меромиозинами, головка миозина, несущая продукты гидролиза АТФ (АДФ и Pi), прикрепляется к миозин-связывающему участку актина ( 2 ), происходит наклон головки миозина с одновременным растягиванием эластического компонента S2 ( 3 ). Из головки освобождаются АДФ и Pi, а последующая ретракция эластического компонента S2 вызывает тянущее усилие ( 4 ). Затем к головке миозина присоединяется новая молекула АТФ, что приводит к отделению головки миозина от молекулы актина. Гидролиз АТФ возвращает молекулу миозина в исходное положение. [17]
Рис. 7-16. Саркомер расслабленного ( I ) и сокращённого ( II ) мышечного волокна . При сокращении саркомера свободные концы тонких нитей приближаются к М-линии, уменьшая ширину Н-зоны. Поскольку противоположные концы тонких нитей прикреплены к Z-линиям, то при скольжении тонких нитей возникает тянущее усилие, Z-линии сближаются, что и приводит к уменьшению ширины I-диска. Длина А-диска, соответствующая расположению толстых нитей, не уменьшается, т.к. длина обоих типов нитей (тонких и толстых) при сокращении не изменяется (нити скользят относительно друг друга при постоянной их длине). [17]
Типы мышечных волокон
Рис. 7-16А. Типы волокон скелетной мышцы . Гистохимическое выявление активности АТФазы миозина и сукцинатдегидрогеназы (СДГ). A (слева) — активность АТФазы миозина: тип I — медленносокращающиеся; II — быстросокращающиеся. Б (справа) — активность СДГ: А — белое (гликолитическое); B — промежуточное (окислительно-гликолитическое); C — красное (окислительное).
Фазные и тонические
Быстрые и медленные
Окислительные и гликолитические
Креатин . Ген SC6A8 кодирует Na - и Cl -зависимый транспортёр креатина. Преимущественно ген экспрессируется в скелетной мышце и почке, в меньшей степени в ЦНС, сердце, кишечнике, яичках, предстательной железе. Сцепленные с Х-хромосомой дефекты гена транспортёра креатина — причина задержки развития, умственной отсталости, гипотонии.
Сводная классификация мышечных волокон
Таблица 7-1. Типы мышечных волокон и их свойства
Читайте также:


