Тяжелые грибковые инфекции вызванные scedosporium spp и fusarium spp
Дрожжевые и плесневые грибы входят в число десяти наиболее часто выявляемых патогенов в клиниках. Около 7 % лихорадок неясного генеза в стационаре и до 50 % в онкогематологии обусловлены грибами. В Украине, где отсутствуют эпидемические очаги особо опасных грибковых инфекций, ведущее место в структуре микотической патологии занимают условно патогенные грибы.
Возбудителями микозов человека являются различные дрожжеподобные (Candida spp., Cryptococcus spp.) и плесневые (Asparagillus spp., Penicillum spp., Mucoz spp.) грибы.
Кандидоз может развиваться как эндогенное и экзогенное заболевание. В виду того, что патогенность Candida невысока, преимущественно развиваются эндогенные формы на фоне ослабления защитных сил организма.
С современных позиций рассматривают два принципиально различных механизма патогенеза кандидоза: инвазивный и неинвазивный кандидоз. Инвазивный кандидоз обусловлен внедрением нитчатой формы гриба Candida в ткани макроорганизма с развитием системного кандидоза с поражением висцеральных органов. Неинвазивный кандидоз реализуется без трансформации гриба в нитчатую форму за счет пролиферации его в просвете полого резорбирующего органа – кишечника или на поверхности кожи и слизистых оболочек. В патогенезе кандидоза играет роль развитие и углубление дисбиоза и микст-инфекций в просвете кишечника, на поверхности кожи и слизистых оболочек резорбция продуктов аномальной ферментации питательных веществ и метаболитов грибов.
В развитии рецидивирующего кандидоза играют роль как неполная эрадикация грибков со слизистой, так и реинфекция, экзогенная или эндогенная.
Классификация кандидоза по глубине поражения:
· поверхностный кандидоз с поражением слизистой оболочки полости рта, глотки, пищевода, толстой кишки, влагалища;
· поверхностный инвазивный кандидоз с распространением инфекции за пределы базальной мембраны, но без поражения паренхимы органов;
· глубокий кандидоз - поражение паренхиматозных органов и нервной системы. Клинические формы кандидоза Клинические формы кандидоза отличаются большим многообразием, основными из них являются:
· кандидоз ногтевых валиков и ногтей;
· кандидоз слизистой оболочки рта;
· кандидоз дыхательных путей и уха;
· кандидоз пищеварительного тракта;
· кандидозный эндокардит, перикардит, миокардит;
· кандидозный остеомиелит, артрит, медиастинит;
· внутрибрюшные абсцессы, перитонит, абсцессы селезенки, печени, поджелудочной железы ассоциированные с Candida spp.;
· кандидемия и острый гемобластозный кандидоз.
Следует отметить, что при кандидозе может поражаться практически любой орган. Наиболее часто поражаются легкие, головной мозг, брюшина, печень, селезенка. Поэтому при выявлении кандидемии обязательно дополнительное обследование для выявления очагов диссеминации (компьютерная томография органов брюшной полости, офтальмоскопия с расширением зрачка и др.).
Клинические и лабораторные признака кандидоза:
· клинические и гистологические признаки грибковых инфекций;
· гипертермия, резистентная к антибиотикам широкого спектра действия;
· положительная серологическая реакция.
· многофокусная колонизация Candida у больных, имеющих факторы риска;
· выделение грибов рода Candida из крови и других стерильных анатомических зон;
· выявление грибкового эндофтальмита;
· Факторы риска инвазивного кндидоза:
· длительная антибактериальная терапия препаратами широкого спектра действия;
· выделение Candida spp. из двух и более анатомических зон (исключая кровь);
· проведение программного гемодиализа;
· многократные трансфузии компонентов и препаратов крови;
· длительное нахождение в ОИТ;
· катетеризация венозных сосудов;
· длительная катетеризация мочевого пузыря;
· парентеральное питание, особенно применение жировых эмульсий;
· зондовое энтеральное питание;
· операции на органах брюшной полости, особенно по поводу перфораций полых органов и острого панкреатита;
· ожоги II-III степени, тяжелые черепно-мозговые травмы, сочетанные травмы;
· тяжелые инфекции (сепсис, перитонит, интраабдоминальные абсцессы);
· иммуносупрессивные состояния (сахарный диабет, применение иммунодепрессантов, длительное лечение кортикостероидами, химио- и лучевая терапия опухолей, ВИЧ-инфекция;
· диарея или выраженный мукозит.
Лечение микозов
В настоящее время существует 4 группы противогрибковых препаратов следующего действия: антибиотики, пиримидиновые производные, азолы, прочие.
Амфотерицин В Наиболее широкий спектр противогрибковой активности свойственен полиеновому антибиотику - амфотерицину В. Он является стандартом при лечении инвазивных микозов, но отличается высокой токсичностью. Рекомендуемая доза препарата - 0,5-1 мг/сут в течение 10-14 дней. Имеют ряд преимуществ липид-ассоциированные формы амфотерицина. Парентеральное введение амфотерицина В используют лишь в случаях инфекции грибами, не чувствительными к флуконазолу, в частности С. krusei и C. glabrata, и при аспергиллезе.
Нистатин мало всасывается в кишечнике и не выводится парентерально. Спектр его применения ограничивается назначением при орофарингеальном кандидозе, поверхностном кандидозе пищевода, неинвазивном кандидозе кишечника.
Антимикотики группы пиримидина имеют ограниченный спектр противогрибковой активности.
Производными азолов являются имидазолы (клотримазол, миконазол, кетоконазол) и триазолы 1-го поколения (флуконазол, итраконазол) и 2-го поколения - производные флуконазола (вориконазол, равуконазол) и производные итраконазола (позаконазол и альбаконазол). Препаратам этой группы свойственны широкий спектр активности, простота в применении, ограниченная токсичность, что делает их препаратами выбора для лечения инвазивных микозов.
Флуконазол Рекомендуемая профилактическая доза флуконазола составляет 50-400 мг/сутки в зависимости от степени генерализации грибковой инфекции (в среднем 6 мг/кг/сутки).
Вориконазол Основным отличием вориконазола от его предшественника, флуконазола, является более широкий спектр антифунгальной активности. Вориконазол блокирует синтез фермента 14a-деметилазы, связанного с продукцией эргостерола – важного компонента мембраны клетки грибов. Назначают вориконазол в дозе 0,2 – 0,4 г/сут. Внутрь или в/в, капельно.
Вориконазол отличается высокой активностью в отношении Candida spp., в том числе резистентных к флуконазолу C. krusei и C. glabrata. Установлено, что вориконазол обладает высокой активностью in vitro и против других дрожжевых возбудителей микозов, например Cryptococcus neoformans, Trichosporon asahii и Saccharomyces cerevisiae. Вориконазол высокоактивен против Aspergillus spp., в том числе резистентных к амфотерицину В A. terreus и A. nidulans. На некоторые виды этих возбудителей, в том числе A. fumigatus и A. flavus, вориконазол действует фунгицидно. При этом препарат активен против штаммов A.fumigatus, резистентных к итраконазолу. В отличие от амфотерицина В и итраконазола вориконазол обладает фунгицидной активностью против Scedosporium и Fusarium spp. Кроме того, установлена клиническая эффективность вориконазола в лечении инфекций, обусловленных Alternaria, Cladosporium, Fonsecaea, Paecilomyces spp. и другими резистентными ко многим антимикотикам возбудителями.
Равуконазол имеет химическую структуру, сходную с флуконазолом и вориконазолом. Имеет широкий спектр активности, включая полирезистентные штаммы. Активен в отношении Candida spp., включая С. krusei и C. glabrata, а также Scedosporium spp., Aspergillus spp. и Cryptococcus neoformans. Равуконазола назначают в дозе 5 и 10 мг/кг/сут
Интраконазол в концентрации в 100 раз меньшей чем кетоконазол подавляет включение 14С-ацетата в эргостерин клеток гриба, чем достигается фунгицидное или фунгистатическое действие. Активность препарата показана при инфекциях, вызванных Candida, Aspergillus, Coccidioides immitis, Cryptococcys neoformans, Hystoplasma capsulatum, Paracoccidioides brasiliensis, Sporothrix schenckii при различных путях заражения. Интраконазол хорошо проникает и распределяется в органах и тканях, где его концентрация в 2-5 раз выше уровня в плазме. Препарат применяется для лечения поверхностных системных микозов. Побочные реакции при лечении интраконазолом (5-8%) регистрируются в 3-5 раз. Интраконазол назначают по 100 мг ежедневно в течение 15 дней.
Тербинафин (ламизил) - препарат с широким спектром действия, активен в отношении дерматофитов, плесеней( в том числе и аспергилл ), диморфных грибов, с первичным фунгицидным действием и очень высокой активностью при системных микозах. Тербинафин назначают в дозе 250 мг в день в течение четырех недель.
Позаконазол является дериватом итраконазола. Препарат имеет очень низкую растворимость в воде, в настоящее время он доступен только в форме для приема внутрь. Позаконазол отличается широким спектром активности. Имеет высокую активность в отношении дрожжей, включая Candida spp. и Cryptococcus neoformans, а также большинства мицелиальных возбудителей микозов, в том числе полирезистентных Scedosporium и Fusarium spp. Важной особенностью позаконазола является его отличная от большинства других антимикотиков активность против возбудителей зигомикозов – Rhizopus, Mucor и Absidia spp.
Альбаконазол – наименее исследованный препарат из представленных азолов. Характеризуется широким спектром активности in vitro, действует против Candida spp., Aspergillus spp. и Paecilomyces spp.
Эхинокандины являются новым классом антимикотиков с отличным от других антимикотиков механизмом действия, связанным с блокадой синтеза 1,3-b-D-глюкана – важного структурного и функционального компонента клеточной стенки грибов. В связи с тем что 1,3-b-D-глюкан отсутствует в организме человека, эхинокандины обладают очень хорошей переносимостью с минимальным количеством нежелательных явлений.
Каспофунгин – полусинтетический водорастворимый липопептид, получаемый при ферментации продуктов жизнедеятельности гриба Glarea lozoyensis. Каспофунгин проявляет фунгицидную активность против Candida spp., включая резистентные (C. krusei) и со сниженной чувствительностью (C. glabrata) к азолам или резистентные к амфотерицину В (C. lusitaniae) штаммы. Каспофунгин не активен в отношении Cryptococcus neoformans, фунгистатически действует на Aspergillus fumigatus, A. flavus, A. niger и A. Terreus. Каспофунгина назначают в дозе 70 мг в первый день, затем – 50 мг в сутки.
Микафунгин является синтетическим препаратом, получаемым при химической переработке продуктов жизнедеятельности гриба Coleophoma empedri. Обладает широким спектром активности in vitro, который включает C. albicans, C. glabrata, C. tropicalis, C. krusei, C. parapsilosis, в том числе резистентные к азолам и амфотерицину В штаммы. Активен в отношении Aspergillus spp., хотя и не оказывает на них фунгицидного действия. Как и все эхинокандины, микафунгин не активен против Cryptococcus, Fusarium и Trichosporon spp.
Анидулафунгин обладает спектром активности, сходным с каспофунгином и микафунгином. Обладает высокой активностью in vitro в отношении Candida spp., включая штаммы, резистентные к флуконазолу и итраконазолу, менее активен против C. famata и C. parapsilosis. В отношении Aspergillus spp. анидулафунгин более активeн, чем итраконазол и амфотерицин В.
При проведении длительной антибактериальной терапии требуется профилактика грибковых инфекций. Широко применяемым профилактическим препаратом является нистатин. Однако он эффективен для профилактики кандидоза только в просвете кишечника. Системная абсорбция его не превышает 3-5%. Поэтому препаратами выбора следует считать препараты из группы триазолов (флуконазол, итраконазол), назначаемые однократно в ударных дозах.
В профилактике кандидоза у лиц, страдающих тяжелыми заболеваниями, которые рассматриваются в качестве предрасполагающих факторов (сахарный диабет, иммунодефицитные состояния), эффективны только системные азольные препараты и амфотерицин. При выборе системного антимикотика следует отдавать предпочтение триазолам: флуконазолу и итраконазолу.
При лечении беременных женщин местные антимикотики по показаниям можно назначать только во II и III триместрах. Системные антимикотики при беременности не рекомендуются.
[youtube.player]При попадании грибков и бактерий в кровь человека развивается инфекционное заболевание — грибковый сепсис. Болезнь обуславливается быстрым распространением болезнетворных микроорганизмов по току крови во внутренние органы и ткани человека. При отсутствии своевременной и эффективной лечебной терапии возможен летальный исход.
Как передается и почему развивается
Возбудителями грибкового сепсиса могут быть грибы рода: Candida spp., Aspergillus spp., Mucorales, Fusarium spp., Scedosporium spp.
Основным возбудителем грибкового сепсиса является грибок рода Candida. Наличие на коже и слизистых местного инфекционного очага инфекции способствует проникновению спор гриба в кровь. Распространяясь с током крови, они образуют гранулемы (узелки), локализующиеся:
- на слизистых ЖКТ;
- в суставах;
- на мозговых оболочках;
- во внутренних органах.
Для развития болезни необходимы следующие факторы:
- наличие первичного очага воспаления, воздействующего с лимфатическими и кровеносными путями;
- одновременное проникновение в кровь нескольких возбудителей;
- присутствие вторичных очагов, активирующих размножение болезнетворного микроорганизма.
Возникновение грибкового сепсиса провоцируют:
- хирургические операции;
- внутриутробное заражение плода;
- раны и царапины на кожных покровах;
- использование зараженных медицинских инструментов.
На фоне грибковой инфекции развивается гранулематозное воспаление, вызывающее тяжелый инфекционный процесс с поражением всего человеческого организма. Ослабление иммунитета и хронические заболевания снижают сопротивляемость человеческого организма к воздействию грибковой инфекции. Организм целенаправлен на излечение существующих патологий и не оказывает сопротивление активации и распространению патогенных грибков. К причинам развития болезни относятся:
- заболевания эндокринной системы — сахарный диабет;
- ослабленный иммунитет;
- инфекционные болезни;
- нарушение обмена веществ;
- дисбаланс гормональной системы;
- онкологические заболевания;
- истощение организма;
- гнойные процессы, ожоги на кожных покровах;
- длительный прием антибиотиков или стероидных препаратов;
- нехватка витаминов и рахит;
- химиотерапия.
Основные виды и симптомы грибкового сепсиса
По характеру течения различают несколько видов грибкового сепсиса. Основные его виды представлены в таблице:
| Вид | Характер течения |
|---|---|
| Молниеносный | Происходит резкая интоксикация всего организма |
| Острый | Первичные очаги формируются несколько дней |
| Подострый | Поражение организма происходит в течение нескольких месяцев |
| Хронический | Болезнь формируется более 6-ти месяцев |
| Рецидивирующий | После полного исчезновения признаков заболевания периодически появляются рецидивы болезни |
Симптоматика заболевания зависит от характера течения болезни. Основные симптомы развития грибкового сепсиса:
- высокая температура, лихорадка;
- чередование диареи и запоров;
- снижение артериального давления;
- депрессивное состояние;
- грибковый дерматит вокруг ануса;
- появление грибковых опрелостей подмышками;
- кандидоз слизистых оболочек;
- тахикардия;
- дыхательные расстройства;
- цианоз носогубного треугольника;
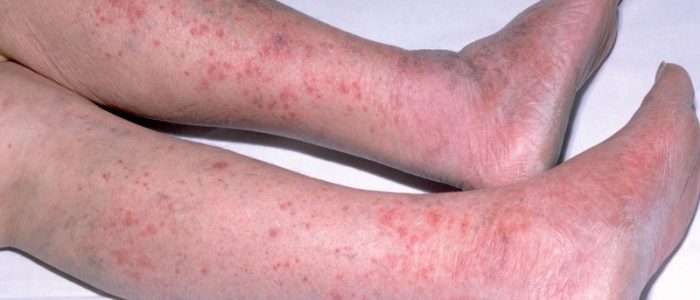
- появление красных пятен на кожном покрове;
- сыпь по всему телу;
- увеличение размеров печени и селезенки;
- ухудшение общего состояния;
- снижение массы тела;
- кровоизлияние в органах.
Диагностика
Диагностика заболевания проводится на основе лабораторных исследований. Для диагностики из очага поражения берется многократный посев крови. Такая процедура определяет возбудителя заболевания и его стойкость к антибиотикотерапии. При поражении внутренних органов проводится УЗИ и рентген.
Лечебная терапия
Лечение грибкового сепсиса зависит от признаков болезни и степени поражения организма. Главными целями лечебной терапии являются:
- уничтожение возбудителя болезни;
- восстановление иммунной системы;
- ликвидация симптомов заболевания;
- корректировка функционирования пораженных органов;
- запуск процесса самоочищения организма.
Лечебная терапия основывается на индивидуальном комплексном подходе. Действенные и эффективные медпрепараты для лечения грибкового сепсиса представлены в таблице:
Лечение грибкового сепсиса проходит только под постоянным врачебным контролем.
Методы профилактики
Опасное заболевание наносит вред всему человеческому организму. Для предотвращения угрозы заболевания рекомендуется:
- обрабатывать антисептиком царапины и раны на кожных покровах;
- не допускать появление воспаленных и гнойных очагов;
- укреплять работу иммунной системы;
- соблюдать врачебный контроль после хирургических операций;
- сбалансировать питание.
При малейших признаках развития грибкового сепсиса в организме необходимо обратиться к специалистам. На начальных стадиях заболевания прогноз на выздоровление всегда благоприятный. Как дополнительный метод борьбы с грибковой инфекцией используются средства народной медицины. Отсутствие своевременного и адекватного лечения способствует поражению всего организма и приводит летальному исходу.
[youtube.player] 
Лекарственное средство против грибков. Назначается врачом при следующих заболеваниях:
- Сильные грибковые инфекции, возбудителем которых являются Scedosporium spp. и Fusarium spp.
- Иные тяжелые грибковые заболевание, лечение которых невозможно другими препаратами из-за аллергической реакции или их неэффективности.
- При тяжелой стадии кандидоза (кандидоз пищевода).
- Инвазивный аспергиллез.
- Применяется как профилактический больным при иммунодефиците.
Описание и состав лекарственного средства
Форма выпуска препарата и состав

Выпускается в стеклянных флаконах 200 мг 1 в картонной пачке и 15 и 20 в картонных коробках (для стационаров). Внутри каждого флакона пористая масса (порошок) белого цвета. В состав входит вориконазол 200 мг и вспомогательные вещества, такие как натриевая соль сульфобутилового эфира β-циклодекстрина.
Инструкция по применению, дозировка
| Взрослые и дети после 12 лет | Насыщающая доза (только первые сутки) | Поддерживающая доза |
(на вторые сутки и далее после начала лечения)
Показания и противопоказания
Лечить можно различные заболевания, вызванные грибком, которые не поддаются лечению другими лекарственными средствами по каким-либо причинам.

Противопоказаниями можно считать:
- Гиперчувствительность к препарату или индивидуальная непереносимость составляющих препарата.
- Применение данного препарата параллельно с такими лекарствами как:
- терфенадин,
- астемизол,
- цизапридом,
- пимозидом,
- хинидин,
- сиролимус,
- алкалоиды спорыньи
- рифампицин,
- карбамазипин.
- фенобарбитал,
- ританавир,
- эфавиренз.
Особые указания
Дети в возрасте до 2 -х лет не должны принимать данное лекарственное средство, так как клиническими исследования не установлено возможность пользы или вреда от применения данного средства. Стоит, после консультации со специалистом, выбрать другое лекарство для лечения.
Перед началом лечения стоит провести соответствующие анализы, после которых будет ясно, стоит принимать лекарство, или пациент находится в зоне риска от побочных эффектов.
Что делать при передозировке
Рассмотрим варианты аналогов по действующему веществу и по действию. Так же изучим примерные цены на эти товары.
Схожесть по действующему веществу:
| Препарат | Цена |
| Вифенд | 19 392 рублей |
| Ворикоз | 9 244 рублей |
| Вориконазол — Тева | 14 762 рублей |
Схожесть по действию:
| Препарат | Действующие вещество | Цена, руб. |
| Микамин | Микафунин | 20 845 |
| Ливарол | Кетоконазол | 721 |
| Итразол | Итраконазол | 1190 |
| Низорал | Кетоконазол | 1100 |
| Ломексин | Фентиконазол | 563 |
| Амфолип | Амфотерицин | 15 500 |
| Кандитрол | Итраконазол | 990 |
| Флуконазол | Флуконазол | 317 |
| Дифлюкан | Флуконазол | 1227 |
| Румикоз | Итраконазол | 365 |
Стоимость и где купить
| Аптека | Цена |
| Аптека ру | 14 762 рублей |
| Аптека вер | 17 700 рублей |
| Аптека 36,6 | 26 467,30 рублей |
Срок годности и условия хранения
Хранить нужно при температуре не более 30 градусов выше нуля. Срок годности 3 года. После истечения срока годности не использовать.
Условия продажи в аптеках
Отпускается из аптек строго по рецепту.
Отзывы о препарате
Мария, Красноярск
Александр, Курс

Состояние не ухудшалось, никаких осложнений я не почувствовал. Стало легче на 5 день. Минусом могу считать только цену, она очень большая. Плюсы — все остальное. Быстрая действие. После лечения данным лекарством не нужно повторять лечение, помогает на раз.
Ирина, Кострома
Смотрите видео на тему диагностирования грибковых инфекций:
[youtube.player]


Поиск
Грибы рода Fusarium как потенциально патогенные виды микроорганизмов
С.А. ЛИСОВСКАЯ, Е.В. ХАЛДЕЕВА
Казанский научно-исследовательский институт эпидемиологии и микробиологии Роспотребнадзора, 420015, г. Казань, ул. Большая Красная, д. 67
Лисовская Светлана Анатольевна ― кандидат биологических наук, ведущий научный сотрудник лаборатории микологии, тел. (843) 236-56-59, e-mail: [email protected]
Халдеева Елена Владимировна ― кандидат химических наук, заведующая лабораторией микологии, тел. (843) 236-56-59, e-mail: [email protected]
Проведен анализ патогенной активности различных видов Fusarium spp. Изучены адгезивные свойства штаммов Fusarium oxysporum, Fusarium solani музейных и клинических (выделенных от больных) с помощью ранее разработанной модели на основе нитроцеллюлозной пленки с иммобилизованным гемоглобином. Определена ростовая активность 5 штаммов с использованием различных сред. Установлено, что микроконидии обладают адгезивной активностью. Выявлено активное образование ростовых трубок всеми видами грибов рода Fusarium на нитроцеллюлозной пленке с иммобилизованным гемоглобином. Полученные данные позволяют предположить, что грибы рода Fusarium могут играть определенную роль в патогенезе заболевания.
Ключевые слова: Fusarium spp., микромицеты, патогенность, адгезия, микроконидии.
S.A. LISOVSKAYA, E.V.KHALDEEVA
Kazan Research Institute of Epidemiology and Microbiology of the Russian Agency for Consumer Supervision, 67 Bolshaya Krasnaya Str., Kazan, Russian Federation, 420015
Lisovskaya S.A. ― Cand. Biol. Sc., Leading Researcher of Mycology Laboratory, tel. (843) 236-56-59, e-mail: [email protected]
Khaldeeva E.V. ― Cand. Chem. Sc., Head of Mycology Laboratory, tel. (843) 236-56-59, e-mail: [email protected]
Analysis of pathogenic activity of different species of Fusarium spp. was carried out. Adhesive properties of standard and clinical strains of Fusarium oxysporum, Fusarium solani were tested with the previously developed model based on nitrate cellulose film with immobilized hemoglobin. The growth activity of 5 strains was determined using various media. It was shown that microconidia demonstrated adhesive activity. All Fusarium species actively formed growth tubes on the nitrate cellulose film with immobilized hemoglobin. The obtained results make it possible to assume participation of Fusarium spp. in the disease pathogenesis.
Key words: Fusarium spp., micromycetes, pathogenity, adhesion, microconidia.
Повсеместное распространение микроскопических грибов в окружающей среде обуславливает постоянный контакт человека с микромицетами. Высокий уровень антропогенных воздействий, часто способствующий накоплению в окружающей среде вредных плесеней и увеличению количества больных иммунодефицитом, наиболее восприимчивых к возбудителям вторичных микозов, может способствовать увеличению риска заражения грибковыми инфекциями. Так, в последнее время увеличивается число регистрируемых случаев вторичных микозов, вызванных видами, ранее остававшимися в тени, относящихся к оппортунистическим ― потенциально патогенным видам из-за лабильных свойств [1]. Среди них есть и достаточно выраженные патогенные формы микромицетов, виды, способные поражать ослабленные организмы, и, наконец, сапрофиты, живущие на растительных остатках, в почве и на отмерших частях растений.
Грибы рода Fusarium обладают большим разнообразием ферментов, что позволяет им использовать в качестве субстрата различные органические соединения. Они способны, с одной стороны, длительно сохраняться и развиваться во внешней среде, а с другой, вызывать тяжелые формы заболеваний различных организмов. Большинство представителей грибов рода Fusarium являются фитопатогенами, однако известны Fusarium spp., паразитирующие на насекомых, а также вызывающие микозы и токсикозы человека и теплокровных животных [2, 3]. В последнее время в литературе появляется все больше сведений о клинических и эпидемиологических аспектах инфекции, вызванных Fusarium spp. [4].
Наиболее часто причиной заражения оппортунистическими видами грибов во внешней среде является вдыхание спор грибов, а в случае повреждения кожных покровов ― занос в раны инфекции, причем часто из почвы. У человека и теплокровных животных грибы рода Fusarium наиболее часто колонизируют ногти, кожу, роговицу глаза и легкие. Fusarium spp. могут быть причиной аллергических состояний у лиц, вдыхающих загрязненный конидиями и спорами воздух, например, риниты, бронхиальная астма. Неинвазивно обитающие в параназальных полостях они способны провоцировать аллергические грибковые синуситы. В то же время у Fusarium spp., в отличие от многих признанных патогенных грибов, имеется необычная способность продуцировать в тканях человека особые морфологические формы: конидии и торулоидные гифы, способные проникать в кровоток и приводить к диссеминации процесса [5]. Такие одноклеточные формы легко циркулируют в кровотоке.
В настоящее время остается не ясным вопрос: могут ли грибы рода Fusarium самостоятельно вызывать микозы или они инфицируют органы человека вторично, например, на фоне заболевания неинфекционной природы. В связи с этим, целью нашей работы было изучение факторов патогенности грибов рода Fusarium, и оценка частоты встречаемости их в микробиологических посевах, от пациентов, обратившихся в микологическую лабораторию Казанского НИИ эпидимиологии и микробиологии.
Материалы и методы
В исследовании использовали клинические штаммы (Fusarium oxysporum, Fusarium solani), выделенные от пациентов, находящихся на амбулаторном лечении, и музейные штаммы, полученные из Всероссийской коллекции F. oxysporum ВКМ- F-1182 и F. Solani ВКМ- F-819.
Материал для выделения изолятов грибов брали от больных с помощью стерильного ватного тампона с последующим смывом стерильной водой по периметру наиболее свежих поражений. Затем тампон помещали в пробирку с 2 мл стерильной воды. Поверхностное культивирование проводили на агаризованных средах: стандартной среде Чапека, стандартной среде Сабуро и модифицированной среде Сабуро с добавлением гидролизат казеина. Выращивание проводили при +30±2 0 С в течение 6-9 суток. Идентификацию выделенных штаммов грибов проводили по основным принятым микроскопическим и биохимическим критериям [6, 7].
Определение адгезивных свойств выделенных штаммов Fusarium spp. проводилось на ранее разработанной авторами модели адгезии клеток гриба на нитроцеллюлозную пленку. Пленку площадью 7 см 2 инкубировали при температуре 30°С с 3 мл суспензии спор гриба в 0,1М фосфатном буфере в течение 1 суток. Определение уровня адгезии проводили по разнице начальной и конечной оптической плотности суспензии клеток при длине волны 540 нм, а также прямым подсчетом клеток в суспензии с помощью микроскопа Микмед-6 при увеличении 10×20, подсчитывали не менее 10 полей зрения.
Определение скорости роста мицелия грибов и прорастания микроконидий проводили на нитроцеллюлозной пленке с иммобилизованным гемоглобином и в его отсутствии. Густота посевной взвеси ― приблизительно 100 спор на пленку. Инкубирование проводили в течение 1-4 суток при температуре 30°С. Скорость прорастания микроконидий определяли временем достижения ростовой трубкой первого ветвления и числом ростковых трубок (в процентах; на основании изучения не менее чем 100 спор).
Результаты и обсуждения
Результаты обследования пациентов, обратившихся в лабораторию микологии КНИИЭМ, показывают, что грибы рода Fusarium наиболее часто обнаруживаются в микробиологических посевах поздней весной и ранней осенью. Это связанно с хорошим ростом этих грибов во влажных условиях и распространением их конидий ветром и осадками [1]. Частота обнаружения грибов рода Fusarium в организме человека за период 2010-2015 гг. составила, по данным наших исследований, около 7% (рис. 1). Грибы рода Fusarium более чем в 95% случаев высевались у больных с кожных покровов, и менее 5% приходилось на долю слизистых носа, роговицу глаза и слухового прохода. Однако, только в восьми случаях обсемененность грибами Fusarium spp. составила более 1х10 4 КОЕ/мл. Причем, в пяти случаях заражения, у больных был поставлен диагноз атопический дерматит с хроническим течением заболевания и в двух случаях ― микоз кожи. Длительное нарушение как общего, так и местного иммунитета, сопровождающее данные хронические заболевание кожи, способствует расширенной колонизации условно-патогенной микрофлорой, в том числе грибами рода Fusarium.
Необходимо отметить, что данные микромицеты в 96% случаев в микробиологических посевах от больных высевались совместно с другими видами грибов. Наиболее часто, в 73% случаев Fusarium spp.встречался в ассоциациях с C. albicans.
Для исследования патогенности данных микромицетов нами были отобраны три клинических и два музейных штамма Fusarium spp. Группу клинических штаммов составили два штамма F. solani (№3, 4) и один штамм F. оxysporum (№5), при выделении которых учитывались клинические проявления микотического заболевания и выявление Fusarium spp. в количестве, превышающем 10 4 КОЕ/мл. Группу музейных штаммов составили два штамма: F. oxysporum (№1), F. solani (№2).
Рисунок 1. Частота встречаемости потенциально патогенных плесневых грибов в микологических посевах за период 2010-2015 гг.

Рисунок 2. Диаметр колоний изолятов Fusarium на различных твердых средах на четвертый день культивирования

Примечание: 1 ― стандартная среда Чапека; 2 ― стандартная среда Сабуро; 3 ― модифицированная среда Сабуро с добавлением гидролизат казеина
С целью описания морфологии колоний и характера роста культур, грибы выращивали на различных твердых средах. Наилучший рост на твердых средах на четвертый день культивирования наблюдался у клинических штаммов на модифицированной среде Сабуро с добавлением гидролизат казеина, по сравнению с общепринятой для выделения данных видов грибов средой Чапека (рис. 2). Изоляты характеризовались обильным ростом мицелия, в том числе воздушного, происходило образование большого количества репродуктивных структур: макро- и микроконидий. Музейные штаммы на данной среде достигали таких же размеров только к шестым суткам. По-видимому, это связано с использованием различных источников азота в этих средах. В первом случае ― это органический источник ― казеин, для его использования в своем метаболизме грибу требуется выработка специфических ферментов, в частности, протеаз. Во втором ― минеральный ― нитрат натрия, он более доступен и быстрее метаболизируется мицелиальными грибами. Можно предположить, что клинические штаммы обладали набором необходимых протеаз. Известно, что секретируемые грибами протеазы участвуют в разнообразных формах патогенеза, например инвазии.
Потенциальную патогенность принято характеризовать наличием и проявлением факторов патогенности, основанных на физиологических особенностях грибковой клетки и характере ее взаимодействия с макроорганизмом, которые способствуют закреплению гриба в организме и развитию заболевания. Известно, что любой инфекционный процесс начинается с адгезии возбудителя на клетках-мишенях. Адгезивность является одним из основных факторов, определяющих поведение микроорганизмов в биоценозах, и она же определяет способность гетеротрофных микроорганизмов переходить к паразитическому образу существования [8]. Поэтому, нами были изучены адгезивные свойства штаммов грибов Fusarium spp., выделенных с поверхности кожи у больных атопическим дерматитом.
В изучении адгезивной активности штаммов использовали микроконидии, несмотря на то, что в морфологическом отношении они менее дифференцированы, чем макроконидии, но играют ключевую роль в распространении вида и заселении субстрата.
Изучение выделенных микроконидий у штаммов Fusarium spp. выявило значительные отличия в их адгезивных свойствах, связанных с видовой принадлежностью штаммов. Тестирование адгезивных свойств микроконидий грибов Fusarium spp., клинических и музейных штаммов показало значительно более высокий (почти в 2 раза) уровень адгезии у вида F. solani, по сравнению с F. oxysporum (табл. 1), что позволило выявить достоверные отличия между изученными видами. Таким образом, адгезивная активность микроконидий, по-видимому, является видовым атрибутом грибов рода Fusarium. Отсутствие отличий в адгезивной активности микроконидий у штаммов одного вида, но выделенных с различных источников, можно объяснить лишь тем, что каждый отдельный вид грибов рода имеет свои определенные особенности в структуре поверхности спор, участвующих в процессе сохранения и размножения вида.
Таблица 1.
Адгезивная активность микроконидий штаммов Fusarium spp. (n=5, p=0,95)
| Исследуемые виды грибов | Принадлежность штамма | Средний уровень адгезии микроконидий, % |
| F. oxysporum (№1)
F. solani (№4) | Музейный штамм
Клинический штамм | 8,6+0,1
17,0+0,1 |
В ходе эксперимента было замечено, что при использовании в качестве лиганда белка гемоглобина, увеличивается количество ростковых трубок у микроконидий всех видов грибов Fusarium spp. Выявлено активное обрастание нитроцеллюлозной пленки с иммобилизованным гемоглобином всеми видами грибов рода Fusarium, по сравнению с ростом данных грибов на нитроцеллюлозной пленке, в отсутствии гемоглобина, где количество ростковых трубок было в 3-5 раз меньше. Время появления первой ростковой трубки для разных видов было различно. Так, у грибов F. solaniее появление отмечено в первые шесть часов, а полное прорастание спор завершилось на вторые сутки опыта, тогда как у штаммов F. oxysporum первые ростковые трубки появились только к концу первых суток (табл. 2).
Таблица 2.
Скорость прорастания микроконидий Fusarium spp.
| Виды грибов | Образование ростковой трубки, время (час) | |||||||
| Нитроцеллюлозная пленка в отсутствии гемоглобина | Нитроцеллюлозная пленка с иммобилизованным гемоглобином | |||||||
| 3 | 6 | 18 | 24 | 3 | 6 | 18 | 24 | |
| F. solani №2 | — | — | + | ++ | — | ++ | ++ | +++ |
| F. oxysporum №1 | — | — | +/- | + | — | — | ++ | ++ |
Примечание: (-) ― при осмотре под микроскопом отсутствуют внешние морфологические изменения; (+) ― при осмотре под микроскопом видно слабое развитие 50%
Проведенные исследования показали наличие патогенных свойств у грибов рода Fusarium. Выявлены статистически достоверные отличия адгезивных свойств и интенсивности прорастания различных видов Fusarium. Полученные данные подтверждают наличие среди грибов рода Fusarium видов с более выраженными патогенными свойствами, что подчеркивает значимость видовой идентификации гриба. Кроме того, в ходе исследования отмечалось проявление агрессии грибов к белкам макроорганизма.
Таким образом, на основании полученных данных, можно предположить, что грибы рода Fusarium могут играть определенную роль в патогенезе заболевания. Присутствие данных микромицетов в микробиологическом посеве необходимо учитывать врачам-клиницистам для прогнозирования микотических осложнений у больных, особенно при наличии выраженных нарушений кожного покрова, например, при атопическом дерматите.
[youtube.player]Читайте также:


