Ведущий патогенетический механизм прогрессирования остеоартроза






1. Укажите факторы, приводящие к развитию первичного деформирующего артроза:
а) эндокринные нарушения
б) функциональная перегрузка с микротравматизацией
в) микрокристаллические артриты
г) наследственное снижение хряща к обычным нагрузкам
д) повторные кровоизлияния в сустав
е) асептический некроз
2. Ведущий патогенетический механизм прогрессирования остеоартроза:
б) дегенерация суставного хряща
в) выпадение в полость сустава кристаллов гидроксиапатита кальция
г) ремоделирование костной ткани
д) атрофия близлежащих мышечных групп
3. Выберите правильные утверждения, относящиеся к функции хондроцитов:
а) для хондроцитов характерен анаэробный тип метаболизма
б) при остеоартрозе хондроциты переключаются на синтез аномальных коротких цепей протеогликанов
в) основной функцией хондроцитов является синтез коллагеновой сети
г) на ранних стадиях развития остеоартроза наступает массовая дегенерация и гибель хондроцитов
д) на ранних стадиях остеоартроза толщина суставного хряща увеличивается за счет компенсаторной синтетической гиперфункции хондроцитов
4. Укажите суставы, наиболее редко поражаемые остеоартрозом у женщин:
в) дистальные межфаланговые суставы кистей
а) с травмой менисков
б) со скоплением жидкости в заворотах сустава
в) с разрывом крестообразных связок
г) с наличием свободного внутрисуставного тела
д) с наличием крупных остеофитов
6. Типичные боли механического типа при остеоартрозе:
а) стихают в покое
б) усиливаются после нагрузки
в) уменьшаются после нагрузки
г) возникают при первых движениях (стартовые боли)
7. Для остеоартроза тазобедренного сустава характерно все, кроме:
а) иррадиация боли в ягодицы, бедро, коленный сустав
б) укорочение конечности с компенсаторным сколиозом, гиперлордозом
г) атрофия четырехглавой мышцы бедра
8. Факторами, способствующими прогрессированию остеоартроза коленного сустава являются:
б) продольное и поперечное плоскостопие
в) повторные травмы
г) слабость четырехглавой мышцы бедра
д) вальгусная и варусная деформации коленного сустава
е) хроническая артериальная недостаточность
9. Наиболее яркая клиническая картина синовита с частыми обострениями
наблюдается при остеоартрозе:
а) тазобедренного сустава
б) дистальных межфаланговых суставов кистей
в) I плюснефалангового сустава
г) коленного сустава
д) проксимальных межфаланговых суставов
10. Ограничение подвижности в пораженном суставе при остеоартрозе не связано с наличием:
а) мышечного спазма
в) костных анкилозов
г) фиброзом и сморщиванием капсулы сустава
д) наличием крупных остеофитов
11. Наиболее информативным диагностическим методом при остеоартрозе:
а) биопсия синовиальной оболочки
б) исследование синовиальной жидкости
в) рентгенография суставов
г) клинический и биохимический анализ крови
д) ультразвуковое исследование
12. Узелки Бушара – это костные утолщения:
а) пястнофаланговых суставов
б) дистальных межфаланговых суставов кисти
в) плюснефаланговых суставов
г) проксимальных межфаланговых суставов кисти
д) проксимальных межфаланговых суставов стопы
13. При какой из локализаций остеоартроза в наибольшей степени страдает
функция кисти:
а) дистальные межфаланговые суставы
б) первый пястнозапястный сустав (ризартоз)
б) проксимальные межфаланговые суставы
в) пястнофаланговые суставы
14. Для остеоартроза дистальных межфаланговых суставов характерно
все, кроме:
а) формирование костных утолщений на боковых поверхностях сустава
б) явления синовита с повышением кожной температуры,
дефигурацией суставов
в) появление на коже в области суставов болезненных пузырьков
с прозрачным содержимым
г) сгибательная контрактура с резким ограничением подвижности
д) подвывихи с искривлением фаланг пальцев
15. Укажите, в каком отделе бедренно-большеберцового сочленения чаще развиваются изменения при гонартрозе:
б) в латеральном
16. Какие из перечисленных рентгенологических признаков могут встречаться при остеоартрозе:
а) сужение суставной щели
б) околосуставной остеопороз
в) краевые остеофиты
г) подвывихи суставов
д) краевые эрозии суставных поверхностей
е) субхондральный остеосклероз
17. Выберите правильные утверждения, относящиеся к полиостеоартрозу
(болезни Келлгрена):
а) чаще развивается у женщин в период наступления менопаузы
б) может развиваться у пациентов с пирофосфатной артропатией
в) развивается у больных, перенесших полиартриты различной этиологии
г) протекает с поражением крупных суставов нижних конечностей
д) поражение мелких суставов кисти при полиостоартрозе встречается редко
е) характерно дегенеративное поражение шейного и поясничного отдела
позвоночника
ж) может наблюдаться поражение околосуставных мягких тканей (тендиниты, тендовагиниты, бурситы)
18. Наиболее безопасным методом лекарственной терапии, рекомендованным к самостоятельному применению больными с остеоартрозом является:
а) длительный прием хондропротекторов
б) локальное применение кремов и мазей с НПВП
в) пероральный прием препаратов НПВП короткими курсами при обострении синовита
19. Выберите препараты, являющиеся селективными ингибиторами ЦОГ-2:
20. При каких локализациях остеоартроза возможно выполнение
протезирования сустава:
а) тазобедренный сустав
б) голеностопный сустав
в) коленный сустав
г) I пястнозапястный сустав
д) I плюснефаланговый сустав
1. Причинами развития вторичного остеоартроза является все, кроме:
г) асептический некроз
д) микрокристаллический артрит
2. Патоморфологическими признаками остеоартроза являются:
а) поверхностное и глубокое разволокнение суставного хряща
б) формирование краевых остеофитов
в) формирование субхондральных кист
г) костное анкилозирование
д) фиброз суставной капсулы
3. Укажите суставы, наиболее часто поражаемые остеоартрозом:
в) дистальные межфаланговые суставы кистей
д) первые плюснефаланговые
4. Выберите правильные утверждения, касающиеся строения и функции суставного хряща:
а) суставной хрящ обеспечивает беспрепятственное скольжение суставных
поверхностей
б) содержит значительное количество нервных окончаний, определяющих
развитие болевого синдрома
в) выполняет функцию амортизатора
г) хорошо развитая капиллярная сеть хряща обеспечивает его высокую
регенераторную способность
д) суставной хрящ выдерживает значительные механические нагрузки
5. Вариантами болевого синдрома при остеоартозе могут быть все перечисленные, кроме:
а) суставные боли в ранние утренние часы
б) стартовые боли
в) ночные боли, обусловленные внутрикостной гипертензией
г) боли при механической нагрузке
д) боли, связанные с блокадой сустава
6. Изменения конфигурации суставов при остеоартрозе:
б) выражены в основном за счет припухлости мягких околосуставных тканей
в) выражены в основном за счет костных изменений
7. К клиническим проявлениям остеоартроза относятся:
а) крепитация при движениях
б) утренняя скованность
г) деформация сустава
д) ограничение подвижности
8. Киста Бейкера – это:
а) околосуставное кистовидное просветление костной ткани на рентгенограммах
б) скопление воспалительной жидкости в полости сустава
в) скопление жидкости в заднем завороте коленного сустава
г) скопление жидкости в препателлярной бурсе
д) скопление жидкости в заднем завороте плечевого сустава
9. Боль при коксартрозе может иррадиировать:
а) в область ягодицы
б) в паховую область
в) по внутренней поверхности бедра
г) в область крестца
д) в коленный сустав
10. Узелки Гебердена - это костные утолщения:
а) проксимальных межфаланговых суставов кисти
б) дистальных межфаланговых суставов кисти
в) пястнофаланговых суставов
11. К наследственным (семейным) формам остеоартроза у женщин относятся:
б) узелки Гебердена
г) артроз I плюснефалангового сустава
12. Назовите наиболее типичные для остеоартроза рентгенологические признаки:
а) сужение суставной щели
б) околосуставной остеопороз
в) краевые остеофиты
г) уплотнение замыкательных пластин (субхондральный остеосклероз)
д) подвывихи суставов
13. К абсолютным противопоказаниям к внутрисуставному введению кортикостероидов относятся:
а) наличие инфекционных заболеваний
б) патологическая кровоточивость
в) невоспалительный характер боли
г) асептический некроз
д) выраженный околосуставной остеопороз
14. К глюкокортикостероидам длительного действия, применяемым для внутрисуставного введения относятся:
а) гидрокортизон ацетат б) трикорт
г) преднизолон
д) дипроспан
а) тазобедренного сустава
б) лучезапястного сустава
в) коленного сустава
г) I пястнозапястного сустава
д) I плюснефалангового сустава
16. Болезнь Келлгрена (полиостеоартроз) включает:
а) дегенеративное поражение суставов позвоночника
б) остеоартроз крупных суставов нижних конечностей и суставов кистей
в) синостозы поперечных отростков позвонков
г) синдром карпального канала
д) множественные периартриты
е) двусторонний сакроилеит
17. У пациентов с факторами риска НПВП-гастропатии наиболее безопасными являются следующие препараты:
18. К хондропротекторам относятся следующие препараты:
19. В случае резкого ограничения функции сустава и выраженных рентгенологических изменениях при остеоартрозе предпочтение следует отдать:
б) внутрисуставному введению кортикостероидов
г) ортопедическим методам
20. К врачебным мероприятиям при остеоартрозе относятся:
а) снижение веса
б) ортопедическая коррекция скелетных дисплазий
в) повышение нагрузки на пораженные суставы
г) постоянный прием нестероидных противовоспалительных препаратов
д) длительный прием хондропротекторов
е) коррекция гиперурикемии, гипергликемии, гиперхолестеринемии
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В статье подробно рассмотрены патогенетические и терапевтические аспекты остеоартроза

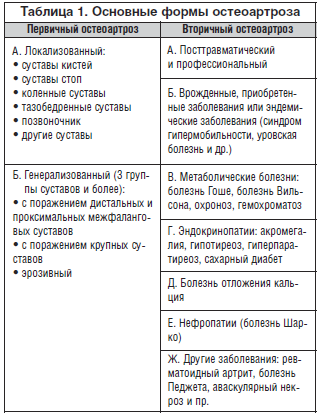
Причины возникновения ОА. На сегодняшний день ОА считается мультифакториальным и полиэтиологическим заболеванием. К основным факторам риска возникновения ОА относят пожилой возраст, женский пол и суставные перегрузки (чрезмерную физическую активность, ожирение). Выделяют 2 основные формы остеоартроза: первичный (идиопатический) ОА с неясной этиологией и вторичный ОА, возникающий в уже пораженном суставе на фоне различных заболеваний (табл. 1).
Патофизиология ОА изучена далеко не полностью. Очевидно, что в его развитии принимает участие целый ряд факторов, взаимодействующих между собой на биохимическом и механическом уровне, что и приводит к возникновению и прогрессированию заболевания [5].
Хрящ – основной компонент сустава, подвергающийся дегенерации при ОА; вместе с ним страдают и другие субхондральные, капсульные, синовиальные и околосуставные структуры [6 ,7]. Суставной хрящ состоит из матрикса и погруженных в него хондроцитов. Матрикс в свою очередь содержит 2 главные макромолекулы: гликозамины (протеогликаны) и коллаген. ОА характеризуется снижением содержания коллагена и протеогликанов, структура и биомеханические свойства внеклеточного матрикса нарушаются. В частности, потеря гликозаминов приводит к снижению сопротивления матрикса воздействию физической нагрузки, и поверхность хряща становится чувствительной к повреждению.
Основные патологические процессы, приводящие к разрушению хряща, происходят в хондроцитах: чрезмерное местное высвобождение протеолитических ферментов (металлопротеиназ, разрушающих матрикс) и прогрессивное замедление репарации хряща приводят к дисбалансу между синтезом и деградацией внеклеточного матрикса. Кроме того, на хондральном уровне синтезируется широкий спектр биоактивных молекул: провоспалительных цитокинов IL-1, -8, -17, -18 и TNF-α, свободных радикалов (NO), фактор роста (TGF-β), липидные медиаторы (простагландин Е2, лейкотриен B4) [8]. Этот воспалительный компонент сосуществует и усиливает дегенеративные механизмы. Воспаление развивается в первую очередь в синовиальной оболочке. Синовиальная мембрана выполняет фильтрацию строительного материала хряща — гиалуроновой кислоты, т. е. предохраняет вымывание последней из полости сустава. Нарушение биохимического состава синовиальной жидкости приводит к прогрессированию дегенерации хряща. Таким образом, страдают все структуры сустава: обнаруживаются дегенерация хряща, его патологическая гипертрофия и кальцификация, формируются костные выросты – остеофиты, происходит склероз субхондральной кости, истончается и повреждается мениск (рис. 2) [9].

Хондроциты вблизи поверхностного слоя хряща образуют кластеры, а в глубоких слоях подвергаются апоптозу. Пролиферация хондроцитов активизируется, но не может противостоять преобладающей катаболической активности. Хондроциты производят деструктивные ферменты – ADAMTS5, MMP13.
Исходя из вышеописанных механизмов, ведущими направлениями борьбы с ОА считаются модуляция воспаления, регуляция метаболизма хондроцитов и стимуляция синтеза хряща [10]. К сожалению, даже при условии постоянного лечения значительное число пациентов продолжают страдать от хронического болевого синдрома.
Структурные изменения при ОА принято подразделять на 4 рентгенологические стадии (классификация ОА по Kellgren – Lawrence) [11]:
• 0 стадия – отсутствие рентгенологических признаков;
• I стадия (сомнительный) – сомнительное сужение суставной щели, возможны остеофиты;
• II стадия (мягкий) – определенные остеофиты и сомнительное сужение суставной щели;
• III стадия (умеренный) – умеренные остеофиты, определенное сужение суставного пространства, возможная деформация костей;
• IV стадия (тяжелый) – большие остеофиты, сужение суставного пространства, тяжелый остеосклероз, определенная деформация костей.
Патогенез хронического болевого синдрома при ОА наряду с ноцицептивными включает и дисфункциональные механизмы, которые не всегда учитываются при терапии.
Долгое время считалось, что боль при ОА обусловлена исключительно воспалительно-дегенеративными изменениями в суставе, т. е. носит ноцицептивный характер. Источниками этой боли являются синовиальная оболочка, кость и мягкие ткани, окружающие сустав. Дегенеративные изменения хрящевой и костной ткани, а также локальное воспаление провоцируют выработку целого ряда медиаторов, вызывающих дальнейшее повреждение тканей и активацию ноцицепторов. Ноцицептивный тип боли терапевтически чувствителен к морфину, другим наркотическим и ненаркотическим анальгетикам. Соответственно, терапия таких болей чаще всего проводится нестероидными противовоспалительными препаратами (НПВП), эффективно действующими на воспалительные механизмы.
Однако для ряда пациентов такая терапия оказывается недостаточной. Кроме того, как известно, существует расхождение между степенью выраженности патологического процесса, в частности рентгенологической стадией, и интенсивностью боли, которые не взаимосвязаны напрямую. Это свидетельствует об участии в формировании болевого синдрома при ОА, как и любого хронического болевого синдрома, центральных дисфункциональных механизмов (изменения нисходящих антиноцицептивных систем и центральной сенситизации). На медиаторном уровне в развитии хронической боли ведущую роль играет дисбаланс серотонина и нор-адреналина. Поэтому для терапии дисфункционального типа болей необходимо применять препараты центрального действия, способные устранить серотонинергический и адренергический дисбаланс, т. е. прежде всего трициклические антидепрессанты и селективные ингибиторы обратного захвата серотонина и норадреналина. Эффективны также антиконвульсанты (габапентин, прегабалин), поскольку они способны уменьшить центральную сенситизацию.
Лечение ОА должно быть комплексным и включает нефармакологические, фармакологические и хирургические методы (табл. 2).

Лекарственная терапия ОА ведется одновременно по нескольким направлениям: уменьшение болей, снятие воспаления и попытки замедления дальнейшей дегенерации хрящевой ткани [12]. Препараты, применяемые для этих целей, принято называть симптом-модифицирующими препаратами (SMOADS) [13]. Существуют 2 основные группы SMOADS:
1. Быстродействующие препараты, включая анальгетики, НПВП, внутрисуставные глюкокортикоиды и опиоиды.
2. Медленнодействующие препараты, или SYSADOA (Symptomatic Slow Acting Drugs for Osteoarthritis).
Что касается первой группы, то препаратами выбора считаются парацетамол и НПВП [14]. НПВП широко применяются в клинической практике, т. к. оказывают сразу и анальгетический, и противовоспалительный эффект: снимают боль, отек и гиперемию. Однако эти препараты неоднозначно влияют на метаболизм хряща, снижая синтез протеогликанов, коллагена и гиалуроновой кислоты, они могут способствовать прогрессированию дегенерации. Кроме того, НПВП имеют ряд побочных эффектов. Как известно, действие НПВП основано на снижении синтеза простагландинов из арахидоновой кислоты посредством ингибирования фермента циклооксигеназы (ЦОГ). ЦОГ существует в двух формах: ЦОГ–1, постоянно присутствующая во всех тканях, и ЦОГ–2, синтезирующаяся на фоне воспаления. Большинство НПВП и ненаркотических анальгетиков ингибируют оба вида ЦОГ. Блокирование ЦОГ-1 обусловливает основные побочные эффекты, среди которых на первом месте стоит поражение ЖКТ на всем его протяжении (стоматит, эзофагит, гастрит, язва желудка и двенадцатиперстной кишки, энтерит, колит, проктит) с возможностью развития кровотечений. При выборе анальгетика следует руководствоваться не только эффективностью, но и безопасностью применения препарата, тем более что пациенту предстоит длительное применение обезболивающего средства [15]. Поэтому предпочтение отдается группе НПВП селективного действия, имеющей менее выраженное негативное влияние на ЖКТ. В России зарегистрированы 3 группы селективных ингибиторов ЦОГ-2:
– производные сульфонанилидов – нимесулид;
– представители коксибов – целекоксиб, валдекоксиб;
– производные оксикамов – мелоксикам.
Не следует, однако, забывать, что постоянное применение даже селективных НПВП имеет свои недостатки. Наиболее угрожающим является повышение риска сердечно-сосудистых осложнений (усиление гипертонии и сердечно-сосудистой недостаточности), что особенно касается пожилых пациентов с соответствующей сопутствующей патологией [15]. Кроме того, по мере хронизации боли применение НПВП становится все менее эффективным, т. к. в процессе формирования боли начинают преобладать центральные патофизиологические механизмы [16].
Внутрисуставные глюкокортикоиды и опиоиды применяются только в ситуациях, когда препараты первой линии неэффективны. Использование препаратов этой группы зависит от их профиля безопасности, согласия пациента, экономической составляющей и других факторов, характерных для конкретного больного.
Терапия ОА – длительный, практически пожизненный процесс, и особое внимание в процессе лечения уделяется предотвращению дальнейшего развития заболевания, разработке мер, направленных на восстановление структурного и функционального повреждения. Для этих целей применяют препараты группы SYSADOA. Симптом-модифицирующее действие SYSADOA развивается более медленно, чем у препаратов первой группы, они имеют выраженное последействие, т. е. эффект сохраняется еще 4–8 нед. и более после прекращения терапии. Препараты этой группы обладают структурно-модифицирующим действием и замедляют прогрессирование заболевания, поэтому их рассматривают в качестве патогенетического базисного лечения ОА.
SYSADOA состоят из биологически активных (хондромодулирующих, хондропротективных) компонентов хрящевой ткани, необходимых для построения и обновления суставного хряща. К ним относятся:
– предшественники хрящевого матрикса (глюкозамин, хондроитин и гиалуроновая кислота);
– модуляторы цитокинов (диацереин и ингибиторы металлопротеиназ).
Наиболее изученными на сегодняшний день хондропротективными веществами являются хондроитин и глюкозамин. Хондроитин вырабатывается хрящевой тканью суставов и входит в состав суставной жидкости. Он способствует отложению кальция в костях, укрепляет соединительнотканные структуры хряща, сухожилий, связок, кожи, способствует регенерации хряща. Сохраняя воду в толще хряща, он повышает прочность соединительной ткани. Именно хондроитин ингибирует специфические ферменты, разрушающие соединительную ткань. Глюкозамин является необходимым компонентом гликозаминогликанов и суставной жидкости, стимулирует синтез в хондроцитах и снижает катаболизм, его недостаточность ухудшает качество синовиальной жидкости и может вызвать хруст в суставах [17]. С возрастом, в результате нейродегенеративных процессов, естественный синтез этих веществ снижается, и с помощью SYSADOA возможно их восполнение.
Накоплена уже достаточная доказательная база, свидетельствующая об эффективности, безопасности SYSADOA и о необходимости их применения в плане долгосрочного лечения и профилактики развития ОА [18, 19]. Они способны влиять на метаболизм костной и хрящевой ткани и стимулировать ее регенерацию, обладают умеренным обезболивающим и противовоспалительным действием и лишены характерных для НПВП побочных эффектов. Вне обострения рекомендуется монотерапия SYSADOA. При обострении процесса и выраженном болевом синдроме рекомендуется комбинирование SYSADOA с НПВП, т. к. анальгетическое действие последних развивается гораздо быстрее. Совместное применение позволяет снизить дозу НПВП и тем самым предотвратить ряд нежелательных побочных эффектов [20].
Среди хондропротекторов большой популярностью пользуются комбинированные препараты хондроитин сульфата и глюкозамина (например, Терафлекс). Их преимущество заключается в сочетании 2-х активных ингредиентов: хондроитина сульфата и глюкозамина в эффективных дозировках. Они являются синергистами и при совместном применении дополняют и усиливают действие друг друга. Хондроитин сульфат и глюкозамин (Терафлекс) замедляют процессы естественного (профилактика) и патологического (терапия артроза) разрушения хрящевой ткани. Препарат улучшает внутреннюю структуру хондроцитов и активирует их деятельность. Механизм его действия связан с:
– активацией синтеза протеогликанов;
– угнетением действия ферментов, разрушающих гиалиновый хрящ;
– увеличением выработки синовиальной жидкости;
– уменьшением вымывания кальция из костей и улучшением фосфорно-кальциевого обмена, т. е. укреплением костной ткани.
Клинически действие препарата проявляется уменьшением болей в области сустава и увеличением объема движений в суставе. Но главное его свойство – замедление дальнейшего прогрессирования заболевания.
Показанием для назначения хондроитин сульфата и глюкозамина (Терафлекса) является любая патология опорно-двигательного аппарата, связанная с дегенеративными изменениями в хрящевой ткани (ОА и остеохондроз). Назначать препарат нужно как можно раньше – при появлении первых признаков заболевания (скрипа, хруста, болевых ощущений). Хондроитин сульфат и глюкозамин (Терафлекс) выпускается в нескольких формах, что обеспечивает удобство применения и максимально удовлетворяет потребности пациента:
– хондроитин сульфат и глюкозамин (Терафлекс) в капсулах для базисной терапии;
– хондроитин сульфат и глюкозамин (Терафлекс Адванс) в капсулах для лечения обострений болевого синдрома;
– хондроитин сульфат и глюкозамин (Терафлекс М) крем для местного применения.
Лечение рекомендуется начинать с препарата хондроитин сульфат и глюкозамин для купирования болевого синдрома (Терафлекс Адванс), который быстро оказывает анальгетическое действие и одновременно начинает стимулировать обновление хрящевой ткани. Терафлекс Адванс помимо хондроитина и глюкозамина дополнительно содержит НПВП ибупрофен, который оказывает быстрое обезболивающее и противовоспалительное действие [21] и более безопасен, чем другие НПВП. При совместном приеме глюкозамина и ибупрофена их взаимодействие позволяет добиться снижения дозы последнего в 2 раза, сохранив обезболивающий эффект, что, безусловно, важно для безопасности лечения. Капсулы хондроитин сульфата и глюкозамина для купирования болевого синдрома (Терафлекс Адванс) просты в применении и меньше таблеток раздражают ЖКТ. Рекомендуется принимать по 2 капсулы 3 р./сут, длительность приема – до 3 нед. Однако курс можно сократить при достижении желаемого результата и перейти на прием базового препарата хондроитин сульфата и глюкозамина (Терафлекс), не содержащего НПВП (по 2–3 капсулы/сут 3 мес.) для продления обезболивающего эффекта и защиты хряща. Возможно также местное применение крема хондроитин сульфата и глюкозамина (Терафлекс М).
Нефармакологические методы лечения и профилактики дальнейшего развития ОА обязательно должны применяться наряду с фармакологическими препаратами. Речь идет о контроле за факторами риска и развитием сопутствующих заболеваний, таких как ожирение, диабет, за состоянием в период менопаузы. Обучение пациентов правильному поведению и соблюдению постуральной гигиены, снижению нагрузки на больной сустав, адекватная физическая активность, защита суставов и физиотерапия, а также контроль веса являются важнейшими инструментами борьбы с травматизацией суставов и болевым синдромом [22, 23].
Снижение нагрузки на пораженный сустав замедляет дегенеративные процессы. Применение супинаторов, трости или костыля облегчает нагрузки при ходьбе. Не рекомендуются длительная ходьба, ношение тяжестей, обувь на высоком каблуке. Индивидуально подобранная лечебная физкультура позволяет увеличить двигательную активность и уменьшить болевой синдром. Физические упражнения проводятся без статических нагрузок (сидя, лежа, в бассейне), несколько раз в течение дня по 10–15 мин, медленно, плавно, постепенно увеличивая нагрузку, без боли. Необходимым моментом является снижение веса при ожирении (целевой индекс массы тела составляет 18,5–25 кг/м2), чему также способствует ЛФК, кроме того, назначается диета с пониженным содержанием животных жиров и включением в меню рыбы, морепродуктов, свежих овощей и фруктов.
Хирургическое лечение используется на поздних стадиях ОА. При неэффективности консервативного лечения, выраженных деформациях сустава с болевым синдромом проводят артропластику или эндопротезирование сустава. Поскольку ОА не является жизнеугрожающим заболеванием, окончательное решение о необходимости хирургического вмешательства всегда остается за пациентом.
В настоящее время к патофизиологическим механизмам развития ОА относят не только механическое поражение сустава и дегенеративный процесс, но и сопутствующее хроническое воспаление, которое способствует разрушению гиалинового хряща [24]. В патологический процесс вовлекаются не только хрящевые структуры, но и все компоненты сустава [25], а также структуры центральной нервной системы, связанные с формированием болевого синдрома.
Понимание патогенетических механизмов развития заболевания вносит коррективы в классические схемы терапии, но применение НПВП и хондропротекторов остается в центре внимания практикующих врачей.
Остеоартроз — хроническое невоспалительное заболевание суставов неизвестной этиологии, характеризующееся прогрессирующей дегенерацией суставного хряща, структурными изменениями субхондральной кости и сопутствующим реактивным синовитом
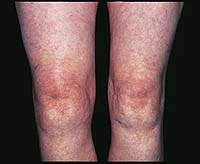 |
| Рисунок 1. Синовит (припухлость, гиперемия, локальное повышение температуры) правого коленного сустава при ОА |
При прогрессировании ОА в результате происходящих дегенеративных процессов хрящ размягчается, разрыхляется. В нем появляются трещины, простирающиеся до кости.
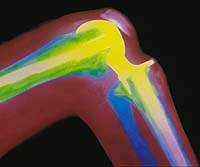 |
| Рисунок 2. Эндопротез коленного сустава. Рентгенограмма |
Особая роль в патогенезе ОА отводится синовиту, морфологически характеризующемуся умеренно выраженными пролиферативными и экссудативными реакциями (гиперплазией синовиальной оболочки и ее мононуклеарной инфильтрацией), наиболее выраженными в местах прикрепления синовии к хрящу с последующим исходом в склероз и липоматоз. В субхондральной кости выявляются микропереломы, утолщение костных трабекул и остеофитоз. Экссудативно-пролиферативные реакции как в субхондральной кости, так и в синовиальной оболочке протекают на фоне нарушений региональной гемодинамики и микроциркуляции с развитием тканевой гипоксии. В последующем прогрессирование болезни принимает, по сути, необратимый характер.
Боль, деформация и тугоподвижность сустава являются основными клиническими проявлениями ОА.
Боль в суставе — наиболее частый и выраженный симптом при ОА, носит неоднородный характер. Причинами ее могут быть деструктивные процессы в хрящевых и субхондральных структурах, нарушения микроциркуляции, особенно при затруднении венозного кровотока в спонгиозной части кости, фиброз капсулы сустава, воспалительный процесс в мягких околосуставных тканях, спазм близлежащих мышц и реактивный синовит.
В целом для заболевания характерен механический ритм болей — возникновение боли под влиянием дневной физической нагрузки и стихание за период ночного отдыха, что связано со снижением амортизационных способностей хряща и костных подхрящевых структур к нагрузкам. При этом происходит прогибание костных балок в сторону спонгиозной кости.
Возможны непрерывные тупые ночные боли, связанные с венозным стазом в субхондральной спонгиозной части кости и повышением внутрикостного давления.
Рефлекторный спазм близлежащих мышц, а также развитие реактивного синовита вызывают постоянные боли.
Реактивный синовит и воспалительный отек параартикулярных тканей усугубляют клиническую картину. При наличии синовита, помимо боли в суставе как при движении, так и в покое, характерны утреннняя скованность, припухлость сустава, локальное повышение кожной температуры. С прогрессированием заболевания рецидивы синовита учащаются.
Обычно ОА развивается медленно и начинается как моноартикулярное заболевание, но через некоторое время в патологический процесс включаются и другие суставы, чаще всего те, которые компенсаторно брали на себя повышенную механическую нагрузку, чтобы разгрузить первоначально заболевший сустав.
Клинически значимыми и инвалидизирующими формами ОА являются гонартроз и коксартроз. Клиническая картина ОА определяется конкретным суставом и группой суставов, вовлеченных в патологический процесс.
Среди неинвазивных методов диагностики гонартроза ведущее место по информативности занимает ультразвуковое двумерное сканирование коленных суставов, которое используют для объективизации и детализации характеристики вторичного синовита, являющегося прогностически неблагоприятным фактором, усугубляющим процессы дегенерации хряща. Наряду с диагностикой наличия синовиальной жидкости можно определить ее характер, особенно над bursa suprapatellaris и появлением жидкости над мыщелками бедренной кости, толщину и характер синовиальной оболочки; при этом ее утолщение при 0,4 см и более, а также контуры суставных поверхностей с учетом однородности контуров хряща на мыщелках бедренной кости и толщину хряща принимают за патологию. Ультразвуковое исследование суставов позволяет также уточнить характер и степень воспалительного процесса для выработки адекватного лечения.
Артроскопия в артрологии для диагностики воспалительных и дегенеративных заболеваний суставов, к сожалению, применяется недостаточно широко и, более того, не выявляет качественных отличий от воспаления синовии при других артритах. Существенно расширяет диагностические возможности артроскопии использование прицельной биопсии, а визуальный контроль позволяет получить фрагмент синовиальной ткани или хряща, наиболее адекватно отражающих развивающийся в суставе патологический процесс, но при этом данная процедура редко показывает распространенность патологического процесса. Артроскопия используется и с лечебной целью — с целью промывания полоски коленного сустава, при которой удаляется хрящевой детрит, а также фрагменты мениска, утолщенной и воспалительной синовии; выполняется аброзивная артропластика при гонартрозе. При коксартрозе ультразвуковое исследование отмечает, наряду с наличием и характером синовиальной жидкости, эхоуплотнение капсулы синовиальной оболочки, хрящевой губы, остеофиты. Однако следует сказать, что как ультразвуковые, так и эндоскопические признаки не могут считаться специфическими при гонартрозе и коксартрозе, поскольку они встречаются и при других заболеваниях суставов, как воспалительного, так и дегенеративного характера.
Основными целями терапии ОА являются: замедление прогрессирования дегенерации хряща и максимально возможное сохранение функции сустава. Терапевтическая тактика при ОА состоит из трех компонентов:
- механическая разгрузка пораженных суставов;
- купирование синовита;
- предотвращение прогрессирования заболевания.
Задачи, которые ставятся при составлении комплекса лечебных мероприятий, можно решать с учетом следующей шкалы приоритетов: болевой синдром, синовит, нарушение трофики суставов и местного кровотока, гипотрофия и гипотония мышц, контрактура.
Режим. Механическая разгрузка сустава является определяющим фактором как в уменьшении болевого синдрома, так и в лечении ОА в целом. Сюда входят рекомендации по исключению длительного пребывания в фиксированной позе, долгого стояния на ногах, длительной ходьбы, повторяющихся стереотипных движений, переноса больших тяжестей, ведущих к механической перегрузке определенных зон суставов. В далеко зашедших стадиях заболевания пациенту полезно ходить с тростью, костылями. При выраженных болях в фазу обострения может быть назначен полупостельный режим.
Диета. Четких патогенетических рекомендаций по диете ОА на настоящий момент не существует. Важным условием в лечении ОА коленных суставов является снижение избыточной массы тела. В последнее время рекомендуются пищевые добавки (глюкозамин, хондроитин и др.), но эффективность их требует клинических подтверждений.
В терапии ОА наиболее часто применяются обезболивающие препараты, нестероидные противовоспалительные препараты (НПВП) и средства с хондропротективными свойствами.
В терапии ОА, который сопровождается болевым и воспалительным синдромами, широко применяются НПВП. В настоящее время известно около 100 НПВП различных классов, но поиск новых лекарственных средств этой группы продолжается. Это связано с потребностью в медикаменте, имеющем оптимальное соотношение обезболивающего и противовоспалительного действия и характеризующемся высокой степенью безопасности. В этом плане большой интерес представляет появившийся на российском рынке препарат ксефокам.
Ксефокам — новый НПВП класса оксикамов.
Подобно другим НПВП, ксефокам обладает обезболивающей и противовоспалительной активностью, связанной с подавлением синтеза простагландинов посредством ингибирования циклооксигеназы (ЦОГ).
Так как большинство НПВП подавляют, как правило, и ЦОГ-1 и ЦОГ-2, то развитие гастропатий, а также нарушение функции почек и агрегации тромбоцитов являются запрограммированным фармакологическим эффектом этих препаратов.
Существует достоверная связь между приемом НПВП и развитием патологии верхних отделов ЖКТ: геморрагий, эрозий, язв в желудке (гастропатий), а также эзофагопатий и дуоденопатий, что проявляется болями или чувством тяжести в эпигастральной области, тошнотой, иногда рвотой, изжогой, дисфагией, метеоризмом, диареей и др. Возможно бессимптомное течение гастропатий, в связи с чем увеличивается риск развития таких серьезных осложнений, как кровотечение и перфорация, нередко ведущих к летальному исходу. Кроме того, длительный прием НПВП вызывает энтеропатии и колонопатии с последующим развитием железодефицитной анемии и гипоальбуминемии.
К образованию эрозий и язв приводит подавление НПВП синтеза простагландинов слизистой ЖКТ, что вызывает:
- уменьшение секреции слизистого геля;
- снижение секреции бикарбонатов;
- ухудшение кровотока в слизистой ЖКТ.
Высокий риск возникновения язв ЖКТ отмечается при продолжительной терапии НПВП, но максимален в первый месяц приема препарата. Снижение риска в дальнейшем объясняется, по-видимому, адаптационными механизмами, благодаря которым гастродуоденальная слизистая приобретает способность противостоять повреждающему действию НПВП.
Полагают, что при приеме НПВП нарушается репарация хряща и субхондральной кости за счет угнетения синтеза простагландинов, в частности в зонах микропереломов, с образованием очагов деструкции и кист. При этом, купируя болевой синдром и явления синовита, НПВП не задерживают дегенеративно-дистрофических изменений в суставных тканях пациента.
Установлено, что селективное ингибирование ЦОГ-2 оказывает незначительный эффект при острой боли. В то же время при острой боли концентрация ЦОГ-1 увеличивается в три-четыре раза, поэтому для анальгетического эффекта может иметь значение ингибирование именно этого изофермента. Таким образом, оптимальным сочетанием анальгетического и противовоспалительного эффекта обладают препараты, ингибирующие как ЦОГ-1, так и ЦОГ-2. Ксефокам является наиболее мощным ингибитором обоих изоферментов. Эта способность ксефокама в 100-200 раз превышает таковую у эталонных НПВП, например у диклофенака и пироксикама. При этом соотношение ингибиторной активности ксефокама в отношении ЦОГ-1 и ЦОГ-2 (мера селективности) занимает срединное положение по сравнению с аналогичными показателями других НПВП, что и обеспечивает баланс анальгетической и противовоспалительной активности ксефокама.
Ксефокам угнетает высвобождение свободных радикалов кислорода из активированных лейкоцитов, что усиливает его анальгетическую и противовоспалительную активность.
Обезболивающий эффект ксефокама отчасти связан с его влиянием на центральную нервную систему. Это подтверждается тем, что внутривенное введение лорноксикама (ксефокама) больным с болями в пояснице повышало уровень эндогенных морфинов при одновременном улучшении состояния. Активация системы нейропептидных опиоидов может быть одним из путей реализации анальгетического эффекта ксефокама. По анальгетическому эффекту ксефокам приравнивается к 20 мг морфина, при этом он не оказывает опиатоподобного действия на ЦНС и не вызывает лекарственной зависимости.
Исследования показали, что в терапевтических дозах ксефокам стимулирует синтез протеогликанов, предотвращая дегенерацию суставного хряща. Эта важная особенность ксефокама делает его препаратом выбора при ОА, поскольку известно, что многие НПВП, напротив, отрицательно влияют на хрящ.
Ксефокам практически весь (на 99%) связывается с белками плазмы, тем не менее он активно проникает в суставные полости, где длительное время (10-12 часов) сохраняется в достаточной терапевтической концентрации — даже когда в плазме его концентрация снижается. Это позволяет принимать препарат всего лишь два раза в день. Благодаря короткому периоду полувыведения из плазмы крови (примерно 4 часа) прием ксефокама сопровождается меньшей выраженностью побочных эффектов, так как в период между введениями доз возможно восстановление протекторных физиологических уровней простагландинов, необходимых для защиты слизистой желудка и поддержания нормального кровотока в почках.
Ксефокам полностью метаболизируется в печени, при этом одна треть его неактивных метаболитов выводится почками, а две трети — печенью и кишечником. Такой двойной путь экскреции снижает нагрузку на данные органы и улучшает переносимость ксефокама. После многократного введения ксефокама не наблюдается его кумуляция в плазме, что снижает риск побочных эффектов по сравнению с НПВП, имеющими более длительный период полувыведения. Фармакокинетика ксефокама примерно одинакова у пожилых людей и лиц молодого или зрелого возраста, поэтому не требуется какой-либо коррекции дозы препарата у пожилых.
Клинические испытания подтвердили высокую эффективность и хорошую переносимость ксефокама у больных ОА. В результате месячного приема лекарства в суточной дозе 16 мг уменьшались боль, длительность утренней скованности, улучшалась функция суставов.
К средствам, модифицирующим течение ОА, относятся препараты, в основе действия которых лежат:
- активация анаболических процессов в матриксе хряща
- подавление активности лизосомальных ферментов
- стимуляция синтетических функций хондроцитов.
Традиционно для лечения ОА использовались парентеральные гликозаминогликаны, однако в последнее время предпочтение отдается пероральным препаратам, а именно глюкозаминсульфату и хондроитинсульфату.
При некупируемом реактивном синовите показана пункция сустава, удаление синовиальной жидкости и внутрисуставное введение глюкокортикоидов, которые ингибируют синтез интерлейкина-1 и фактора некроза опухоли-α, участвующих в воспалении и деградации хряща. Широко используются при этом гидрокортизон, метипред, кеналог и дипроспан. Последние препараты характеризуются более выраженным и пролонгированным лечебным действием. Вместе с глюкокортикоидами возможно введение анестетиков (новокаина, лидокаина), действие которых при этом потенцируется. Введение ингибиторов медиаторов воспаления — контрикала (трасилола) или гордокса — благотворно влияет на метаболизм хряща.
В настоящее время рассматривается вопрос о широком внедрении в практику для подавления локального воспаления внутрисуставного введения ксефокама.
Широко применяемые для восстановительного лечения ОА физиотерапевтические методы уменьшают болевой синдром, а также воспалительные процессы и мышечный спазм, улучшают микроциркуляцию, благоприятно воздействуют на метаболические процессы в тканях сустава. При этом используются ультрафиолетовое облучение, электрические токи, переменные магнитные поля, электрофорез и фонофорез лекарственных средств на суставы. При пролиферативных явлениях, вазотрофических расстройствах и контрактурах показаны тепловые процедуры, включая аппликации парафина, озокерита, иловой и торфяной грязи. При отсутствии синовита эффективны морские, радоновые, сульфидные, бишофитные и йодобромные ванны. Для укрепления мышц рекомендуется применение электромиостимуляции.
При выполнении лечебного массажа больным ОА следует избегать механического раздражения суставной капсулы, обращая особое внимание на работу с прилегающими к суставу мышцами. Тогда снижается болевой мышечный спазм, повышается тонус ослабленных групп мышц, усиливается трофика пораженных суставов и улучшаются функциональные способности больного.
При выраженном длительном болевом синдроме, не купируемом традиционными средствами, а также при значительных нарушениях функции сустава применяется хирургическое лечение чаще всего на коленных и тазобедренных суставах. Кардинальной операцией является эндопротезирование сустава. Хорошо зарекомендовали себя эндопротезы, в которых узел скольжения состоит из пары металл–полиэтилен.
Важную роль в профилактике ОА играет выявление и своевременная ортопедическая коррекция врожденных аномалий: вывиха бедра, варусной и вальгусной установки голеней, плоскостопия и др. В профессиональной деятельности необходимо исключить длительные статические и стереотипные механические перегрузки суставов. Существенным условием профилактики ОА коленных суставов является нормализация избыточной массы тела.
Читайте также:


