Для подтверждения серологического диагноза бруцеллеза применяют
Возбудители бруцеллеза (Brucella melitensis, Brucella abortus, Brucella suis и Brucella canis) высоко контагиозны и работа с ними проводится в специализированных лабораториях особо опасных инфекций. Постановку серологических реакций и аллергических проб для диагностики бруцеллеза производят соответственно в обычных микробиологических лабораториях и больничных условиях.
Главным резервуаром бруцелл являются домашние сельскохозяйственные животные, а также другие виды животных, от которых человек заражается преимущественно контактным или контактно-бытовым, реже алиментарным путем. Клинические проявления бруцеллеза многообразны, поражаются лимфатическая, сосудистая, гепато-лиенальная системы и особенно опорно-двигательный аппарат Методы микробиологической диагностики бруцеллеза представлены в схеме 7.
Схема 7. Микробиологическая диагностика бруцеллеза
|
|
Серологический метод- постановка РА с сывороткой крови больного (реакция Райта, ставят в начале 2-й недели болезни, диагностический титр 1:200 и выше), ускоренной РА на стекле (реакция Хеддльсона), РСК и ИФА.
Диагностикумом в реакции Райта и Хеддльсона является взвесь убитых бруцелл с красителем генциановым фиолетовым или метиловым фиолетовым.
Реакцию агглютинации Хеддльсона ставят на стеклянной пластинке, на которую наносят микропипеткой неразведенную исследуемую сыворотку в количествах 0,08; 0,04; 0,02; 0,01 и 0,02 мл, добавляют по 0,03 мл бруцеллезного диагностикума, кроме последней дозы, в которую вносят 0,03 мл ФР (контроль сыворотки). Контролем диагностикума является смесь из 0,03 мл антигена и 0,03 мл ФР. Все капли перемешивают стеклянной палочкой или бактериологической петлей и после легкого покачивания стекла наблюдают за появлением мелкозернистого окрашенного агглютината. Отсутствие агглютинации во всех пробах сыворотки оценивается как отрицательная реакция, наличие агглютинации в 1-й пробе (0,08 мл сыворотки) - сомнительная, во 2-й (0,04 мл) - слабоположительная, в 3-й или 4-й пробах (0,02-0,01 мл) - положительная, во всех пробах - резко положительная реакция. Поскольку реакция агглютинации Хеддльсона иногда бывает положительной у здоровых людей за счет нормальных антител, она обязательно подтверждается реакцией Райта.
РИФ, РНГА, РСК и особенно ИФА более чувствительны, чем реакция агглютинации. Для ранней диагностики бруцеллеза особую ценность имеет ИФА, позволяющий выявить в сыворотке больных антибруцеллезные антитела класса IgM,которыев отличие от IgG появляются в ранние сроки болезни, свидетельствуя о свежем инфицировании.
Аллергический метод –постановка внутрикожной аллергической пробы Бюрне с 15-20 дня заболевания. Учет реакции проводится через 24-48 часов, положительной считается реакция в случае появления на месте введения аллергена (бруцеллина) болезненности, гиперемии и инфильтрации кожи диаметром 3 см и более. Положительная аллергическая реакция на бруцеллин сохраняется в течение длительного времени после перенесенного бруцеллеза, а также после прививки.
Бактериологический метод- посев крови для выделения гемокультуры в 2 флакона с 50 мл печеночного или асцитического бульона (рН 7,1-7,2) или МПБ с добавлением 1 % глюкозы, 2 % глицерина и антифаговой сыворотки (для инактивации бруцеллезного бактериофага) в первые дни болезни при наличии лихорадки. При отрицательных результатах исследование повторяют, т.к. бактериемия наблюдается в течение 1 года и более.
Один флакон выращивают в обычных аэробных условиях, другой — в герметично закрытом сосуде с 10 % углекислого газа (или СО2-инкубаторе) при температуре 37 0 С до 1 месяца, делая пересевы на скошенный печеночный агар или эритрит-агар каждые 4-5 дней. На жидких средах бруцеллы растут с образованием легкого помутнения и небольшого слизистого осадка, на плотных средах в виде округлых, диаметром до 5 мм, серовато-белых, блестящих, прозрачных с янтарным оттенком в проходящем свете колоний. Типичные колонии пересевают на скошенный агар и идентифицируют выделенную культуру до уровня вида.
Выполняются также посевы исследуемого материала в желток свежего куриного яйца или в желточный мешок куриного эмбриона с последующей их инкубацией в течение 5 дней при 37 0 С и пересевом содержимого желточного мешка на плотные и жидкие питательные среды для выделения чистой культуры бруцелл.
Бруцеллы идентифицируют на основании изучения морфологических (рис. 13 - грамотрицательные коккобактерии), культуральных, биохимических (они не ферментируют уг-
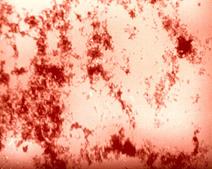
Рис. 13. Возбудитель бруцеллеза (Brucella melitensis). Окраска по Граму. Мелкие грамотрицательные коккобактерии.
леводы, не свертывают молоко и не разжижают желатину, выделяют сероводород), антигенных свойств (постановка РА с моноспецифическими сыворотками против антигеновА, М, R), чувствительности к специфическому бактериофагу и бактериостатическому действию анилиновых красителей (табл. 8).
Таблица 8.Дифференциация основных видов бруцелл
| Признак | Вид бруцелл | ||
| Br. melitensis | Br. abortus | Br. suis | |
| Условия культивирования | аэробные | 10% СО2 | аэробные |
| Рост на средах с красителями: | |||
| фуксином 1:50000 | + | + | - |
| тионином 1:25000 | + | - | + |
| пиронином 1:200000 | + | + | - |
| Образование Н2S | - | ± | ± |
| РА с монорецепторными сыворотками | |||
| А | ± | ± | + |
| М | ± | ± | ± |
| Чувствительность к бруцеллезному фагу | - | + | ± |
Разнообразные клинические проявления бруцеллеза приводят к необходимости широкого использования лабораторных методов исследования: бактериологического, биологического, серологического и аллергического. Комплекс лабораторных исследований с обязательным учетом клинических, эпидемиологических и эпизоотологических данных обеспечивает правильную диагностику заболевания.
Бактериологический метод.Для исследования на бруцеллез в лабораторию поступает патологический материал от больных людей (кровь, мокрота, гной, суставная жидкость, пунктат из селезенки, моча), сельскохозяйственных животных (абортированный плод, лимфатические узлы, паренхиматозные органы, кровь, моча, молоко, молочные продукты) и различные объекты окружающей среды (вода, навоз). Материал для исследования забирают в стерильную посуду.
Исследование крови необходимо проводить во время лихорадочного состояния больного до лечения антибиотиками, так как в этот период наблюдается наибольший процент выделения культур. Кровь в количестве не менее 10 мл стерильно берут из локтевой вены и засевают по 5 мл в два флакона среды Кастанеда. Начиная с четвертого дня, посевы ежедневно просматривают и, при отсутствии роста культуры, поверхность агара орошают бульоном путем осторожного покачивания флакона. При положительном результате на поверхности агара появляются колонии бруцелл. Если в течение месяца роста бруцелл не обнаруживают, то делают контрольный высев из бульона среды Кастанеда на твердую питательную среду.
При обследовании людей на бруцеллез для удобства доставки флаконов с кровью можно пользоваться транспортной жидкой средой, которую готовят заранее и хранят в лаборатории в течение полугода. Кровь доставляют в лабораторию в транспортной среде, засевают на среду Кастанеда и исследуют по общепринятой схеме.
Бруцеллы можно выделить из костного мозга, мочи, спинномозговой жидкости, грудного молока, желчи, мокроты, трупного материала и т. д. Исследуемый материал по 0,1 мл засевают на пластинки питательного агара и по 5-10 мл на жидкие питательные среды. Для задержки роста посторонней микрофлоры при исследовании загрязненного материала к среде добавляют генцианвиолет (1:200 000) или антибиотики (пенициллин 0,25 ед/мл и стрептомицин 0,05 ед/мл).
Особого внимания заслуживает получение культуры из молока сельскохозяйственных животных. Забор молока у овец, коров, верблюдов и коз рекомендуется проводить путем сдаивания его последних порций из каждого соска вымени по 10 мл в стерильную посуду. Если исследовать молоко в течение первых суток не удается, то его консервируют добавлением сухой борной кислоты 1 %, генцианвиолета 1:25 000. Для исследования молока из больших емкостей забирают 100 мл верхнего слоя, затем перемешивают и набирают еще 100 мл.
Лучшие результаты дает посев сливок, полученных центрифугированием молока при 2,5-3 тыс. об/мин в течение 3-5 мин или путем отстаивания в течение одних суток в холодильнике. Сливки в количестве 0,1-0,2 мл засевают на твердую питательную среду с подавителем посторонней микрофлоры (4-6 пробирок на 1 пробу).
Бактериологический метод считается самым достоверным, т. к. выделение бруцелл является неопровержимым доказательством бруцеллезной инфекции. Отрицательные результаты бактериологического исследования не дают права для заключения об отсутствии заболевания.
Биологический метод.Для выделения бруцелл из материала, загрязненного посторонней микрофлорой или содержащего малые концентрации возбудителя, в качестве биологической пробы используют морских свинок (весом 250-300 г) или белых мышей (весом 17-18 г). Исследуемый материал в объеме не более 0,5 мл вводят подкожно в паховую область белой мыши и 1 мл морской свинке.
Вскрытие белых мышей производят через 20-25 дней, а морских свинок - через 30-35 дней после введения материала. Перед вскрытием у свинок кровь из сердца исследуют в реакции агглютинации. Для посевов у морских свинок берут лимфатические узлы (паховый, подчелюстной, шейный, парааортальный), кусочки селезенки, печени, костный мозг, кровь, мочу; у белых мышей - лимфатические узлы (паховый, аксиллярный, парааортальный, подчелюстной), кусочки селезенки и печени. Лимфатические узлы, кусочки печени и селезенки помещают в стерильную чашку. Костный мозг извлекают пипеткой из рассеченной бедренной кости. Посевы крови из сердца, мочи и костного мозга производят стерильной пипеткой непосредственно на питательную среду (агар и бульон). Лимфатические узлы и органы перед посевом надсекают ножницами, берут стерильной деревянной палочкой, вносят первоначально в пробирку с агаром, раздавливают и тщательно втирают материал в поверхность питательной среды. Затем остатки посевного материала переносят в пробирку с бульоном. Палочка должна быть длиной 25-30 см, диаметром 4-5 мм, хорошо отструганная, с несколько заостренным концом. После использования ее погружают на 1 час в дезраствор.
Все посевы дублируют (часть помещают в условия повышенного содержания углекислоты), выдерживают при 37 °С до 30 дней. Для предотвращения высыхания питательных сред пробирки заливают парафином или закрывают резиновыми колпачками.
Посевы просматривают каждые 3-4 дня. Из помутневших бульонов делают высев в пробирки со скошенным агаром. Колонии бруцелл на пластинчатом агаре становятся видимыми на 5-7 сутки, иногда позднее. По истечении 30 дней наблюдение прекращают. Если за это время рост не появился, посевы уничтожают, а результаты бактериологического исследования считают отрицательными.
Результат оценивают положительно при выделении хотя бы одной колонии бруцелл. Идентификацию возбудителя бруцеллеза проводят по: по характеру роста культуры на плотных питательных средах; морфологии микроба в мазках, окрашенных по Граму, Козловскому; агглютинации со специфической бруцеллезной сывороткой на стекле и объемным методом; свечению на 3-4+ культур, обработанных бруцеллезной люминесцирующей сывороткой.
Культуры предварительно проверяют на наличие признаков диссоциации, одним из перечисленных выше методов.
Дифференциации (определение видов и биоваров) подлежат культуры в S-форме после идентификации.
Подкомитетом по таксономии бруцелл Международного комитета номенклатуры бактерий и Объединенным комитетом экспертов ФАО/ВОЗ по бруцеллезу в 1972 г. были определены единые тесты для проведения идентификации и дифференциации бруцелл для всех стран мира.
Серологические и аллергические методы исследования на бруцеллез.Серологические реакции и аллергическая проба являются общедоступными методами и применяются для диагностики бруцеллеза наряду с бактериологическим и биологическим методами.
В случае малой обсемененности пробы и отрицательных результатов, полученных при посеве исследуемого материала на питательные среды и заражении лабораторных животных, серологический метод может быть единственным, позволяющим диагностировать бруцеллез. В зависимости от целей исследования используют те или иные серологические методы.
При проведении эпидемиологического исследования в очагах применяют реакцию агглютинации пластинчатую (Хеддльсона) и объемную (Райта), реакцию Кумбса, РСК, РДСК, РПГА, кожную аллергическую пробу, иммуноферментный анализ (ИФА). Перед профилактической вакцинацией населения можно ограничиться постановкой пластинчатой реакции агглютинации (Хеддльсона) и кожной аллергической пробы.
Для диагностики острого и подострого бруцеллеза ставят реакцию Хеддльсона, Райта и РПГА. В случаях отрицательного результата используют реакцию Кумбса.
При диагностике хронического бруцеллеза и проведении диспансерного наблюдения за переболевшими рекомендуют наряду с реакциями Хеддльсона, Райта, РПГА, использовать реакцию Кумбса и аллергическую пробу (Бюрне).
Серологические реакции и аллергическая кожная проба по своему диагностическому значению в различные периоды заболевания не равноценны, вследствие чего не могут заменить друг друга. Это обусловливает необходимость применения комплексного серологического метода, являющегося наиболее надежным способом диагностики бруцеллеза.
В ранние сроки от начала заболевания (первые 6 месяцев) диагностическая ценность серологического метода выше, чем аллергического. Серологические реакции в этот период оказываются положительными почти в 95 % случаев. По мере удлинения срока заболевания процент положительных серологических реакций начинает снижаться. При проведении обследования необходимо учитывать, что высокие титры антител всегда указывают на наличие инфекции, антитела в низких титрах или их полное отсутствие не исключает возможности заболевания. В связи с этим рекомендуется проводить повторные исследования с интервалом 1-2 недели, особенно при подозрении на острую форму бруцеллеза.
Для постановки диагноза бруцеллеза у крупного рогатого скота применяют серологические и аллергические методы. Обследование начинают с постановки роз-бенгал пробы (РБП). Сыворотки, с которыми получена положительная РПБ, исследуют в РА Райта, РСК (РДСК), РПГА для установления титра агглютининов и наличия комплементсвязывающих антител. Исследование проводят двукратно с промежутком в 30 дней.
ПРАКТИЧЕСКИЕ ЗАНЯТИЯ
Занятие 3.
Последнее изменение этой страницы: 2016-12-30; Нарушение авторского права страницы
4.1. Серологическая диагностика бруцеллеза заключается в обнаружении специфических
антител в сыворотке крови животных с помощью реакции агглютинации в пробирках (РА), реакции
связывания комплемента (РСК), реакции длительного связывания комплемента на холоде (РДСК),
пластинчатой реакции агглютинации с роз бенгал антигеном (роз бенгал проба - РБП) и в молоке
коров - кольцевой реакции (КР).
4.2. Постановка и учет результатов реакции агглютинации в пробирках (РА).
4.2.1. Реакцию агглютинации в пробирках с бруцеллезным антигеном применяют при
диагностике бруцеллеза у крупного рогатого скота, овец, коз, лошадей, буйволов, верблюдов, оленей,
собак, пушных зверей и животных других видов.
4.2.2. Компоненты реакции агглютинации:
испытуемые сыворотки крови (см. подпункт 2.3.1);
позитивная бруцеллезная сыворотка, изготовленная биопредприятием или полученная от
больного бруцеллезом животного. На этикетке флакона с такими сыворотками указывают титры в РА
и РСК и дату изготовления;
негативная сыворотка (сыворотка крови здоровых животных), изготовленная биопредприятием
или полученная в лаборатории;
антиген бруцеллезный единый для РА, РСК и РДСК (см. Приложение N 2, п. 6);
раствор хлорида натрия. При исследовании сывороток крови крупного рогатого скота, лошадей,
верблюдов, собак, пушных зверей и морских свинок для разведения испытуемых сывороток и
антигена используют фенолизированный (0,5-процентный) физиологический раствор хлорида
натрия (0,85-процентный), при исследовании сывороток крови овец, коз, буйволов - 5-процентный
и оленей - 10-процентный фенолизированный раствор хлорида натрия (см. Приложение N 2, п. 1).
4.2.3. Постановка реакции агглютинации.
Реакцию агглютинации проводят в объеме 1 мл в четырех разведениях:
при исследовании сывороток крови овец, коз, буйволов, оленей и собак - 1:25, 1:50, 1:100 и
крупного рогатого скота, лошадей и верблюдов - 1:50, 1:100, 1:200 и 1:400;
пушных зверей и морских свинок - 1:10, 1:20, 1:40 и 1:80.
При массовых исследованиях допускается постановка реакции в первых двух разведениях.
Разлив компонентов реакции проводят индивидуальными мерными пипетками или
групповыми дозаторами Флоринского.
Для исследования каждой испытуемой сыворотки крови требуется 5 пробирок. В пробирках
первого ряда делают основное разведение. Для этого сыворотку крови крупного рогатого скота,
лошадей и верблюдов берут в дозе 0,1 мл, вносят в пробирки и добавляют к ней 2,4 мл
соответствующего раствора хлорида натрия, получают разведение сыворотки 1:25. Сыворотку крови
овец, коз, буйволов, оленей и собак берут в дозе 0,2 мл и добавляют 2,3 мл соответствующего
раствора хлорида натрия (разведение 1:12,5), а сыворотку крови пушных зверей и морских свинок
берут в дозе 0,3 мл и добавляют 1,2 мл соответствующего раствора хлорида натрия (разведение 1:5).
Таким образом делают основное разведение испытуемых сывороток в пробирках первого ряда
штатива (по 10 проб в ряду).
После приготовления основного разведения сывороток в первом ряду в пробирки третьего,
четвертого и пятого рядов вливают по 0,5 мл соответствующего раствора хлорида натрия. Затем из
пробирок первого ряда при помощи группового дозатора Флоринского переносят в пробирки второго
и третьего рядов по 0,5 мл основного разведения сывороток (1:25, 1:12,5 или 1:5). В пробирках
третьего ряда сыворотки смешивают с раствором хлорида натрия, по 0,5 мл этого разбавления
переносят в пробирки четвертого ряда и так же из пробирок четвертого ряда - в пятый. Из пробирок
пятого ряда по 0,5 мл жидкости удаляют. Таким образом делают последовательные двукратные
разведения одновременно 10 сывороток.
После этого в каждую пробирку второго, третьего, четвертого и пятого рядов с разведенными
сыворотками вносят при помощи группового дозатора Флоринского или другого дозирующего
устройства по 0,5 мл антигена, предварительно разбавленного в соотношении 1:10 соответствующим
раствором хлорида натрия. После добавления антигена разведение сывороток в каждой пробирке
удваивается и в зависимости от вида исследуемых животных будет составлять соотношения: 1:50,
1:100, 1:200 и 1:400; 1:25, 1:50, 1:100 и 1:200 или 1:10, 1:20, 1:40 и 1:80.
В пробирки первого ряда бруцеллезный антиген не вносят, и они служат контролем качества
сыворотки. При наличии хлопьев, фибрина, эритроцитов и посторонних примесей результаты
реакции агглютинации не учитывают.
При массовых исследованиях сыворотки разливают индивидуальной микропипеткой (с грушей)
или групповыми дозаторами Флоринского в две пробирки в дозах 0,02 и 0,01 мл (сыворотки
крупного рогатого скота, лошадей и верблюдов) или 0,04 и 0,02 мл (при исследовании сывороток
овец, коз, буйволов, оленей и собак). Затем в каждую пробирку добавляют по 1,0 мл антигена,
разведенного соответствующим раствором хлорида натрия в соотношении 1:20. При этом разведения
сывороток будут соответствовать соотношениям 1:50 и 1:100 или 1:25 и 1:50.
При постановке реакции агглютинации одновременно с испытуемыми сыворотками ставят
с негативной сывороткой в тех же разведениях, как с испытуемыми;
с позитивной бруцеллезной сывороткой в разведениях до ее предельного титра.
После добавления к испытуемым и контрольным сывороткам антигена штативы с пробирками
осторожно встряхивают и помещают в термостат при 37 - 38 °С на 16 - 20 часов, затем выдерживают
при комнатной температуре в течение 1 часа, после чего проводят учет реакции.
4.2.4. Учет реакции агглютинации. Результаты реакции учитывают визуально и определяют в
крестах по следующей схеме:
++++ (4 креста) - полное просветление жидкости, микробные тела
осели на дно пробирки в виде "зонтика", при легком
встряхивании "зонтик" разбивается на хлопья и
а жидкость остается прозрачной (100% агглютинации);
+++ (3 креста) - неполное просветление жидкости и хорошо выраженный
"зонтик" (75% агглютинации);
++ (2 креста) - просветление жидкости, "зонтик" умеренно выражен
+ (1 крест) - едва заметное просветление жидкости, "зонтик"
слабо, при встряхивании заметно небольшое
хлопьев или комочков (25% агглютинации);
- (знак минус) - просветления жидкости и образования "зонтика" не
наступило, на дне пробирки виден "пунктик" осевших
микробов антигена, при легком встряхивании
За титр антител принимают последнее разведение сыворотки, в котором произошла
агглютинация не менее чем на 2 креста (++), что соответствует количеству международных единиц
(ME) антител в 1 мл сыворотки (например, сыворотка с конечным титром РА 1:100 содержит 100 ME,
1:200 - 200 ME и т.п.).
Для более объективной оценки результатов РА в крестах готовят стандарты мутности,
соответствующие 0 (нулю), 25, 50 и 75% просветления жидкости.
В четыре пробирки последовательно наливают 1, 2, 3 и 4 мл антигена, разведенного 1:10. Затем
в том же порядке в три первые пробирки добавляют 3, 2 и 1 мл фенолизированного
физиологического раствора. В четвертую пробирку раствор не добавляют. После встряхивания
пробирок жидкость из каждой из них переносят по 0,5 мл в серологические пробирки и добавляют по
0,5 мл фенолизированного физиологического раствора. Полученные стандарты соответствуют 75, 50
и 25% просветления жидкости. В последней, четвертой пробирке просветление отсутствует.
Стандарты мутности готовят каждый раз при постановке РА и выдерживают в термостате
одновременно с основной реакцией.
Степень просветления в пробирках с исследуемыми сыворотками определяют визуально путем
сравнения со стандартами и результаты реакции выражают в крестах.
При массовых исследованиях сывороток в двух разведениях все сыворотки, давшие
агглютинацию с оценкой не менее чем на 2 креста (++) в каком-либо из указанных разведений,
исследуют повторно в четырех разведениях.
4.2.5. Диагностическая оценка реакции агглютинации.
Реакцию считают положительной при наличии агглютинации с сыворотками крови крупного
рогатого скота, лошадей и верблюдов начиная с разведения 1:100 (100 ME - международных единиц
антител), коз, овец, буйволов, оленей и собак - с разведения 1:50 (50 ME), пушных зверей и морских
свинок - с разведения 1:10 (10 ME) с оценкой не менее чем на 2 креста.
Реакцию считают сомнительной при наличии агглютинации только в разведении 1:50 (50 ME) с
сыворотками крови крупного рогатого скота, лошадей и верблюдов и в разведении 1:25 (25 ME) с
сыворотками овец, коз, буйволов, оленей и собак с оценкой не менее чем на 2 креста.
При получении сомнительного результата реакции сыворотку крови данного животного
исследуют повторно через 3 - 4 недели.
На неблагополучных по бруцеллезу фермах животных, при исследовании которых будет
получена дважды сомнительная РА, относят к положительно реагирующим.
В заключении лаборатории о результатах исследования должна быть сообщена диагностическая
оценка каждой пробы (положительная, сомнительная, отрицательная) и конечное разведение (титр)
сыворотки, в котором получен соответствующий результат, выраженное в международных единицах
(например: конечный титр сыворотки крови крупного рогатого скота 1:100 с оценкой 2 креста или
более - "положительная 100 ME"; конечный титр сыворотки 1:50 с оценкой 2 креста или более -
"сомнительная 50 ME").
Суммарные результаты исследования испытуемых сывороток, серию антигена, срок его
годности, а также предельный титр позитивной сыворотки записывают в журнал серологических
4.3. Постановка и учет реакции связывания комплемента (РСК) и реакция длительного
связывания комплемента на холоде (РДСК).
4.3.1. Реакцию связывания комплемента применяют при диагностике бруцеллеза у крупного
рогатого скота, овец, коз, свиней, лошадей, оленей, собак, пушных зверей и животных других видов.
Реакцию длительного связывания комплемента, как более чувствительную, применяют вместо
РСК при исследовании на бруцеллез сывороток животных указанных видов, а также при диагностике
инфекционного эпидидимита баранов.
4.3.2. Компоненты реакций и их подготовка к работе:
испытуемые сыворотки крови (см. подпункт 2.3.1);
позитивная бруцеллезная или овисная сыворотка, изготовленная на биофабрике или полученная
от больного животного. На этикетках флаконов с сыворотками указывают титр в РСК (РДСК) и дату
негативная сыворотка (сыворотка крови здоровых животных), изготовленная на биофабрике
или полученная в лаборатории.
Испытуемые и контрольные (позитивную и негативную) сыворотки инактивируют в водяной
бане в день постановки реакции: для РСК - при 60 - 62 °С в течение 30 мин. (сыворотки крови ослов
и мулов - при 64 - 65 °С, буйволов - при 62 - 64 °С в течение 30 мин., свиней - при 60 - 62° в течение
50 мин.); для РДСК сыворотки крови животных всех видов - при 63 - 64 °С в течение 30 мин.;
антиген бруцеллезный единый для РА, РСК и РДСК или овисный для РДСК в рабочем титре,
указанном предприятием, его изготовившим (см. Приложение N 2, п. 6);
комплемент - сыворотка крови морской свинки (свежая, консервированная добавлением 4%
борной кислоты или лиофильно высушенная). При использовании в качестве комплемента свежей
или консервированной сыворотки и при получении каждой новой серии сухого комплемента
проводят титрование его в гемолитической системе для определения активности (см. Приложение N
Сухой биофабричный комплемент растворяют в физиологическом растворе, как указано на
этикетке. Берут такое количество ампул (флаконов), в которых содержится необходимое для
проведения всего опыта количество комплемента. Содержимое ампул (флаконов) сливают в одну
пробирку, осторожно смешивают, берут 0,5 мл и разводят физиологическим раствором 1:20 для
титрования. Остальное количество комплемента хранят в холодильнике при плюс 2 - 4 °С;
гемолитическая сыворотка (гемолизин) - для РСК в удвоенном титре, для РДСК - в утроенном.
Титрование гемолизина проводят периодически один раз в 3 месяца и при использовании каждой
новой серии (см. Приложение N 2, п. 5);
эритроциты барана - 2,5-процентная от осадка взвесь эритроцитов в физиологическом растворе
для РСК и 3-процентная для РДСК (см. Приложение N 2, п. 3).
Для приготовления гемолитической системы соответствующую взвесь эритроцитов и
гемолитическую сыворотку в рабочем разведении смешивают в равных объемах и выдерживают в
термостате при 37 °С в течение 15 - 20 мин. При смешивании гемолизин вливают во взвесь
физиологический раствор - 0,85-процентный раствор химически чистого хлорида натрия в
дистиллированной воде рН = 7,3 - 7,4 или физиологический раствор, содержащий ионы магния и
кальция (см. Приложение N 2, п. 2).
Рабочие разведения всех компонентов для РСК или РДСК готовят перед постановкой реакции
и проверяют их на антикомплементарность и гемотоксичность по следующей схеме:
¦ Комплемент в разведении ¦ 0,2 ¦ 0,2 ¦ - ¦ - ¦ -
¦ Гемолизин в рабочем титре ¦ 0,2 ¦ - ¦ 0,2 ¦ - ¦ -
¦ Антиген в рабочем титре ¦ 0,4 ¦ - ¦ - ¦ 0,4 ¦ -
¦ Эритроциты (2,5% или 3%) ¦ 0,2 ¦ 0,2 ¦ 0,2 ¦ 0,2
¦ Физиологический раствор ¦ - ¦ 0,6 ¦ 0,6 ¦ 0,2
¦ водяная баня 10 минут при 37 -
¦ Результат: гемолиз полная задержка
В реакциях используют компоненты, не обладающие антикомплементарными и
4.3.3. Постановка реакции связывания комплемента.
Реакцию проводят в водяной бане при 37 - 38 °С в объеме 1 мл (по 0,2 мл каждого компонента -
сыворотки, антигена, комплемента, гемолизина и эритроцитов).
Перед постановкой главного опыта проводят титрование комплемента в бактериолитической
системе на позитивной (бруцеллезной) сыворотке, негативной сыворотке крови того вида животных,
которых исследуют, и одной сыворотке, взятой из исследуемой партии.
Каждую сыворотку разводят 1:5 физиологическим раствором (1 мл сыворотки + 4 мл
физиологического раствора), инактивируют, как указано в подпункте 4.3.2, и разливают по 0,2 мл в
два ряда по 10 пробирок. Затем в пробирки каждого ряда вносят комплемент (разведенный 1:20) в
возрастающих дозах от 0,02 мл до 0,2 мл с интервалом 0,02 мл и недостающее до 0,2 мл (в каждой
пробирке) количество физиологического раствора.
После разлива комплемента в первый ряд пробирок с каждой сывороткой вносят по 0,2 мл
антигена в рабочем разведении, а во второй ряд - по 0,2 мл физиологического раствора. Пробирки
ставят в водяную баню при 37 - 38 °С на 20 мин. Затем во все пробирки добавляют по 0,4 мл
гемолитической системы, встряхивают их и вновь ставят в водяную баню на 20 мин., после чего
Схема титрования комплемента в бактериолитической системе (на примере негативной
Читайте также:


