Факторы вирулентности хеликобактер пилори
Язвенная болезнь - заболевание, которое характеризуется наличием язвенного дефекта в слизистой желудка или двенадцатиперсной кишке. Открытие H.pylori обусловило переворот в представлениях об этиологии, патогенезе, лечении и профилактике язвенной болезни. Язвенная болезнь практически в 100% ассоциирована с хеликобактером пилори. Существенную роль имеют также стрессовые факторы и психологические особенности больных, а также генетические факторы в развитии болезни.
Морфологические и культуральные свойства - аналогичны Campylobacter. Предпочитает шоколадный агар.
Биохимические свойства. Имеет уреазу, оксидаза- и каталаза- положителен.
Антигенные свойства. Имеет О- и Н- антигены.
Патогенез поражений. Хеликобактеры проникают через слой слизи (чаще в антральной части желудка и двенадцатиперсной кишке), прикрепляются к эпителиальным клеткам, проникают в крипты и железы слизистой оболочки. Антигены бактерий (в первую очередь ЛПС) стимулируют миграцию нейтрофилов и вызывают острое воспаление. Хеликобактеры локализуются в области межклеточных ходов, что обусловлено хемотаксисом на мочевину и гемин (разрушение гемоглобина эритроцитов в микроциркуляторном русле). Под действием уреазы хеликобактеров мочевина расщепляется до аммиака, с действием которого связано повреждение слизистой оболочки желудка и двенадцатиперсной кишки. Многие ферменты (муциназа, фосфолипаза и др.) также могут стимулировать нарушения целостности слизистых.
К факторами патогенности H.pylori в первую очередь относят факторы колонизации (адгезию, подвижность), факторы персистенции и факторы, вызывающие заболевание. Ключевые факторы в тропизме и патогенности H.pylori включают механизмы адгезии и секреции бактериальных токсинов. Представлены доказательства ведущей роли Lewis B антигена как рецептора для адгезии. Кроме них имеют значение муцины желудка и сульфатиды слизистой желудка. Выявлен белок Bab A возбудителя (адгезин), который позволяет микроорганизму связываться с групповым антигеном крови Lewis B, присутствующим на поверхности клеток эпителия желудка. Другими факторами патогенности являются cag A (цитотоксин- ассоциированный ген) и vac A (вакуолизирующий цитотоксин). Штаммы, экспрессирующие эти маркеры вирулентности, относятся к штаммам первого типа, которые ассоциированы с повышенным ульцерогенным и воспалительным потенциалом, в отличии от штаммов второго типа, не имеющих этих факторов.
Присутствие всех трех факторов (Bab A, cag A, vacA) является существенным для проявления патогенных свойств H.pylori (триплет - позитивные штаммы). Повреждающее действие на слизистую может быть связано как с прямым действием бактериальных токсинов, так и с опосредованным влиянием через иммунную систему. Длительная персистенция возбудителя связана с рядом механизмов, позволяющих преодолевать защитные барьеры слизистой, и способностью формирования кокковых, не обладающих патогенным потенциалом, форм.
H.pylori не всегда приводит к развитию язвенной болезни, однако при язвенной болезни этот возбудитель выявляют постоянно. Факторы, определяющие ульцерогенность H.pylori, усиленно изучаются.
Лабораторная диагностика должна быть комплексной, основанной на нескольких тестах. Методы выявления могут быть инвазивными (связанными с необходимостью взятия биоптата слизистой) и неинвазивными (косвенными).
Основные методы выявления H.pylori в биоптатах слизистой.
1.Микроскопические методы (окраска гематоксилином - эозином, акридиновым оранжевым, по Граму, водным фуксином, инпрегнация серебром; фазово - контрастная микроскопия с определением подвижности).
2.Определение уреазной активности.
3.Выделение и идентификация возбудителя на плотных средах (чаще кровяных). Посевы осуществляют на кровяной агар, кровяной агар с амфотеррицином, эритрит - агар с амфотеррицином. Культивируют 5-7 суток при 37о С в микроаэрофильных, аэробных и анаэробных условиях. Принадлежность определяют по морфологии микроорганизмов и их колоний, винтообразной подвижности, росту в микроаэрофильных условиях и отсутствию роста в аэробных и анаэробных условиях и при температурах +25 и +42о С, по наличию оксидазной, каталазной и уреазной активности.
4.Выявление антигенов возбудителя в ИФА.
5.ПЦР- диагностика - наиболее чувствительный и специфичный тест.
Среди неинвазивных методов - "дыхательный тест", ИФА для выявления IgG и IgA - антител.
Лечение комплексное, с применением методов санации (эррадиации возбудителя). Применяют Де- НОЛ (коллоидный субцитрат висмута), ампициллин, трихопол (метронидазол) и др.
Контрольные вопросы:
1.Общая характеристика бактерий кишечной группы. Общие принципы микробиологической диагностики кишечных инфекций.
2.Классификация патогенных кишечных палочек. Морфологические, биологические и антигенные свойства эшерихий.
3.Патогенез эшерихиозов, вызванных разными группами патогенных эшерихий. Микробиологическая диагностика.
4.Морфологические и биологические свойства сальмонелл. Классификация сальмонелл. Антигенная структура сальмонелл. Схема Кауфмана-Уайта.
5.Патогенез тифопаратифозных инфекций и сальмонеллезных пищевых токсикоинфекций.
6. Методы микробиологической диагностики брюшного тифа и паратифов в разные сроки заболевания. Серологическая диагностика брюшного тифа. Реакция Видаля.
7.Методы микробиологической диагностики сальмонеллезных токсикоинфекций
8. Классификация, морфологические и биологические свойства шигелл.
9. Патогенез и микробиологическая диагностика бактериальной дизентерии (шигеллеза).
10.Классификация, морфологические и биологические свойства холерных вибрионов.
11.Методы микробиологической диагностики холеры. Экспресс диагностика холеры.12.Препараты для специфической профилактики, лечения и диагностики заболеваний, вызванных патогенными бактериями кишечной группы.
Набор факторов патогенности Н. pylori весьма выразителен, он складывается из ферментов агрессии, жгутиков, факторов ацидопротекции, адгезинов, поверхностных антигенов, индукторов воспаления, токсина. Экспрессия факторов патогенности зависит как от условий окружающей среды, в первую очередь, от ее кислотности, так и от фазы развития патологического процесса. Отдельные факторы патогенности выполняют по две и более сочетанные функции — активную локомоцию и адгезию, ацидопротекцию, индукцию воспаления и токсическое воздействие.
а) Жгутики. Молекулярная структура жгутика Н. pylori напоминает таковую прочих жгутиконосных бактерий: основная филамента, состоящая из упорядоченно расположенных субъединиц белка флагеллина, соединена крючком со стержневидным базальным телом, посредством трех колец фиксированном в толще наружной мембраны, пептидогликана и цитоплазматической мембраны.
Хотя в процессе вращения пучок переплетенных между собой жгутиков функционирует как единое целое, вращение каждого отдельного жгутика обеспечивается индивидуально так называемым жгутиковым мотором — расположенным у основания жгутика субмембранным ферментным комплексом.
От жгутиков бактерий иных родов жгутики Н. pylori отличаются наличием защитного чехла и колбовидного утолщения, венчающего их дистальный конец. Чехол жгутика, являющийся продолжением наружной мембраны бактериальной клетки, отличается наличием ацидорезистентных липидов и сохраняет отдельные структурные компоненты наружной мембраны, в первую очередь, липополисахарид.
Синтез в цитозоле белковых субъединиц жгутика, их экспорт на поверхность бактериальной клетки, сборка структурно и функционально полноценной органеллы представляют собой сложный стадийный процесс, контролирующийся почти четырьмя десятками генов, экспрессия которых усиливается, в частности при низких значениях pH окружающей среды.
Жгутики являются фактором патогенности, чьи патогенные свойства реализуются тотчас же по попадании бактериальных клеток в просвет желудка. Описанные выше структурные и функциональные особенности жгутикового пучка позволяют клеткам не только преодолевать толщу желудочного содержимого и достигать поверхности эпителиального пласта в относительно короткие сроки, но и противостоять желудочной перистальтике.
б) Ферменты агрессии. Упоминавшиеся выше ферменты Н. pylori обладают выраженным патогенным потенциалом: одни выполняют деструктурирующую фукцию, другие способствуют образованию токсических продуктов. Так, муциназа деполимеризует муцин желудочной слизи, разнообразные протеазы гидролизуют пепсин, фосфолипазы А1, А2 и С дезинтегрируют фосфолипиды апикальных мембран эпите-лиоцитов с образованием токсичного лизолецитина и освобождением биологически активных веществ, алкоголь-дегидрогеназа обусловливает образование токсичного ацетальдегида, уреаза — токсичного иона аммония.
Факторы ацидопротекции. Важнейшим, хотя и не единственным, фактором ацидопротекции, является уреаза, локализующаяся в цитозоле, в периплазматическом пространстве и в наружной мембране бактериальных клеток. Фермент представляет собой мультимерный белок массой 550 кД, состоящий из шести пар структурных субъединиц — UreA и UreB. Каждая субъединица UreB содержит в своем активном центре по два иона никеля Ni 2+ в качестве кофактора. Уреаза катализирует гидролиз мочевины до аммония и углекислоты, сопровождающийся весьма значительным защелачиванием окружающей среды: pH ее возрастает в среднем с 2 до 6.
Помимо уреазы, ацидопротекцию обеспечивают белки наружной мембраны, экспрессия которых усиливается при низких значениях pH, а также ЛПС, молекулярная структура которого также подвержена влиянию pH: в кислой среде экспрессируется более резистентная к действию кислоты конфигурация. Наконец, Н. pylori способен к продукции белка, ингибирующего выработку хлористоводородной кислоты париетальными клетками ямочного эпителия желудка.
в) Белки наружной мембраны. В состав наружной мембраны входят не менее сорока структурных белков, составляющих так называемое семейство белков наружной мембраны. Важнейшей их особенностью является то, что значительная часть молекулы оказывается выступающей за пределы мембраны, способствуя тем самым возникновению контакта с теми или иными окружающими бактериальную клетку объектами — метаболитами, сигнальными молекулами, поверхностными структурами эпителиальных клеток.
К числу белков наружной мембраны относятся в частности упоминавшиеся выше порины — белки, формирующие поры, и шапероны двух типов — Hsp60 и Hsp70 — белки, выполняющие вспомогательные, но незаменимые функции, например, связывание ионов никеля, предшествующее включению последнего в молекулу уреазы. Уровень содержания шаперонов в бактериальной клетке возрастает при стрессах различного рода, в частности при возрастании температуры окружающей среды, за что они получили название белков теплового шока. Шапероны являются эволюционно древними белками, вследствие чего у бактерий различных видов они отличаются высокой степенью гомологии не только между собой, но и с аналогичными белками цитоплазматических мембран эукариотических клеток.
Отдельные белки наружной мембраны обладают свойствами адгезинов, т.е. способностью к специфическому высокоаффинному связыванию с рецепторами — разнообразными по своей природе соединениями гомологичной им структуры. Белки подобного типа рассматриваются в соответствующем разделе.
г) Прочие белки наружной мембраны. К числу белков наружной мембраны относится и так называемый NapA-белок, способный активизировать фагоцитарную активность нейтрофилов. При этом NapA-белок является типичным бактериоферритином — белком, способным связывать одной своей молекулой до 40 атомов экзогенного железа, нейтрализуя тем самым его бактерицидное действие. Кроме того, описан белок, активирующий макрофаги (НР-МР1) — индуцирующий выброс ими разнообразных медиаторов воспаления. Оба белка изучены весьма слабо, однако их участие в индукции воспалительной реакции вполне очевидно.
д) Адгезины. H.pylori обладает широким набором адгезинов, взаимодействующих с рецепторами апикальных мембран эпителиоцитов и молекулами межклеточного матрикса, что способствует избирательному прикреплению бактериальных клеток к клеткам поверхностного эпителия желудка. Большинство адгезинов относится к классу лектинов — белков, способных специфически связываться с определенными олигосахаридными последовательностями, входящими в состав молекул тех или иных веществ, в частности, гликопротеинов. Так, входящие в число наиболее значимых адгезины BabA и BabB в качестве своего рецептора используют так называемый Lewis b -антиген — гликопротеин с терминально расположенными молекулами фукозы, экспрессирующийся на поверхности апикальных мембран клеток поверхностного эпителия желудка (а также эукариотических клеток иных типов, в первую очередь, эритроцитов).
Другой адгезии НраА, входящий, в частности, в состав чехла жгутика, взаимодействует с терминально расположенными молекулами сиаловой кислоты, входящей в состав огромного числа биологически значимых веществ — ганглиозидов апикальных мембран эпителиоцитов, муцина, молекул межклеточного матрикса — ламинина, витронектина, гепарансульфата, коллагена типа IV. Описаны также адгезины AlpA и AlpB, рецепторы к которым остаются неизвестными. В общей сложности описано более двадцати адгезинов Н. pylori, многие из которых не имеют специального названия и характеризуются лишь значениями молекулярных масс — от 19,6 до 64 кД; большинство из них отличается сродством к сиаловой кислоте.
Адгезивной активностью обладает также и ЛИС, рассматривающийся отдельно.
е) Липополисахарид (ЛПС). Как всякая грамотрицательная бактерия, Н. pylori обладает ЛПС — компонентом наружной мембраны, относящимся к классу фосфорилированных гликолипидов. Молекула ЛПС состоит из трех следующих друг за другом доменов: заякоренного во внешний слой наружной мембраны токсичного липида А и выдающихся за пределы бактериальной клетки сердцевины и О-специфической цепи. Липид А, состав которого характерен для вида в целом, состоит из дисахарида глюкозамина и связанных с ним остатков четырех жирных кислот. Сердцевина ЛПС состоит из олигосахарида — гомополимера 10-15 остатков гексоз; состав их варьирует в некоторых пределах от штамма к штамму. Наконец, О-специфическую цепь ЛПС составляют повторяющиеся субъединицы — гетерополимерные олигосахариды, вариации которых открывают широкие возможности для формирования штаммовых различий. Поскольку О-специфические цепи обладают антигенной специфичностью, упомянутые штаммовые различия представляют собой, в первую очередь, различия антигенные.
ЛПС Н. pylori способен выполнять функции адгезина: связываться терминальными остатками О-специфических цепей с молекулами муцина, а олигосахаридом сердцевины — с ламинином межклеточного матрикса. Отличительной и чрезвычайно важной в патогенетическом отношении характеристикой Н. pylori является его способность изменять олигосахаридный состав О-специфических цепей своего ЛПС таким образом, что он становится идентичным строению Lewis x - и Lewis y -анти-генов эукариотических клеток, т.е. мимикрирует под них, обеспечивая тем самым формирование одного из механизмов иммунного уклонения.
ЛПС грамотрицателытых бактерий обладает пирогенностью и летальной токсичностью, выраженной у разных их видов в различной степени в зависимости от химического состава каждого из доменов. У H. pylori упомянутые свойства проявляются в минимальной степени: его ЛПС в 1000 раз менее токсичен, нежели ЛПС бактерий рода Salmonella.
ж) Вакуолизирующий цитотоксин. H. pylori обладает способностью к продукции уникального экзотоксина, оказывающего специфическое повреждающее действие на эпителиоциты желудка — формирование в их цитозоле крупных вакуолей. Вакуолизирующий цитотоксин VacA синтезируется в цитозоле бактериальных клеток в виде белка массой 140 кД, состоящего из трех фрагментов. В процессе секреции в окружающую среду вакуолизирующий токсин утрачивает два вспомогательных фрагмента и трансформируется в активную токсическую форму молекулярной массой 95 кД. Шесть или семь копий 95-кД VacA при нейтральных значениях pH ассоциируют в неактивную четвертичную олигомерную структуру, диссоциирующую в обратном направлении на мономеры при pH — 3.
Мономер 95-кД VacA обладает всеми характеристиками токсина АВ-типа: состоит из двух субъединиц, одна из которых (А), массой 37 кД, обладает собственно токсичностью, вторая же (В), массой 58 кД, выступает в качестве связующего звена с цитоплазматической мембраной эпителиоцита. Последняя связывает В-субъеди-ницу VacA своим рецептором с эпидермальным фактором роста (EGF) — широко распространенным цитокином, регулирующим пролиферацию клеток эпителия желудка. В результате такого связывания в толще цитоплазматической мембраны формируется пора, сквозь которую субъединица А и проникает в цитозоль эпителиоцита.
Субъединица A VacA активирует систему тирозин-киназы клетки хозяина — комплекса ферментов, в свою очередь, активирующих разнообразные метаболические пути. В данном случае речь идет о локализующейся на мембранах эндоплазматического ретикулума аденозинтрифосфотазе (АТФазе) V-типа, способной формировать вакуоли с кислым содержимым, отделяющиеся от материнских мембран ретикулума. Мелкие вакуоли способны к слиянию друг с другом с образованием более крупных, подчас занимающих более половины объема цитозоля.
Хотя ген vacA, детерминирующий структуру апоферментной формы токсина массой 140 кД, имеют все без исключения штаммы Н. pylori, способностью к активной секреции указанного токсина обладают в среднем около половины их. Такой фенотип обозначается как tox+, а штаммы, им обладающие, относятся к типу I штаммов Н. pylori. Именно такие штаммы достоверно чаще ассоциируются с язвенной болезнью, дистальным раком и MALT-лимфомой желудка, тогда как нетокси-генные штаммы типа II с фенотипом tox чаще встречаются при хроническом гастрите.
Различия в способности к активной секреции токсина связывают с различными аллелями гена vacA. Так, штаммы H.pylori, несущие аллели si/ml гена vacA являются активно секретирующими вакуолизирующий цитотоксин, чего нельзя сказать о штаммах, несущих аллели sl/m2 и s2/m2.
Наконец, способность того или иного штамма H.pylori к секреции токсина определяется его cagA-статусом, биологическая характеристика которого приводится отдельно.
з) CagA-белок и сходные с ним белки. Части штаммов Н. pylori свойственна способность к образованию белка массой 128 кД, ассоциированного с цитотоксичностью и являющегося продуктом гена cagA. Этот белок является мощным индуктором воспалительной реакции в эпителии желудка; он активизирует так называемый ядерный фактор NF-kB клеток поверхностного эпителия желудка, в свою очередь, стимулирующий образование и секрецию интерлейкина-8 (IL-8) — собственно индуктора воспаления. Проникновение интегрированного в наружную мембрану бактериальной клетки CagA-белка в цитозоль эпителиоцита обеспечивается системой секреции IV типа, весьма редко встречающегося у патогенных для человека бактерий типа секреции. Система секреции IV типа предусматривает установление прямого сообщения между цитозолем эукариотической клетки хозяина и цитозолем бактериальной.
В формировании соответствующего канала принимает участие несколько специализированных белков, и сборка его становится возможной лишь по установлении тесного контакта между клетками, в свою очередь, обеспечивающегося адгезией. Помимо CagA-белка, H.pylori способен к образованию функционально сходных с ним белков — продуктов генов iceA и picB, также являющихся индукторами воспаления.
Ген cagA, как и гены, детерминирующие строение разнообразных белков, формирующих необходимый для секреции IV типа канат, локализуются в составе описанного выше острова патогенности cag PAI, присутствующего в геноме лишь части штаммов H.pylori — около половины их. Такие штаммы обладают положительным cagA-статусом и обозначаются как cagA -штаммы; в противоположность им cagA -штаммы имеют отрицательный cagA-статус.
Интересно, что способность к активной секреции вакуолизирующего цитотоксина ассоциируется с наличием гена cagA, иными словами, с наличием острова патогенности cag PAI. Хотя молекулярные механизмы этой связи остаются неизвестными (гены vacA и cagA не являются сцепленными), фенотипу tox+, очевидно, соответствует генотип cagA+ vacA+, тогда как фенотипу tox — генотип cagA- vacA+.
и) Биологические модели инфекции. Инфекционный процесс хеликобактерной этиологии может быть с успехом смоделирован in vitro на модели культур тканей различного типа и in vivo — на животных различных видов. Среди культур тканей, пригодных для моделирования хеликобактериоза, используются линии HeLa (для оценки вакуолизирующей цитотоксической активности), Нер-2 (для оценки адгезивной и инвазивной активности), AGM (для оценки способности H.pylori индуцировать злокачественную трансформацию эпителия). Среди животных в качестве объектов моделирования хеликобактериоза используются мыши (для моделирования гастрита и аденокарциномы желудка), монгольские песчанки (для моделирования гастрита и оценки эффективности действия антибактериальных средств противохеликобактерной направленности), морские свинки (для оценки эффективности противохеликобактерных вакцин), гнотобионтные поросята-сосунки и нечеловекообразные приматы (для экспериментального изучения деталей патогенеза хеликобактериоза и терапевтической эффективности различных схем противохеликобактерной эрадикационной терапии).
Редактор: Искандер Милевски. Дата публикации: 11.1.2020
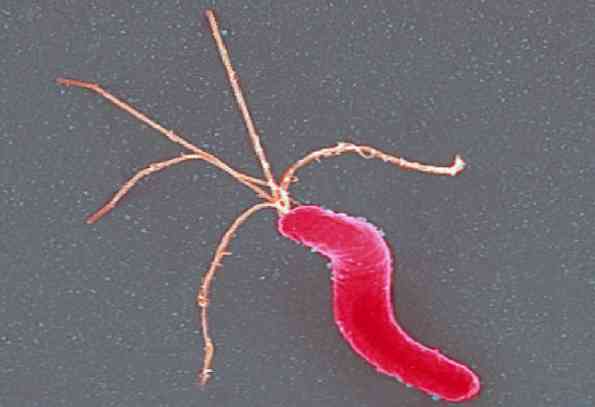
Helicobacter pylori является грамотрицательной спиральной бактерией, участвующей в развитии гастрита, язвенной болезни и связанной с раком желудка. Он был открыт в 1983 году австралийскими патологами Робином Уорреном и Барри Маршаллом при исследовании слизистых оболочек желудка человека..
Даже Маршалл экспериментировал с самим собой, проглатывая материал, зараженный бактериями, где он обнаружил, что он вызывает гастрит, и смог проверить наличие бактерий в его собственной биопсии желудка. Он также обнаружил, что он ответил на лечение антибиотиками.
Это разрушило старые теории, которые утверждали, что гастрит был вызван употреблением острой пищи или стресса. По этой причине в 2005 году Уоррен и маршал были удостоены Нобелевской премии по медицине..
- 1 Общая характеристика
- 2 Среда обитания
- 3 Факторы вирулентности
- 3.1 Жгутики
- 3.2 Клеи
- 3.3 Липополисахариды (ЛПС)
- 3.4 Мочевина
- 3.5 вакуолизирующий цитотоксин (VacA)
- 3.6 Цитотоксин (CagA)
- 3.7 Супероксиддисмутаза и каталаза
- 3.8. Индуцируемая синтаза оксида азота (iNOS):
- 3.9 Фосфолипазы, липазы и муциназы
- 4 Таксономия
- 5 Морфология
- 6 Диагноз
- 6.1 - Инвазивные методы
- 6.2 Неинвазивные методы
- 7 Жизненный цикл
- 8 Патогенез
- 8.1 Воспалительный инфильтрат
- 9 Патология
- 10 клинических проявлений
- 11 Заражение
- 12 Лечение
- 13 ссылок
Общие характеристики
Из-за его большого сходства с родом Campylobacter, он изначально назывался Campylobacter pyloridis и позже Кампилобактер пилори, но тогда это было реклассифицировано в новый жанр.
Заражение Helicobacter pylori Он широко распространен во многих слаборазвитых странах и является одной из самых частых инфекций у человека, которая обычно происходит с детства..
Считается, что после того, как микроорганизм был приобретен впервые, он может сохраняться годами или на всю жизнь, в некоторых случаях протекает бессимптомно..
С другой стороны, желудок не является единственным местом, где можно разместить микроорганизм, считается, что H. pylori может быть консолидирован во рту перед колонизацией желудка.
Также возможно, что H. pylori Присутствующий в полости рта может повторно заразить желудок после лечения. Это подтверждается тем фактом, что некоторые бессимптомные дети были изолированы от зубного налета..
Тем не менее, хотя инфекция Helicobacter pylori Бессимптомное течение у некоторых людей, это не безвредно, оно было связано с 95% язв двенадцатиперстной кишки, 70% язвенной болезни желудка и 100% хронического гастрита антрального локализации.
также, Helicobacter pylori Международным агентством по исследованию рака был классифицирован как канцероген I класса из-за его связи между инфекцией и раком желудка.
среда обитания
Helicobacter pylori был найден в следующих гостях: человек, обезьяна и кошки.
Эта бактерия требует микроаэрофильной атмосферы (10% СО)2, 5% О2 и 85% N2) для выращивания, железо является важным элементом для его роста и обмена веществ.
Оптимальная температура роста составляет от 35 до 37 ºC, хотя некоторые штаммы способны развиваться при 42 ºC. Кроме того, определенная степень влажности способствует его росту.
Helicobacter pylori В лаборатории он растет медленно, для того чтобы колония находилась посередине, требуется от 3 до 5 дней и даже до 7 дней.
Для его культивирования можно использовать неселективные среды, дополненные кровью..
С другой стороны, Helicobacter pylori Он характеризуется подвижностью и благодаря своей спиральной форме позволяет ему перемещаться по спирали, как если бы он был прикручен. Это помогает вам мобилизоваться через желудочную слизь.
Он также является каталазой и оксидазой и является крупным продуцентом уреазы, последняя играет жизненно важную роль для микроорганизма. Уреаза позволяет ему выживать в средах с кислым pH, генерируя аммиак, который помогает подщелачивать pH.
Для размножения микроорганизму необходим рН от 6 до 7. Для этого, помимо использования уреазы, она установлена ниже уровня слизистой оболочки желудка, где слизь желудка защищает ее от крайней кислотности просвета желудка (рН 1,0-2,0).
С другой стороны, протеазы, которые выделяют бактерии, модифицируют слизь желудка, уменьшая вероятность того, что кислота диффундирует через слизь..
Факторы вирулентности
Движение бактерий представляет собой фактор вирулентности, поскольку он помогает колонизировать слизистую оболочку желудка..
Бактерия представляет пилимис и фимбриальный гемагглютинин, которые влияют на прилипание микроорганизма к клеткам желудка и двенадцатиперстной кишки..
Адгезия - это стратегия бактерий, направленная на сопротивление перистальтике слизистого слоя, в котором они находятся, для последующей миграции в эпителиальные клетки..
С другой стороны, специфические гемагглютинины сиаловой кислоты на поверхности слизистой оболочки задерживают адгезию и проглатывание H. pylori.
Он эндотоксичен, как и ЛПС других грамотрицательных бактерий. Очищенный антиген может вызывать апоптоз.
Бактерия использует производство уреазы для разложения мочевины в аммиаке и углекислом газе..
Это действие позволяет ему поддерживать щелочной pH вокруг него и таким образом избежать разрушения соляной кислотой в желудке, гарантируя его выживание.
Это свойство кодируется геном Ura A.
Это белок, который вызывает вакуоли в эпителиальных клетках желудка, поэтому ткани язвы. Он кодируется геном VacA.
Штаммы с геном CagA более вирулентны. Они связаны с тяжелым гастритом, атрофическим гастритом, дуоденитом и / или раком желудка..
Этот цитотоксин CagA увеличивает пролиферацию клеток желудка без апоптоза, что приводит к изменению нормальной схемы обновления эпителия желудка..
Это важно для защиты от O2-зависимой смерти от нейтрофилов.
Это работает, разлагая перекись водорода, метаболит, который токсичен для бактерий.
Бактерия индуцирует iNOS и макрофаги в пробирке.
Этот факт свидетельствует о том, что высокая продукция оксида азота путем индукции этой синтазы в сочетании с иммунной активацией участвует в повреждении тканей..
Они позволяют проникать микроорганизмам под слизистую оболочку желудка, чтобы затем модифицировать слизь так, чтобы она функционировала в качестве водонепроницаемого слоя, защищающего ее от кислоты в желудке..
Также в этом месте иммунный ответ совершенно неэффективен.
таксономия
морфология
Helicobacter pylori Это тонкая грамотрицательная спиральная палочка, маленькая, изогнутая и слегка короткая. Он имеет длину около 3 мкм и ширину 0,5 мкм. Цвет хорошо с гематоксилин-эозином, модифицированной окраской Giensa или Warthin-Starry.
Он подвижен благодаря наличию множества полярных жгутиков (в пучке), в общей сложности от 4 до 6, которые имеют характерную оболочку.
Оболочка, покрывающая жгутики, содержит белки и липополисахарид, эквивалентные компонентам наружной мембраны. Однако его функция неизвестна.
Он не образует спор и не покрыт оболочкой. Клеточная стенка похожа на клеточные грамотрицательные бактерии..
Колонии Helicobacter pylori Они обычно маленькие серые и полупрозрачные. Когда колонии стареют (продолжительные культуры), бациллярные формы становятся кокковидными.
диагностика
Для диагностики Helicobacter pylori Есть много методов, и они классифицируются как инвазивные и неинвазивные.
Он взят с помощью эндоскопии, наиболее чувствительного метода диагностики Helicobacter pylori.
Микроорганизмы могут наблюдаться в срезах тканей, а слизистая оболочка будет представлять патогномоничные характеристики ее присутствия..
Недостатком является то, что распределение H. pylori по животу не равномерно.
Это метод косвенного обнаружения бактерии.
Порции образцов могут быть погружены в мочевинный бульон с индикатором pH (феноловый красный), и менее чем за один час можно наблюдать результаты.
Среда мочевинного бульона изменяется от желтой до фуксии из-за изменения рН, вызванного продукцией аммиака из мочевины, под действием уреазы.
Чувствительность этого теста зависит от бактериальной нагрузки в желудке.
Часть образца, взятого с помощью эндоскопии, может быть предназначена для культивирования. Негативная культура является наиболее чувствительным показателем лечения после терапии.
Образец биопсии желудка или двенадцатиперстной кишки должен быть свежим, и его перенос не следует откладывать более чем на 3 часа. Они могут храниться до 5 часов при 4ºC, а ткани должны оставаться влажными (емкость с 2 мл стерильного физиологического раствора).
Перед посевом образца необходимо приготовить мацерат для получения большей чувствительности. Образец может быть нанесен на бруцеллезный агар, инфузию сердца или триптиказу сои с добавлением 5% овечьей или конской крови..
Срезы тканей могут быть подвергнуты методам молекулярной биологии для обнаружения ДНК микроорганизмов.
Преимущество ПЦР заключается в том, что его можно использовать при анализе образцов, таких как слюна, что позволяет диагностировать H. pylori неинвазивно, хотя тот факт, что бактерии находятся в слюне, не обязательно является признаком инфекции желудка.
Этот метод имеет чувствительность 63 -97%. Он состоит из измерения антител IgA, IgM и IGG методом ELISA. Это хороший диагностический вариант, но он имеет ограниченное применение для контроля лечения.
Это потому, что антитела могут оставаться повышенными до 6 месяцев после уничтожения микроорганизма. Его преимущество заключается в том, что он является быстрым, простым и более дешевым методом, чем те, которые требуют эндоскопии при биопсии..
Следует отметить, что антитела, генерируемые против H. pylori, Они служат для диагностики, но не предотвращают колонизацию. Поэтому люди, которые приобретают H. pylori как правило, страдают от хронических заболеваний.
Для этого теста пациент должен проглотить мочевину, отмеченную углеродом ( 13 C o 14 С). Это соединение при контакте с уреазой, продуцируемой бактериями, превращается в меченый диоксид углерода (СО2 С 14 ) и аммоний (NH)2).
Углекислый газ попадает в кровоток и оттуда в легкие, где он выдыхается дыханием. Образец дыхания пациента собирается в баллоне. Положительный тест подтверждает инфекцию этой бактерией.
Он равен предыдущему, но в этом случае добавляется коллоид 99mTc, который не всасывается в пищеварительной системе..
Этот коллоид позволяет визуализировать выработку мочевины именно в той части пищеварительной системы, где она генерируется гамма-камерой..
Жизненный цикл
Helicobacter pylori Внутри организма он ведет себя двумя способами:
98% населения H. pylori они свободно проживают в слизи желудка. Это служит резервуаром для прилипших бактерий и будет служить для передачи.
При этом 2% прикрепляются к эпителиальным клеткам, которые поддерживают инфекцию.
Таким образом, существует две группы населения, приверженцев и не приверженцев, с различными характеристиками выживания.
патогенез
Как только бактерии попадают в организм, они могут в основном колонизировать желудочный антральный отдел желудка, используя факторы вирулентности..
Бактерия может долго оставаться в слизистой оболочке желудка, иногда на всю жизнь, не вызывая дискомфорта. Инвазирует и колонизирует глубокие слои слизи желудка и двенадцатиперстной кишки через протеазы и фосфолипазы.
Затем он прикрепляется к поверхностным эпителиальным клеткам слизистой оболочки желудка и двенадцатиперстной кишки, не вторгаясь в стенку. Это стратегическое место, которое бактерии применяют, чтобы защитить себя от чрезвычайно кислого pH света желудка..
Одновременно на этом участке бактерии раскрывают мочевину, чтобы дополнительно подщелачивать окружающую среду и оставаться жизнеспособными.
В большинстве случаев в слизистой оболочке желудка наблюдается постоянная воспалительная реакция, которая, в свою очередь, изменяет механизмы регуляции секреции желудочной кислоты. Вот как активируются определенные ульцерогенные механизмы, такие как:
Ингибирование функции париетальных клеток через ингибирование соматостатина, где благоприятствует недостаточное производство гастрина.
Образующийся аммиак, а также цитотоксин VacA плохо воздействуют на эпителиальные клетки, вызывая повреждения в слизистой оболочке желудка или двенадцатиперстной кишки..
Следовательно, наблюдаются дегенеративные изменения поверхности эпителия, включая истощение муцина, цитоплазматическую вакуолизацию и дезорганизацию слизистых желез..
Вышеупомянутые повреждения приводят к проникновению в слизистую оболочку и ее собственную пластинку плотного инфильтрата воспалительных клеток. Первоначально инфильтрат может быть минимальным только с мононуклеарными клетками.
Но тогда воспаление может распространяться с присутствием нейтрофилов и лимфоцитов, которые вызывают повреждение слизистых и париетальных клеток и может даже образовываться микроабсцессы..
Цитотоксин CagA поступает в эпителиальную клетку желудка, где запускаются множественные ферментативные реакции, которые вызывают реорганизацию актинового цитоскелета.
Конкретные механизмы канцерогенеза неизвестны. Однако считается, что воспаление и агрессия в течение длительного периода времени приводят к метаплазии и длительному раку..
патология
В общем, хронический поверхностный гастрит возникает через несколько недель или месяцев после того, как бактерии были установлены. Этот гастрит может прогрессировать до язвенной болезни и впоследствии вызывать лимфому или аденокарциному желудка.
Кроме того, заражение Helicobacter pylori является состоянием, которое предрасполагает страдать от MALT-лимфомы (лимфомы лимфоидной ткани, связанной со слизистой оболочкой).
С другой стороны, в последних исследованиях упоминается, что Helicobacter pylori вызывает заболевания желудочного сока. Среди них можно упомянуть: железодефицитную анемию и идиопатическую тромбоцитопению пурпуры.
Также кожные заболевания, такие как розацеа (наиболее распространенные кожные заболевания, связанные с H. pylori), хроническое пруриго, хроническая идиопатическая крапивница, псориаз и др. У беременных может развиться гиперемезис гравидарум.
Другие менее частые сайты, где считается, что H. pylori может иметь некоторую вовлеченность, вызывающую патологию на уровне:
Среднее ухо, полипы носа, печень (гепатоцеллюлярная карцинома), желчный пузырь, легкие (бронхоэктазия и хроническая обструктивная болезнь легких ХОБЛ).
Это также было связано с глазными заболеваниями (открытоугольная глаукома), сердечно-сосудистыми заболеваниями, аутоиммунными расстройствами и другими..
Клинические проявления
Эта патология может протекать бессимптомно у 50% взрослых. В противном случае при первичной инфекции могут возникнуть тошнота и боли в верхней части живота, которые могут длиться до двух недель..
Позднее симптомы исчезают, чтобы появиться позже после того, как установлен гастрит и / или язвенная болезнь.
В этом случае наиболее распространенными симптомами являются тошнота, анорексия, рвота, боль в эпигастральной области и даже менее специфические симптомы, такие как отрыжка.
Язвенная болезнь желудка может вызвать сильное кровотечение, которое может осложниться перитонитом из-за утечки содержимого желудка в брюшную полость.
зараза
Люди с Helicobacter pylori Они могут выделять бактерии в кале. Таким образом, питьевая вода может быть загрязнена. Поэтому наиболее важным путем заражения человека является фекально-оральный.
Считается, что это может быть в воде или в некоторых овощах, которые обычно едят сырыми, таких как салат и капуста..
Эти продукты могут стать загрязненными при орошении загрязненной водой. Тем не менее, микроорганизм никогда не был изолирован от воды.
Другой путь заражения - орально-оральный, но в Африке был задокументирован обычай некоторых матерей предварительно жевать пищу своих детей..
Наконец, возможно заражение ятрогенным путем. Этот путь состоит из загрязнения путем использования загрязненного или плохо стерилизованного материала в инвазивных процедурах, которые включают в себя контакт со слизистой желудка..
лечение
Helicobacter pylori в пробирке Он восприимчив к различным антибиотикам. Среди них: пенициллин, некоторые цефалоспорины, макролиды, тетрациклины, нитроимидазолы, нитрофураны, хинолоны и соли висмута..
Но они по своей природе устойчивы к блокаторам рецепторов (циметидин и ранитидин), полимиксинам и триметоприму.
Среди самых успешных процедур у нас есть:
- Комбинация лекарств, в том числе 2 антибиотика и 1 ингибитор протонного насоса.
- Наиболее часто используемой комбинацией антибиотиков является кларитромицин + метронидазол или кларитромицин + амоксициллин или кларитромицин + фуразолидон или метронидазол + тетрациклин.
- Ингибитором протонной помпы может быть омепразол или эзомепразол.
- Некоторые методы лечения могут также включать потребление солей висмута.
Терапия должна быть завершена в течение не менее 14 дней, в соответствии с рекомендациями FDA. Однако у некоторых пациентов эту терапию трудно переносить. Для них рекомендуется сочетать лечение с потреблением продуктов, содержащих пробиотики.
Эти методы лечения эффективны, однако в последние годы наблюдается Helicobacter pylori к метронидазолу и кларитромицину.
Микроорганизм может быть уничтожен, однако возможна повторная инфекция. Во второй терапии из-за реинфекции рекомендуется применение левофлоксацина.
Читайте также:


