Как отличить глпс от лептоспироза

Геморрагическая лихорадка (ГЛПС) и лептоспироз (ЛС) относятся к нетрансмиссивным зоонозным болезням человека, и социально-экономическая значимость этих инфекций определяется, прежде всего, появлением новых и активностью уже существующих очагов, отсутствием тенденции к снижению заболеваемости и периодически регистрируемыми вспышками, а также сложностью ранней дифференциальной диагностики и отсутствием эффективных способов профилактики. Высокий социально-экономический ущерб, наносимый этими заболеваниями, обусловлен развитием тяжелых осложнений, длительной потерей трудоспособности и высокой стоимостью госпитального лечения [1, 2].
Возбудители ГЛПС, ортохантавирусы – оболочечные вирусы, содержащие отрицательно заряженную одиночную цепь РНК, составляют род Ortohantavirus в семействе Hantaviridae, порядок Bunyavirales [3, 4]. Основными резервуарными хозяевами хантавирусов в природных очагах являются мелкие млекопитающие разных видов: 51 вид грызунов отряда Rodentia (мыши, полевки, крысы, хомяки и т.д.), 20 видов насекомоядных землероек и кротов (отряд Soricomorpha), 7 видов летучих мышей (отряд Chiroptera). Во всем мире генетически идентифицировано более 80 ортохантавирусов, 41 для 25 из них доказана роль в патологии человека [2, 5, 6]. В синантропных очагах ортохантавирусной инфекции во всем мире и в России ведущая роль резервуара возбудителя принадлежит серой крысе Rattus norvegicus (отряд Rodentia, семейство Muridae, род Rattus, Berkenhout, 1769).
Лептоспиры принадлежат к роду Leptospira семейства Leptospiraceae, в зависимости от резервуара, в котором они обитают, выделяют вид патогенных лептоспир (interrogans), паразитирующих у животных - носителей, и сапрофитический вид (biflexa) – свободноживущие особи. По антигенной структуре патогенные лептоспиры делят на серологические группы – серовары, описано более 300 сероваров, патогенных для человека лептоспир. Как и для ортохантавирусов, основным резервуаром лептоспир являются дикие грызуны, включая серую крысу, которая, как полагают, является основным источником инфекции для людей и других, в том числе домашних животных, например собак [7–9]. В природных очагах инфекции среди мышевидных грызунов лептоспиры чаще всего обнаруживаются у желтогорлой мыши (9,74 %), рыжей полевки (6,51 %), полевки-экономки (5,31 %), полевки обыкновенной (5,08 %) и мыши лесной (4,96 %). Среди насекомоядных животных высокий процент (7,09 %) инфицированности отмечен у бурозубки обыкновенной. Доминирующей серогруппой лептоспир, выделяемой от диких и синантропных грызунов, является icterohaemorrhagiae (39,3 %) [10].
Несмотря на широкий спектр хозяев и ортохантавирусам и патогенным лептоспирам свойственна гостальная специфичность. Возбудители отдельных серотипов/сероваров циркулируют преимущественно в популяциях животных одного вида или ограниченного круга видов, являющихся основными резервуарами инфекции: каждый тип ортохантавируса в процессе коэволюции адаптировался к уникальному виду природного хозяина [11–14]. Также показана специфическая ассоциация крыс и лептоспир серогруппы icterohaemorrhagiae, наиболее частого возбудителя инфекции у людей, кроме того, серовар copenhageni встречается чаще у серой крысы, hardjo у крупного рогатого скота (КРС), canicola у собак, tarassovi у свиней и КРС, grippotyphosa – у серых полевок, КРС [15].
Еще одним немаловажным фактом является то, что и ортохантавирусы и лептоспиры вызывают у своих природных хозяев – грызунов бессимптомную инфекцию, характеризующуюся длительным выделением возбудителя в среду. Процесс непрерывной циркуляции патогенных лептоспир в природе обеспечивается их способностью к колонизации эпителия извитых канальцев коркового слоя почек теплокровных хозяев, у которых формируется хроническое, часто пожизненное лептоспироносительство, сопровождаемое выделением лептоспир с мочой [15]. Ортохантавирусная инфекция у грызунов протекает также в виде пожизненной, латентной персистентной инфекции, с постоянным выделением вируса с калом, мочой и слюной в окружающую среду. Однако в отличие от лептоспир основными клетками мишенями размножения ортохантавируса является эндотелий сосудов разных органов и тканей, в том числе и почек [18, 19].
Заражение ортохантавирусом людей и грызунов происходит, в основном при вдыхании аэрозолированных экскретов, контаминированных вирусом, у грызунов второстепенную роль играет прямой контакт (в том числе через раны при выражении агрессии). Инфицирование лептоспирами людей и животных также происходит при непрямом контакте с контаминированными субстратами окружающей среды. Кроме того, распространение лептоспир в популяциях крыс также может происходить и при прямом контакте (конъюнктивальный, подкожный, накожный, внутрикожный) [20], хотя проникновение лептоспир через слизистую при проглатывании контаминированной воды считается наиболее эффективным путем заражения. Данные Costa et al. [21] об инфицировании лептоспирами более молодых серых крыс и с меньшей массой тела, по сравнению с особями, инфицированными ортохантавирусом Seoul и Bartonella spp., предполагают различия в динамике передачи этих патогенов.
Очень важно, что лептоспиры и ортохантавирусы сохраняют свою жизнеспособность в течение определенного периода времени в окружающей среде [15, 22], и, хотя для выживания обоих патогенов оптимальными показателями являются высокая влажность и нейтральный показатель рН среды, для лептоспир благоприятными считаются высокие температуры, а для ортохантавирусов, как и для большинства вирусов – низкие. Поэтому большая часть случаев лептоспироза регистрируется преимущественно в тропических и субтропических регионах, а ортохантавирусная инфекция более распространена в умеренных широтах.
Однако в связи с быстрой урбанизацией, глобальным потеплением и экстремальными климатическими событиями (наводнения) увеличение активности сочетанных (природных или городских) очагов лептоспироза и ортохантавирусной инфекции приобретает актуальность и для регионов с более умеренным климатом.
Так сочетанные природные очаги лептоспирозной и ортохантавирусной инфекции выявлены на Дальнем Востоке России, где основными носителями обоих возбудителей являются полевая мышь – носитель патогенного для человека ортохантавируса Hantaan и дальневосточная полевка Microtus fortis (отряд Rodentia, семейство Cricetidae, род Microtus, Buchner 1889), резервуар ортохантавируса Fusong, вируса с пока не выясненной для человека патогенностью [23, 24].
Очаг одновременной циркуляции ортохантавирусной инфекции и лептоспироза в популяциях диких грызунов выявлен в Хорватии: 46 % исследованных особей желтогорлой мыши Apodemus flavicolis (отряд Rodentia, семейство Muridae, подсемейство Murinae, род Apodemus, Melchior, 1834) были инфицированы лептоспирами и 71 % ортохантавирусами, причем у 14 % исследованных грызунов обнаружена одновременная инфекция ортохантавирусом Dobrava и лептоспирами серогрупп australis и grippotyphosa [25].
Такая ситуация с наличием ко-инфекции лептоспирами и ортохантавирусов у одного природного хозяина может привести к одновременному заражению человека этими двумя патогенами. Случаи острой ко-инфекции лептоспироза и ГЛПС зарегистрированы в Бельгии и Голландии в ареале рыжей полевки Myodes glareolus (отряд Rodentia, семейство Cricetidae, род Myodes, Schreber, 1780), носителя патогенного для человека хантавируса Puumala [26]. Кроме того, в странах с более тропическим климатом, Шри-Ланка и Мали, также отмечены случаи одновременной инфекции лептоспирами и ортохантавирусами [27, 28], однако если лептоспироз для данных территорий является эндемичным заболеванием, то подтверждающие сведения о типе ортохантавируса – возбудителя в данном регионе практически отсутствуют или требуется его дополнительная серологическая и молекулярно-генетическая дифференциация.
Диагностика ко-инфекции ортохантавирусами и лептоспирами и дифференциальная диагностика каждой отдельной инфекции у людей может быть затруднена наличием неспецифических симптомов, особенно на ранних этапах, что подтверждается сообщениями о трудностях, возникающих при клинической дифференциации между случаями этих природноочаговых инфекций [29, 30, 31]. Более того, такие общие клинические симптомы, как лихорадка, почечная недостаточность, геморрагический синдром, являются типичными для ГЛПС и лептоспироза, а единый резервуар возбудителей данных инфекций – мелких мышевидных грызунов обуславливает сходство эпидемиологических аспектов заболеваемости.
Как при многих инфекциях, большая часть случаев ГЛПС и лептоспироза протекает субклинически или очень легко, так что за медицинской помощью обращаются только лица со среднетяжелой и тяжелой формами. Частыми симптомами, наблюдающимися у 80 % пациентов при обеих инфекциях, являются лихорадка, миалгия, головная боль, реже встречаются тошнота, рвота, артралгии, боль в области живота. Типичные формы с проявлением желтушного синдрома встречаются примерно у 5 % больных с лептоспирозом [7] и сопровождаются умеренным повышением уровней трансаминаз и щелочной фосфатазы. В то же время по данным В.И. Верхотуровой [32] при ортохантавирусной инфекции, вызванной вирусами Seoul или Hantaan, синдром гепатита (желтушный синдром, гипербилирубинемия) выявлен у 25 %, а гепатомегалия у 60 % – 80 % обследованных пациентов. Другим общим для лептоспироза и ГЛПС синдромом является острая почечная недостаточность. Как и при ГЛПС, при лептоспирозе может наблюдаться петехиальная сыпь и описаны случаи лептоспироза у путешественников, вернувшихся из Африки, с клиническими симптомами, напоминающими вирусные геморрагические лихорадки [7]. Еще одним фактором, затрудняющим клиническую дифференциацию этих двух инфекций, является вовлечение дыхательной системы разной степени тяжести, вплоть до острого респираторного дистресс-синдрома взрослых [3, 33].
Учитывая глобальное распространение серых крыс – носителей патогенных для человека ортохантавируса Seoul и лептоспир и других важных, в том числе особо опасных патогенов, таких как бактерии (Yersina pestis, Rickettsia typhi, Bartonella spp., Streptobacillus moniliformis) и паразиты (Angiostrongylus cantonensis, Chen, 1935) [34], а также концентрацию грызунов этого вида на ограниченных территориях крупных, в том числе портовых городов [35], такие очаги – это наиболее важные с точки зрения возможности наличия микст-инфекций территории.
Данные о наличии ко-инфекций возбудителей зоонозов у животных – резервуаров и их векторов многочисленны. Особенно это касается клещевых инфекций, одним из примеров многочисленных микст-инфекций является выявление в клещах Ixodes sinensis в Китае бактерий четырех родов Borrelia, Bartonella, Anaplasma и Ehrlichia) [36]. В сочетанных очагах имеют место и многообразные взаимодействия возбудителей, которые не препятствуют совместному развитию эпизоотических процессов, а общая паразитарная система обеспечивает сохранение в природе возбудителей лептоспироза и ортохантавирусов в очагах такого типа [37].
Таким образом, наличие природных и городских очагов, характеризующихся одновременной циркуляцией возбудителей таких опасных заболеваний, как геморрагическая лихорадка с почечным синдромом и лептоспироз, общность источника – природного резервуара, путей передачи возбудителя, значительное сходство клинических симптомов существенно затрудняет дифференциальную диагностику этих природно-очаговых инфекций, без лабораторного подтверждения специфической природы заболевания. Использование истребительных мероприятий, позволяющих снизить популяцию грызунов – носителей разных возбудителей инфекций, в совокупности с мерами дезинфекции, уничтожающими внеорганизменную популяцию патогенов, может существенно снизить уровни заболеваемости как вирусными, так и бактериальными зоонозами.
Еще один феномен, не рассматриваемый в данном обзоре, но чрезвычайно интересный: взаимодействие разных патогенов на организменном и/или популяционном уровне хозяев при одновременной инфекции, степень воздействия и влияние на состояние пациентов остается неизученным и требует проведения дальнейших экспериментальных исследований.
Целью настоящей работы было дать сравнительную характеристику больных лептоспирозом и геморрагической лихорадкой с почечным синдромом (ГЛПС).
Под наблюдением находилось 40 больных (20 человек с лептоспирозом и 20 - с ГЛПС). У всех диагноз подтвержден специфическими серологическими методами исследования (ГЛПС в, диагностический титр1:; лептоспироз в диагностический титр 1:).
ГЛПС поражает людей чаще в возрасте старше 30 лет (85%), причем преимущественно мужчин (83%); в этих возрастных группах наибольший процент заболевших приходится на возраст 30 - 50 лет, т.е. трудоспособное население. Причиной этого, по-видимому, является большой процент занятости в сельском хозяйстве, работа на приусадебных участках, посещение леса.
Поступление больных в стационар начиналось в летние месяцы, причем 35% больных ГЛПС поступили в июне-июле и 65% в сентябре, в то время как 95% больных лептоспирозом поступили в сентябре. Догоспитальная диагностика этих болезней была весьма затруднительна, т.к. начальные симптомы напоминают ОРВИ, грипп, энтеровирусную инфекцию, пиелонефрит и т.д., что и находило свое отражение в направлениях в стационар.
Ведущим фактором заражения ГЛПС, равно как и лептоспирозом, является употребление некипяченой воды (50 и 60% соответственно).
Средние сроки пребывания больных в стационаре составили при ГЛПС 19 койко-дней, при лептоспирозе - 20. В целом лептоспирозом болеют несколько дольше, чем ГЛПС, хотя разница несущественна.
Такие симптомы, как лихорадка, слабость, головная боль, снижение аппетита с одинаковой частотой отмечались у всех больных. Специфическими для ГЛПС были следующие симптомы: боли в суставах, нарушение зрения, более учащенное мочеиспускание в полиурическом периоде, увеличение печени, гиперемия кожных покровов, боли в пояснице (нередко с иррадиацией в брюшную полость), экзантема; в это время при лептоспирозе чаще отмечались тошнота, рвота, боли в эпигастрии, жидкий стул, уреженное мочеиспускание, потливость, боли в правом подреберье, боли в мышцах.
Оба этих заболевания, кроме общих симптомов интоксикации, характеризует выраженная органная патология, проявлением которой были не только клинические признаки, но и изменения лабораторных показателей.
Для лептоспироза было более характерно превалирование поражения печени над изменениями в почках, что находило отражение в высоких показателях билирубина и АЛТ по сравнению с нормой. При ГЛПС, наоборот, на фоне умеренно повышенной активности АЛТ, показатели мочевины и креатинина превышали таковые по сравнению с больными лептоспирозом, что отражало более выраженное поражение почек.
При лептоспирозе протенурия встречается в 85% случаев, а средний уровень белка составляет 0,65 г/л, лейкоцитурия встречается в 70%, гематурия - в 35%, гипостенурия наблюдается в 20%, а тенденция к гипостенурии имеется в 40%. У больных ГЛПС протеинурия отмечена в 95% случаев со средним уровнем белка 0,9 г/л, лейкоцитурия наблюдалась в 85% случаев, гематурия - в 30%, гипостенурия в 35%, а тенденция к развитию гипостенурии имелась в 30% случаев.
В общем анализе крови присутствовали изменения, характерные для воспалительного инфекционного процесса, однако при лептоспирозе они были более выражены.
Для оценки эффективности лечения нами были проанализированы лабораторные данные больных ГЛПС и лептоспирозом. Средние значения основных показателей биохимического анализа крови больных пришли в норму, но в 15% случаев наблюдался повышенный уровень мочевины, в 10% - креатинина, в 37% - АЛТ при лептоспирозе, а при ГЛПС в 10% случаев сохранялся повышенный уровень креатинина, в 75% случаев - АЛТ.
Протеинурия при ГЛПС сохранялась при выписке в 30% случаев при среднем уровне белка 0,044г/л, лейкоцитурия в 45% случаев, гипостенурия - в 55%, а тенденция к гипостенурии - в 25% случаев. При лептоспирозе протенурия отмечалась чаще 80% случаев со средним уровнем белка 0,54 г/л, лейкоцитурия в 60% случаев, гематурия - в 10%, гипостенурия - в 55%, а тенденция к гипостенурии - в 15% случаев.
При оценке данных при выписке общего анализа крови больных лептоспирозом выявлено отклонение основных показателей от нормы в 90% случаев, у больных ГЛП - в 78% случаев.
Таким образом, в общем анализе крови и мочи у больных лептоспирозом после проведенного лечения сохраняются более выраженные изменения, чем при ГЛПС, где отмечается превалирующий уровень гиперферментемии.
Приведенные выше данные выявляют различия в клинических симптомах ГЛПС и лептоспироза. При ГЛПС обращает на себя внимание преобладающее поражение почек, в то время как при лептоспирозе отмечается полиорганность поражения. Восстановительный период при лептоспирозе более продолжительный по сравнению с ГЛПС, на что указывают изменения в лабораторных показателях, отражающих состояние почек и печени.

Врагов нужно знать в лицо, сообщает сайт Роспотребнадзора по рязанской области. Мелкие грызуны не только могут изрядно подпортить ваши сбережения, съедобные и несъедобные, но и заразить вас самих опасными инфекционными заболеваниями, так называемыми - природно-очаговыми. Что это означает? Это означает, что болезнь распространяется в определенных местностях, а именно там, где живут определенные мелкие млекопитающие, которые являются носителями возбудителей природно-очаговых инфекций.
На территории области практически во всех районах регистрируются такие инфекционные заболевания как туляремия, геморрагическая лихорадка с почечным синдромом (ГЛПС), лептоспироз.
Природные очаги природно-очаговых инфекций существуют в Старожиловском, Спасском, Клепиковском, Касимовском, Михайловском, Рыбновском, Ухоловском, Захаровском, Новодеревенском, Пронском, Кораблинском, Сасовском, Шацком, Ряжском, Шиловском, Рязанском районах и в окрестностях г.Рязани.
Таким образом, мы стоим перед проблемой дальнейшего распространения этих болезней по территориям Рязанской области и, естественно, увеличением уровня заболеваемости. Ведь каждый случай болезни не только наносит вред здоровью, но и приносит большой экономический ущерб.
Болезнь легче предупредить, чем ее лечить.
И наравне с медиками каждый житель Рязанской области должен знать, что необходимо делать, чтобы предотвратить заражение и не заболеть этими опасными заболеваниями.
Источниками распространения возбудителей природно-очаговых инфекций являются мышевидные грызуны (водяная крыса, мышь полевая, мышь лесная, мышь домовая, а также рыжая и обыкновенная полевки), а туляремией можно заразиться и от укуса насекомыми.
Человек заражается различными путями:
- вдыхая пыль при перелопачивании, обмолоте зерна, при перекладке, перевозке сена, соломы;
- при переработке овощей после их длительного хранения в буртах, ямах;
- при употреблении инфицированных продуктов, воды;
- при снятии шкурок, при прямых контактах с грызунами (когда берут в руки больных животных или трупы павших);
- при укусе грызунами, клещами, комарами, слепнями.
При туляремии поражаются лимфатические узлы, при ГЛПС - почки, при лептоспирозе - капилляры печени, почек, мышц.
Больные грызуны выделяют туляремийный микроб и вирусы ГЛПС и лептоспироза с мочой, слюной, и испражнениями, которыми загрязняются продукты, вода колодцев, прудов, сено, зерно и даже почва. Заражение человека происходит через поврежденную кожу, слизистые оболочки глаз, рта, пищеварительного тракта, а так же при вдыхании пыли при проведении уборок территории дач, лесопосадок.
При туляремии спустя 3-7 дней (иногда даже через 3 недели) появляются симптомы общей интоксикации: сильные головные боли, высокая температура, озноб, боли в икроножных мышцах, увеличение лимфатических узлов. Проявляться эта болезнь может по разному: в пневмонии, бронхитах, конъюнктивитах, лимфаденитах.
Ничуть не лучше последствия ГЛПС - геморрагический диатез, поражение почек, вплоть до острой почечной недостаточности. Заболевание начинается с высокой температуры до 40 градусов, головной боли, боли в мышцах и в пояснице; кровоизлияние под кожу и слизистые оболочки.
При лептоспирозе беспокоит волнообразная лихорадка, резкие боли в мышцах, особенно икроножных, спины, затылочных и шейных.
Опасными являются жилища человека, в которые проникают и живут грызуны, а так же хозяйственные и бытовые постройки: сараи, погреба, подвалы, гаражи, дачные дома. Именно здесь с наступлением холодов обосновываются грызуны. Кроме того, для зимовки могут оказаться удобными кучи мусора и валежника.
Однако предотвратить эти болезни не так уж и сложно:
- Делайте профилактические прививки от туляремии, они создают стойкую защиту на 5 лет. Прививку можете сделать в поликлинике по месту жительства.
- После зимы проводите влажную уборку дачных домиков с хлорсодержащими препаратами в резиновых перчатках, в ватно-марлевой повязке или респираторе. После уборки необходимо тщательно с мылом вымыть руки, одежду постирать. Не захламляйте участки и жилые помещения бытовым и строительным мусором. Сделайте недоступными для грызунов жилые постройки: закройте вентиляционные отверстия металлической сеткой, а щели законопатьте стекловатой и зацементируйте.
- Уничтожайте грызунов всеми доступными способами (приманками, мышеловками, капканами). Трупы грызунов необходимо сжигать.
- Храните продукты в закрытых емкостях. Не употребляйте продукты попорченные грызунами.
- Не употребляйте сырую воду из рек, ручьев, прудов как для питья, так и для мытья овощей и посуды при отдыхе на природе. Содержите в порядке колодцы. Если в колодце обнаружен труп грызуна, срочно очистите колодец и продезинфицируйте хлорной известью.
- Не курите во время проведения уборки помещений и участка. Перед курением вымойте руки с мылом.
- Не стоит раскладывать пищу на траве и камнях. В походе для ночлега выбирайте сухие, не заросшие кустарником участки леса. Избегайте ночевки в стоге сена или соломы.
Выполняя эти рекомендации, вы сохраните свое здоровье.
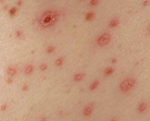
Геморрагическая лихорадка с почечным синдромом - зоонозная хантавирусная инфекция, характеризующаяся тромбогеморрагическим синдромом и преимущественным поражением почек. Клинические проявления включают острую лихорадку, геморрагическую сыпь, кровотечения, интерстициальный нефрит, в тяжелых случаях - острую почечную недостаточность. К специфическим лабораторным методам диагностики геморрагической лихорадки с почечным синдромом принадлежат РИФ, ИФА, РИА, ПЦР. Лечение заключается во введении специфического иммуноглобулина, препаратов интерферона, проведении дезинтоксикационной и симптоматической терапии, гемодиализа.
МКБ-10
Общие сведения
Геморрагическая лихорадка с почечным синдромом (ГЛПС) - природно-очаговое вирусное заболевание, характерными признаками которого являются лихорадка, интоксикация, повышенная кровоточивость и поражение почек (нефрозонефрит). На территории нашей страны эндемичными районами являются Дальний Восток, Восточная Сибирь, Забайкалье, Казахстан, европейская территория, поэтому ГЛПС известна под различными названиями: корейская, дальневосточная, уральская, ярославская, тульская, закарпатская геморрагическая лихорадка и др. Ежегодно в России регистрируется от 5 до 20 тыс. случаев заболеваний геморрагической лихорадкой с почечным синдромом. Пик заболеваемости ГЛПС приходится на июнь-октябрь; основной контингент заболевших (70-90%) составляют мужчины в возрасте 16-50 лет.

Причины ГЛПС
Возбудителями болезни являются РНК-содержащие вирусные агенты рода Hantavirus (хантавирусы), относящиеся к семейству Bunyaviridae. Для человека патогенны 4 серотипа хантавирусов: Hantaan, Dubrava, Puumala, Seoul. Во внешней среде вирусы относительно долго сохраняют стабильность при отрицательной температуре и малоустойчивы при температуре 37°C. Вирусы имеют сферическую или спиральную форму, диаметр 80-120 нм; содержат одноцепочечную РНК. Хантавирусы обладают тропностью к моноцитам, клеткам почек, легких, печени, слюнных желез и размножаются в цитоплазме инфицированных клеток.
Переносчиками возбудителей геморрагической лихорадки с почечным синдромом служат грызуны: полевые и лесные мыши, полевки, домовые крысы, которые инфицируются друг от друга через укусы клещей и блох. Грызуны переносят инфекцию в форме латентного вирусоносительства, выделяя возбудителей во внешнюю среду со слюной, фекалиями и мочой. Попадание инфицированного выделениями грызунов материала в организм человека может происходить аспирационным (при вдыхании), контактным (при попадании на кожу) или алиментарным (при употреблении пищи) путем. К группе повышенного риска по заболеваемости геморрагической лихорадкой с почечным синдромом относятся сельскохозяйственные и промышленные рабочие, трактористы, водители, активно контактирующие с объектами внешней среды. Заболеваемость человека напрямую зависит от численности инфицированных грызунов на данной территории. ГЛПС регистрируется преимущественно в виде спорадических случаев; реже – в виде локальных эпидемических вспышек. После перенесенной инфекции остается стойкий пожизненный иммунитет; случаи повторной заболеваемости единичны.
Патогенетическую сущность геморрагической лихорадки с почечным синдромом составляют некротизирующий панваскулит, ДВС-синдром и острая почечная недостаточность. После заражения первичная репликация вируса происходит в эндотелии сосудов и эпителиальных клетках внутренних органов. Вслед за накоплением вирусов наступает вирусемия и генерализация инфекции, которые клинически проявляются общетоксическими симптомами. В патогенезе геморрагической лихорадки с почечным синдромом большую роль играют образующиеся аутоантитела, аутоантигены, ЦИК, оказывающие капилляротоксическое действие, вызывающие повреждение стенок сосудов, нарушение свертываемости крови, развитие тромбогеморрагического синдрома с повреждением почек и других паренхиматозных органов (печени, поджелудочной железы, надпочечников, миокарда), ЦНС. Почечный синдром характеризуется массивной протеинурией, олигоанурией, азотемией, нарушением КОС.
Симптомы ГЛПС
Геморрагическая лихорадка с почечным синдромом характеризуется циклическим течением с последовательной сменой нескольких периодов:
- инкубационного (от 2-5 дней до 50 суток - в среднем 2-3 недели)
- продромального (2-3 дня)
- лихорадочного (3-6 дней)
- олигоурического (с 3-6-го по 8-14-й день ГЛПС)
- полиурического (с 9-13 дня ГЛПС)
- реконвалесцентного (раннего – от 3-х недель до 2 месяцев, позднего - до 2-3-х лет).
В зависимости от выраженности симптомов, тяжести инфекционно-токсического, геморрагического и почечного синдромов различают типичные, стертые и субклинические варианты; легкие, среднетяжелые и тяжелые формы геморрагической лихорадки с почечным синдромом.
В олигоурический период геморрагической лихорадки с почечным синдромом температура тела снижается до нормы или субфебрильных цифр, однако это не приводит к улучшению состояния пациента. В эту стадию еще более усиливаются симптомы интоксикации и возникают признаки поражения почек: нарастают боли в пояснице, резко снижается диурез, развивается артериальная гипертензия. В моче выявляется гематурия, протеинурия, цилиндрурия. При нарастании азотемии развивается ОПН; в тяжелых случаях - уремическая кома. У большинства больных отмечается неукротимая рвота и диарея. Геморрагический синдром может быть выражен в различной степени и включать в себя макрогематурию, кровотечения из мест инъекций, носовые, маточные, желудочно-кишечные кровотечения. В олигоурический период могут развиваться тяжелые осложнения (кровоизлияния в головной мозг, гипофиз, надпочечники), служащие причиной летального исхода.
Переход геморрагической лихорадки с почечным синдромом в полиурическую стадию знаменуется субъективными и объективными улучшениями: нормализацией сна и аппетита, прекращением рвоты, исчезновением боле в пояснице и т. д. Характерными признаками данного периода служит увеличение суточного диуреза до 3-5 л и изогипостенурия. В период полиурии сохраняется сухость во рту и жажда.
Период реконвалесценции при геморрагической лихорадке с почечным синдромом может затягиваться на несколько месяцев и даже лет. У больных долго сохраняется постинфекционная астения, характеризующаяся общей слабостью, снижением работоспособности, быстрой утомляемостью, эмоциональной лабильностью. Синдром вегетативной дистонии выражается гипотонией, инсомнией, одышкой при минимальной нагрузке, повышенной потливостью.
Специфическими осложнениями тяжелых клинических вариантов ГЛПС могут являться инфекционно-токсический шок, кровоизлияния в паренхиматозные органы, отек легких и головного мозга, кровотечения, миокардит, менингоэнцефалит, уремия и др. При присоединении бактериальной инфекции возможно развитие пневмонии, пиелонефрита, гнойных отитов, абсцессов, флегмон, сепсиса.
Диагностика ГЛПС
Клиническая диагностика ГЛПС основывается на цикличности течения инфекции и характерной смене периодов. При сборе эпидемиологического анамнеза обращается внимание на пребывание пациента в эндемичной местности, возможный прямой или косвенный контакт с грызунами. При проведении неспецифического обследования учитывается динамика изменения показателей общего и биохимического анализа мочи, электролитов, биохимических проб крови, КОС, коагулограммы и др. С целью оценки тяжести течения и прогноза заболевания выполняется УЗИ почек, ФГДС, рентгенография органов грудной клетки, ЭКГ и др.
Специфическая лабораторная диагностика геморрагической лихорадки с почечным синдромом проводится с помощью серологических методов (ИФА, РНИФ, РИА) в динамике. Антитела в сыворотке крови появляются в конце 1-ой недели болезни, к концу 2-й недели достигают максимальной концентрации и сохраняются в крови 5–7 лет. РНК вируса может быть выделена с помощью ПЦР-исследования. ГЛПС дифференцируют с лептоспирозом, острым гломерулонефритом, пиелонефритом и энтеровирусной инфекцией, прочими геморрагическими лихорадками.
Лечение ГЛПС
Больные геморрагической лихорадкой с почечным синдромом госпитализируются в инфекционный стационар. Им назначается строгий постельный режим и диета №4; проводится контроль водного баланса, гемодинамики, показателей функционирования сердечно-сосудистой системы и почек. Этиотропная терапия геморрагической лихорадки с почечным синдромом наиболее эффективна в первые 3-5 суток от начала заболевания и включает введение донорского специфического иммуноглобулина против ГЛПС, назначение препаратов интерферона, противовирусных химиопрепаратов (рибавирина).
В лихорадочном периоде проводится инфузионная дезинтоксикационная терапия (внутривенные вливания глюкозы и солевых растворов); профилактика ДВС-синдрома (введение препаратов-дезагрегантов и ангиопротекторов); в тяжелых случаях применяются глюкокортикостероиды. В олигурическом периоде осуществляется стимуляция диуреза (введение ударных доз фуросемида), коррекция ацидоза и гиперкалиемии, профилактика кровотечений. При нарастающей ОПН показано переведение пациента на экстракорпоральный гемодиализ. При наличии бактериальных осложнений назначается антибиотикотерапия. В полиурическую стадию основной задачей является проведение оральной и парентеральной регидратации. В период реконвалесценции проводится общеукрепляющая и метаболическая терапия; рекомендуется полноценное питание, физиотерапия (диатермия, электрофорез), массаж и ЛФК.
Легкие и среднетяжелые формы геморрагической лихорадки с почечным синдромом в большинстве случаев заканчиваются выздоровлением. Резидуальные явления (постинфекционная астения, боли в пояснице, кардиомиопатия, моно- и полиневриты) длительно наблюдаются у половины переболевших. Реконвалесценты нуждаются в ежеквартальном диспансерном наблюдении инфекциониста, нефролога и окулиста на протяжении года. Тяжелое течение сопряжено с высоким риском осложнений; смертность от ГЛПС колеблется в пределах 7-10%.
Профилактика геморрагической лихорадки с почечным синдромом заключается в уничтожении мышевидных грызунов в природных очагах инфекции, предупреждении загрязнения жилищ, водоисточников и продуктов питания выделениями грызунов, дератизации жилых и производственных помещений. Специфической вакцинации против ГЛПС не разработано.
Читайте также:


