Лепра по цилю нильсену
Всемирный день борьбы с лепрой отмечается 30 января как напоминание о существовании болезни с многовековой историей. Проказа не исчезла вместе со средневековой антисанитарией: по данным ВОЗ, число новых заболевших в 2016 году — 173 358 человек. Больше всего случаев заражения — в Африке и Азии, но риск не стремится к нулю и в развитых странах.
Описание проказы встречается и в многочисленных отрывках Библии, причем как в Новом, так и в Ветхом завете. Для христиан и иудеев проказа — божья кара за неправедное поведение, поэтому больные подвергались дополнительному порицанию. Церковные отцы Григорий Великий и Исидор Севильский писали о прокаженных как о еретиках. У простолюдинов проказа стала синонимом наказания за распутство и похотливость.

Эпидемии лепры случались периодически, как и вспышки других инфекций. Рост заболеваемости был зафиксирован в XII–XIII веках, в эпоху крестовых походов. Во Франции насчитывалось около 2 тыс. лепрозориев, в то время как в Англии и Шотландии — 220 для размещения примерно 1,5 млн человек.
Лепрозорий — эндемичная зона и организационный центр по борьбе с проказой. В Средневековье — изолированная территория для больных лепрой, обреченных на медленную смерть, гниение заживо.
Сегодня стратегия борьбы с лепрой запрещает травлю на законодательном уровне. Тем не менее, из-за низкой осведомленности людей больные до сих пор подвергаются травле и остракизму. В России всего четыре учреждения занимаются конкретно болезнью Хансена: НИИ по изучению лепры в Астрахани, Сергиево-Посадский филиал Государственного научного центра дерматовенерологии, Терский лепрозорий в Ставрополье и лепрозорий Краснодарского края.
Лепру считали наказанием грешников, которое в корне меняло внешний вид человека. Уродливая внешность — только самый яркий и финальный симптом болезни Хансена. Первый симптом всех больных — онемение и потеря чувствительности к температурным изменениям, отсутствие ощущения жара или холода. Дальше пораженные участки лишаются ощущений легкого касания, боли и, наконец, сильного надавливания. Дальше сценарии болезни расходятся: у лепры три основных типа, для каждого из которых свойственны разные симптомы.
Mycobacterium leprae — тип бактерии с высоким содержанием гуанина и цитозина, вызывающий хроническое гранулематозное заболевание — лепру. Это единственная известная бактерия, которая поражает нервную ткань организма.
Даже исключив из круга общения зараженных людей, нельзя быть уверенным в безопасности. Бактерия-возбудитель может передаваться не только респираторным путем, но и через воздействие насекомых, зараженную почву или воду. Хотя у ученых нет законченного списка распространителей заболевания, большинство точно признает воздушно-капиллярный путь передачи.
Возбудители лепры появляются в организме с помощью слизистых оболочек, попадая в нервные окончания, кровеносную и лимфатическую системы. На этом этапе не происходит видимых изменений кожных покровов или организма вообще.
У людей, заразившихся от одного и того же источника, в одинаковых условиях могут развиться разные формы лепры с разными последствиями. Это значит, что вирулентность, то есть сумма болезнетворных свойств микроба, не влияет на характер болезни.
M. leprae выживает в человеческом организме в течение нескольких часов или дней, и затем либо приживается, либо сталкивается с иммунной защитой организма.
Иммунитет человека не дает проказе прижиться в организме. Даже в эндемичных районах заболевания скорость распространения лепры минимальна, а болезнь редко прогрессирует до клинических уровней при наличии необходимого лечения.
Из-за долгого инкубационного периода заболевания, от 9 месяцев до 20 лет, раньше проказа оставалась незамеченной вплоть до появления явной симптоматики. Сегодня для диагностики формы заболевания есть несколько действенных, но довольно трудоемких способов.

При любом из видов диагностики медиками учитываются нахождение в эндемичном районе, контакты с больными, данные непосредственного осмотра: наличие и длительность кожных высыпаний, признаки нарушения работы нервных окончаний.
Норвежец Герхард Хенрик Армауэр Хансен был первым человеком, обнаружившим микроб, вызывающий проказу. Бактерия Mycobacterium leprae была открыта им в 1873 году с помощью микроскопа. Хотя способы лечения заболевания оставались неизвестными, открытие возбудителя принесло облегчение больным и их родственникам: найденная естественная причина прекратила гонения на прокаженных и их детей.
Герхард Хансен — норвежский врач, известный открытием и идентификацией бактерии Mycobacterium leprae в 1873 году как агента, вызывающего лепру.
Проказа до Хансена в основном рассматривалась в качестве наследственной или же имеющей миазматическое происхождение болезни. На основе эпидемиологических исследований Хансен сделал вывод, что проказа является болезнью с конкретной причиной.
В феврале 1873 года Герхард Хансен, рассматривая материал больного под микроскопом, внезапно увидел в клетках крохотные палочки. Он объявил об обнаружении Mycobacterium leprae в тканях всех больных, хотя не распознал их как бактерии, — и получил незначительную поддержку.
В 1879 году молодой немецкий ученый Альберт Нейссер приехал в Берген, чтобы изучить болезнь проказы. Хансен передал ему образцы тканей. Нейссер успешно окрасил бактерии и объявил о своих выводах в 1880 году, заявив, что обнаружил организм, вызывающий заболевание, без упоминания Хансена. Это привело к серьезному спору о приоритете в открытии бациллы проказы.
Благодаря усилиям Хансена в 1879 году было запрещено свободное передвижение больных проказой по стране, а в 1885 году он добился принятия закона, предусматривающего обязательную изоляцию больных лепрой в стационарах или на дому и систематические медосмотры лиц, контактировавших с больными. Эта система показала такую эффективность, что послужила основой для законодательства многих европейских стран в отношении больных лепрой.

Коллеги не поддержали доктора и не поняли важности его открытия. Впрочем, и сам Хансен не распознал микроб как бактерию, а потому не получил поддержки научного сообщества. Кроме того, изучение Mycobacterium leprae затруднялось особенностями роста на питательных средах: в отличие от похожей по свойствам туберкулезной палочки, бактерия лепры не росла в питательном растворе чашки Петри.
Лепру лечили практически народными методами вплоть до 40-х годов XX века. Больным назначались инъекции масла из ореха чаульмугры. Процедура была крайне неприятной и доставляла большие страдания больным. При этом полезность метода ставилась под сомнение. Ситуация изменилась в 1941 году, когда сульфоновый препарат промин был впервые использован в качестве лекарства.
Тест промина прошел в Центре заболеваний имени Дж. Лонга в Карвилле, штат Луизиана. Появившись в 1921 году, Центр стал местом исследования лепры и борьбы с ней.
Спустя десятилетие стагнации в исследованиях в 70-х на Мальте провели первый успешный опыт лечение болезни Хансена полихимиотерапией: комбинированным мультидраговым лечением, сочетающим в себе курс из нескольких препаратов. В 1981 году ВОЗ создала рекомендованный список препаратов для лечения мультибацилярной лепры: дапсон, рифампицин и клофазимин. Больные с олигобацилярнной формой заболевания принимают только рифампицин и дапсон. Монотерапия лепры неприемлема. Лечение только одним препаратом из списка делает бактерии резистентными. Они приобретают сопротивляемость, а воздействие лепры на организм усугубляется.
Каждое из лекарств выполняет собственную функцию в комплексном лечении. Дапсон прекращает размножение бактерий и замедляет ферментативную реакцию двух дигидрофолатов, ключевых ферментов биосинтеза M. leprae. Рифампицин уничтожает бактерии и блокирует синтез РНК. Загадочное действие оказывает клофазимин — не до конца изученное антибактериальное свойство препарата, скорее всего, блокирует матричные функции ДНК и дает результаты на дапсонрезистентных формах M. leprae.
В 1997 году ВОЗ установила продолжительность курса лечения лепры: от шести месяцев до года. Рецидивы заболевания минимальны, и лепру называют почти побежденной болезнью. Исследование перешло на новый этап: разработку вакцины, которая предупредит развитие болезни или сможет прекращать ее долгий инкубационный период.
Если схема лечения продумана и работает, а количество больных по всему миру не превышает 11 млн человек, то проблема почти решена. Тем не менее, российские лепрозории существуют до сих пор, а количество заражений остается стабильным. Почему это происходит и зачем люди продолжают изучать лепру?
Комбинированная терапия не исключает развития резистентности, а сами пациенты, не всегда переезжающие в лепрозории, могут нарушать курс приема препаратов из-за его длительности и комплексности. Кроме того, нестабильный клофазимин в России не зарегистрирован, поэтому лечение проходит только по схеме олигобацилярнной формы заболевания. Сегодня в Астрахани разрабатываются лекарственные аналоги и новые схемы терапии, менее продолжительные и более эффективные.
Диагностика и профилактика лепры важна еще и потому, что человечество живет в эпоху глобализации. Европейские мигранты приезжают из высокоэндемичных стран Африки и Южной Америки, и единственная гарантия здоровья без специального обследования — отсутствие явных признаков заболевания. В России въезжающие в страну обязаны проходить медицинское освидетельствование, но проработанной методики этой процедуры пока нет. Тем более, можно ли игнорировать болезнь, которая до сих пор уносит жизни в Южной Азии и Африке? Это вопрос этики, который определяет стратегии развитии медицины развитых стран. Лепра для европейца стала кошмаром из прошлого, но пренебрежение заболеванием в настоящем может привести к плачевному повторению эпидемий Средневековья.
Лепра (лат. lepra, болезнь Хансена, хансениаз, проказа, болезнь святого Лазаря, elephantiasis graecorum, lepra arabum, leontiasis, satyriasis, ленивая смерть, чёрная немочь, скорбная болезнь) — хроническая антропонозная инфекционная болезнь из группы микобактериозов с аэрозольным механизмом заражения, при которой происходит первичное поражение производных эктодермы (кожа, периферическая нервная система, слизистые оболочки верхних дыхательных путей, передний отдел глазного яблока).
Коды по МКБ -10
А30. Лепра (болезнь Хансена).
А30.0. Недифференцированная лепра.
А30.1. Туберкулоидная лепра.
А30.2. Пограничная туберкулоидная лепра.
А30.3. Пограничная лепра.
А30.4. Пограничная лепроматозная лепра.
А30.5. Лепроматозная лепра.
А30.8. Другие формы лепры.
А30.9. Лепра неуточнённая.
Этиология (причины) лепры
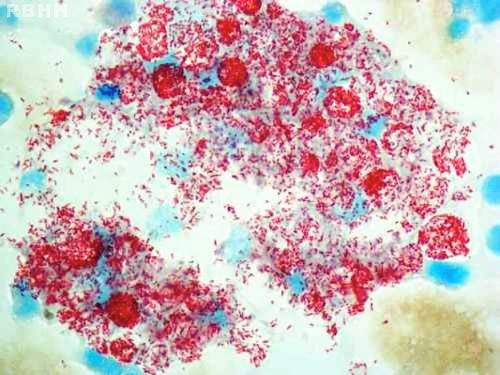
Микобактерии лепры. 1000 × увеличение
Для возбудителя характерен необычайно медленный рост, не свойственный бактериям: время одного деления составляет 12 сут.
Из антигенных детерминант наиболее значим специфический фенольный гликолипид (ФГЛ-1). В его состав входит уникальный трисахарид, на основе которого предпринимаются попытки создать специфический искусственный антиген.
Клеточная стенка микобактерии лепры на 50% состоит из липидов, среди которых преобладают высокомолекулярные миколовые кислоты. Описан также безуглеводный липид (фтиоцерол димикоцерозат), отличающийся от таковых других микобактерий. Установлена способность M. leprae секретировать липиды.
Факторы патогенности M. leprae не изучены.
M. leprae длительно выживают при низких температурах и при хранении, например, в 40% растворе глицерола; сохраняют жизнеспособность в течение нескольких недель при высушивании различными способами в условиях затенения. Прямое ультрафиолетовое облучение действует на них губительно.
Эпидемиология лепры
Единственный доказанный источник инфекции при лепре — больной человек. Большинство специалистов допускают как воздушно-капельный, так и контактный (перкутанный) путь передачи лепры. Данные эпидемиологических исследований свидетельствуют о преобладающем значении воздушно-капельного пути передачи: обычно больной может служить источником инфекции при развитии у него обширных поражений слизистой оболочки носоглотки, т.е. в период массивного выделения возбудителя в окружающую среду респираторным путём. В то же время зарегистрированные случаи заражения при хирургических вмешательствах, а также при татуировке подтверждают, что возможны заражение лепрой и проникновение возбудителя через повреждённую кожу.
Большинство людей относительно невосприимчивы к лепре. Какой-либо расовой предрасположенности или особой резистентности к лепре не существует.
Однако, если учитывать данные иммуногенетики, нельзя отрицать роль факторов генетически обусловленной предрасположенности к лепре внутри отдельных этносов и популяций, о чём свидетельствует в 3–6 раз более частое заражение лепрой кровных родственников, чем супругов друг от друга, поскольку между последними генетические различия более выражены. Известно, что конкордантность по лепре у монозиготных близнецов почти в три раза выше, чем у дизиготных близнецов.
Сезонность и климатические условия имеют некоторое значение в заражении лепрой лишь в отношении усиления миграционных процессов, степени профессиональных контактов с источниками инфекции, снижения неспецифической резистентности, общей гигиены. Основной показатель иммунореактивности к M. leprae — внутрикожная проба на лепромин, предложенная в 1919 г. K. Митсуда.
Лепромин — суспензия растёртой и автоклавированной лепромы больного, содержащая огромное количество M. leprae (1 мл стандартизированного лепромина содержит от 40 до 160 млн бактериальных тел). При введении внутрикожно во внутреннюю поверхность предплечья 0,1 мл этого антигена у больных лепроматозным типом заболевания и у незначительной части (до 10–12%) здоровых лиц проба всегда отрицательная (анергия, толерантность к M. leprae). В то же время у больных с туберкулоидным типом лепры и большинства здоровых людей она положительная, т.е. относительный естественный иммунитет к лепре у них характеризуется довольно высокой напряжённостью. Следовательно, лепроминовая проба диагностического значения не имеет, но помогает установить тип заболевания, а также важна для прогноза. Лепроминоотрицательные лица из числа контактных составляют группу повышенного риска заболевания, а трансформация отрицательной лепроминовой пробы у больного в положительную свидетельствует о нарастании напряжённости специфического клеточного иммунитета к антигенам M. leprae. Реакция на лепромин Митсуда развивается через 3–4 нед после его введения (возникает бугорок, узел, иногда — с некрозом).
Во второй половине ХХ в. больных лепрой регистрировали практически во всех странах мира. В 1980 г. их численность, по оценке ВОЗ, составила около 13 млн человек. Однако после того, как ВОЗ приняла решение обеспечить комбинированную терапию тремя препаратами (дапсон, рифампицин, клофазимин) всех больных и снять с учёта пациентов, прошедших полный курс этого лечения, к 2000 г. число состоящих на учёте уменьшилось до 600–700 тыс. человек. В то же время уже в XXI в. ежегодно регистрируют от 500 тыс. до 800 тыс. новых случаев лепры, всё более насущной становится проблема рецидивов, и, как считают большинство специалистов, проблема элиминации лепры до единичных случаев продлится ещё на десятилетия. В настоящее время наиболее поражены лепрой страны Юго-Восточной Азии (Индия, Индонезия, Мьянма), некоторые страны Африки и Бразилия.
В России лепра никогда не имела широкого распространения. Максимум зарегистрированных больных (около 2500 человек) отмечался в начале 60-х гг.
В начале 2007 г. на учёте состояли 580 человек, а за предыдущие десять лет зарегистрировано всего 14 новых больных.
В отсутствие специфической противолепрозной вакцины для профилактики лепры рекомендуется вакцина БЦЖ, но, по данным разных авторов, она защищает от лепры лишь на 20–70%. В ряде стран, в том числе и в России, проводят химиопрофилактику лепры. Превентивное лечение одним из препаратов сульфонового ряда в течение 6–12 мес назначают лицам, проживающим совместно с больным лепрой (бактериовыделителем).
Патогенез лепры
При туберкулоидном типе лепры чёткие фокусы эпителиоидных клеток окружены лимфоидным бордюром (туберкулоидный бугорок); гранулёма достигает непосредственно эпидермиса; отмечают признаки гиперчувствительности (глубокая эрозия эпидермиса, утолщение и центральный казеоз кожных нервов, фибриноидный некроз в дерме, наличие гигантских клеток Лангханса). Мелкие нервы обычно не определяются, так как они разрушены или сильно инфильтрированы. M. leprae обнаруживают с трудом в виде единичных клеток в ткани утолщённого нерва или они не выявляются.
При недифференцированной форме лепры гранулёма не развивается, а возникает инфильтрат простой воспалительной структуры с большим или меньшим содержанием M. leprae, расположенных внутриклеточно.
Клиническая картина (симптомы) лепры
Для лепры характерны крайне длительный и неопределённый инкубационный период (от нескольких месяцев до 20 лет и более; в среднем 3–7 лет), большое разнообразие клинических симптомов, отсутствие чётких признаков течения.
Современная классификация лепры Ридли–Джоплинга (1966) основана на зависимости клинических симптомов болезни и результатов гистопатологических, бактериоскопических и иммунобиологических исследований от состояния иммунологической реактивности больных к M. leprae. Лепрозный процесс рассматривают как непрерывный спектр иммунопатологических изменений между туберкулоидным и лепроматозным типами лепры, называемыми полярными типами, с выделением трёх пограничных групп: погранично-лепроматозной, пограничной, погранично-туберкулёзной и одной недифференцированной формы.
В качестве продромальных при лепре иногда выступают признаки периферической вегетативной недостаточности и симптомы рефлекторно-сосудистых расстройств (мраморность кожи, цианоз, отёки кистей и стоп, нарушения пото- и салоотделения), а также слабость, ломота, парестезии, кровотечения из носа.
В начале развития манифестных форм заболевания, как правило, отмечают диффузные изменения окраски кожного покрова, одиночные или множественные пятнистые высыпания, варьирующие по локализации, форме, размерам и окраске (эритематозные, гипопигментные, гиперпигментные, синюшные, с буроватым оттенком), усиливающиеся парестезии. В более поздних стадиях болезни возникают ограниченные или разлитые кожные инфильтраты, папулы, бугорки, узлы, ринит и высыпания на слизистых оболочках верхних дыхательных путей, лепрозный пемфигус, выпадение бровей и ресниц (мадароз), амиотрофия, ломкость ногтей, ихтиозиформные признаки, язвы и другие трофические расстройства, грубые нарушения поверхностных видов чувствительности.

Кожные проявления туберкулоидного типа лепры (ТТ-лепры), в зависимости от стадии болезни, имеют вид одиночных или множественных пятен с чёткими краями, а также папулёзных элементов, бляшек, саркоидных и кольцевидных бордюрных элементов с чётко очерченным приподнятым краем.
Характерный признак высыпаний туберкулоидного типа лепры на коже — рано обнаруживаемое уменьшение болевой, температурной и тактильной чувствительности на них, обычно выходящее на 0,5 см за видимые границы поражений, нарушение потоотделения и выпадение пушковых волос. При регрессе высыпаний туберкулоидного типа лепры на их месте остаются гипопигментные пятна, а в случае более глубокой инфильтрации — атрофия кожи.
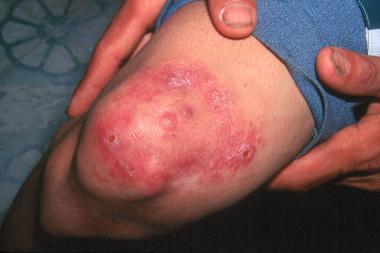
Начальные высыпания при лепроматозном типе лепры (ЛЛ-лепры) чаще всего имеют вид многочисленных эритематозных, эритематозно-пигментных или эритематозно-гипопигментных пятен, характерные признаки которых — небольшие размеры, симметричное расположение и отсутствие чётких границ. Чаще пятна возникают на лице, разгибательных поверхностях кистей и предплечий, голенях и ягодицах. Поверхность их обычно гладкая и блестящая.
Часто уже в ранних стадиях заболевания в области инфильтратов возникают одиночные или множественные бугорки и узлы (лепромы), размеры которых варьируют от просяного зерна до 2–3 см в диаметре. Лепромы резко отграничены от окружающей кожи, безболезненны. Наиболее частым исходом их развития, если не проводится противолепрозное лечение, бывает изъязвление.
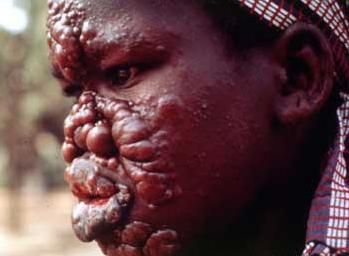
Во всех случаях лепроматозного типа лепры отмечают поражения слизистой оболочки носоглотки. Она выглядит гиперемированной, сочной, испещрена небольшими эрозиями.
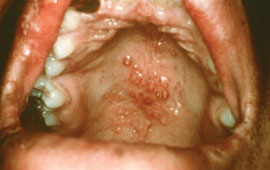

В очень запущенных случаях заболевания может наблюдаться изъязвление лепром на слизистой оболочке нёба. Поражение области голосовых связок может вызвать резкое сужение голосовой щели, афонию. Если генерализация лепроматозного типа лепры наступила до периода полового созревания, то нередко отмечают недоразвитие вторичных половых признаков, у мужчин — гинекомастию. Периферическая нервная система вовлекается в процесс в поздних стадиях развития лепроматозного типа лепры, поэтому в течение длительного времени нарушения кожных видов чувствительности могут отсутствовать.
В клинической картине других разновидностей лепры в различном соотношении выражены признаки обоих полярных типов заболевания (пограничные состояния).
Поражения периферической нервной системы раньше или позже обнаруживаются при всех формах лепры. Особенность лепрозных невритов — их восходящий характер и островковый (рамускулярный) тип расстройства чувствительности, что обусловлено разрушением нервных окончаний в очагах высыпаний, поражением кожных веточек нервов и отдельных нервных стволов. Чаще всего именно поражение периферической нервной системы приводит к инвалидности (отсутствие кожных видов чувствительности, амиотрофия, контрактуры, параличи, нейротрофические язвы, остеомиелит, мутиляции, лагофтальм).

После внедрения в практику эффективных противолепрозных препаратов заболевание перестало фигурировать в качестве причин смерти, а показатели средней продолжительности жизни у больных лепрой превышают таковые в остальной популяции.
Диагностика лепры
Диагностика лепры основывается на выявлении дерматологических и неврологических симптомов болезни и оценке результатов функциональных и лабораторных исследований. Большое значение придают анамнезу, проживанию в эндемической зоне, контакту с больными лепрой. Поскольку у больного человека длительно (годами) отсутствует субъективное ощущение болезни (отсутствие повышенной температуры, боли и зуда в области высыпаний), для своевременного её выявления обязательно осматривать пациента при хорошем освещении. Необходимо провести неврологическое обследование, чтобы обнаружить утолщённые нервные стволы и кожные нервные веточки (особенно в области высыпаний на коже).
Стандарт диагностики лепры включает:
· осмотр всего кожного покрова, а также слизистых оболочек верхних дыхательных путей;
· пальпацию нервных стволов и кожных веточек нервов;
· обследование конечностей для обнаружения амиотрофии и контрактур;
· постановку функциональных проб в очагах кожных поражений (выявление нарушений различных видов чувствительности кожи, проба на потоотделение, проба с никотиновой кислотой и др.);
· бактериоскопическое исследование, позволяющее обнаружить кислотоустойчивые микобактерии в мазках из скарификатов кожи;
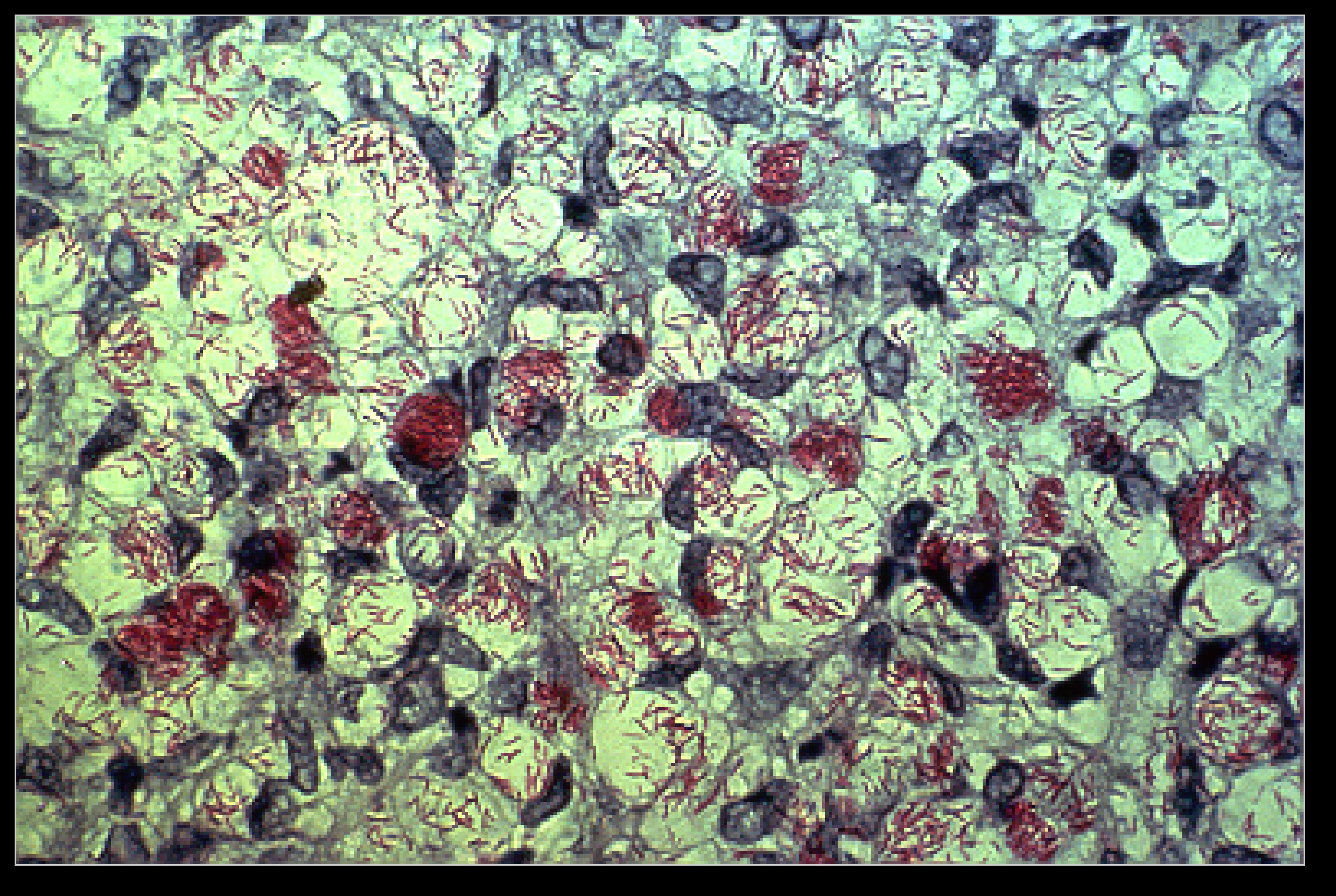
· патогистологическое исследование кожи, взятой из края очага поражения, с окраской по Цилю–Нильсену для выявления M. leprae.
Дифференциальную диагностику проводят со многими заболеваниями кожи и периферической нервной системы: бугорковым сифилидом, сифилитическими гуммами, токсидермией, многоформной экссудативной эритемой, красным плоским лишаём, туберкулёзом кожи, саркоидозом, грибовидным микозом, ретикулёзом, лейшманиозом, узловатой эритемой, трофическими и прободными язвами стоп различной этиологии и др. О туберкулоидном типе лепры свидетельствуют характер высыпаний и нарушение в них поверхностных видов чувствительности (иногда — выявление единичных M. leprae при гистологическом исследовании).
Верифицирующий признак при лепроматозном типе лепры, помимо клинических симптомов, — обнаружение большого количества M. leprae.
Поскольку при лепре, помимо высыпаний на коже, можно обнаружить неврологические и амиотрофические поражения, трофические язвы и остеомиелиты, поражения глаз и органов дыхания, больным показаны консультации дерматолога, невропатолога, хирурга, офтальмолога, оториноларинголога.
Больных с лепроматозным типом лепры, а также пациентов с погранично-лепроматозной и пограничной формами лепры, относящихся к бактериовыделителям (открытые формы), необходимо по эпидемическим показаниям госпитализировать в противолепрозные учреждения. Показано, что после 3–6 мес активного лечения они перестают выделять бактерии в окружающую среду. Госпитализации также подлежат больные с любыми другими формами лепры в стадии обострения процесса (реактивные состояния). Больные с туберкулоидными формами лепры после установления диагноза могут проходить амбулаторное лечение (вопрос об этом и о переводе на диспансерное наблюдение решает комиссия врачей противолепрозного учреждения). Больные должны соблюдать предписанный им индивидуальный эпидемический режим; каких-либо других требований к режиму нет.
Рацион должен быть богат белками, содержать небольшое количество жира.
Лечение лепры
Для лечения бактериовыделителей ВОЗ рекомендует следующую помесячную схему комбинированной терапии. В первый день назначают три препарата: дапсон (100 мг), рифампицин (600 мг) и клофазимин (300 мг), а в последующие дни в течение месяца — по два препарата (100 мг дапсона и 50 мг клофазимина). Затем цикл повторяют (без перерыва). Длительность курса не менее двух лет (до исчезновения M. leprae в биоптатах кожи).
Больным туберкулоидной и погранично-туберкулоидной формой лепры с самого начала назначают по такой же схеме два препарата: в первый день — 100 мг дапсона и 600 мг рифампицина, а затем, в течение месяца, — дапсон по 100 мг.
В России из группы препаратов сульфонового ряда производят димоцифон. В качестве препаратов второго ряда для лечения больных лепрой применяют этионамид и протионамид. Для купирования острых лепрозных реакций назначают глюкокортикоиды, НПВС, анальгетики, витамины, средства, улучшающие нервную проводимость и предупреждающие развитие мышечных атрофий, десенсибилизирующие препараты и иммуномодуляторы. Из дополнительных методов лечения по показаниям применяют физиотерапевтические (лечение невритов) и хирургические (остеомиелиты).
Прогноз
При своевременно поставленном диагнозе прогноз благоприятный. При поздней диагностике и несвоевременно начатом лечении возможны инвалидизирующие последствия. При ранней диагностике и хорошей переносимости комбинированного лечения трудоспособность не страдает.
Диспансеризация
Пациентов, находящихся на диспансерном учёте, не реже двух раз в год должен осматривать врач-лепролог или дерматолог. Периодически по решению противолепрозного учреждения, наблюдающего больного, ему назначают противорецидивные курсы специфического лечения, проводят общеукрепляющие мероприятия. Отдых в бальнеологических санаториях больным, завершившим лечение, противопоказан.
Памятка для пациента
Пациенты, особенно с нарушением кожной чувствительности, должны ежедневно осматривать свои конечности, чтобы своевременно обнаружить травмы и ожоги и провести соответствующее лечение. Они должны регулярно принимать назначаемые им противорецидивные курсы химиотерапии, несмотря на субъективно хорошее самочувствие и отсутствующие признаки активации заболевания.

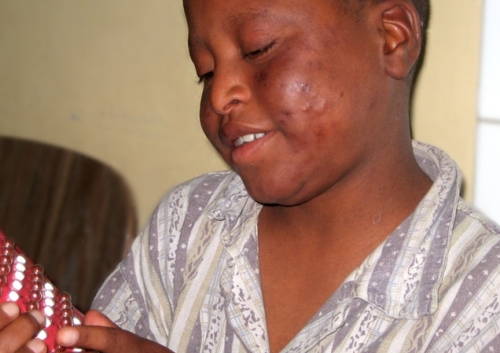
Gudiya из Непала, ему всего 7, болен лепрой, имеет поражения кожи, охватывающие все тело. Проказа все еще не искоренена.
При исследовании мазков по Цилю-Нельсону следует избегать:
- 1. приготовления толстых мазков мокроты;
- 2. фиксации плохо высушенных мазков;
- 3. недостаточной фиксации;
- 4. обжигания препарата при длительной фиксации.
Эта методика должна выполнятся в условиях клинических лабораторий, начиная с уровня поликлиники, входит в поликлинический и клинический минимум обследования пациента, страдающего кашлем с мокротой (трехкратное микроскопическое исследование мокроты на микобактерии туберкулеза). Бактериоскопия мокроты должна проводится и больным хроническими заболеваниями органов дыхания и мочевыводящих путей, а также работникам неблагоприятных по туберкулезу животноводческих хозяйств. При обнаружении в мазке в одном поле зрения пяти и более микобактерии вероятность получения положительного результата посева материала на питательные среды значительно возрастает. Метод микроскопического исследования кислотоустойчивых мазков с окраской по Цилю-Нильсону позволяет быстро получить результаты, но обладает низкой чувствительностью и специфичностью. Частота выявлений микобактерии у больных туберкулезом при микроскопии мокроты составляет по данным разных авторов от 48 до 78%. При этом сравнение данных микроскопических исследований с данными культуральных исследований показывает, что доля ложноположительных результатов составляет до 6%.
Приготовление растворов для метода по Цилю-Нильсону:
Раствор 1. Насыщенный спиртовый раствор фуксина (3%) - растереть в ступке 0,3 г основного фуксина с 2-3 каплями глицерина, добавить по каплям 10 мл 96 ? этилового спирта. Добиться полного растворения фуксина.
Раствор 2. Рабочий раствор фенола (5% водный раствор) - расплавить 5 г кристаллического фенола на водяной бане или в термостате (температура плавления фенола 41 ? С).
Осторожно! При попадании фенола на кожу вызывает ожоги. Растворить расплавленный фенол в 100 мл воды.
Рабочий раствор 3. Рабочий раствор карболового фуксина - в 90 мл полученного раствора фенола (раствор №2) добавить 10 мл насыщенного раствора фуксина (раствор №1).
Раствор 4. Обесцвечивающий раствор серной кислоты (25%) - к 75 мл дистиллированной воды осторожно долить 25 мл концентрированной серной кислоты, постепенно наслаивая ее по стенкам сосуда, смешать. Содержимое нагреется.
Или: обесцвечивающий раствор соляной кислоты (3%) - к 97 мл 96% этилового спирта осторожно добавить 3 мл концентрированной соляной кислоты.
Всегда медленно добавляйте кислоту в спирт, а не наоборот! Смесь может нагреться.
Раствор 5. 0,3% раствор метиленового синего - растворить 0,3 г хлорида метиленового синего в 100 мл дистиллированной воды.
Переходные материалы и реактивы
Предметные стекла; 25х75 мм; 1,1-1,3 мм толщиной (на 1 год).
Восковые карандаши или алмазные ручки или несмываемые водой фломастеры.
Фильтровальная бумага, фильтры диаметром 15 см №1.
Салфетки для линз.
Шариковая ручка черная или синяя.
Шариковая ручка красная.
Петля бактериологическая, нихромовая, 1 мм диаметром.
Фуксин основной, х.4.
Спирт этиловый 96%, х.4 (для приготовления спиртового фуксина).
Фенол кристаллический, х.4.
Метиленовый синий, х.4.
Реактивы для обесцвечивания:
- - серная кислота, 96% х.4, или
- - солянокислый спирт 3%
- - соляная кислота, концентрированная, х.4
- - спирт этиловый, 96%, х.4
Спирт этиловый технический.
Учет результатов микроскопического исследования
Количество КУМ являет очень важным информационным показателем, так как оно характеризует степень эпидемиологической опасности больного и тяжесть заболевания. Поэтому микроскопическое исследования должно быть не только качественным, но и количественным. При использовании объектива 90х или 100х окуляра 7х10 (общее увеличение равно 630х 1000х) используется следующая градация результатов световой иммерсионной микроскопии.
Градация результатов микроскопического исследования
Читайте также:


