Микробиологическая диагностика дифтерии коклюша
Коклюш относят к инфекциям с весьма длительным течением, что делает возможным применение двух основных (бактериологический, серологический) и одного вспомогательного (микроскопический) методов диагностики.
I. МИКРОСКОПИЧЕСКИЙ МЕТОД
Микроскопический метод является вспомогательным вариантом диагностики, так как коклюшные бактерии не имеют четких морфотинкториальиых особенностей.
Диагностическое значение имеет лишь 1 фаза существования коклюшных бактерий, соответствующих S - форме. В таком варианте патогенные штаммы возбудителя коклюша выделяются из организма. Это грамотрицательные, мелкие однородные, овоидной формы палочки без спор, но с нежными капсулами. При переходе во II и III фазы появляются полиморфные длинные или, наоборот, кокковидные бактерии. Для отличия названных стадий развития коклюшных палочек микроскопический метод незаменим.
II. БАКТЕРИОЛОГИЧЕСКИЙ МЕТОД
Выделение чистой культуры возбудителя является самым ранним и достоверным способом диагностики коклюша. Материалом для исследования служат мокрота, слизь и смывы из носоглотки больного, выделяемые цри кашле или искусственно собранные стерильными носоглоточными тампонами.
Возбудитель коклюша очень требователен к питательным средам. Поэтому для его выделения используются элективные среды: казеиново-угольный агар (КУА), Борде-Жангу и молочно-кровяной агар Осиповой.
КАЗЕИНОВО-УГОЛЬНЫЙ АГАР ИЛИ СРЕДУ КУА готовят из сухого субстрата, выпускаемого ИЭМ имени Н. Ф. Гaмалей. Перед употреблением 4-5 г сухого порошка растворяют в 100 мл дистиллированной воды, стерилизуют в автоклаве 30 минут при +110 °C и, соблюдая стерильность, разливают в чашки Петри или пробирки. Готовые среды можно хранить при +4, +10 °C до двух недель.
Колонии коклюшных бактерий на среде КУА появляются на 3-4 день. Они мелкие, выпуклые, блестящие, гладкие, серовато-кремовые. Колонии паракоклюшных бактерий такие же, но более крупные и дают коричневое окрашивание среды.
СРЕДА БОРДЕ-ЖАНГУ. 500 г мелко нарезанного очищенного картофеля заливают 1 л дистиллированной воды с 40 мл глицерина, варят до размягчения, а затем доводят дистиллированной водой до исходного объема, фильтруют через 2-3 слоя марли и дают отстояться до просветления. К 500 мл прозрачного картофельно-глицеринового экстракта добавляют 1,5 л солевого раствора, содержащего следующий комплекс солей: К2НРО4- 2,25 г; MgS04-0,075 г; КН2Р04 -0,75 г; NaCl-7,5 г; КС1 -1,50 г. После этого прибавляют 60 г агар-агара (3%), кипятят на огне с асбестовой сеткой до растворения, устанавливают pH = 7,1-7,2, фильтруют и, разлив в соответствующую посуду, стерилизуют 30 минут при +110 °C или 25 минут при +120 °C. Это основа среды. Она может храниться очень долго.
Перед употреблением среду растапливают, охлаждают до 4-45 °C и добавляют 15-20% стерильной дефебринированной крови (барана, кролика, человека, лошади).
Готовая среда светло-вишневого цвета (без пузырьков воздуха). Для подавления посторонней микрофлоры добавляют 0,25-0,50 единиц пенициллина на 1 мл среды (1 ед. тормозит развитие коклюшных бактерий).
Колонии коклюшных бактерий на этой среде гладкие, блестящие, прозрачные, куполообразные с жемчужным или ртутным оттенком, окруженные зоной гемолиза. Колонии паракоклюшных бактерий крупные с коричневым окрашиванием среды и зоной гемолиза.
МОЛОЧНО-КРОВЯНОЙ АГАР ОСИПОВОЙ. 5% МПА расплавляют на водяной бане, добавляют 1% поваренной соли и смешивают с таким же количеством обезжиренного подогретого молока. Стерилизуют в автоклаве при 0,5 атм. 40 минут. Горячую смесь отфильтровывают от свернувшегося молока, разливают по флаконам и автоклавируют при 0,5 атм. 20 минут. К остуженному до +45°, +50 °C агару добавляют 20% дефибринированной крови барана и пенициллин из того же расчета, что и в среде Борде-Жангу.
При выделении чистой культуры возбудителя следует учитывать большую требовательность к питательным средам, сравнительно медленное развитие колоний, отсутствие потемнения среды вокруг колоний, относительную биохимическую инертность, морфологическую однородность и способность агглютинироваться специфической противококлюшной сывороткой первой фазы.
При выделении чистой культуры коклюшных бактерий очень важно отдифференцировать их от часто встречающихся гемоглобинофильных бактерий паракоклюша и септического бронхита.
Антигенная дифференциация коклюшных и паракоклюшных бактерий должна проводиться с учетом общности и различий в их антигенном составе. При отсутствии необходимых монорецепторных сывороток отличием могут служить прочие, в частности культурально-биохимические признаки.

| Свойство бактерий коклюша и их отличие от палочек паракоклюша | ||
| Свойства | Бактерии коклюша | Бактерии паракоклюша |
| Морфология | мелкие, коккобактерии | крупные палочки |
| Капсулы | есть, нежные | нет |
| Рост на простом МПА | - | + |
| Энергия роста | слабая, колонии видны на 3-4 день | средняя, колонии видны на 2-3 день |
| Образование коричневого пигмента на казеиновоугольном агаре (КУА) | - | + |
| Рост МПА с 0,1% тирозина | - | + |
| Гемолиз на кровяном МПА | + четкий | + слабый |
| Рост на пептонной воде, | - | + |
| с гематином | + | - |
| с дрожжами (экстракт) | + | - |
| Ферментация углеводов: | ||
| глюкозы | - | + |
| галактозы | - | + |
| левулезы | - | + |
| Разложение мочевины | - | + |
| Щелочение лакмусового молока | на 10-14 день | в первые 1-4 дня |
| Специфические видовые антигены | 1 | 14 |
| Типовые антигены | 2, 3, 4, 5, 6, 13 | 8, 9, 10 |
Отношение к мочевине выясняется пробой Закса, широко используемой при дифтерии.
Основные различия между коклюшными палочками и бактериями септического бронхита приведены ниже.
| Микробы | Признаки | |
| Рост на МПА | Наличие уреазы | |
| Коклюшные бактерии | не растут | - |
| Бактерии септического бронхита | растут без изменения цвета среды | + |
СЕРОЛОГИЧЕСКИЙ МЕТОД ДИАГНОСТИКИ КОКЛЮША
Начиная с 3-4 недели заболевания в крови больных начинают появляться антитела, которые можно обнаружить серологическим методом c помощью реакции агглютинации и реакции связывания комплемента по Борде-Жангу.
РЕАКЦИЯ АГГЛЮТИНАЦИИ. Для выполнения реакции берут кровь больного в количестве 0,8-1 мл (из пальца или пятки ребенка), помещают на 10-15 минут в термостат, а после этого - в холодильник для уплотнения и отделения сгустка. Затем проводят центрифугирование, сьшоротку отсасывают и разводят физиологическим раствором от 1:5 до 1:2500. В качестве антигена используется изготовленный производственным способом диагностикум. Схема постановки реакции следующая.
| Ингредиенты | Пробирки | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| контроль антигена | контроль сыворотки | |||||||||
| Физ. раствор | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | |
| Сыворотка больного в разведении 1:5 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | - | 0,25 |
| Разведение | 1:10 | 1:20 | 1:40 | 1:80 | 1:160 | 1:320 | 1:640 | 1:1280 | 1:5 | |
| Диагностикум в каплях | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | - |
Пробирки с разведенной сывороткой и добавленным в них диагностикумом помещают на 2 часа в термостат при 37 °C, а затем на сутки оставляют при комнатной температуре.
Агглютинация носит мелкозернистый характер. Поэтому учет ее производят с помощью агглютиноскопа.
Реакция считается положительной при четкой агглютинации с интенсивностью на ++ + + и + + +. Диагностическим является титр 1:40. Результаты серологических реакций имеют диагностическое значение только при изучении их в динамике, в связи с чем они повторяются не менее двух раз в течение болезни с интервалами 5-7 дней.
РСК ПО БОРДЕ-ЖАНГУ. Реакцию ставят по общепринятой методике. Особенностью ее является: длительное связывание (18-24 часа на холоду при +4 °C); в качестве диагностикума берется свежеприготовленная 1 млрд. взвесь 2-дневной культуры палочек коклюша, выращенных на 20% картофельно-глицериновом агаре и смытых физиологическим раствором. Омыв бактерий центрифугируют до полного просветления, осадок эмульгируют в дистиллированной воде для растворения случайно смытых со среды эритроцитов. После повторного центрифугирования готовят 1 млрд. суспензию культуры, инактивируют при +56 °C 1 час и подвергают титрованию.
Антиген титруют в присутствии комплемента.
| Схема титрования антигена коклюшных бактерий | ||||||||
| Ингредиенты в мл | Номера пробирок и их содержимое в мл | Контроль | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | антигенная гемотоксичность | комплемента | |
| Антиген | 0,05 | 0,1 | 0,12 | 0,15 | 0,2 | 0,25 | 0,25 | - |
| Комплемент в рабочей дозе | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | - | 0,25 |
| Физиологический раствор | 0,45 | 0,40 | 0,38 | 0,35 | 0,30 | 0,25 | 0,50 | 0,50 |
| Встряхнуть, в термостат на 35-40 минут при +37 °C. Затем добавить гемолитическую систему. | ||||||||
| Гемолитическая система | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| Учет результатов | гемолиз | гемолиз | гемолиз | гемолиз | - | - | - | гемолиз |
Титром антигена считают то его максимальное количество, при котором еще возможен гемолиз (в данном примере - 0,15 мл). Рабочая доза должна быть на 20% ниже (0,12 мл).
После этого антиген используют для постановки РСК.
Рекомендуемая литература:
- Дяченко С. С. Микробиологические методы диагностики инфекционных заболеваний. 1962; стр. 238-244.
- Земсков М. В., Степанов И. И. Медицинская микробиология. Пособие для студентов медицинских институтов, 1962, стр. 182-185.
- Руководство по микробиологии, клинике и эпидемиологии инфекционных болезней, 1964, т. VI, разд. VI, стр. 349-374.
- Руководство по микробиологической диагностике инфекционных заболеваний, под ред. проф. К. И. Матвеева и М. И. Соколова, 1964, стр. 438-449, 493, 497.
- Сборник официальных материалов по лабораторному делу. Книга первая, 1961, стр. 338-343.
- Ашмарин И. И. Практическая медицинская микробиология, 1966, изд. "Медицина", Уз. ССР, стр. 157.
Источник: Мотавкина Н.С., Пьянова Р.Е. Микробиологическая диагностика некоторых капельных инфекций и токсоплазмоза. Методическая разработка для студентов. ВГМУ, 1973
Вопросы для самоподготовки:
Возбудитель туберкулеза, его основные свойства, патогенез, лечение и профилактика туберкулеза. Методы микробиологической диагностики туберкулеза.
Возбудители дифтерии, их свойства, отличия от дифтероидов и ложнодифтерийных бактерий. Патогенез, лечение, профилактика и микробиологическая диагностика дифтерии.
Возбудители коклюша, их свойства. Патогенез, лечение, профилактика и микробиологическая диагностика коклюша.
Теоретический материал для самоподготовки
Вопрос 1. Микобактерии туберкулеза
Туберкулез – первично хроническое заболевание человека и животных, сопровождающееся поражением различных органов и систем (органов дыхания, лимфатических узлов, кишечника, костей, суставов, глаз, кожи, почек и мочевыводящих путей, половых органов, ЦНС).
Возбудители туберкулеза относятся к семейству Mycobacteriaceae, роду – Mycobacterium. Заболевание вызывается 3 видами:
M. tuberculosis – человеческий вид (в 92% случаев),
M. вovis – бычий вид (в 5% случаев),
M. аfricanum – промежуточный вид (в 3% случаев).
Морфологические и культуральные свойства.
- прямые или изогнутые палочки,
- грамположительны (но из-за большого содержания липидов в клеточной стенке плохо воспринимают красители),
- чаще применяют окраску по Цилю–Нильсену, при этом микобактерии обнаруживаются в препаратах в виде ярко-красных кислотоустойчивых палочек, расположенных поодиночке или небольшими скоплениями.
- спор не образуют,
- в состав клеточной стенки входят миколовая, фтионовая, туберкулостеариновая и другие жирные кислоты.
Родовой признак микобактерий – кислото-, спирто- и щелочеустойчивость.

Рис.Туберкулезные палочки в чистой культуре (рисунок)

Рис. Мазок из чистой культуры M. вovis Рис. M.tuberculosis в мазке
(окраска по Цилю-Нильсену) из мокроты (окраска по Цилю-Нельсену)
Растут на сложных питательных средах, содержащих яйца, глицерин, картофель, аспарагин, витамины, соли. Для подавления токсического действия образуемых в процессе метаболизма жирных кислот к средам добавляют активированный уголь или сыворотки животных, для подавления роста сопутствующей микрофлоры – красители (малахитовый зеленый) и антибиотики, не действующие на микобактерии. Элективной средой является среда Левенштейна–Йенсена.

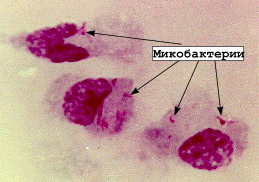
Рис. Корд-фактор M.tuberculosis: палочки, Рис. Незавершенный фагоцитоз микобактерий
расположены в виде "косы", жгутов (окраска по Цилю-Нильсену)
В отличие от условно-патогенных микобактерий, M. tuberculosis и M. bovis в большом количестве образуют никотиновую кислоту (ниацин), которая накапливается в жидкой питательной среде.
В отличие от M. bovis, M. tuberculosis обладают способностью редуцировать нитраты в нитриты.
К факторам патогенности микобактерий относятся компоненты клеточной стенки бактерий: туберкулопротеины, липиды и их комплексы.
- Туберкулопротеины являются основными носителями антигенных свойств микобактерий, они – высокотоксичны и вызывают развитие гиперчувствительности 4-го типа.
- Липиды (миколовая и фтионовая кислоты, корд-фактор) вызывают развитие гранулем, подавляют активность фагоцитарных клеток.
- Корд-фактор – это гликолипид, состоящий из трегалозы и димиколата. Он разрушает митохондрии клеток инфицированного организма, чем нарушает функцию дыхания.
Экзотоксины микобактерии не образуют.
Устойчивость в окружающей среде.
В естественных условиях при отсутствии солнечного света жизнеспособность микобактерий сохраняется в течение нескольких месяцев, при рассеянном свете – погибают через 1-1,5 мес.
В уличной грязи они сохраняются до 4 мес., в речной воде – до 7 мес., в сточной воде – до 15 мес., в навозе – до 2-х лет.
При кипячении они погибают через 5 мин, при пастеризации – в течение 30 мин, под воздействием ультрафиолетовых лучей – через 2-3 мин.
Возбудители туберкулеза устойчивы к действию дезинфицирующих веществ. Для дезинфекции используются активированные растворы хлорамина и хлорной извести, вызывающие гибель бактерий в течение 3-5 ч.
1.Основной - больной туберкулезом органов дыхания человек, выделяющий микробы в окружающую среду с мокротой.
2. Второстепенную роль играют больные сельскохозяйственные животные (крупный рогатый скот, верблюды, свиньи, козы, овцы) и люди, страдающие внелегочными формами туберкулеза (пищеварительного тракта или урогенитальной системы) и выделяющие микробактерии с мочой и калом.
Основной механизм заражения – аэрогенный с соответствующими ему воздушно-капельным и воздушно-пылевым путями передачи инфекции. Входными воротами при этом могут быть слизистая оболочка полости рта, миндалин, бронхи и легкие.
Реже заражение туберкулезом может происходить пищевым путем при употреблении термически не обработанных мясных или молочных продуктов, что особенно характерно для заболеваний, вызванных M. bovis, чаще поражающих детей.
Возможен контактный путь передачи инфекции от больных туберкулезом через поврежденные кожные покровы и слизистые оболочки при использовании инфицированной одежды больных, игрушек, книг, посуды. Известны случаи заражения людей при уходе за больными животными. Описаны редкие случаи заражения хирургов, паталогоанатомов, мясников.
Возможен и трансплацентарный путь передачи, но он, как правило, не реализуется вследствие тромбоза кровеносных сосудов плаценты в местах поражения. Внутриутробное заражение плода может происходить не только через пупочную вену и плаценту, но и при заглатывании амниотической жидкости, содержащей микобактерии.
Организм человека обладает высокой устойчивостью к действию патогенных микобактерий, поэтому большое значение для возникновения заболевания имеют длительность контакта с источником инфекции, массивность инфицирования, вирулентность микобактерий и снижение резистентности макроорганизма.
Инкубационный период длится от 3-8 недель до 1 года и более (40 лет). Возбудитель в течение длительного времени сохраняется в фагоцитирующих клетках региональных лимфатических узлов.
В развитии заболевания выделяют первичный туберкулез, диссеминированный и вторичный.
Первичный туберкулез возникает у ранее неинфицированных людей и характеризуется выраженными токсикоаллергическими осложнениями и некротическими изменениями в тканях, возникающими на фоне высокой чувствительности макроорганизма к возбудителям туберкулеза. Для него характерна гематогенная диссеминация.
В зоне проникновения и размножения бактерий возникает специфический воспалительный очаг – инфекционная гранулема. Затем развивается специфический воспалительный процесс в региональных лимфатических узлах и наблюдается сенсибилизация организма - формируется первичный туберкулезный комплекс. Обычно первичный очаг имеет доброкачественное течение, он рассасывается, пораженный участок кальцинируется и рубцуется. Но бактерии полностью не уничтожаются. В первичном очаге и лимфатических узлах они могут сохраняться долгие годы и при неблагоприятных условиях может произойти активация возбудителя и генерализация процесса.
Из первичного туберкулезного комплекса микобактерии разносятся:
в результате чего образуются очаги в других органах и тканях и возникает диссеминированный легочный или внелегочный туберкулез.
Вторичный туберкулез возникает у ранее инфицированных людей, процесс, чаще всего, локализуется в каком-либо органе. Возникновение вторичного туберкулеза – результат активации старых эндогенных очагов или нового экзогенного заражения возбудителями туберкулеза (суперинфекция) вследствие тесного контакта с бактериовыделителем.
Различают 3 клинические формы заболевания: первичная туберкулезная интоксикация у детей и подростков, туберкулез органов дыхания, туберкулез других органов и систем.
Чаще всего возникает туберкулез органов дыхания (легких и внутригрудных лимфатических узлов). Он проявляется субфебрильной температурой тела, кашлем с мокротой, кровохарканьем, одышкой. Симптомов, характерных только для туберкулеза, нет.
В отличие от M. tuberculosis, M. bovis чаще поражает детей и вызывает такие внелегочные формы заболевания, как туберкулез периферических лимфатических узлов и мочеполовых органов, туберкулез костей и суставов, сопровождающиеся лекарственной устойчивостью к изониазиду.
Иммунитет нестерильный, что обусловлено длительной персистенцией L-форм бактерий в макроорганизме. Он появляется через 4-8 недель после попадания микробов в макроорганизм.
Материалом для исследования служит мокрота.
Обязательными методами микробиологической диагностики туберкулеза являются бактериоскопическое и бактериологические исследования, биопроба и туберкулинодиагностика. Обнаружение в патологическом материале возбудителей является прямым доказательством активности инфекционного процесса.
Бактериоскопическое исследование. Из материала готовят мазки, окрашивают по Цилю–Нильсену и микроскопируют. В препаратах обнаруживают единичные или слипшиеся по 2-3 красные палочки, если в 1 мл мокроты их содержится не менее 10 4 -10 5 бактериальных клеток (предел метода). При получении отрицательных результатов прибегают к методам обогащения материала: гомогенизации и флотации.
Метод гомогенизации: к суточной порции мокроты добавляют равный объем 1% раствора едкого натра, флакон закрывают пробкой и встряхивают 10-15 мин, центрифугируют, нейтрализуют кислотой и из осадка готовят мазок.
Чаще применяют метод флотации: мокроту гомогенизируют и прогревают при 55 0 С 30 мин на водяной бане. Затем добавляют 1-2 мл ксилола, дистиллированную воду и повторно встряхивают в течение 10 мин. Оставляют стоять 25-30 мин при комнатной температуре. На поверхности образуется пена, состоящая из всплывших капелек ксилола с адсорбированными бактериями. Мазок готовят из пенообразного слоя, несколько раз наслаивая материал на стекло. Метод флотации на 10% повышает обнаружение микобактерий в патологическом материале.
Широкое распространение получил высокочувствительный метод люминесцентной микроскопии, основанный на способности липидов микобактерий воспринимать люминесцентные красители и светиться при облучении ультрафиолетовыми лучами.
Бактериологическое исследование является основным методом диагностики туберкулеза Исследуемый материал перед посевом в течение нескольких минут подвергают действию 10% серной кислоты или 4-6% едкого натра для освобождения от сопутствующей микрофлоры, затем тщательно встряхивают и центрифугируют. Осадок нейтрализуют и засевают в несколько пробирок со средой Левенштейна–Йенсена. Посевы инкубируют при 37 0 С 4-6 нед и более, просматривая посевы 1 раз в неделю. Выделенную культуру микобактерий туберкулеза дифференцируют от условно-патогенных микобактерий по морфологическим, тинкториальным, биохимическим свойствам и др.
Из биохимических свойств чаще всего определяют способность исследуемой культуры синтезировать никотиновую кислоту (ниациновая проба). Для определения ниацина к культуре микобактерий в жидкой питательной среде добавляют 1 мл КСN и 1 мл 5% раствора хлорамина. При наличии ниацина через несколько минут появляется ярко-желтая окраска. После учета результатов для нейтрализации КСN в пробирки добавляют 3-5 мл 10% гидрокарбоната натрия.
2.А. Для ускорения диагностики используют метод микрокультур Прайса. На нескольких предметных стеклах делают толстые мазки из исследуемого материала, высушивают, обрабатывают несколько минут 2-6% серной кислотой и нейтрализуют. Затем стекла опускают во флаконы с гемолизированной цитратной кровью в разведении 1/4-1/8 и ставят в термостат. Через 4-14 дней извлекают стекла, фиксируют препарат, окрашивают по Цилю–Нильсену и микроскопируют. Вирулентные штаммы образуют микрокультуры, имеющие вид кос или жгутов.
2.Б. Определение лекарственной устойчивости микобактерий проводят перед началом лечения, спустя 3 мес. и далее при продолжающемся выделении бактерий туберкулеза через каждые 6 мес. методом серийных разведений.
С этой целью по 0,1 мл взвеси микобактерий засевают в пробирки со средой Левенштейна–Йенсена, содержащей различные концентрации антибактериальных препаратов: 5, 10, 50 мкг/мл стрептомицина, 1, 5, 10, 25 мкг/мл тубазида и т.п. Результаты исследования учитывают по истечении определенного срока выращивания, достаточного для получения обильного роста в контрольных пробирках.
Устойчивость штамма выражается максимальной концентрацией антибактериального препарата (количество микрограммов в 1 мл питательной среды), при которой еще наблюдается рост, приближающийся к росту в контроле.
Биологический метод является наиболее надежным при выявлении микобактерий туберкулеза, он позволяет обнаружить от 1 до 5 микробных клеток в исследуемом материале. Исследуемый материал обрабатывают серной кислотой для освобождения от посторонней микрофлоры, нейтрализуют и вводят подкожно по 2-3 мл морской свинке и кролику с отрицательными туберкулиновыми реакциями. Через 4 мес., если животное не погибнет, его забивают и проводят микроскопическое исследование его органов. M. tuberculosis – высокопатогенны для морских свинок и малопатогенны для кроликов, M. bovis –высокопатогенны для кроликов.
4.Туберкулодиагностика – это ведущий метод диагностики туберкулеза у детей и подростков, основан на определении повышенной чувствительности макроорганизма к туберкулину, наступившей в результате заражения возбудителями туберкулеза или вакцинации ВСG, с помощью кожно-аллергических проб. Туберкулин – это белковые фракции – протеины, выделенные из бульонной культуры микобактерий путем добавления химических веществ, осаждающих белок, с последующей очисткой и лиофилизацией. Туберкулин вводят внутрикожно в строго определенной дозировке – проба Манту. Результаты оценивают через 48-72 ч. Реакция считается положительной при наличии выраженного инфильтрата (папулы) диаметром 5 мм и более.
5. Для экспресс-диагностики применяют реакцию иммунофлюоресценции (РИФ) с использованием видоспецифических моноклональных антител, иммуноферментный анализ (ИФА) и полимеразно-цепную реакцию (ПЦР). Эти методы направлены на обнаружение как антигенов возбудителей туберкулеза, так и антител к ним.
Препараты для лечения.
Международный союз борьбы с туберкулезом в связи с распространением в настоящее время множественно-резистентных штаммов предложил все противотуберкулезные препараты по степени их эффективности разделить на 3 группы:
группа А – наиболее эффективные – изониазид, рифампицин и их производные;
группа В – препараты средней эффективности – стрептомицин, канамицин, этионамид (пропионамид), этамбутол, пиразинамид, флоримицин, циклосерин, производные фторхинолонов; группа С – препараты малой эффективности – ПАСК, тибон (тиоацетозон).
В России препараты группы С в последнее время не применяются, а также получены препараты, превосходящие рифампицин по лечебным свойствам: рифапентин, рифабутин и комбинированные препараты: рифатер, рифанг.
Период лечения состоит из 2 этапов. Цель первого - подавить репликацию активно размножающейся бактериальной популяции, располагающейся в основном внеклеточно, добиться снижения ее численности. Цель второго этапа – долечивание в результате воздействия на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий.
Большинство больных перестают быть источником инфекции в течение 2 недель с начала соответстующей противотуберкулезной терапии.
Препараты для специфической профилактики.
Для специфической профилактики используют живую вакцину БЦЖ – BCG, полученную путем длительного культивирования M. bovis на картофельно-глицериновом агаре с добавлением бычьей желчи. Вакцинацию проводят новорожденным на 2-5 день в роддоме внутрикожно с последующей ревакцинацией согласно календарю прививок. Ревакцинацию проводят лицам с отрицательной туберкулиновой пробой с интервалом 5-7 лет до 30-летнего возраста.
Читайте также:


