Полиорганной недостаточности и септического шока в
При всех вариантах шоковых состояний, за исключением ней-рогенного шока, нарушается нормальная деятельность практически всех органов. В современной литературе это явление принято именовать полиорганной недостаточностью. Возможно, более правильно и точно говорить о тотальной дисфункции органов при шоке, поскольку в ряде случаев на определенных, этапах развития шока приходится наблюдать не только недостаточность, но и гиперфункцию органов (например, при гипердинамической фазе септического шока). Непосредственными обстоятельствами (и условиями), определяющими выраженность наблюдаемой полиорганной дисфункции, являются различная способность органов противостоять гипоксии и снижению кровотока, характер шокового фактора (гиповолемический, кардиогенный или септический) и исходное функциональное состояние самого органа.
Таким образом, дисфункция органа при шоке определяется его физиологическим резервом и исходной способностью противостоять метаболическим расстройствам [Гологорский В. А. и др., 1988]. Если больной страдал каким-либо заболеванием в исходном (дошоковом) периоде жизни, то способность его противостоять разрушающим эффектам низкого кровотока и развивающейся в связи с этим гипоксии чрезвычайно мала.
Почки являются органами, весьма чувствительными к снижению объемного кровотока. Вместе с тем они обеспечивают один из основных компенсаторных резервов при шоке, поскольку могут задерживать воду и Na+. Основной механизм, реализующий этот компенсаторный эффект, связан с деятельностью ренин-ангиотензиновой системы и освобождением АДГ из гипофиза. При выраженном шоке кровоток в организме перераспределяется таким образом, что основная его масса минует почки и попадает главным образом в такие органы, как сердце и мозг. Почки переживают при этом ишемический инсульт. Сепсис или другие нефротоксические факторы могут усиливать влияние подобного инсульта.
Клинически почечная недостаточность может быть олигурической или неолигурической. Точные механизмы подобных различий в проявлениях шоковой почечной недостаточности пока неизвестны. Однако есть основания считать, что при варианте олигурической почечной недостаточности сниженная перфузия почек и гипоксия повреждают гломерулярную функцию. Замедление гломерулярной фильтрации приводит к снижению продукции мочи. При неолигурической почечной недостаточности первичного поражения гломерулярного аппарата не происходит. В связи с меньшей выраженностью ишемического инсульта почек остается также мало поврежденным канальцевый аппарат. Общий прогноз в подобных случаях, разумеется, более благоприятный.
Печень имеет высокий уровень метаболической активности и играет важную роль в синтезе белков, различных биологически активных соединений и в процессах очищения организма. В нормальных условиях печеночный кровоток составляет 25—30% сердечного выброса. Следовательно, печень находится в большой зависимости от объемного кровотока в организме. Кровь попадает в печень по системе печеночной артерии (системное кровообращение) и по системе воротной вены (спланх-ническое кровообращение). При гиповолемии начинает действовать механизм аутоперфузии печени, который проявляется открытием прямых внутрипеченочных шунтов через печеночные синусоиды. При выраженном шоке кровоток по воротной системе может существенно снижаться (до 40—50% должного). В результате уменьшается кровоток в ретикулоэндотелиальной системе печени — снижается перфузия звездчатых ретикулоэндотелиоцитов (купферовских клеток) [Дадкевич М.М. и др., 1988]. Фильтрация печенью естественного плазменного детрита и бактерий в связи с этим нарушается и часть токсического материала попадает непосредственно в легкие, где и задерживается, вызывая повреждение самих легких.
Хотя морфологические последствия шока достаточно отчетливы, никаких клинических проявлений непосредственного повреждения функции печени при шоке (особенно геморрагическом) выявить не удается. Иногда отмечается умеренное повышение уровня билирубина в плазме крови. Изменений ферментной активности, как правило, не бывает. Иногда наблюдается снижение синтетической функции, которое выражается преимущественно в снижении уровня протромбина в крови.
У больных, находящихся в септическом шоке, особенно если шок продолжителен, изменения печеночной функции более значительны. Они могут выражаться прежде всего существенным повышением уровня билирубина в крови, который может достигать 250—350 мкмоль/л. Гистологически у больных, погибших от септического шока, выявляется выраженная жировая инфильтрация печени.
Легкие, по-видимому, являются наиболее уязвимым органом при шоке. С другой стороны, они определяют состояние оксигенации и, следовательно, возможность выживания больного при шоке, поскольку с клинических позиций основным выражением шока является как раз гипоксия. Во многих случаях именно от состояния легочной функции в периоде шока зависят судьба больного и исход болезни [Багдатьев В. Е., 1988].
Легкие являются естественным фильтром для находящихся в плазме при шоке различного происхождения токсического детрита, клеточных агрегатов, липидов, жировых нерастворимых субстанций, микроскопических осколков костей, взвешенной целлюлозы и синтетических субстанций, попадающих в кровяное русло при инфузионной терапии, а также для агрегатов эритроцитов при гемотрансфузии. Все эти субстанции, осаждаясь в легочных капиллярах, частично или полностью закупоривают их и вызывают в окружающей легочной ткани воспалительную инфильтрацию, которая сопровождается повышением капиллярной проницаемости. Развивающийся на этой основе интерстициальный легочный отек ухудшает проницаемость альвеолярно-капиллярной мембраны для О2 и СО2. Эти процессы дополняются активацией комплемента и других вазоактивных субстанций, источником которых являются преимущественно полиморфноядерные лейкоциты.
Наиболее отчетливо указанные процессы проявляются при септическом шоке. У больных, находящихся в состоянии гиповолемического шока, относительно редко приходится наблюдать классическую картину увеличения содержания воды в легких, приводящую к существенному ухудшению оксигенации. Однако при затянувшейся гиповолемии и интенсивной инфузионной и гемотрансфузионной терапии выраженный интерстициальный отек легких — явление весьма обычное.
Развившееся в ходе шокового состояния внутрисосудистое свертывание (ДВС-синдром), как правило, проявляется существенным ухудшением легочной функции. Возникающее при этом внутрилегочное шунтирование, обусловливающее тяжелую гипоксию, у отдельных больных составляет 50—60% СВ. Подобные изменения наиболее характерны для септического шока. В подобных случаях показания к ИВЛ определяются следующим комплексом патологических сдвигов: 1) частотой дыхания 30 мин —1 и больше; 2) Рась ниже 60 мм рт. ст. при дыхании 40% О2; 3) Рсо2 выше 45 мм рт. ст. при наличии метаболического ацидоза или выше 50 мм рт. ст. при нормальном BE; 4) дыхательным объемом легких меньше 5 мл/кг; 5) жизненной емкостью легких меньше 10 мл/кг; 6) MOB меньше 8 л/мин; 7) затрудненным дыханием.
Точные механизмы повреждения легочного аппарата при шоке остается еще не до конца ясными и напряженно изучаются. Есть основания подозревать, что, помимо упомянутых факторов, в развитии шокового легкого принимают участие лизосомные ферменты, освобождающиеся из лейкоцитов, образование перекисных анионов в ишемизированных тканях, освобождение кальцийзависимых циклических нуклеотидов и простаноидов.
Поджелудочная железа и желудочно-кишечный тракт также являются органами, испытывающими существенные повреждения при шоке, поскольку имеют высокую метаболическую активность. В условиях сепсиса и при гиповолемическом состоянии увеличивается продукция инсулина и глюкагона поджелудочной железой. По своей сути эти гормональные ответы являются протективными, поскольку готовят организм к повышенным метаболическим требованиям. В настоящее время имеются сведения о том, что при шоке поджелудочная железа выделяет ряд факторов, дающих миокардиодепрессивный эффект.
При шоке, проявляющемся снижением объемного кровотока, обычно развивается эрозивный гастрит, который сам по себе может усилить кровопотерю. Риск желудочного кровотечения существенно снижается при использовании местных антацидных веществ и антисекреторных препаратов, например циметидина. Слизистая оболочка кишечника обычно меньше подвержена повреждающему воздействию низкого кровотока при шоке и достаточно противостоит инвазии кишечной бактериальной флоры в кровяное русло и переносу ее в другие органы. Однако известно, что в условиях выраженного шока (геморрагического или септического) возможны внезапный прорыв кишечного барьера и инвазия бактериальной флоры и токсинов. Это достаточно убедительно доказано экспериментально [Carrico С. J. et al., 1986], особенно при геморрагическом шоке. Следствием такого нарушения целости слизистой оболочки кишечника и прорыва бактериальной флоры является внезапное развитие гематогенного сепсиса.
В нормальных условиях так называемая система защиты хозяина является хорошим фильтром для попадающих в организм антигенов и потенциально токсических агентов. Имеется много различных компонентов этой системы. Основными из них являются фиксированные и циркулирующие макрофаги, лейкоциты и опсонические белки. При сепсисе и гиповолемическом шоке развивается депрессия продукции опсонических белков и фибронектина, в результате которой повреждается нормальный механизм очищения. Из-за повреждения очищающей функции печени и селезенки, защищающей в норме организм от инвазии бактерий и частиц с антигенными свойствами, легкие становятся мишенью для этих агентов. Развивающийся воспалительный процесс и отек легочной ткани формируют их функциональную недостаточность [Christon N. V. et al., 1984].

Септический шок является одним из тяжелейших осложнений сепсиса, и сопровождается высоким риском летального исхода. Данное состояние свидетельствует о полном истощении компенсаторных систем организма, его неспособности самостоятельно поддерживать артериальное давление, а также о присоединении полиорганной недостаточности (состояние, при котором органы не способны выполнять свои функции без медицинского вмешательства).
Для септического шока характерно изменение сосудистого русла, а также развитие паралича сосудов. Возможно нарушение сократительной способности сердечной мышцы, хотя и на поздних сроках, а также возможно сгущение крови. Не исключено, что может развиться дыхательная недостаточность.
Что такое септический шок
Септический шок – это тяжелое течение сепсиса , характеризующееся развитием артериальной гипотензии, устойчивой к стандартной реанимации жидкостями и сопровождающейся возникновением тканевой гипоперфузии (нарушение микроциркуляции в тканях) и множественной органной дисфункции.
Артериальная гипотензия, резистентная к инфузионной терапии, является обязательным и важнейшим критерием выставления диагноза септический шок.
Течение сепсиса, сопровождающееся только дыхательной или сердечно-сосудистой дисфункцией, сочетающимися с двумя и более, другими дисфункциями (неврологическая, гематологическая, почечная, желудочно-кишечная, печеночная и т.д.) определяется как тяжелый сепсис без септического шока.

Развитию септического шока предшествует сепсис-индуцированная артериальная гипотония, сопровождающаяся понижением систолического артериального давления ниже 90 мм.рт.ср. для пациентов с исходным нормальным давлением или на 40 мм.рт.ст. ниже привычного рабочего давления для пациентов с гипертонией.
На этой стадии гипотония временно устраняется проведением адекватной инфузионной терапии. О присоединении септического шока будут свидетельствовать падение систолического давления ниже 65 мм.рт.ст., а также отсутствие реакции на проведение инфузионной терапии в возрастной дозировке.
Причины развития септического шока
Септический шок является осложнением тяжелого сепсиса. То есть, вначале развивается синдром системной воспалительной реакции, затем сепсис, далее тяжелый сепсис. Финальным этапом является развитие септического шока. Для его развития требуется наличие предрасполагающих факторов риска, а также тяжелая септицемия, септикопиемия и тяжелейшая интоксикация.
Чаще всего септический шок развивается у:
- ослабленных больных, недавно перенесших длительные инфекционно-воспалительные заболевания, травмы, ожоги и т.д.;
- лиц, с декомпенсированными соматическими заболеваниями (сердечная недостаточность, сахарный диабет, хроническая почечная недостаточность и т.д.);
- лиц, с иммунодефицитами (первичными и вторичными);
- пациентов с выраженными авитаминозами, дефицитом белка (вегетарианцы, лица, придерживающиеся низкобелковых диет);
- новорожденных детей;
- пациентов пожилого возраста;
- больных со злокачественными новообразованиями (в особенности, в период опухолевого распада либо при наличии большого количества метастатических очагов);
- больных, получающих или недавно проходивших курс химиотерапии или лучевой терапии;
- пациентов, принимающих цитостатическую или иммунодепрессивную терапию;
- лиц, с тяжелыми аутоиммунными патологиями;
- пациентов после трансплантации органов.
Септический шок может развиваться при генерализации инфекции на фоне отитов, синуситов, пневмоний, абсцессов в легких, гнойных поражений кожных покровов и подкожно-жировой клетчатки, септических артритов, остеомиелитов, гнойных бурситов, аппендицита, перитонита, аднекситов, сальпингоофорита, миокардитов , эндокардитов, кишечных инфекций, менингитов и т.д.

Спектр основных возбудителей зависит от возраста больного, состояния его иммунной системы, а также первичного очага инфекции.
Причинами пупочного и кожного сепсиса и септического шока, чаще всего, выступают золотистые и эпидермальные стафилококки, эшерихия коли, пиогенные стрептококки.
Легочной сепсис, как правило, развивается из-за пневмококков, клебсиеллы пневмония, гемофильной инфекции типа В, золотистых и эпидермальных стафилококков. У интубированных больных может развиться сепсис и септический шок, вызванных синегнойной палочкой или ацинетобактером.
Кишечный сепсис может быть ассоциирован энтеробактериями (сальмонеллы, шигеллы и т.д.), энтеробактером, эшерихией коли. У детей первых трех лет жизни септический шок может развиваться на фоне тяжелого септического течения сальмонеллеза (у взрослых, генерализированный сальмонеллез встречается гораздо реже).
Септический шок, связанный с гнойно-воспалительными заболеваниями мочеполовой системы, как правило, вызывается эшерихией коли, стафилококками, стрептококками, клебсиеллой, протеем, энтерококком. У пациентов с катетеризированным мочевым пузырем, среди основных возбудителей сепсиса и септического шока выделяют золотистый и эпидермальный стафилококк, энтеробактер и псевдомонады.
- фузобактерией некрофорум (палочкой Шморля),
- гемофильной инфекцией типа В,
- стафилококковой, стрептококковой и пневмококковой флорой.
Сепсис у пациентов с менингитом развивается из-за пневмококков, гемофильной инфекции и менингококков (септический шок на фоне менингококковой инфекции, как правило, встречается у детей, для взрослых более характерно здоровое носительство менингококков или менингококковые назофарингиты).
Причиной септического шока у больных с остеомиелитом, гнойным бурситом или септическим артритом, чаще всего, становятся золотистые стафилококки, пневмококки, пиогенные стрептококки, гемофильная палочка, клебсиеллы.
Септический шок – классификация
Септические шоки принято разделять на:
- теплые компенсированные (гипердинамическая фаза шока);
- холодные декомпенсированные (гиподинамическая фаза);
- рефрактерные к введению дофамина;
- рефрактерный к введению катехоламинов;
- абсолютно рефрактерный шок (картина септического шока продолжает нарастать, несмотря на введение вазопрессорных, вазодилататорных и инотропных препаратов).
По длительности течения септический шок может быть молниеносный, прогрессирующий, стертый, рецидивирующий и терминальный.
В патогенезе развития шока выделяют две основные стадии:
- гипердинамическую, сопровождающуюся снижением периферического сосудистого сопротивления, рефлекторным увеличением работы сердца и компенсаторным повышением сердечного выброса;
- гиподинамическая, характеризующаяся нарушением микроциркуляции в органах и тканях, резким уменьшением периферического кровообращения, гипоксией и ишемией органов и тканей, а также прогрессирующими нарушениями функции органов (сердечная, дыхательная, почечная, печеночная и т.д. недостаточности).
Септический шок – это следствие:
- развития синдрома системной воспалительной реакции;
- массивной септицемии, септикопиемии, токсинемии;
- выброса в кровь большого количества воспалительных медиаторов;
- относительной (развивается за счет расширения сосудов и снижения периферического сопротивления сосудов) и абсолютной (возникающей как результат резко увеличенной сосудистой проницаемости) гиповолемии;
- снижения сократимости миокарда и понижения сердечного выброса (наблюдается при прогрессирующем септическом шоке). При начальных стадиях септического шока при адекватной и ранней инфузионной терапии, характерно компенсаторное повышение сердечного выброса, с целью поддержания периферического кровообращения. При истощении компенсаторных механизмов организма, способность сердечной мышцы к сокращению снижается.

В результате резко выраженной артериальной гипотонии и гипоперфузии в тканях, нарушается кислородный обмен и полноценный метаболизм. Развивается гипоксия, увеличивается процесс анаэробного гликолиза (ферментативные процессы, в результате которых происходит расщепление глюкозы без потребления О2).
Анаэробный гликолиз позволяет некоторое время поддерживать метаболизм в клетках и обеспечивать их энергией, однако прогрессирующая гипоксия приводит к накоплению в клетках молочной кислоты и развитию лактатацидоза.
Лактатацидоз при септическом шоке развивается остро (в течение одного-двух часов). У пациентов появляется:
- сильная мышечная боль,
- боли за грудиной,
- одышка,
- учащенное дыхание,
- боли в животе,
- многократная и не приносящая облегчения рвота,
- заторможенность,
- нарушение сердечного ритма ,
- появление дыхания Куссмауля (шумного, редкого, глубокого дыхания).
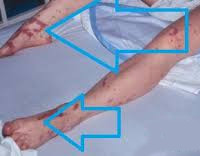
Неврологическая симптоматика может проявляться отсутствием рефлексов, либо наоборот гиперкинезами и судорогами. Также характерны симптомы почечной недостаточности (анурия), снижение температуры тела (гипотермия), диссеминированное внутрисосудистое свертывание крови, внутрисосудистый тромбоз. При тяжелом лактатацидозе возможно появление очагов некроза на кончиках пальцев рук и ног.
Кроме симптомов лактатацидоза, септический шок сопровождается развитием острого респираторного дистресс-синдрома, нарушения сознания, ишемией головного мозга, паралитической кишечной непроходимостью, ишемией и некрозом кишечника.
Симптомы и признаки септического шока

Развитию септического шока всегда предшествуют прогрессирующие симптомы сепсиса. Пациенты бледные, вялые, заторможенные, может отмечаться выраженное беспокойство, страхи. Характерен также озноб и профузная потливость. Первыми признаками сепсиса у детей может быть капризность, плаксивость, отказ от еды, частое шумное дыхание, вздутие живота. Характерно появление рвоты, не приносящей облегчения.
Отмечается также снижение диуреза и парез кишечника (отсутствие стула и перистальтики). При пальпации живота обнаруживается увеличение печени и селезенки. У большинства пациентов печень при пальпации болезненна, живот вздут и напряжен.
При развитии компенсированного септического шока (теплый или гипердинамический шок), характерно развитие:
- гипертермии (температура повышается выше 38.5-39 градусов);
- тахикардии, нарушений сердечного ритма;
- ускорения периферического пульса, время наполнения капилляров менее двух секунд (симптом белого пятна оценивается надавливанием пальцем на кисть и подсчетов времени, которое требуется на исчезновение белого пятна);
- олигурии (снижения объема мочеиспускания);
- спутанности сознания, сонливости, заторможенности.

Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.

Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация

Синдром полиорганной недостаточности развивается в результате одновременного или последовательного нарушения функций нескольких органов. В большинстве случаев полиорганная недостаточность является терминальной стадией тяжелых заболеваний, в том числе и последних стадий рака. Термин был введен относительно недавно — в 1973 году и на протяжении более 45 лет продолжает оставаться одной из самых частых причин смерти среди пациентов, которые находятся в реанимационных отделениях.
Особенности полиорганной недостаточности
Патологические изменения в органе или системе органов не развиваются одномоментно. Этот процесс протекает в три основные стадии:
- Компенсация. Длится от трех до пяти дней. В ответ на повреждение, организм старается компенсировать утраченную функцию. На начальных этапах ему удается сделать это относительно просто, поэтому полного отказа в работе органа не возникает. Если на этом этапе провести лечение, то можно будет избежать серьезных последствий, которые характерны для других стадий.
- Субкомпенсация. В этот период организм не может в полной мере восполнить утраченную функцию, поэтому пациент нуждается в медикаментозном лечении. Для того чтобы скорректировать имеющиеся нарушения, достаточно небольших доз лекарственных препаратов.
- Декомпенсациия. Эта стадия характеризуется выраженными изменениями в органах и полной утратой работоспособности. Состояние пациента становится крайне тяжелым. Он нуждается в больших дозировках лекарственных препаратов и проведении дополнительных мероприятий, которые призваны поддерживать жизнеобеспечение (ИВЛ, гемодиализ).
Степень тяжести полиорганной недостаточности определяется исходя из объема поражения. Декомпенсация двух систем соответствует тяжелой, а трех — крайне тяжелой степени.
Как проявляется синдром полиорганной недостаточности
Точный набор симптомов зависит от поражения тех или иных органов. Как правило, самыми отчетливыми являются признаки нарушения функций дыхательной системы. Об этом могут свидетельствовать следующие клинические проявления:
- Одышка.
- Активация вспомогательных мышц в процессе дыхания.
- Цианоз кожных покровов.
- Выраженная потливость.
- Нарушение сознания и заторможенность на поздних стадиях.
При поражении сердечно-сосудистой системы отмечаются боли за грудиной, различные нарушения гемодинамики, отеки мягких тканей и внутренних органов. На начальном этапе присутствует выраженная тахикардия, вплоть до 180 ударов в минуту. Она развивается с целью компенсации нарушений и со временем сменяется брадикардией, при которой частота сердечных сокращений может опускать до 40 ударов в минуту и даже ниже. На поздних стадиях пациент слабо отвечает на препараты, которые помогают нормализовать деятельность сердечно-сосудистой системы. Это одна из причин, по которой лечение полиорганной дисфункции становится сложным.
Нарушение деятельности желудочно-кишечного тракта при полиорганной недостаточности проявляется симптомами механического сдавления кишечника. К этим симптомам относятся:
- Нарушение процесса дефекации.
- Задержка газов.
- Вздутие и асимметрия живота.
- Рвота.
- Потеря аппетита.
В некоторых случаях развивается желудочно-кишечное кровотечение, которое усугубляет течение основного заболевания и нередко становится причиной смерти пациента.
Достаточно часто в клинической картине присутствуют признаки, которые характерны для почечной недостаточности. Прежде всего, это выраженное снижение объема мочи с последующим развитием анурии, что является показанием для проведения гемодиализа. Кроме того, у пациентов выявляется снижение уровня калия в крови, почечные отеки, нарушение водно-электролитного баланса и др.
Почему развивается полиорганная недостаточность
Среди причин, которые приводят к развитию синдрома полиорганной недостаточности, отмечаются тяжелые заболевания и состояния, которые оказывают существенное влияние на функции организма. К ним относятся тяжелые травмы, сепсис, инфекционно-токсический шок и др.
У онкологических пациентов синдром полиорганной недостаточности развивается после радикального удаления опухоли. Отличительной особенностью оперативных вмешательств в онкологии является необходимость удаления части одного или нескольких органов, которые поражены опухолевым процессом. При этом часто такие операции сопровождаются массивной кровопотерей, что увеличивает вероятность развития синдрома.
Полиорганная недостаточность развивается постепенно. В ее течении выделяют три основных этапа:
- Выработка различных активных молекул, которые приводят к развитию системного воспалительного ответа. Такими молекулами могут быть интерлейкины, фактор активации тромбоцитов, фактор некроза опухоли, гормоны, ферменты, свободные радикалы и др. В результате нарушается проницаемость и тонус сосудов, изменяются механизмы иммунной защиты и важнейшие биохимические процессы. Все эти изменения соответствуют индукционной фазе полиорганной недостаточности.
- Во время каскадной фазы отмечается развитие системных повреждений, которые проявляются характерными симптомами — тромбоцитопенией, лейкоцитозом, нарушением микроциркуляции, гипоксией и т.д.
- Фаза вторичной аутоагрессии характеризуется выраженной дисфункцией органов и нарушением гомеостаза.
Для полиорганной недостаточности характерно несколько повреждающих механизмов, среди которых ведущее значение имеет ишемия, активное тромбообразование и нарушение мозгового кровообращения.
Методы диагностики заболевания
Симптомы полиорганной недостаточности могут быть похожими на другие заболевания, поэтому для подтверждения диагноза врач назначает комплексное обследование, в которое входят следующие методы диагностики:
- Осмотр пациента, анализ жалоб, сбор анамнеза. Уже на этом этапе специалист может заметить характерные признаки, которые свидетельствуют о поражении одного или нескольких органов. Это могут быть нарушения дыхательной и сердечной деятельности, метаболические изменения, отклонения в гемодинамике.
- Инструментальное обследование. Его объем зависит от проявлений полиорганной недостаточности. В распоряжении врача имеются все неинвазивные методы, например, УЗИ, рентген, КТ, МРТ и др. Кроме того, важно регулярно отслеживать основные показатели жизнедеятельности организма — артериальное давление, частоту сердечных сокращений, частоту дыхания и др.
- Лабораторные методы диагностики. Обычно назначаются базовые анализы, которые позволяют оценить и в дальнейшем контролировать основные показатели гемодинамики, уровень электролитов и ферментов в крови и др.

С учетом того факта, что пациенты в большинстве случаев находятся в условиях палаты реанимации и интенсивной терапии, полиорганную недостаточность удается выявить на ранних стадиях, когда полного отказа органа или системы не произошло.
Методы лечения
Основная цель лечения пациента заключается в восстановлении утраченных функций, устранении негативных последствий полиорганной недостаточности и предупреждении осложнений. Для этого назначаются медикаментозные препараты из группы антибиотиков, НПВС, гормонов, антикоагулянтов и др. При необходимости выполняется переливание крови или ее компонентов, проводится профилактика ДВС-синдрома, внутренних кровотечений, коллапса. На всем протяжении лечения, пациент должен соблюдать строгий постельный режим.
При тяжелом течении применяются хирургические методы лечения. К ним относятся экстракорпоральная детоксикация, устранение кишечной непроходимости, удаление нежизнеспособных органов, которые начали некротизироваться.
Чем опасна полиорганная недостаточность
Основная опасность полиорганной недостаточности заключается в высоком риске летального исхода. В зависимости от объема поражения, смертность может составлять от 30% до 100%. Даже если основные проявления синдрома удается своевременно устранить, вероятность развития отсроченных заболеваний остается очень высокой. Среди наиболее частых осложнений отмечаются:
- Хроническая почечная недостаточность.
- Ишемическая болезнь сердца.
- Различные заболевания легких.
- Блокады проводящих путей сердца.
- Неврологические нарушения.
- Энцефалопатия и др.
Несмотря на развитие методов хирургического лечения и систем мониторинга основных показателей работы организма во время операции, а также подходов к послеоперационному ведению пациентов, частота развития полиорганной недостаточности продолжает оставаться высокой. Ввиду актуальности данной проблемы специалисты ищут новые пути ее решения, начиная от своевременной диагностики и заканчивая эффективным лечением.
Читайте также:
- Можно ли заразиться столбняком от укуса домашней собаки
- Африканская чума свиней в республике башкортостан
- Экспресс-диагностическая система для определения in vitro b-гемолитического стрептококка группы а стрептатест
- Лечение рожи на ноге как и чем лечить рожу на ноге
- Морфологическая картина при иерсиниозе


