Сепсис при множественной миеломе
Миеломная болезнь – злокачественная пролиферация зрелых дифференцированных плазматических клеток, сопровождающаяся усиленной выработкой моноклональных иммуноглобулинов, инфильтрацией костного мозга, остеолизом и иммунодефицитом. Миеломная болезнь протекает с болями в костях, спонтанными переломами, развитием амилоидоза, полинейропатии, нефропатии и ХПН, геморрагического диатеза. Диагноз миеломной болезни подтверждается данными рентгенографии скелета, комплексного лабораторного исследования, биопсии костного мозга и трепанобиопсии. При миеломной болезни проводится моно- или полихимиотерапия, лучевая терапия, аутотрансплантация костного мозга, удаление плазмоцитомы, симптоматическое и паллиативное лечение.


Общие сведения
Миеломная болезнь (болезнь Рустицкого-Калера, плазмоцитома, множественная миелома) – заболевание из группы хронических миелобластных лейкозов с поражением лимфоплазмоцитарного ряда гемопоэза, приводящее к накоплению в крови аномальных однотипных иммуноглобулинов, нарушению гуморального иммунитета и разрушению костной ткани. Миеломная болезнь характеризуется низким пролиферативным потенциалом опухолевых клеток, поражающих преимущественно костный мозг и кости, реже - лимфоузлы и лимфоидную ткань кишечника, селезенку, почки и другие органы.
На миеломную болезнь приходится до 10 % случаев гемобластозов. Заболеваемость миеломной болезнью составляет в среднем 2-4 случая на 100 тыс. населения и увеличивается с возрастом. Болеют, как правило, пациенты старше 40 лет, дети – в крайне редких случаях. Миеломной болезни более подвержены представители негроидной расы и лица мужского пола.
Классификация миеломной болезни
По типу и распространенности опухолевого инфильтрата выделяют локальную узловую форму (солитарную плазмоцитому) и генерализованную (множественную миелому). Плазмоцитома чаще имеет костную, реже - внекостную (экстрамедуллярную) локализацию. Костная плазмоцитома проявляется одиночным очагом остеолиза без плазмоклеточной инфильтрации костного мозга; мягкотканная – опухолевым поражением лимфоидной ткани.
Множественная миелома встречается чаще, поражает красный костный мозг плоских костей, позвоночника и проксимальных отделов длинных трубчатых костей. Подразделяется на множественно-узловатую, диффузно-узловатую и диффузную формы. С учетом характеристик миеломных клеток выделяют плазмоцитарную, плазмобластную, и низкодифференцированные (полиморфно-клеточную и мелкоклеточную) миелому. Миеломные клетки избыточно секретируют иммуноглобулины одного класса, их легкие и тяжелые цепи (парапротеины). В связи с этим различают иммунохимические варианты миеломной болезни: G-, A-, M-, D-, E- миеломы, миелому Бенс-Джонса, несекретирующую миелому.
В зависимости от клинических и лабораторных признаков определяют 3 стадии миеломной болезни: I – с малой массой опухоли, II – со средней массой опухоли, III – с большой массой опухоли.
Причины и патогенез миеломной болезни
Причины миеломной болезни не выяснены. Довольно часто определяются разнотипные хромосомные аберрации. Имеет место наследственная предрасположенность к развитию миеломной болезни. Подъем заболеваемости связан с влиянием радиоактивного облучения, химических и физических канцерогенов. Миеломная болезнь часто выявляется у людей, имеющих контакт с нефтепродуктами, а также у кожевенников, столяров, фермеров.
Перерождение клеток лимфоидного ростка в миелому начинается в процессе дифференцировки зрелых B-лимфоцитов на уровне проплазмоцитов и сопровождается стимуляцией определенного их клона. Ростовым фактором миеломных клеток служит интерлейкин-6. При миеломной болезни обнаруживаются плазмоциты различной степени зрелости с чертами атипизма, отличающиеся от нормальных большим размером (>40 мкм), бледной окраской, многоядерностью (нередко 3-5 ядер) и наличием нуклеол, бесконтрольным делением и длительным сроком жизни.
Разрастание миеломной ткани в костном мозге приводит к деструкции кроветворной ткани, угнетению нормальных ростков лимфо- и миелопоэза. В крови снижается количество эритроцитов, лейкоцитов и тромбоцитов. Миеломные клетки не способны полноценно выполнять иммунную функцию из-за резкого снижения синтеза и быстрого разрушения нормальных антител. Факторы опухоли дезактивируют нейтрофилы, снижают уровень лизоцима, нарушают функции комплемента.
Локальная деструкция костей связана с замещением нормальной костной ткани пролиферирующими миеломными клетками и стимуляцией остеокластов цитокинами. Вокруг опухоли формируются очаги растворения костной ткани (остеолиза) без зон остеогенеза. Кости размягчаются, становятся ломкими, значительное количество кальция выходит в кровь. Парапротеины, поступая в кровяное русло, частично депонируются в различных органах (сердце, легких, ЖКТ, дерме, вокруг суставов) в виде амилоида.
Симптомы миеломной болезни
Миеломная болезнь в доклиническом периоде протекает без жалоб на плохое самочувствие и может обнаружиться лишь при лабораторном исследовании крови. Симптомы миеломной болезни обусловлены плазмоцитозом костей, остеопорозом и остеолизом, иммунопатией, нарушением функции почек, изменением качественных и реологических характеристик крови.
Обычно множественная миелома начинает проявляться болями в ребрах, грудине, позвоночнике, ключицах, плечевых, тазовых и бедренных костях, самопроизвольно возникающими при движениях и пальпации. Возможны спонтанные переломы, компрессионные переломы грудного и поясничного отделов позвоночника, приводящие к укорочению роста, сдавлению спинного мозга, что сопровождается радикулярной болью, нарушением чувствительности и моторики кишечника, мочевого пузыря, параплегией.

Миеломный амилоидоз проявляется поражением различных органов (сердца, почек, языка, ЖКТ), роговицы глаза, суставов, дермы и сопровождается тахикардией, сердечной и почечной недостаточностью, макроглоссией, диспепсией, дистрофией роговицы, деформацией суставов, кожными инфильтратами, полинейропатией. Гиперкальциемия развивается при тяжелом течении или терминальной стадии миеломной болезни и сопровождается полиурией, тошнотой и рвотой, дегидратацией, мышечной слабостью, вялостью, сонливостью, психотическими расстройствами, иногда - комой.
Частым проявлением заболевания является миеломная нефропатия с устойчивой протеинурией, цилиндрурией. Почечная недостаточность может быть связана с развитием нефрокальциноза, а также с AL-амилоидозом, гиперурикемией, частыми инфекциями мочевых путей, гиперпродукцией белка Бенс-Джонса, приводящего к повреждению почечных канальцев. При миеломной болезни может развиться синдром Фанкони - почечный ацидоз с нарушением концентрирования и подкисления мочи, потерей глюкозы и аминокислот.
Миеломная болезнь сопровождается анемией, снижением продукции эритропоэтина. За счет выраженной парапротеинемии происходит значительный рост СОЭ (до 60-80 мм/ч), увеличение вязкости крови, нарушение микроциркуляции. При миеломной болезни развивается иммунодефицитное состояние, повышается восприимчивость к бактериальным инфекциям. Уже в начальном периоде это приводит к развитию пневмонии, пиелонефрита, имеющих в 75% случаев тяжелое течение. Инфекционные осложнения являются одними из ведущих прямых причин летальности при миеломной болезни.
Синдром гипокогуляции при миеломной болезни характеризуется геморрагическим диатезом в виде капиллярных кровоизлияний (пурпуры) и синяков, кровотечений из слизистых десен, носа, пищеварительного тракта и матки. Солитарная плазмоцитома возникает в более раннем возрасте, имеет медленное развитие, редко сопровождается поражением костного мозга, скелета, почек, парапротеинемией, анемией и гиперкальциемией.
Диагностика миеломной болезни
При подозрении на миеломную болезнь проводится тщательный физикальный осмотр, пальпацией болезненных участков костей и мягких тканей, рентгенография грудной клетки и скелета, лабораторные исследования, аспирационная биопсия костного мозга с миелограммой, трепанобиопсию. Дополнительно в крови определяют уровни креатинина, электролитов, C-реактивного белка, b2-микроглобулина, ЛДГ, ИЛ-6, индекса пролиферации плазмоцитов. Проводится цитогенетическое исследование плазматических клеток, иммунофенотипирование мононуклеарных клеток крови.
При множественной миеломе отмечается гиперкальциемия, увеличение креатинина, снижение Hb 1%.. При плазмоцитозе >30% в отсутствии симптомов и костной деструкции (или ее ограниченном характере) говорят о вялотекущей форме заболевания.
Главными диагностическими критериями миеломной болезни служат атипическая плазматизация костного мозга >10-30%; гистологические признаки плазмоцитомы в трепанате; присутствие плазматических клеток в крови, парапротеина в моче и сыворотке; признаки остеолиза либо генерализованного остеопороза. Рентгенография грудной клетки, черепа и таза подтверждает наличие локальных участков разрежения костной ткани в плоских костях.
Важным этапом является дифференциация миеломной болезни с доброкачественной моноклональной гаммапатией неопределенного генеза, макроглобулинемией Вальденстрема, хронической лимфолейкемией, неходжкинской лимфомой, первичным амилоидозом, костными метастазами рака толстой кишки, легких, остеодистрофией и др.

Лечение и прогноз миеломной болезни
Лечение миеломной болезни начинают сразу после верификации диагноза, что позволяет продлить жизнь больного и повысить ее качество. При вялотекущей форме возможна выжидательная тактика с динамическим наблюдением до нарастания клинических проявлений. Специфическая терапия миеломной болезни проводится при поражении органов-мишеней (т. н. CRAB - гиперкальциемии, почечная недостаточности, анемии, костной деструкции).
Основной метод лечения множественной миеломы – длительная моно- или полихимиотерапия с назначением алкилирующих препаратов в сочетании с глюкокортикоидами. Полихимиотерапия чаще показана при II, III стадиях заболевания, I стадии протеинемии Бенс-Джонса, прогрессировании клинической симптоматики.
После лечения миеломной болезни рецидивы проявляются в течение года, каждая последующая ремиссия менее достижима и короче предыдущей. Для удлинения ремиссии обычно назначаются поддерживающие курсы препаратов a-интерферона. Полная ремиссия достигается не более чем в 10% случаев.
У молодых пациентов в первый год выявления миеломной болезни после курса высокодозированной химиотерапии проводится аутотрансплантации костного мозга или стволовых клеток крови. При солитарной плазмоцитоме применяется лучевая терапия, обеспечивающая многолетнюю ремиссию, при неэффективности назначается химиотерапия, хирургическое удаление опухоли.
Симптоматическое лечение миеломной болезни сводится к коррекции электролитных нарушений, качественных и реологических показателей крови, проведению гемостатического и ортопедического лечения. Паллиативное лечение может включать болеутоляющие средства, пульс-терапию глюкокортикоидами, лучевую терапию, профилактику инфекционных осложнений.
Прогноз миеломной болезни определяется стадией заболевания, возрастом больного, лабораторными показателями, степенью почечной недостаточности и костных поражений, сроками начала лечения. Солитарная плазмоцитома часто рецидивирует с трансформацией во множественную миелому. Самый неблагоприятный прогноз при III Б стадии миеломной болезни - со средней продолжительностью жизни 15 месяцев. При III А стадии она составляет 30 месяцев, при II и I А, Б стадии - 4,5-5 лет. При первичной резистентности к химиотерапии выживаемость составляет менее 1 года.
Множественная миелома — это злокачественная опухоль лимфоидной природы, для которой характерна триада признаков:
- Колонизация костного мозга опухолевыми плазматическими клетками.
- Возникновение очагов расплавления костной ткани (деструкция кости).
- Обнаружение в крови и/или моче специфического белка — моноклонального глобулина.
Основу миеломы составляют плазматические клетки (дифференцированные В-лимфоциты, плазмоциты). Они секретируют особый белок — моноклональный иммуноглобулин, он же М-белок, М-компонент, М-протеин, который негативно влияет на организм, приводя к развитию тяжелых симптомов. Кроме того, колонизация плазмоцитами костного мозга приводит к нарушению кроветворения и очаговому расплавлению костной ткани.
Симптомы множественной миеломы
В начальных стадиях множественная миелома протекает бессимптомно. По мере увеличения количества опухолевых клеток, заболевание прогрессирует и могут развиваться следующие симптомы:

Виды множественной миеломы
Существует несколько классификаций миеломной болезни. По степени распространенности опухолевых поражений выделяют:
- Диффузная форма множественной миеломы. Происходит инфильтрация костного мозга без костных разрушений (остеодеструкции).
- Диффузно-очаговая форма миеломы. Помимо инфильтрации костного мозга имеются очаги деструкции костей.
- Множественно-очаговая форма миеломы. Есть очаги остеодеструкции, но нет диффузного поражения костного мозга. В этом случае при исследовании пунктата возможно получение нормальной миелограммы.
- Редкие формы миеломы — склеротическая, висцеральная и др.
Также множественная миелома классифицируется на основе иммунохимического типа опухоли. Основным фактором здесь является вид патологического иммуноглобулина, определяемого в крови и моче. Выделяют G, A, D, E, M-миелому, миелому Бенс-джонса, биклональную и несекретирующую.
Стадии и прогноз при множественной миеломе
Стадирование множественной миеломы определяется на основании 4-х параметров: количество М-компонента, уровень гемоглобина, уровень кальция, степень поражения костей. Стадии:
- 1 стадия миеломы – легкая анемия (гемоглобин более 100 г/л), кальций в норме, низкий М-белок, менее 5 очагов поражения костей. Средняя продолжительность жизни таких пациентов составляет 6,5 лет.
- 2 стадия миеломы – анемия средней степени тяжести, кальций повышен до 3 ммоль/л, количество очагов остеолизиса не превышает 20, уровень М-компонента: 35 IgG
Причины множественной миеломы
Причиной развития миеломной болезни являются мутации в клетках-предшественницах В-лимфоцитов. Что приводит к этим мутациям, до конца неизвестно. Но выделяют несколько факторов риска, при наличии которых вероятность развития заболевания превышает общепопуляционную:
- Возраст старше 40 лет.
- Мужской пол.
- Принадлежность к негроидной расе.
- Наличие моноклональной гаммапатии — у каждого сотого такого пациента развивается миелома.
- Вторичные иммунодефициты — ВИЧ, прием иммуносупрессивной терапии.
- Наличие миеломы среди близких кровных родственников.
- Наличие в анамнезе радиационного воздействия, в том числе лучевой терапии.
Диагностика множественной миеломы
Диагностика миеломы предполагает оценку жалоб пациента и проведение инструментальных методов диагностики:
- Лабораторные исследования — помимо рутинных анализов выполняется биопсия костного мозга и/или опухолевой ткани, определение β2-микроглобулина и др.
- Рентген костей или компьютерная томография костей для поиска очагов остеодеструкции.
- Иммунофенотипирование и цитогенетическое исследование опухолевых клеток для определения прогноза и составления плана лечения.
Диагноз множественной миеломы выставляется на основании следующих критериев:
- Уровень плазмоцитов в костном мозге или опухолевом биоптате превышает 10%.
- В крови и моче определяется М-белок (кроме несекретирующей формы множественной миеломы).
- Присутствуют признаки поражения внутренних органов миеломными клетками — гиперкальциемия, анемия, поражение костей, почечная недостаточность.
Как лечится множественная миелома
Множественная миелома сегодня считается неизлечимым заболеванием. Усилия медицины направлены на то, чтобы сдержать рост опухоли, продлить и улучшить качество жизни таких больных.
Выделяют следующие виды лечения миеломы:
- Стандартная химиотерапия. Назначается пациентам, которым противопоказана высокодозная полихимиотерапия. Средняя продолжительность жизни после нее 29 месяцев. В стандартную схему первой линии входит мелфалан и преднизолон. Более эффективные схемы включают талидомид, леналидомид или бортезомиб (относительно новые противоопухолевые препараты).
- Высокодозная полихимиотерапия (ВПХТ) с последующей пересадкой кроветворных стволовых клеток ТГСК (как аутологичных, так и донорских). Данное лечение позволяет достичь полной ремиссии у большинства пациентов (до 75%), но к сожалению, в течение 2-5 лет отмечается прогрессирование заболевания. Более эффективным является проведение двойного курса ВПХТ с ТГСК (тандемная ВПХТ). Она позволяет добиться пятилетней безрецидивной выживаемости у 90% пациентов. Но такое тяжелое лечение могут перенести не все пациенты, поэтому показания к нему ограничены.
- Поддерживающая терапия. Даже ВПХ не может предотвратить развитие рецидива, назначается лечение, которое призвано подавлять клон злокачественных клеток. С этой целью используются интерфероны. Они помогают продлить медиану безрецидивной выживаемости до 42 месяцев.
- Борьба с осложнениями. Лечение боли — назначение сильных аналгезирующих препаратов, лучевая терапия. Хирургические операции проводятся при компрессионных переломах позвонков. Коррекция осложнений, вызванных угнетением кроветворения — переливание эритромассы и назначение эритропоэтина, применение антибиотиков при повышении температуры. Проведение гемодиализа, плазмофереза, назначение бисфосфонатов для контроля гиперкальциемии.

Диета и питание при миеломе
Особой диеты при множественной миеломной болезни не требуется, за исключением периода прохождения химиотерапии. Учитывая то, что основным побочным эффектом такого лечения является потеря аппетита, тошнота и рвота, требуется легкое и, вместе с тем, калорийное сбалансированное питание. Более подробные рекомендации пациенту дает лечащий врач.
Число лейкоцитов, вариабильное, нормальное или повышенное. В развитых стадиях болезни можно наблюдать лейкопении, отягощаемые и применяемыми цитостатическими лечениями. Лейкоцитарная формула, обычно нехарактерная, может показывать иногда повышенное число плазмоцитарных элементов, подобных клеткам в костном мозге.
Число тромбоцитов нормальное или умеренно пониженное.
Исследование костного мозга при множественной миеломе имеет важнейшее значение для постановки диагноза. Костная пункция производится обычно в грудную кость или в подвздошный гребень, но ее можно производить и в другие затронутые кости: позвонки, пяточную кость, ключицу. Иногда проникание в кость происходит очень легко, костная ткань давая ощущение особой хрупкости.
В цитоплазме миеломатозных клеток можно встретить гиалиновые шарики (тела Russel), многочисленные вакуоли, придающие клетке вид ежевики (клетки Mott), или хрустальные азурофильные включения иногда подобные телам Auer при миелобластической лейкемии (протеиновые кристаллы) (цветная вклейка III).
С цитохимической точки зрения, цитоплазма миеломатозных клеток является пероксидазо-отрицательной и окрашивается метахроматически с метиловой зеленью. Гиалиновые шарики (тела Russel) обычно PAS-положительные.
Миеломатозные клетки преставляют множество нуклеоцитоплазматических асинхронизмов созревания. Согласно Bernier и Graham, степень этих асинхронизмов пропорциональна клиническому распространению заболевания.

Исследования при помощи электронного микроскопа показали наличие определенных аномалий на уровне клеточных органитов, аномалии тем более явные, чем менее дифференцирована миеломатозная клетка. Митохондрии численно увеличены и имеют патологические аспекты: удлиненные, кольцевидные, иногда с чертами миелиновой дегенерации; аппарат Гольджи везикулярнио трансформирован, центриоли имеют гигантский удлиненный вид, а число рибозомов может возрастать (Bessis). Наиболее интересный аспект представляет эргастоплазмический аппарат. В большинстве случаев он расширен и имеет везикулярный вид.
Содержимое эргастоплазмических везикул состоит из протеина и имеет твердую консистенцию, принимая аспект тел Russel, либо в растворимой форме, flaming cells или тезауроцотив (Paraskevas и сотр.), либо в кристаллизованной форме.
Протеиновые кристаллы бирефрингентные с периодичностью около 110 A (Bessis). В других случаях эргатоплазмический аппарат менее развит и представлен несколькими пластинками, а редко бывает плохо развитым, подобным лимфоидной клетке. На уровне ядра появляются аномалийные, гипертрофированные нуклеоли, а также и множество интрануклеарных вакуолей (Smetena и сотр.). Некоторые авторы описали наличие в ядре вирусных телец, в 15% случаев (Sorensen), тельца, которые Bessis нашел лишь в одном из 12 изученных им случаев.
Иммунохимические и иммунофлюоресцентные исследования, с разными специфическими антисыворотками (IgG, IgA, IgM, IgD IgE, ламбда, каппа) показали наличие Ig в цитоплазме миеломатозных клеток. Они локализированы в особенности на уровне эргастоплазмического аппарата и рибозомов. Делались попытки установить связь между морфологическим аспектом клеток и типом секретированного Ig. Полученные до настоящего времени результаты неубедительны. Paraskevas и сотр. утверждают, что пламенистые клетки секретируют IgA.
Цитогенетическое исследование множественной миеломы показало существование разных форм анейплоидии, но которые наблюдаются не во всех случаях. Кроме этого кыло описано и присутствие различных хромозомов маркеров. Вследствие внедрения метода бандирования, Liang и Rowley нашли хромозом 14р+ у 3 больных с множественной миеломой и 1 больного с плазмоцитарной лейкемией, из 22 изученных больных. Этот хромозом 14q+ был найден и при других лимфомах типа Б, а также, изредка, и при лимфомах non-Б. Следует отметить, что Croce и сотрудники установили, что структуральные гены для тяжелых цепей Ig локализированы у человека на хромозоме 14.
Исследование протеинового обмена при множественной миеломе. Расстройства протеинового метаболизма составляют характерный аспект множественной миеломы. Злокачественно модифицированные плазмоциты сохраняют и усиливают способность синтетизировать цельные Ig или только определенные составные части глобулиновой молекулы.
В сыворотке большинства больных, общее количество протеинов повышено, достигая 23 г/100 мл. Среднее количество сывороточных протеинов у больных с миеломой равняется 9 г/100 мл. Этот рост происходит за счет глобулинов, точнее Ig. При электрофорезе на бумаге или в агаре наблюдается появление узкой и высокой полосы, с заметным сокращением остальных дуг. Это является изображением количественного роста гомогенного населения глобулинов. Пик находится обычно в зоне миграции у-глобулинов или b-глобулинов. Аномалийный протеин, находящийся в сыворотке больных с миеломой, получил название парапротеина, миеломатозного глобулина (М-глобулин) или компонента М.
В рамках множественной миеломы может происходить:
1) избыточный синтез, однако уравновешенный, цепей Н и L, с образованием цельных Ig;
2) неуравновешенный синтез, с избытком цепей L и образованием цельных Ig, параллельно с повышенным количеством свободных цепей L и
3) синтез лишь цепей L.
В настоящее время миеломы делятся по типу секретируемого Ig: миеломы IgG наиболее частые, встречающиеся в 60% случаев; миеломы IgA, в 20—25% случаев; IgD, в 2,1% случаев; и ограниченное число миелом IgE. Среди случаев множественной миеломы, 20% — с цепями L (миеломы Бенс-Джонса), причем некоторые без патологического протеина в сыворотке, так как он элиминируется через мочу. Очень малый процент заболеваний (1%) не представляет изменений протеинового метаболизма (несекретирующие миеломы).
В рамках миелом IgG, наблюдается следующее распределение на субклассы (Schur): yG1 60—82%; yG2 10—18%; yG3 6—15%; yG4 1—8%. Сравнивая эти цифры с относительными концентрациями в нормальной сыворотке (гл. 7) можно утверждать, что моноклональные Ig типа yGl и yG3 встречаются чаще по сравнению с yG2.
Характерной чертой миеломатозного Ig является его гомогенность: узкая зона электрофоретической миграции, индивидуальная антигенная специфичность и цепь L только одного типа (ламбда или каппа). При миеломах IgG и IgA преобладают случаи с цепями каппа (2/3 случаев) (Hobbs и Corbet); при миеломах IgD, цепи ламбда преобладают в 90% случаев, в то время как при миеломах Бенс-Джонса, цепи ламбда присутствуют приблизительно в 45% случаев (Jancelewicz и сотр.). До сих пор не удалось выявить физико-химические или иммунохимические различия между миеломатозными протеинами и соответствующими им нормальными Ig.
Было доказано, что миеломатозные Ig обладают способностью связываться с другими веществами, следовательно действовать как антитела. Такая антителовая деятельность отмечалась по отношению к бактериальным соединениям (стрептолизин 0 или спрептококковая гиалу-ронидаза), к гематиям, к некоторым сывороточным протеинам, а также и к гаптенам (динитрофенол, 5-ацетоурацил, пуриновые и пиримидиновые нуклеотиды) (Osterland и сотр.). Способность миеломатозного протеина связываться с гематиями или сывороточными протеинами порождает определенные симптомы, как например агглютинация гематий в виде монетных столбиков, явления повышенной кровоточивости и пр.
У больных с миеломой, количественный рост характерного миеломатозного Ig сопровождается сокращением производства других типов глобулинов.
Значительная диспротеинемия в крови больных с множественной миеломой оказывает влияние на все пробы коллоидальной лабильности.
Реакция оседания эритроцитов в большинстве случаев бывает очень ускоренной, достигая 100 мм в час. При миеломах Бенс-Джонса, РОЭ показывает более низкие цифры, иногда даже в нормальных пределах.

Реакции на формол-гелифицирование, сульфат кадмия, Вельтмана — положительные. Реакция Sia (помутнение сыворотки в дистилированной воде) — слабо или умеренно положительная.
В редких случаях отмечалось наличие сывороточных криоглобулинов с появлением синдрома Рейно на холоде и наблюдалось также наличие пироглобулинов.
Тесты на коагуляцию модифицированы у некоторых больных. Патологические протеины в сыворотке могут интерферировать с различными фазами коагуляции, как например в трансформация фибриногена в фибрин, во взаимодействии с факторами II, V и VII. Функции тромбоцитов могут быть также модифицированными.
Анализ мочи показывает наличие протеина Бенс-Джонса в 40—50% случаев, когда он детерминируется путем нагревания и в 61% случаев, когда он выявляется путем иммуноэлектрофореза. Он представлен выведением легких цепей. Протеин Бенс-Джонса преципитирует в моче нагретой до 50—60°, создавая беловатое облако, которое перерастворяется при кипячении. В случае ассоциированной альбуминурии, перерастворение является неполным и иногда оказывается неполным и без альбуминурии. В такой ситуации мочу можно сделать прозрачной путем добавления нескольких капель 5%-й уксусной кислоты. Физикохимическое исследование альбумина Бенс-Джонса показало, что он состоит из легких цепей, димеризованных дисульфидными связями. Постоянно легкая цепь в моче идентична с легкой цепью сывороточного миеломатозного протеина.
В мочевом осадке могут появляться цилиндры, гематии, а в случаях почечного калкулеза появляются кристаллы фосфатов, уратов, а также гематии и лейкоциты.
Гиперкальцемия встречается часто при множественной мизломе (20—53% случаев), достигая 12—16 мг/100 мл сыворотки. Этот рост связан в первую очередь с процессами костной деструкции, но и с гиперпаратиреоидизмом, как вторичное явление почечной недостаточности. Гиперкальцемия при множественной миеломе не сопровождается ростом фосфора в крови, а щелочные сывороточные фосфатазы находятся в нормальных пределах, что представляет ценные данные для дифференциальной диагностики по отношению к первичному гиперпаратиреоидизму.
Сывороточная мочевая кислота бывает часто повышена, а в случаях, осложняющихся почечной недостаточностью, наблюдается рост креатинина и непротеинового азота.
Патологоанатомическое исследование при множественной миеломе. Наиболее явные изменения встречаются на уровне скелета, особенно в черепных костях, позвонках, ключицах, ребрах, грудной кости, лопатке, тазовых костях. Длинные кости затронуты в меньшей мере. На срезе, кость оказывается мягкой, а нормальная ткань заменяется красноватой или серо-красноватой туморальной тканью. Иногда опухоль переходит за периост, инфильтрируя смежные участки.
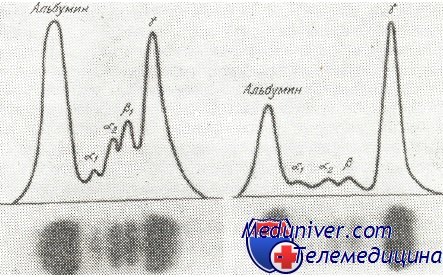
Изображения электрофореза нормальной сыворотки человека (слева) и сыворотки больного с множественной миеломой (справа). При миеломе констатируется наличие большого количества гаммагпобулина (высокая и узкая волна), с сокращением альбуминов и остальных глобулинов
Микроскопически, туморальная ткань состоит из пролиферации злокачественных плазмоцитоидных клеток, описанных при исследовании костного мозга. На срезе остеокласты и остеобласты немодифицированы.
В редких случаях внекостных миелом можно обнаруживать плазмоцитарные опухоли в различных органах, причем характерные особенности пролиферированных клеток подобны тем, которые наблюдаются при костных опухолях.
При множественной миеломе почка бывает часто затронута. Наиболее важные поражения встречаются на уровне канальцев. Дистальные канальцы расширены, с уплощенным эпителием и просветами заполненными эозинофильными и полихроматофильными цилиндрами. На периферии этих цилиндров встречаются многоядерные синцитин эпителиальных клеток. Цилиндры состоят из цельного миеломатозного Ig или из цепей L (протеин Бенс-Джонса). На электронном микроскопе, эти цилиндры имеют фибрилярную, амилоидную структуру (Abrahams и сотр.). Не удалось установить несомненную связь между наличием амилоида и протеинурией Бенс-Джонса. Несмотря на это, Glenner и сотр. показали in vitro образование амилоидных волокон путем протеолитической дигестии человеческого протеина Бенс-Джонса. Возможно, что подобный процесс происходит и на уровне почечных канальцев (Zlotnick).
В тубулярных эпителиальных клетках часто встречаются отложения кальция. Также на уровне почечных канальцев было отмечено наличие кристаллов, находящихся как в просвете, так и в эпителии. Их химическая структура не была установлена.
Почечные гломерулы бывают реже затронутыми при множественной миеломе. Отмечается утолщение базальной мембраны и мезангиомы, которое выступает с особенной ясностью на электронном микроскопе. Встречается также и гипертрофия эндотелиальных и эпителиальных клеток. В развитых фазах болезни появляются гиалиноз и склероз. Иногда в гломерулах можно найти отложения амилоида, что приводит к его гомогенизации.
Читайте также:


