Сепсис у детей с лейкозами

Причины
Сепсис возникает под воздействием микробной, реже – грибковой флоры. Возбудителями могут стать кишечная или синегнойная палочка, стрепто- и стафилококк, протей, клебсиелла.

Новорожденные мальчики болеют сепсисом чаще девочек
Именно новорожденные попадают в группу риска заражения крови, так как их иммунитет недостаточно крепкий, чтобы бороться с патогенной флорой. Наибольшую опасность сепсис несет для новорожденных:
- недоношенных;
- рожденных с массой тела менее 2 кг;
- с пороками развития;
- с врожденным иммунодефицитом или ВИЧ-статусом.
Инфицирование может произойти внутриутробно, во время родов или после появления на свет. Следует отметить, что больничная патогенная флора достаточно агрессивная и тяжело поддается лечению.
Факторы риска заражения сепсисом:
- инфекционные болезни беременной, например, кольпит, эндометрит;
- акушерские манипуляции, проведенные с недостаточной стерильностью рук медперсонала или инструмента;
- раннее излитие околоплодных вод;
- внутриутробная гипоксия, асфиксия;
- черепно-мозговая травма, полученная в процессе родов;
- повреждение кожного покрова, слизистых младенца;
- гнойный мастит у кормящей матери;
- инфекционные заболевания новорожденных – пиодермия, конъюнктивит, отит, фарингит, бронхит, пневмония, цистит, дисбактериоз;
- местные очаги инфекций, например, псевдофурункулез, который проявляется абсцессами.
Инфекционный возбудитель может попасть в кровь через поврежденную кожу или слизистые, пупочную рану, уши, легкие, желудочно-кишечный тракт или мочевые пути.
Иногда сепсис развивается по причине перенесенного оперативного вмешательства. Это может быть операция или малоинвазивная манипуляция, например, катетеризация пупочной или центральной вены, интубация трахеи. В группе риска также дети, которые находятся на парентеральном питании или получают инфузионную терапию.
Симптомы
Симптоматика сепсиса тяжелая. На начальном этапе ребенок становится вялым или, наоборот, беспокойным, у него плохой аппетит, после еды он срыгивает пищу, плохо прибавляет в весе.
По мере распространения инфекции заметны такие симптомы:
- бледный, бледно-серый или желтый оттенок кожного покрова;
- сыпь на теле, не похожая на атопический дерматит;
- обезвоживание;
- отечность кожного покрова;
- гипотрофия;
- высокая или патологически низкая температура тела;
- боль в теле;
- синюшность носогубного треугольника, кончиков пальцев;
- нарушение сердечного ритма – тахикардия, брадикардия;
- учащение дыхания;
- боль в животе, нарушение пищеварения, рвота, диарея;
- мочевой синдром – олигурия, анурия;
- надпочечниковая недостаточность.
На фоне обильного срыгивания после кормления и судорог можно ошибочно предположить, что у малыша спазмофилия. Это заболевание, проявляющееся спазмами, мышечными подергиваниями и судорожной активностью. Провокатором его возникновения является рахит.

Грибковые инфекции могут осложнять течение бактериального сепсиса
Если у новорожденного желтуха или бледность кожи, железодефицитная анемия, снижение рефлексов и мышечного тонуса, увеличены печень и селезенка, то это может быть гемолитическая болезнь. Ее возникновение связано с резус-конфликтом между матерью и ребенком.
Сепсис всегда сопровождается признаками общей интоксикации. В тяжелых случаях появляются локальные гнойно-воспалительные очаги. Это абсцессы, флегмоны. Гнойные очаги возникают не только на кожном покрове, но и во внутренних органах – мозговые оболочки, легкие, печень. Иногда поражаются кости.
По тяжести сепсис новорожденных подразделяют:
- на легкий. Характерно повышение температуры тела, учащаются пульс и дыхание;
- средний. Проявляется симптоматика осложнений – пневмонии, менингита, перитонита;
- тяжелый. Выражены гипотензия, дисфункция пораженных внутренних органов;
- септический шок. Самое тяжелое состояние младенца. В 50% всех случаев наступает летальный исход.
Лечебные мероприятия зависят от степени тяжести заражения крови.
Классификация
По времени появления первых симптомов сепсис бывает:
- внутрибольничным – признаки появляются в роддоме;
- ранним – клинические проявления возникают на 2–5-е сутки жизни;
- поздний – симптомы определяются через 1–3 недели после рождения малыша.
В случае обнаружения внутрибольничного сепсиса весь роддом закрывается на карантин для установления причинно-следственной связи и предупреждения заражения остальных младенцев.
Прогноз зависит от течения сепсиса у новорожденных. Существуют такие формы:
- молниеносный – развивается в первые сутки;
- острый – длится до 3–6 недель;
- подострый – протекает на протяжении 1,5–3 месяцев;
- затяжной – длится более 3 месяцев.
Именно первая форма наиболее опасна для детей.
В зависимости от первичного септического очага классифицируют:
- хирургический сепсис – источником инфекции являются местные гнойные очаги;
- акушерско-гинекологический – провокатором выступают послеродовые осложнения или заболевания половых органов матери;
- уросепсис – вызван инфекциями мочеполовой системы младенца;
- ротовой – очаг находится в полости рта;
- кишечный – провокатором выступает кишечная палочка.
Существуют также другие разновидности.
Диагностика сепсиса у детей
Диагноз ставится неонатологом родильного отделения или педиатром, если малыш уже находится дома. При подозрении на сепсис ребенка экстренно госпитализируют. Если состояние тяжелое, то малыша сразу помещают в реанимацию.
Основу обследования составляет посев крови на микрофлору. Он позволяет выявить бактериальных возбудителей, определить чувствительность к антибиотикам. Забор крови делается из вены. В норме она должна быть стерильной.

До 30–40% детей с сепсисом умирают
Также проводится клинический анализ крови. По результатам видны такие отклонения:
- снижение концентрации нейтрофилов и лейкоцитов или повышение до критических отметок;
- увеличение уровня С-реактивного белка.
Все эти отклонения свидетельствуют о воспалительном процессе. Также проводят соскоб кожи, бакпосев мочи, мазки из зева и конъюнктивы, анализ кала на дисбактериоз.
Дифференциальная диагностика проводится с лейкозом, внутриутробной инфекцией, микозами.
Лечение
При молниеносном развитии каждая минута важна. При несвоевременной терапии может наступить летальный исход.
Бактериальный сепсис лечится антибиотиками. Причем их нужно ввести в течение 1 ч после появления первых признаков. Если этого не сделать, то инфекция мгновенно разносится по всему организму, развиваются осложнения.
В раннем периоде антибактериальная терапия предполагает применение препаратов широкого спектра действия, после получения данных бакпосева – узконаправленных антибиотиков. Медикаменты вводятся внутривенно, в максимальных дозах. Через 10–15 суток делается замена на препарат с другим действующим веществом.
Для лечения новорожденных применяются антибиотики таких групп:
- цефалоспорины;
- аминогликозиды;
- карбапенемы;
- аминопенициллины;
- макролиды.
Фторхинолоны не используются, так как они очень токсичны.
Одновременно с подавлением возбудителя в крови производится санация местных очагов инфекции. Она предполагает вскрытие гнойников и абсцессов, промывание антибактериальными растворами, наложение стерильной повязки.
Дополнительно применяются физиотерапевтические процедуры:
Для устранения признаков интоксикации организма проводится дезинтоксикационная терапия. С целью профилактики обезвоживания малышу вливают растворы для восполнения утраченной жидкости – натрия хлорид, глюкоза.
Если новорожденный отказывается от груди, то сцеженное молоко вводится через зонд. Но отказываться от грудного вскармливания нельзя.
При сепсисе эффективна иммунозаместительная терапия. Применяются иммуноглобулины, интерфероны. Они помогают иммунной системе бороться с патогенной флорой.
Во время лечения постоянно производится контроль основных показателей жизнедеятельности – артериальное давление, частота сердечных сокращений. Исследуется кислотно-основное и газовое состояние крови. Обязательны электрокардиограмма, биохимическое исследование плазмы, чтобы оценить уровень сахара, креатинина и электролитов.
Последствия
Смертность от сепсиса среди младенцев высока. Самые неблагоприятные прогнозы при заражении, вызванном стрептококками группы В. Они часто провоцируют молниеносное развитие сепсиса, моментально вызывают пневмонию или менингит. Среди других осложнений возможны пурпуры, абсцессы, флегмоны, гнойно-некротические очаги. Одним из самых тяжелых является перитонит.
Последствием антибактериальной терапии является подавление нормальной микрофлоры, из-за чего развивается дисбактериоз, кандидоз.

Грудное молоко – отличная профилактика сепсиса
После перенесенного сепсиса организм ребенка слишком ослаблен. Велика вероятность частых респираторных заболеваний, пиелонефрита, цистита, энцефалопатии.
Профилактика
Профилактические мероприятия важны еще во время беременности. Женщина должна вылечить все инфекционные заболевания. Для поддержания иммунитета важны правильное питание, здоровый образ жизни.
Профилактика внутрибольничного инфицирования зависит от медперсонала. Медики должны придерживаться правил личной гигиены, дезинфицировать руки и инструменты. Важно соблюдение санитарно-эпидемиологического режима в роддоме.
После выписки родители должны наблюдать за самочувствием малыша, в случае отклонений немедленно обращаться к педиатру. Чтобы предотвратить страшные последствия сепсиса, необходимо вовремя его обнаружить.
У многих пациентов уже до начала лечения выявляются лихорадка и нейтропения. Нераспознанные инфекции могут быстро диссеминировать и закончиться фатально, поэтому недопустима отсрочка назначения антибиотиков до появления развернутой клинической картины.
Наиболее важным предрасполагающим фактором развития инфекций является нейтропения. Риск инфекции зависит от уровня и длительности постцитостатической нейтропении и возрастает при количестве нейтрофилов меньше 1 • 10 9 /л.
При развитии агранулоцитоза (нейтрофилов меньше 0,5 • 10 9 /л) вероятность инфекции очень велика, а при количестве нейтрофилов меньше 0,1 • 10 9 /л инфекции развиваются у большинства пациентов и имеют чрезвычайно тяжелое течение.
До середины 1980-х годов грамотрицательные бактерии кишечного происхождения были причиной 70-80% бактериальных инфекций у больных острым лейкозом. В настоящее время 60-80% бактериальных инфекций вызывается грамположительными микроорганизмами. Это обусловлено:
1) использованием сосудистых катетеров;
2) проведением деконтаминации кишечника, подавляющей грамотрицательную микрофлору;
3) выбором антибактериальных препаратов для эмпирической антибактериальной терапии.
Наряду с бактериальными инфекциями большое значение у больных с нейтропенией имеют грибковые (кандидоз, аспергиллез), вирусные (вызванные herpes simplex и zoster, ЦМВ) и протозойные инфекции.
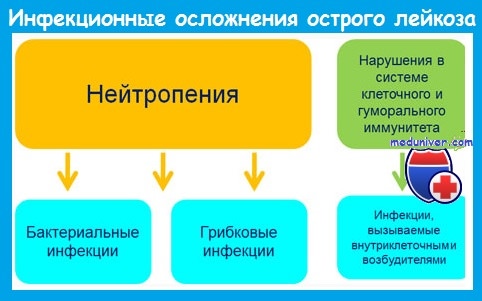
Инфекционные осложнения при остром лейкозе отличаются атипичным течением. Это обусловлено следующими обстоятельствами:
1) агранулоцитоз существенно изменяет реакцию организма на инфекционный агент, что клинически чаще всего проявляется развитием фебрильной температуры без других признаков локальной или системной инфекции;
2) многие антибиотики нарушают микрофлору больного, подавляют чувствительные микроорганизмы и способствуют пролиферации резистентных бактерий и грибов рода Candida (суперинфекция);
3) большое влияние на защитные механизмы оказывает химиотерапия, вызывающая миелосупрессию и повреждение эндотелия;
4) глюкокортикостероиды, часто вводимые больным как часть специфической терапии, также отрицательно влияют на защитные механизмы;
5) интубация, зондовое энтеральное питание и использование сосудистых катетеров вызывают нарушение целостности кожных покровов и/или повреждение слизистых оболочек.
В связи с высокой вероятностью развития инфекционных осложнений у больных острым лейкозом разработан комплекс профилактических мероприятий:
1) изоляция больного в период нейтропении, которая обеспечивает снижение частоты инфекций, передающихся воздушно-капельным путем;
2) обработка кожи и слизистых оболочек дезинфицирующими растворами (хлоргексидин и др.);
3) деконтаминация кишечника (per os назначаются неабсорбируемые антибактериальные препараты, например канамицин, и противогрибковые средства, чаще всего нистатин или суспензия амфотерицина В), позволяющая снизить количество грамотрицательных организмов кишечного происхождения;
4) гигиена ротовой полости (регулярное полоскание и использование мягких зубных щеток с целью предотвращения травмирования десен);
5) системная профилактика (бисептол или фторхинолоны);
6) отказ от ректальных и вагинальных манипуляций (кроме проводимых по неотложным и жизненным показаниям);
7) назначение препаратов гранулоцитарного или гранулоцитарно-моноцитарного колониестимулирующего фактора (КСФ) для более быстрого восстановления нейтрофилов и уменьшения вероятности инфекционных осложнений.
Показанием к назначению эмпирической антибактериальной терапии на фоне агранулоцитоза является фебрильная температура тела (выше 38 °С) более 2 часов, не связанная с инфузиями или аллергическими реакциями. Оптимально сочетание антипсевдомонального пенициллина или цефалоспорина с аминогликозидом.
Допустима монотерапия цефалоспорином 3-го или 4-го поколения или карбепенемом, например имепенемом. При отсутствии эффекта в течение 2-3 суток необходимо дополнение эмпирической антибактериальной терапии ванкомицином; в случае сохранения лихорадки в течение 4-6 дней назначается амфотерицин В в связи с высокой вероятностью системной грибковой инфекции. После идентификации возбудителя проводится целенаправленная антибактериальная, противовирусная и антимикотическая терапия.
Антибактериальная терапия проводится до повышения абсолютного содержания нейтрофилов в крови больше 0,5 • 10 9 /л и нормализации температуры тела. Длительность терапии у пациентов с документированной инфекцией должна быть не менее 10-14 дней.
Трансфузии гранулоцитов используются крайне редко. Единственным показанием к трансфузии является развившийся на фоне агранулоцитоза бактериальный сепсис при отсутствии ответа на адекватную антибактериальную терапию.
В гематологии и реаниматологии достаточно новым направлением является интенсивная терапия больных с заболеваниями системы крови. Определенно можно сказать, что ее развитие связано с успехами современной противоопухолевой химиотерапии, благодаря которой стало возможным излечивать многие опухолевые заболевания системы крови, считавшиеся ранее фатальными.
Увеличение агрессивности химиотерапии, трансплантация стволовых гемопоэтических клеток повышают эффективность лечения, но в то же время сопровождаются ростом числа угрожающих жизни осложнений.
Нуждаются в изучении и могут отличаться от таковых у пациентов, не страдающих заболеваниями кроветворной системы: этиология, патогенез, клинические проявления; структура и методы лечения критических состояний у больных в условиях опухолевого роста, депрессии одного или нескольких ростков кроветворения тяжелой иммуносупрессии.
Септический шок – наиболее частое и грозное осложнение в гематологии. Данная патология является причиной госпитализации в реанимационное отделение и летальных исходов больных с заболеваниями системы крови.
Проведен анализ результатов клинико-лабораторного и инструментального обследования 34 больных с острым лейкозом в возрасте от 0 до 18 лет, находившихся на лечении в отделении реанимации, интенсивной терапии и анестезиологии (ОРИТА) онкогематологических больных Научного центра педиатрии и детской хирургии за период с января по июнь 2013 г.
Из 34 больных септический шок (СШ) был диагностирован у 14 (36%).
По возрасту пациенты распределились следующим образом: от 0 до 5 лет – 3 ребенка, от 5 до 10 лет – 4, от 10 до 15 лет – 6, старше 15 – 1 ребенок, т.е. СШ чаще наблюдался у детей старшего возраста.
По половому признаку различий не отмечалось, мальчиков и девочек было одинаковое количество.
Все больные с СШ до поступления в ОРИТА получали химиотерапию по протоколу БФМ-ОЛЛ и БФМ-ОМЛ. Из 14 пациентов с СШ на I протоколе получали лечение 4 ребенка, на II протоколе – 3 ребенка, блоки высокого риска и рецидивные получили 3 ребенка, блок для ОМЛ (HAM) – 1 ребенок. У одного больного ухудшение состояния развилось после лучевой терапии.
Периодом наибольшего риска присоединения инфекции у иммунокомпроментированных больных является нейтропения длительностью более 14 дней, на фоне которой достоверно чаще развиваются сопутствующие инфекции другой этиологии.
Так, у наших пациентов уже при поступлении в ОРИТА панцитопения регистрировалась у 7 детей (50%), нейтропения у 6 (42,9%), гиперлейкоцитоз отмечался у 2 (14,2%) детей (первичный пациент только с установленным диагнозом ОЛЛ).
Из 14 детей с СШ тромбоцитопения ниже критического уровня наблюдалась у 13 (92,8%) детей, у 7 (53,8%) из которых осложнилась тяжелым геморрагическим синдромом, у 1 (7,7%) – геморрагическим шоком, у 1 (7,7%) – нарушением мозгового кровообращения и у 3 (21,4%) детей – постгеморрагической тяжелой анемией III степени.
Инфекционные осложнения при поступлении в ОРИТА были представлены у всех больных пневмонией, в том числе осложненной плевритом у 4 (28,6%), кардитами, осложненными экссудативным перикардитом у 11 (78,6%) детей; у 2 (14,3%) детей пневмония была грибковой этиологии. У всех больных пневмония сочеталась с другими инфекционными очагами.
Энтероколит с язвенно-некротическим поражением ЖКТ наблюдался у 7 (50%) детей, реже встречались пансинусит – у 2 (14,3%), проктит – у 1 (7,1%), флебит периферической вены – у 1 (7,1%) ребенка.
При микробиологическом исследовании различных локусов (зев, нос, кровь, моча, кал, мокрота) выявление патогенной микрофлоры отмечалось в основном в зеве и в носу, мокроте и в одном случае в крови. Всего при исследовании было выявлено 32 положительных результата.
Микробиологическое исследование зева и носа показало наличие патогенных микроорганизмов у 10 (71,4%) больных, при исследовании мокроты – у 3 (21,4%) больных. Положительные результаты микробиологических исследований были выявлены именно у тех пациентов, которые имели наибольшее количество комбинированных осложнений.
Этиологическая структура инфекционных осложнений в 78,1% случаев была представлена грамположительными микроорганизмами, в 9,3% грамотрицательными микроорганизмами и в 12,5% – грибами. Ассоциации микроорганизмов наблюдались в 85,7% случаев.
Среди грамположительных микроорганизмов доминировали стафилококки (68%), из них St. aureus составил 5 (29,4%) случаев, St. Epidermidis – 5 (29,4%), St. Hаemolyticus – 7 (41,2%) случаев. В 8 (25%) случаях выявлялись стрептококки. Среди грамотрицательных в 2 (6,2%) случаях выявлялся Ps. aeruginosa и в 1-м (3,1%) Klebsiella. Грибы у пациентов с СШ выявлялись в 4 случаях, из них Candida отмечалась у 2 детей, у 1 – Aspergillius и у 1 – Mucor.
В биохимическом анализе крови у 7 (50%) детей было увеличение уровня билирубина и трансаминаз (АЛТ, АСТ).
В коагулограмме у всех больных было значительное снижение протромбинового индекса, в среднем значение этого показателя – 46,5%, удлинение АПТВ отмечалось у 5 (35%) детей, гипофибриногенемия у 7 (50%), средний показатель – 1,0 г/л, и гипопротеинемия у 4 (28,5%) детей, средний показатель общего белка – 39 г/л.
Гемодинамические нарушения имели место у 10 (71,4%) пациентов с СШ, из них в виде артериальной гипотонии с брадикардией у 1 пациента, у остальных наблюдалась тахиаритмия (90%).
Кислотно-газовый состав определялся только у 4 детей, которые находились на искусственной вентиляции легких. Отмечались резкое повышение лактата (от 4,6 до 17 ммоль/л), изменение ВЕ, рН крови у 2 детей был в пределах 7,0.
Из 14 больных с СШ 8 (57,1%) детей умерли, из них 2 (25%) ребенка умерли в первые сутки с момента поступления в ОРИТА. У всех умерших пациентов отмечалась комбинация нескольких инфекционных осложнений (от 5 и более).
Анализ микробиологического исследования показал, что грибы выявлялись только в группе умерших больных и были выделены из крови и из некротического поражения кожи.
1. Риск развития СШ у пациентов с лейкозом наблюдается на фоне лечения по протоколам I, II и блоков высокого риска и противорецидивных блоков, т.к. эти схемы терапии включают в себя применение кортикостероидов длительными курсами или в большой дозировке.
2. СШ чаще развивается у больных с лейкозом в период панцитопении или выраженной нейтропении, которая в нашем исследовании наблюдалась в 92%.
3. Среди инфекционных осложнений представляет большую опасность и риск развития СШ у больных с лейкозом пневмонии грибковой этиологии и язвенно-некротическое поражение желудочно-кишечного тракта (50%).
4. В этиологической структуре инфекционных осложнений в 78,1% преобладала грамположительная флора, среди которой доминирующими (в 68% случаев) были стафилококки и на втором месте (в 12,5%) грибы.
5. В 71,4% случаев у онкогематологических больных имели место гемодинамические нарушения в виде артериальной гипотензии, в основном с тахиаритмией.
Что такое Лейкоз у детей -
Лейкоз у детей (лейкемия) – заболевание, которое сопровождается нарушением костномозгового кроветворения и замещением нормальных клеток крови незрелыми бластными клетками лейкоцитарного ряда. Из ста тысяч детей болеет около 4-5. Среди детских онкологических заболеваний удельный вес случаев лейкоза составляет 30%, рак крови поражает наиболее часто малышей от 2 до 5 лет.
В последние годы заболеваемость пациентов маленького возраста растет, высокая летальность всё еще сохраняется.
Формы лейкоза у детей:
- острая (менее 2 лет)
- хроническая (от 2 лет)
В 97 случаях из 100 у детей диагностируют острый лейкоз. Особая его форма – врожденная.
Виды острого лейкоза:
Касательно течения заболевания, исследователи выделяют 3 стадии, от которых зависит тактика терапии:
- I – острая фаза лейкоза у детей
- II – неполная или полная ремиссия
- III - рецидив лейкоза у детей
Что провоцирует / Причины Лейкоза у детей:
Сегодня доказанной является роль онкогенных вирусных штаммов, радиационного излучения, наследственной предрасположенности, химических факторов, эндогенных нарушений на возникновение лейкоза у детей. Лейкоз вторичный может появиться в результате лучевой или химиотерапии, которые были проведены для лечения другого заболевания (окнологического).
- синдром Клайнфельтера
- синдром Ли-Фраумени
- синдром Блума
- синдром Вискотт-Олдрича
- первичные иммунодефициты
- анемия Фанкони
- полицитемия и т.д.
Факторы риска при лейкозах у детей
Факторами риска считаются любые влияния, которые увеличивают вероятность заболевания ребенка лейкозом. Сюда относят вредные привычки, нездоровое питание, многочасовое пребывание на солнце. Важную роль играют генетические факторы риска, которые были перечислены выше.
Если у одного из сиблингов в возрасте до 6 лет возник острый лейкоз, то вероятность 20-25%, что лейкоз обнаружат со временем и у второго сиблинга.
Больные, которые получают интенсивную терапию с целью угнетения иммунных функций, имеют повышенный риск развития опухолей, особенно лимфоидной системы, в том числе острого лимфобластного лейкоза.
Патогенез (что происходит?) во время Лейкоза у детей:

У нормальной кроветворной клетки снижается резистентность и повышается чувствительность к действию различных канцерогенов и коканцерогенов. Далее клетка мутирует. Кроветворная клетка превращается в опухолевую. Далее следует опухолевая прогрессия. Причем сначала длительный период происходит безграничная моноклональная пролиферация — так называемая доброкачественная прогрессия.
Следующий этап патогенеза – повторная мутация опухолевых клеток, которые приводят к появлению субклонов-поликлонов. Как итог – происходит злокачественная опухолевая прогрессия. Для всех лейкозных клеток, как было доказано исследователями, характерны выраженные расстройства их структуры, метаболизма, гистохимических особенностей и функций.
Продолжительность существования бластных клеток удлиняется, а функциональная активность (фагоцитарная, двигательная, ферментативная, регуляторная) снижается.
Симптомы Лейкоза у детей:
Лейкоз проявляется неспецифическими симптомами:
- нарушения сна
- утомляемость
- оссалгии
- снижение аппетита
- артралгии
- повышение температуры без причины
В некоторых случаях первым проявлением лейкоза у детей будет геморрагический или интоксикационный синдром.
В части случаев проявляются и такие симптомы лейкоза у детей:
- бледность слизистых и кожи
- желтушный или землистый тон кожи
- стоматит
- гингивит
- тонзиллит
- сиаладенопатия
- лимфаденопатия
- гепатоспленомегалия
Типичные проявления острого лейкоза в детском возрасте:
- гематурия
- кровоизлияния в кожу и слизистые оболочки
- маточные, носовые, легочные, желудочно-кишечные кровотечения
- кровоизлияния в полость суставов
При остром лейкозе у детей может быть выявлен анемический синдром, который возникает как следствие угнетения эритропоэза и кровотечений. Кардиоваскулярные расстройства при лейкозе у ребенка могут проявляться аритмией, тахикардией, диффузными изменениями миокарда (могут быть выявлены по ЭКГ), расширением границ сердца (видно на рентгенограмме), снижением фракции выброса.
Интоксикационный синдром при лейкозе (лейкемии) у детей проявляется так:
- лихорадка
- значительная слабость
- анорексия
- потливость
- гипотрофия
- тошнота и/или рвота
Среди осложнений лейкемии у детей выделяют лейкемическую инфильтрацию головного мозга, мозговых оболочек и нервных стволов. Нейролейкоз проявляется головными болями, головокружением, диплопией, тошнотой, ригидностью затылочных мышц. При инфильтрации вещества спинного мозга возможно развитие парапареза ног, нарушения чувствительности, тазовых расстройств.
Диагностика Лейкоза у детей:
При подозрении на лейкоз ребенка должен исследовать педиатр, а потом детский онкогематолог. Основной диагностики являются лабораторные методы: исследование периферической крови и костного мозга.
При остром лейкозе у ребенка выявляют в общем анализе крови типичные изменения:
- лейкоцитоз различной степени или лейкопения
- исчезновение базофилов и эозинофилов
Лейкоз диагностируют обязательно с проведением стернальной пункции и миелограммы. О болезни говорит содержание бластных клеток 30% и более. Если исследования костного мозга не дали четких результатов, ребенку делают трепанобиопсию. Чтобы определить вариант острого лейкоза, проводят такие исследования: иммунологические, цитохимические, цитогенетические.
Подтверждение диагноза проводится при участии детского офтальмолога и детского невролога. Также проводится в некоторых случаях рентгенография черепа, люмбальная пункция и исследование цереброспинальной жидкости, офтальмоскопия.
Вспомогательные методы диагностики лейкоза у детей:
- УЗИ слюнных желез
- УЗИ лимфоузлов
- УЗИ мошонки у мальчиков
- УЗИ печени и селезенки
- компьютерная томография у детей
- рентгенография органов грудной клетки
Лейкоз при диагностике врачи отличаются от лейкозоподобной реакции, которая бывает при коклюше, тяжелых формах туберкулеза, цитомегаловирусной инфекции, инфекционном мононуклеозе, сепсисе. При таких заболеваниях проявления лейкоза могут иметь обратимый характер.
Как установить стадию лейкоза?
Лейкозы стадируются не так, как большинство случаев рака. С самого начала болезни поражена периферическая кровь и костный мозг. Нужно выявить проникновение клеток лейкоза в селезенку, печень, лимфоузлы, ЦНС, яички, яичники.
Если в центральной нервной системе лейкозные клетки есть в большом количестве, то их фиксируют при помощи исследования спинномозговой жидкости под микроскопом. Если клетки выявлены, ребенку нужно более интенсивное лечение.
Прогностические факторы при лейкозе (лейкемии) у детей:
- Возраст на момент обнаружения болезни
- Возраст больного и исходное количество лейкоцитов
- Пол
- Количество лейкоцитов
- Раса
- Количество хромосом
- Иммунофенотипирование лейкозных клеток
- Ответ на лечение
- Хромосомные транслокации
Лечение Лейкоза у детей:
При обнаружении лейкоза ребенка нужно госпитализировать в специализированное учреждение онкогематологического профиля. Чтобы не возникли инфекционные осложнения, ребенка помещают в отдельный бокс, условия в котором максимально приближенны к стерильным. Рацион больного обязательно должен быть сбалансированным и полноценным.
Для лечения лейкозов необходима полихимиотерапия, направленная на полную эрадикацию лейкозного клона. При острых лимфобластных и миелобластных лейкозах необходима различная комбинация химиопрепаратов, дозы и способы введения.
Этапы лечения:
- достижение ремиссии болезни
- закрепление ремиссии
- поддерживающая терапия
- профилактика / лечение осложнений
Химиотерапию в части случаев дополняют активной и пассивной иммунотерапией: вакцинами БЦЖ, введением лейкозных клеток, интерферонами, противооспенной вакциной и т.д. Сегодня исследуется эффективность методов трансплантации пуповинной крови, костного мозга, стволовых клеток.
Также необходимо симптоматическое лечении при лейкемии у детей:
- проведение гемостатической терапии
- переливание эритроцитарной и тромбоцитарной массы
- дезинтоксикационные мероприятия (гемосорбция, внутривенные инфузии, плазмаферез, плазмосорбция)
- антибиотикотерапия инфекционных осложнений
Прогноз зависит от возраста ребенка, когда у него возник лейкоз, от стадии диагностирования и прочих факторов. Худший прогноз дают детям, у которых лейкоз возник в возрасте до 2-х лет и старше 10-ти лет; у детей с диагнозом гепатоспленомегалии и лимфаденопатии; с нейролейкозом на момент диагностирования лейкемии. Также плохой прогноз у детей с Т- и В-клеточными вариантами лейкоза, при бластном гиперлейкоцитозе.
Благоприятный прогноз при остром лимфобластном лейкозе L1 типа; в случаях раннего начала лечения, при быстром достижении ремиссии; у детей в возрасте 2-10 лет. У девочек с острым лимфобластным лейкозом вероятность излечение несколько выше, чем у мальчиков.
При непроведении специфического лечения лейкоза у детей, гарантирован смертельный исход. Современная химиотерапия позволяет обеспечить отсутствие рецидивов на протяжении 5 лет у большинства детей. О вероятном выздоровлении можно говорить, если рецидива лейкоза не было 6-7 лет.
Профилактика Лейкоза у детей:
Необходимо снизить факторы риска, которые перечислялись выше. Дети с известным фактором риска развития лейкоза, например, при синдроме Ли-Фраумени или синдроме Дауна, должны находиться под тщательным периодическим наблюдением.
Нужно избегать изменения климатических условий и физиотерапевтического лечения, чтобы не спровоцировать рецидив лейкоза у детей. Вакцинопрофилактика проводится по индивидуальному календарю с учетом эпидемической ситуации.
К каким докторам следует обращаться если у Вас Лейкоз у детей:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Лейкоза у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Euro lab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют Вас и окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Euro lab открыта для Вас круглосуточно.
Как обратиться в клинику:
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
У Вас ? Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Люди уделяют недостаточно внимания симптомам заболеваний и не осознают, что эти болезни могут быть жизненно опасными. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Читайте также:


