Сыворотка листериозная поливалентная сухая для ра на стекле
Сухая адсорбированная холерная О1 сыворотка готовится из крови лошадей, полученной после гипериммунизации холерными вибрионами сероваров Инаба и Огава в S-форме, инактивированными нагреванием до 100°С. Сыворотка адсорбирована убитыми Vibrio cholerae non O1 . В пробирочной реакции агглютинации титр антител сыворотки с гомологичными культурами составляет 1:1600 или выше, в реакции агглютинации на стекле – не менее 1:100. Препарат применяется для серологической идентификации штаммов Vibrio cholerae O1 .
Срок годности 5 лет.
Форма выпуска: ампулы по 1 мл.
Сухая неадсорбированная холерная О1 сыворотка готовится из крови кроликов, полученной после гипериммунизации холерными вибрионами сероваров Инаба и Огава в S-форме, инактивированными нагреванием до 100°С. В пробирочной реакции агглютинации титр антител сыворотки с гомологичными культурами составляет 1:1600 или выше, в реакции агглютинации на стекле – не менее 1:100. Препарат применяется для серологической идентификации штаммов Vibrio cholerae O1 .
Срок годности 5 лет.
Форма выпуска: ампулы по 1 мл.
Сухая холерная диагностическая сыворотка серотипа Огава готовится из крови лошадей, полученной после гипериммунизации холерными вибрионами серовара Огава в S-форме, инактивированными нагреванием до 100°С, с последующей адсорбцией сыворотки убитыми клетками Vibrio cholerae Инаба. В пробирочной реакции агглютинации титр сыворотки с гомологичными культурами составляет не менее 1:400, в реакции агглютинации на стекле – не менее 1:25. Препарат применяется для определения принадлежности холерного вибриона к серовару Огава.
Срок годности 5 лет.
Форма выпуска: ампулы по 1 мл.
Сухая холерная диагностическая сыворотка серотипа Инаба готовится из крови лошадей, полученной после гипериммунизации холерными вибрионами серовара Инаба в S-форме, инактивированными нагреванием до 100°С, с последующей адсорбцией сыворотки убитыми клетками Vibrio cholerae Огава. В пробирочной реакции агглютинации титр антител сыворотки с гомологичными культурами составляет не менее 1:400, в реакции агглютинации на стекле – не менее 1:25. Препарат применяется для определения принадлежности холерного вибриона к серовару Инаба.
Срок годности 5 лет.
Форма выпуска: ампулы по 1 мл.
Сухая диагностическая туляремийная сыворотка готовится из крови лошадей, полученной после гипериммунизации смесью культур трех вирулентных штаммов туляремийного микроба, инактивированного формалином. В пробирочной реакции агглютинации титр антител сыворотки с гомологичными культурами составляет не менее 1:3200, в реакции кольцепреципитации не менее 1:20. Препарат применяется для идентификации туляремийного микроба в пробирочной реакции агглютинации и обнаружения его антигенов в органах павших животных в реакции кольцепреципитации.
Срок годности 5 лет.
Форма выпуска: ампулы по 1 мл.
Диагностикум туляремийный цветной лиофилизированный представляет собой взвесь туляремийного микроба, инактивированную формалином и окрашенную гематоксилином. Рабочее разведение препарата не менее 1:16. Препарат в рабочем разведении в микрореакции агглютинации агглютинируется туляремийной диагностической сывороткой до титра антител 1:1280 и выше; цельный диагностикум в реакции агглютинации на стекле – в разведении 1:10. Препарат применяется для обнаружения туляремийных антител в сыворотках крови людей и животных.
Срок годности 5 лет.
Форма выпуска: ампулы по 1 мл.
Сухая бруцеллезная диагностическая сыворотка готовится из сыворотки крови кроликов, гипериммунизированных бруцеллами вакцинного штамма B. abortus 19ВА в S-форме, инактивированными нагреванием до 100°С или добавлением формалина. В пробирочной реакции агглютинации титр антител сыворотки с гомологичными культурами составляет не менее 1:1600, в реакции агглютинации на стекле – не менее 1:25. Препарат применяется для идентификации бруцелл.
Срок годности 5 лет.
Форма выпуска: ампулы по 1 мл.
Диагностикум бруцеллезный цветной лиофилизированный представляет собой взвесь бруцеллезного микроба, инактивированную формалином и окрашенную гематоксилином. Рабочее разведение препарата не менее 1:16. Препарат в рабочем разведении в микрореакции агглютинации и пробирочной реакции агглютинации агглютинируется бруцеллезной диагностической сывороткой до титра антител 1:800 и выше; цельный диагностикум в реакции агглютинации на стекле (Хеддльсона) агглютинируется на четыре креста в сыворотке объемом 0,04, 0,02 и 0,01 мл. Препарат применяется для выявления специфических антител в сыворотке крови больных бруцеллезом людей и животных.
Срок годности 5 лет.
Форма выпуска: ампулы по 1 мл.
Сухая листериозная диагностическая сыворотка готовится из крови кроликов, гипериммунизированных культурой вирулентного штамма Listeria monocytogenes, инактивированной нагреванием до 100°С. В реакции агглютинации на стекле титр антител сыворотки с гомологичной культурой составляет не менее 1:100. Препарат применяется для идентификации возбудителя листериоза.
Срок годности 5 лет.
Форма выпуска: ампулы по 1 мл.
Сыворотка лошадиная нормальная готовится из крови лошади. Сыворотка не содержит консерванта. Препарат предназначен для добавления в питательные среды, применяемые для выделеия и культивирования микроорганизмов (коринебактерий, нейссерий, стрептококков и др.) при диагностике соответствующих инфекций и может использоваться при определении токсигенности дифтерийного микроба.
Срок годности 2 года.
Форма выпуска: флаконы по 40 мл.
Сыворотка не содержит консерванта. Препарат предназначен для добавления в бактериологические питательные среды, применяемые для культивирования микроорганизмов (коринебактерий, нейссерий, стрептококков и др.) при диагностике соответствующих инфекций. Может использоваться при определении токсигенности дифтерийного микроба.
Срок годности 2 года.
Форма выпуска: флаконы по 40 мл.
Препарат представляет собой дефибринированную кровь барана. Кровь не содержит консерванта.
Срок годности 2 года.
Форма выпуска: флаконы или пробирки от 5 мл до 200 мл.
Набор реагентов «Сыворотки диагностические сальмонеллезные адсорбированные О-поливалентные для реакции агглютинации" предназначен для идентификации с помощью реакции агглютинации (РА) на предметном стекле бактерий рода Salmonella, выделенных из биологического материала человека (моча, испражнения, промывные воды желудка, рвотные массы).
Описано более 2400 патогенных сероваров сальмонелл, вызывающих у человека острые гастроэнтериты, тифоподобные и септикопиемические формы заболевания, объединенных под названием сальмонеллез. Основными возбудителями сальмонеллеза являются Salmonella сероваров enteritidis, typhi murium, cholerae-suis, haifa и т.д.
Набор реагентов «Сыворотки диагностические сальмонеллезные адсорбированные О-поливалентные для реакции агглютинации" предназначен для идентификации таких бактерий с целью назначения правильного лечения больного.
Набор выпускается в 4 вариантах комплектации:
Комплект №1 Сальмонеллезная поливалентная О-сыворотка основных групп (А, В, С, D , E ):
Комплект №1/1 - Сальмонеллезная поливалентная О-сыворотка основных групп, сухая;
Комплект №1/2 - Сальмонеллезная поливалентная О-сыворотка основных групп, жидкая;
Комплект №2 Сальмонеллезная поливалентная О-сыворотка редких групп:
Комплект №2/1 - Сальмонеллезная поливалентная О-сыворотка редких групп, сухая;
Комплект №2/2 - Сальмонеллезная поливалентная О-сыворотка редких групп, жидкая.
Каждый вариант комплектации в 2 исполнениях.
СОСТАВ И КОМПЛЕКТАЦИЯ НАБОРА
Комплект №1 Сальмонеллезная поливалентная О-сыворотка основных групп (А,В,С,D,E)
сухая иммунная адсорбированная сыворотка крови кролика или барана, содержащая О-агглютинины против антигенов 1;2;3,4;5;6.1;6.2;7;8;9;10;12,Vi; инактивированная; аморфная масса белого или кремового цвета
жидкая иммунная адсорбированная сыворотка крови кролика или барана, содержащая О-агглютинины против антигенов 1;2;3,4;5;6.1;6.2;7;8;9;10;12,Vi; инактивированная; бесцветная или розовато-желтого цвета жидкость
Комплект №2 Сальмонеллезная поливалентная О-сыворотка редких групп
сухая иммунная адсорбированная сыворотка крови кролика или барана следующих групп (F; G; H, I, J, K, L, M, N, O, P, Q, R, S, T, U, W, V, X,Y, Z,52,53,54' 55,57, 58, 59, 60, 61), содержащая О-агглютинины против антигенов 11;13, 22; 14, 24; 23; 24; 25; 16; 17; 18; 21;28; 30; 35; 38; 39; 40; 41; 42; 43; 44; 45; 47; 48; 50; 52; 53; 54; 55; 57; 58; 59; 60; 61); инактивированная; аморфная масса белого или кремового цвета
жидкая иммунная адсорбированная сыворотка крови кролика или барана следующих групп (F; G; H, I, J, K, L, M, N, O, P, Q, R, S, T, U, W, V, X,Y, Z,52,53,54' 55,57, 58, 59, 60, 61), содержащая О-агглютинины против антигенов 11;13, 22; 14, 24; 23; 24; 25; 16; 17; 18; 21;28; 30; 35; 38; 39; 40; 41; 42; 43; 44; 45; 47; 48; 50; 52; 53; 54; 55; 57; 58; 59; 60; 61); инактивированная; бесцветная или розовато-желтого цвета жидкость
Компоненты набора упакованы в коробку, в коробку вложена инструкция по применению сокращенная схема антигенной структуры бактерий сальмонеллезной группы.
ОСНОВНЫЕ ПОТРЕБИТЕЛЬСКИЕ ХАРАКТЕРИСТИКИ
Базовые варианты комплектов набора рассчитаны на исследование 200 (исполнение 1) или 40 образцов (исполнение 2).
ПРИНЦИП ДЕЙСТВИЯ
Адсорбированные сыворотки содержат антитела, которые агглютинируют культуры сальмонелл, содержащие гомологичные О-антигены, и не агглютинируют культуры сальмонелл, содержащие гетерологичные О-антигены.
ИССЛЕДУЕМЫЕ ОБРАЗЦЫ
Исследуется культура, выделенная при бактериологических исследованиях из биологического материала (моча, испражнения, промывные воды желудка, рвотные массы) и выращенная в пробирках на скошенном питательном агаре в течение 18-20 ч при температуре 37 0 С.
Допускается хранение выделенной культуры на питательном агаре при температуре +2 -+8 в течение 2 суток.
АНАЛИТИЧЕСКИЕ И ДИАГНОСТИЧЕСКИЕ ХАРАКТЕРИСТИКИ
Аналитическая чувствительность: определяется с гомологичными музейными тест-штаммами Salmonella и составляет 100%
Аналитическая специфичность: определяется с гетерологичными музейными тест-штаммами Salmonella и составляет 100%
Воспроизводимость результатов составляет 100%.
Диагностическая чувствительность (с доверительной вероятностью 95%) составила:
Музейные тест-штаммы Salmonella - 98,07%-100%;
Культуры Salmonella, выделенные из клинического материала пациентов - 98,25%-100%.
Диагностическая специфичность (с доверительной вероятностью 95%) составила:
Музейные тест-штаммы Salmonella - 98,07%-100%;
Культуры Salmonella, выделенные из клинического материала пациентов - 98,25%-100%.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Набор биологически безопасен, однако с исследуемыми образцами необходимо обращаться как с потенциально инфицированным материалом.
Потенциальный риск применения набора – класс 2б (Приказ МЗ РФ №4н от 6 июня 2012 г.).
Меры предосторожности при работе с набором – соблюдение правил "Инструкции по мерам профилактики распространения инфекционных заболеваний при работе в клинико-диагностических лабораториях лечебно-профилактических учреждений" (Утв. Минздравом СССР 17 января 1991 г.), ГОСТ Р 52905–2007 (ИСО 15190:2003).
Утилизацию или уничтожение, дезинфекцию наборов реагентов следует проводить в соответствии с СанПиН 2.1.7.2790-10 "Санитарно-эпидемиологические требования к обращению с медицинскими отходами" и МУ 287-113 "Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения".
СПОСОБ ПРИМЕНЕНИЯ
Оборудование и материалы (для "ручной" постановки)
Холодильная камера с температурным режимом 2-8 0 С;
Пипетки полуавтоматические с рабочими диапазонами: 5-50 мкл, 20-200 мкл;
Одноразовые наконечники к указанным пипеткам;
Контейнеры для жидких и твердых отходов;
Резиновые или латексные перчатки, средства дезинфекции;
Лупа с увеличением (2х);
0,9 % раствора хлористого натрия;
Термостат суховоздушный, поддерживающий температуру (37 ± 1) °С;
70 %-ный раствор спирта этилового и 6 %-ный раствор перекиси водорода (дез.растворы) или растворы иных дезинфектантов, разрешенных к применению СП 1.32322-08.
СПОСОБ ПРИМЕНЕНИЯ
Постановка РА на стекле
Сальмонеллезная поливалентная О-сыворотка
Сухую сыворотку растворяют в 2 мл 0,9% водного раствора хлористого натрия
На предметное стекло наносят одну каплю (около 50 мкл) сыворотки и одну каплю 0,9% водного раствора хлористого натрия. Идентифицируемую культуру, выращенную в пробирках на скошенном питательном агаре в течение 18-20 ч при температуре 37 о С, снимают с верхней части агара петлей, наносят на предметное стекло вблизи капли 0,9% водного раствора хлористого натрия и эмульгируют (контроль на отсутствие спонтанной агглютинации). При отсутствии спонтанной агглютинации манипуляцию повторяют в капле О - сыворотки, формируя равномерную непрозрачную суспензию. Учет результатов проводят в течение 1-2 минут, мягко покачивая стекло. Гомогенная суспензия свидетельствует об отрицательном результате.
При наличии агглютининов к исследуемому штамму в капле сыворотки в течение 1 -2 мин появляется хлопьевидный агглютинат.
Учет результат РА производят визуально при помощи лупы с увеличением(2х) по четырехкремстной системе
Результаты РА учитываются и оцениваются следующим образом:
++++ – отчетливый агглютинат при полном просветлении жидкостив капле (100%).
+++ – отчетливый аггютинат на фоне мутноватой жидкости (75%)
++ – незначительный агглютинат на фоне мутной жидкости (50%)
+ – следы агглютината, жидкость в капле мутная (25%)
(–) – отрицательный результат, гомогенно мутная жидкость в капле (0%).
РА с диагностической сывороткой учитывается только при отрицательном результате контроля спонтанной агглютинации.
Исследуемую культуру относят к соответствующей О-группе, если на стекле получена РА с поливалентной сывороткой этой группы не ниже чем на (+++).
СРОК ГОДНОСТИ
Комплект №1/1, №1/2. Сальмонеллезная поливалентная О-сыворотка, сухая - 3 года со дня приемки ОБТК предприятия-изготовителя.
Комплект №2/1, №2/2. Сальмонеллезная поливалентная О-сыворотка, жидкая- 1 год со дня приемки ОБТК предприятия-изготовителя.
ХРАНЕНИЕ И ТРАНСПОРТИРОВАНИЕ
Хранение
В упаковке предприятия-изготовителя при температуре от 2 о С до 8 о С. Замораживание не допускается.
После вскрытия упаковок неиспользованные реагенты допускается хранить в плотно закрытых упаковках при температуре от 2 до 8 о С в течение 1 мес.
Транспортирование
При температуре от 2 до 8 о С транспортом всех видов в крытых транспортных средствах в соответствии с правилами перевозок, действующими на транспорте данного вида. Замораживание не допускается. Допускается транспортирование при температуре от 9 о С до 25 о С в течение 14 сут.
3000.00 грн

Сыворотка сальмонеллезная ABCDE (Poly A-E + Vi), 1 мл, SSI Diagnostica, ДанияПрименениеБыстрый ..
Сыворотка сальмонеллезная ABCDE (Poly A-E + Vi), 3 мл, SSI Diagnostica, ДанияПрименениеБыстрый ..

Сыворотка шигеллезная, 3 мл, SSI Diagnostica, ДанияПрименениеИммунные сыворотки шигеллы от SSI Diagn..

Сыворотка эшерихииозная, 3 мл, SSI Diagnostica, ДанияПрименениеСыворотка эшерихиозная от SSI Di..

Сыворотка сальмонеллезная Salmonella, 2 мл, DENKA SEIKEN, ЯпонияSalmonella относятся к семейству Ent..

Сыворотка эшерихиозная E. coli, 2 мл, DENKA SEIKEN, ЯпонияEscherichia coli это группа грамотрицатель..
Сыворотки диагностические эшерихиозные ОК-поливалентные сухие для реакции агглютинации (РА) представ..

Сыворотки диагностические эшерихиозные ОК-поливалентные сухие для реакции агглютинации (РА) представ..

Сыворотки диагностические эшерихиозные ОК-поливалентные сухие для реакции агглютинации (РА) представ..

Сыворотки диагностические эшерихиозные ОК-поливалентные сухие для реакции агглютинации (РА) представ..

Сыворотки диагностические эшерихиозные ОК-поливалентные жидкие для реакции агглютинации (РА) предста..

Набор реагентов «Сыворотки диагностические сальмонеллезные адсорбированные H-моновалентные для реа..

Набор реагентов «Сыворотки диагностические сальмонеллезные адсорбированные H-пуловые для реакции а..

Набор реагентов «Сыворотки диагностические сальмонеллезные адсорбированные H-поливалентные для реа..

Набор реагентов «Сыворотки диагностические сальмонеллезные адсорбированные О-моновалентные-плюс для..

Набор реагентов «Сыворотки диагностические сальмонеллезные адсорбированные О-поливалентные для реакц..

Набор реагентов «Сыворотки диагностические сальмонеллезные адсорбированные О-поливалентные для реакц..
Страницы: 1 (всего товаров - 11)
Форма выпуска: Жидкий глобулин для подкожного введения, а также применения в виде глазных и назальных капель. Флакон 3 мл (1 доза)
Показания к применению: Назначают собакам для специфической профилактики и лечения чумы, парвовирусного энтерита и аденовирусной инфекции
Единица измерения: 1 доза
Форма выпуска: Раствор для инъекций. Флакон 3 мл (1 доза)
Показания к применению: Назначают собакам для специфической профилактики и лечения чумы, парвовирусного энтерита и аденовирусной инфекции
Единица измерения: 1 доза

Форма выпуска: Ампула 1 мл (1 доза)
Показания к применению: Назначают кошкам и другим животным семейства кошачьих для специфической профилактики и лечения панлейкопении, инфекционного ринотрахеита, калицивироза и хламидиоза
Единица измерения: 1 доза
Форма выпуска: Ампула 1 мл (1 доза)
Показания к применению: Назначают кошкам и другим животным семейства кошачьих для специфической профилактики и лечения панлейкопении, инфекционного ринотрахеита, калицивироза и хламидиоза
Единица измерения: 1 доза
Форма выпуска: Сыворотка для подкожного или внутримышечного введения. Расфасовывают во флаконах по 2 мл (1 доза)
Показания к применению: Назначают собакам для специфической профилактики и лечения чумы плотоядных коронавирусной, аденовирусной и парвовирусной инфекции
Единица измерения: Флакон
Форма выпуска: Флакон 2 мл (1доза). В упаковке 10 флаконов (10 доз)
Для кого предназначено: Для собак
Показания к применению: Иммуноглобулин поливалентный против чумы плотоядных, парвовирусного, коронавирусного энетритов и аденовирусных инфекций собак
Единица измерения: 1 доза
Форма выпуска: Бесцветная или слегка желтоватая, прозрачная или опалесцирующая жидкость с незначительным осадком на дне. Флакон 1 мл (1 доза)
Показания к применению: Применяют для профилактики и лечения панлейкопении, инфекционного ринотрахеита, калицивироза и хламидиоза кошек и других животных семейства кошачьих
Единица измерения: 1 доза

Форма выпуска: Флакон 100 мл
Для кого предназначено: Для сельхозживотных
Единица измерения: Флакон

Форма выпуска: Флакон 100 мл
Показания к применению: Назначают крупному рогатому скоту в целях специфической профилактики и лечения сальмонеллеза, пастереллеза, парагриппа и инфекционного ринотрахеита
Единица измерения: Флакон
Форма выпуска: Жидкость светло-желтого цвета с красноватым оттенком. Флакон 100 мл
Показания к применению: Назначают крупному рогатому скоту в целях специфической профилактики и лечения сальмонеллеза, пастереллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита.
Единица измерения: Флакон
Форма выпуска: Сыворотка против сальмонеллеза сельскохозяйственных животных и птиц для внутримышечного введения. Флаконы 100 мл
Показания к применению: Назначают телятам, ягнятам, поросятам, овцам и водоплавающей птице в целях специфической профилактики и лечения сальмонеллеза в неблагополучных или угрожаемых по данному заболеванию хозяйствах и индивидуальном секторе
Единица измерения: Флаконы
Рекомендуем:
Товары для животных:
Разделы каталога:
Подпишись на новости
ветаптеки VETLEK!
Применяют в целях специфической профилактики и лечения сальмонеллеза, пастереллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита у КРС.
553 руб.
- Код товара: syvorotka-protiv-pasterelleza-salmonelleza
Варианты доставки:
1) Почта России
2) ТК Деловые линии
3) Доставка курьером по Москве
4) Самовывоз г. Железнодорожный (м. Некрасовка)
Описание
Сыворотка против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота — биопрепарат, по внешнему виду представляет собой жидкость светло-желтого цвета с красноватым оттенком, при хранении образуется незначительный осадок, который легко разбивается при встряхивании флакона.
Состав
Сыворотка получена из крови волов, гипериммунизированных инактивированными штаммами возбудителей сальмонеллеза, эшерихиоза и пастереллеза, авирулентными штаммами вирусов парагриппа-3 и инфекционного ринотрахеита.
Фасовка
Стеклянные флаконы из темного стекла по 100 мл.
Фармакологические свойства
Гипериммунная сыворотка способствует формированию пассивного иммунитета к возбудителям сальмонеллеза, пастереллеза, кишечной палочки, инфекционного ринотрахеита и парагриппа-3 у крупного рогатого скота, напряженность которого составляет 10 дней. Для формирования напряженного активного иммунитета у животных к инфекциям применяются вакцины. Механизм действия сыворотки основан на связывании и нейтрализации патогенных антигенов специфическими антителами биопрепарата. Гипериммунная сыворотка эффективна для лечения указанных выше заболеваний, особенно на ранних стадиях инфекционного процесса и хорошо сочетается с препаратами, применяемыми для симптоматического лечения (противомикробные препараты и пробиотики).
Показания к применению
Назначают крупному рогатому скоту в целях специфической профилактики и лечения сальмонеллеза, пастереллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита.
Способ применения и дозы
Перед введением сыворотки необходимо простерилизовать шприцы и иглы. Для каждого животного используют отдельную стерильную иглу.
Перед использованием флакон необходимо энергично встряхнуть, а место укола обработать 70% этиловым спиртом. Перед введением флакон следует подогреть на водяной бане до температуры 36-38 ºС.
С профилактической целью сыворотку вводят животным подкожно двукратно с интервалом 7-10 дней:
- телятам по 20-30 мл,
- взрослому поголовью по 30-60 мл.
С лечебной целью сыворотку вводят внутримышечно или внутривенно в начальной стадии инфекционного заболевания:
- телятам по 40-60 мл,
- взрослому поголовью по 60-120 мл.
Отсутствие лечебного эффекта уже после инъекции свидетельствует о другой этиологии заболевания и для уточнения диагноза следует провести дополнительные лабораторные исследования.
Особые указания
Открытые флаконы с сывороткой, а также при наличии механических повреждений, плесени и не разбивающегося при встряхивании осадка подлежат обеззараживанию кипячением в течение 15 минут с последующей утилизацией.
Побочные действия
В очень редких случаях при повышенной индивидуальной чувствительности у животных возможны аллергические реакции.
Противопоказания
При применении сыворотки противопоказания не выявлены.
Период ожидания
Мясо и субпродукты, полученные от животных, которым применялась гипериммунная сыворотка, реализуются без ограничений.
Меры предосторожности
- При попадании сыворотки на кожу или слизистые оболочки рекомендуется промыть их большим количеством водопроводной воды.
- По окончании обработки руки следует тщательно вымыть теплой водой с мылом.
- Использованные флаконы и шприцы подлежат утилизации.
Условия хранения
Хранить в сухом, защищенном от прямых солнечных лучей и в недоступном для детей и животных месте. Отдельно от пищевых продуктов и кормов при температуре от 2 до 10 ºС.

С 2009 по 2015 гг. в хозяйствах Алматинской области РК проводили исследования по обнаружению возбудителя листериоза у 1 % животных. Ежегодно в стационарно неблагополучных хозяйствах области проводили бактериологические исследования биоматериала от больных и патматериала от павших животных по обнаружению возбудителя листериоза. Диагностические исследования проводились с использованием бактериологических, биохимических, серологических и генетических методов, постановкой биопробы.
Листериоз – инфекционная болезнь человека и многих видов животных, которая чаще всего встречается у овец и свиней, реже у крупного рогатого скота и коз, промысловых животных, пушных зверей, кроликов, домашних и диких птиц, лошадей, лисиц, хорьков, кур. Листериоз протекает либо в септической форме (кролики, морские свинки, мыши, поросята), либо с явлениями нервного синдрома и значительным расстройством центральной нервной системы (свиньи, крупный рогатый скот, овцы, лисы). Листериоз может сопровождаться абортами у крупного рогатого скота, овец и коз. Листериозу свойственны природная очаговость и стационарность.
В естественных условиях листериозом поражаются все виды домашних и диких животных. Основным резервуаром возбудителя в природе являются некоторые виды диких животных, но особенно грызуны. Листерии длительное время могут не только сохраняться во внешней среде – почве, навозе, воде, на растениях, но и размножаться, даже при низких (+ 4 °С) температурах. Некачественный силос является благоприятной средой для размножения листерий, особенно в его поверхностных слоях. Загрязненные листериями водоемы опасны в эпизоотологическом и эпидемиологическом отношении. Человек листериозом заражается в результате контакта с инфицированными грызунами, либо с сельскохозяйственными животными, особенно со свиньями, через поврежденную кожу; через пищеварительный тракт – при употреблении в пищу не подвергавшихся термической обработке ранних овощей, собранных с участков, где использованы для полива необеззараженные сточные воды и навоз. В результате инфицирования поражается нервная система и головной мозг человека. Внедрение листерий в организм человека может привести к развитию сепсиса, поражению отдельных органов и систем, а также к бессимптомному заболеванию. У женщин при поражении листериозом отмечаются аборты листериозной этиологии. Заболевание человека возможно также после употребления инфицированной пищи, в частности молока и мяса больных животных. Распространение листерий в организме происходит нейрогенным, лимфогенным, гематогенными путями. Листерии, распространяясь различными путями, преодолевая защитный барьер, проникают в головной мозг. У человека листериоз протекает в форме моноцитарной ангины и листериозного менингита, который во многих случаях заканчивается смертельно. Поражается центральная нервная система, отмечаются приступы судорог, возбуждение. Температура тела в начальный период заболевания повышена, а затем снижается. При листериозе у различных видов животных, а также у человека отмечается значительное повышение числа моноцитов в крови (отсюда и название Listeria monocytogenes). Гистологическое исследование мозга указывает на моноцитарную инфильтрацию.
В хозяйствах Алматинской области листериоз сельскохозяйственных животных встречается. По нашим данным, в стационарно неблагополучных хозяйствах, имеющих крупный и мелкий рогатый скот, листериоз обнаруживается у 10–30 % исследованных животных. В Казахском научно-исследовательском ветеринарном институте из 10 проб, предоставленных из хозяйств Алматинской области РК в 2009 год выделен возбудитель листериоза в двух случаях (от 7 месячного теленка, 2-летней коровы), в 2011 году – в двух случаях (от 3-летней коровы, годовалой овцы); в 2014 году – в трех случаях (от 6 месячного теленка, овцы, 8 месячного ягненка); а в 2015 году – в двух случаях (от коровы и быка-производителя).
Диагноз на листериоз ставят на основании комплекса эпизоотологических данных и результатов лабораторного исследования. Решающее значение принадлежит бактериологическому исследованию – выделению культуры листерий. Бактериологическая диагностика включает микроскопическое исследование исходного материала, посевы на питательные среды, идентификацию выделенных культур по культурально-морфологическим, биохимическим, молекулярно-биологическим и серологическим свойствам, а также постановку биологической пробы на лабораторных животных.
Материалы и методы исследования
Для бактериологического исследования на листериоз отбирается: головной мозг, доля печени, почка.
В патологическом материале с подозрением на листериоз – в паренхиматозных органах павших животных характерные патологоанатоми- ческие изменения: изменен цвет паренхимы печени, мягкой консистенции, бывает разложившаяся; селезенка кровенаполнена, темного цвета; паренхима почки мягкой консистенции, цвет изменен. Предоставленные патматериалы были отобраны от трупов животных. Заболевание протекало в острой форме и закончилось гибелью животных.
Бактериологические исследования проводили путем посева суспензии из головного мозга и паренхиматозных органов на физиологическом растворе в соотношении 1:5 на питательные среды МПБ (мясо-пептонный бульон), МПА (мясо-пептонный агар). При приготовлении сред для лучшего роста листерий добавляли 3 % сыворотки крови КРС, 3 % глюкозы и 2 % глицерина. Посевы культур выращивали в термостате при 25 °С. Из головного мозга и печени готовили мазки-отпечатки. Мазки из суточных колоний листерий и мазки-отпечатки окрашивали по Граму.
Биохимические свойства выделенной культуры листерий, каталазную и лецининазную активность определяли общепринятыми методами, биопробу ставили на белых мышах и морских свинках. Для окончательной идентификации выделенных культур, выполняли генетические исследования по секвенированию 16S rRNA гена бактерии.
Предназначенные для идентификации 24 – часовые бульонные культуры, выращенные при 25 °С, бактериологической петлей засевали частым штрихом на 2 пробирки МПА, так, чтобы получить рост по всей поверхности агара, выращивали при комнатной температуре 24 – 30 часов. Затем агаровую культуру смывали небольшим количеством физраствора, чтобы получить густую взвесь (1–1,5 млрд м.к. (микробных клеток) в 1 мл) для постановки РА – реакция агглютинации, пластинчатая реакция для серологической диагностики листериоза.
Для серологической идентификации выделенной культуры листерий использовали поливалентную листериозную агглютинирующую сыворотку, которая представляет собой смесь кроличьих листериозных агглю- тинирующих сывороток и содержит антитела Н-АВ и О-II, V, VI, VII, IX. Для проведения РА на чистое обезжиренное предметное стекло наносили две капли: каплю поливалентной сыворотки и каплю физиологического раствора (физраствора). К обеим каплям на стекле добавляли по одной капле смыва суточной культуры, смесь тщательно перемешивали бактериологической петлей, после чего стекла плавно покачивали круговыми движениями. Одновременно для контроля исследовали на стекле каплю сыворотки с добавлением капли физраствора.
Результаты исследования и их обсуждение
Через 24 ч культивирования посевов в термостате при 25 °С в МПБ наблюдалось легкое равномерное помутнение бульона, на МПА выросли колонии мелкие, росинчатые, блестящие, вязкой консистенции, в проходящем свете наблюдали нежный рост колоний – мелкие выпуклые беловатые колоний как беловатый налет на агаре.
Для выделения листерий из патматериала использовали МПБ, МПА с добавками. Через 24 ч при появлении сплошного роста колоний бактериоло- гической петлей производили пересев на селективную диагностическую среду Palkam. Через 24 часа инкубирования на селективной среде Pаlcam отмечался обильный рост мелких, серовато-зелёных или оливково-зелёных колоний с чёрным ореолом, диаметром 0,5–1,0 мм. Через 48 часов колонии диаметром 1,0–2,0 мм приобретали зеленую окраску с углубленными центрами, окруженными чёрным ореолом. При появлении сплошного роста колоний листерий производили пересев бактериологической петлей из зон наибольшего почернения среды штрихами на 2–3 чашки Петри с селективной дифференциально-диагностической средой для получения изолированных колоний. Бактериальную массу из выросших изолированных колоний использовали для окрашивания по Граму, проведения молекулярно-генетических исследований.
В окрашенных по Граму препаратах бактерии рода листерия установлены в виде коротких палочек, располагающихся одиночно и попарно. Возбудитель листериоза представляет собой грамположительные с закругленными концами палочки, которые могут быть полиморфными. Характерной особенностью листерий является то, что некоторые 2 бактерий располагаются по отношению друг к другу в виде римской цифры V или летящей чайки (важный дифференцирующий признак). Суточная культура листерий, выделенная от теленка, представлена на рис. 1.

Рис. 1. Культура листерий в мазке, окрашенном по Граму
На рис. 1 видны мелкие грамположительные палочки с закругленными концами, которые являются полиморфными, располагаются по одиночке, попарно или группой клеток. Видны бактерий листерий, располагающихся в виде римской цифры V и летящей чайки.
Дальнейшую идентификацию возбудителя листериоза проводили путем определения подвижности методом висячей капли 12-часовой бульонной культуры, выращенной при комнатной температуре. Для установления подвижности листерий культуры выращивали на ПЖА при комнатной температуре, так как при культивировании при 37 °С термолабильные жгутики у листерий разрушаются и подвижность их прекращается. На ПЖА отмечался характерный рост по линии укола в виде зонтика, в культуре листерий были подвижны.
При хранении патологического материала в холодильнике при + 4 °С происходит размножение и накопление листерий. Поэтому в качестве дополнительного диагностического метода использовали исследуемый материал в течение 30 дней для проведения повторных исследований через каждые 10 дней путем посева на МПБ и МПА. В трех повторностях посевов изолята выросли культуры листерий с характерными культурально-морфологическими признаками.
Изучением биохимических свойств установлено, что при посеве суточных культур на среды Гисса листерии ферментировали с образованием кислоты без газа глюкозу, рамнозу, салицин, левулезу, несколько медленнее -сахарозу, растворимый крахмал и глицерин; не ферментировали арабинозу, дульцит, инулин, сорбит; не образовывали индола и сероводорода, не разжижали желатин, не восстанавливали нитраты в нитриты. Определение каталазной активности листерий: к 1 мл суточной бульонной культуры и агаровой культуре добавляли 1 мл свежеприготовленной 5 %-ной перекиси водорода. Вследствие присутствия фермента каталазы у выращиваемой культуры перекись водорода разлагается с образованием кислорода (пузырьков газа). В наших опытах в пробирочной и пластинчатой реакциях агглютинации наблюдалось газообразование (бурлило), поэтому выделенная культура предварительно идентифицирована как Listeria.
Видовую идентификацию проводили методом определения лецитиназной активности листерий. К среде ГРМ № 1, содержащей 5 % вытяжки желтка куриного яйца в 50 % содержании питательного агара, добавляли порошкообразный активированный уголь до концентрации 0,5 %. Для определения лецитиназной активности исследуемую культуру и контрольный штамм листерий пересевали штрихами в 2 чашки среды ГРМ № 1 (без активированного угля) и 2 чашки с добавлением активированного угля. Инкубировали 48 ч при температуре 25 °С, после чего чашки просматривали в проходящем свете и определяли наличие активности в присутствии активированного угля. Эталонный штамм Listeria ivanovii давала плотную зону помутнения независимо от присутствия активированного угля, Listeria monocytogenes образовывала аналогичную зону помутнения в присутствии активированного угля и не образовывала в отсутствие угля. Это биохимическое свойство отличает Listeria monocytogenes от других видов рода Listeria.
Способом усовершенствования идентификации и таксономической классификации бактериальных разновидностей является получение нуклеотидной последовательности 16S rRNA гена путем секвенирования ДНК бактерий. Данный метод позволит провести генетическую идентификацию рода Listeria путем генотипирования.
Методом ПЦР был амплифицирован фрагмент ДНК протяженностью около 1100 п.н.. ПЦР была выполнена универсальными праймерами 16SrRNA-190F 5’– ATTAGCTAGTAGGTGGGGTAA-3 и 16SrRNA-1100R- 5’ TTACTAGCGATTCCGACTTCA в общем объеме 25 мкл. ПЦР смесь содержала 15 нг ДНК, 2.5х смеси, 5 пмоль каждого праймера и деионизированную воду 10 мкл. Программа амплификации ПЦР включала начальную денатурацию 94 °С в течение 3 минут; 27 циклов: 94 °С – 30 секунд, 60 °С – 30 секунд, 72 °С – 30 секунд; заключительную элонгацию 7 минут при 72 °С. ПЦР программа была выполнена с применением амплификатора Mastercycler Gradient, (Eppendorf).
Перед проведением реакции секвенирования для полученных фрагментов ДНК применяли ферментативный метод очистки. При ферментативном методе ПЦР продукты очищали от остатков олигонуклеотидов методом дефосфорилирования с помощью щелочной фосфатазы (SAP – Shrimp Alkaline Phosphatase, SibEnzyme) и эндонуклеазы Exonuclease I (Fermentas).
После ферментативной очистки ПЦР продукты были использованы для выполнения реакции секвенирования, очистки и разделения на автоматическом генетическом анализаторе ABI 3500.
Нуклеотидные последовательности 16S rRNA гена идентифицируемого штамма Listeria monocytogenes от 6 месячного теленка были проанализированы в программном обеспечении SeqScape 2.6.0 (Applide Biosystems).
С учетом полученных результатов, были проведены дальнейшие исследования по проверке чистоты представленного штамма, которые были осуществлены на основе анализа ферограммы нуклеотидной последовательности 16S rRNA гена. Было установлено, что у анализируемого штамма отсутствует смешение сигналов, что свидетельствует об отсутствии в предоставленной культуре посторонних видов бактерий. На рис. 2 в представлена ферограмма фрагмента нуклеотидной последовательности анализируемого гена Listeria monocytogenes.
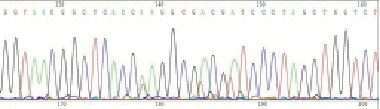
Рис. 2. Ферограмма фрагмента нуклеотидной последовательности гена 16S r RNA
Из рис. 2 видно, что проведенный анализ позволяет сделать выводы об отсутствии перекрестной контаминации культуры Listeria monocytogenes посторонними бактериями.
Последовательности нуклеотидов, полученные с применением прямого и обратного праймеров были объединены в общую последовательность, используя программное обеспечение SeqMan. Последовательности праймеров и плохо разделенные концевые участки были удалены из анализа. В результате проведенного анализа была получена нуклеотидная последовательность протяженностью около 700 п.н. Полученная нуклеотидная последовательность была проанализирована с применением базы данных NCBI утилиты BLAST. Нуклеотидная последовательность и результаты идентификации представлены в таблице и на рис. 3.
Результат идентификации гена 16S rRNA Listeria monocytogenes
Последовательность фрагмента 16S r RNA гена
Идентификация нуклеотидных последовательностей в международной базе данных (http://www.ncbi.nlm.nih.gov/) алгоритм BLAST
Инвентар-ный номер GeneBank (Accesion number) или коллекционный номер штамма
TAAAGAGAGTTTGATCCTGGCTCAGGACGAACGCTGGCGGCGTGCCTAATACATGCAAGTCGAACGAACGGAGGAAGAGCTTGCTCTTCCAAAGTTAGTGGCGGACGGGTGAGTAACACGTGGGCAACCTGCCTGTAAGTTGGGGATAACTCCGGGAAACCGGGGCTAATACCGAATGATAAAGTGTGGCGCATGCCACGCTTTTGAAAGATGGTTTCGCTATCGCTTACAGATGGGCCCGCGGTGCATTAGCTAGTTGGTAGGGTAATGGCCTACCAAGGCAACGATGCATAGCCGACCTGAGAGGGTGATCGGCCACACTGGGACTGAGACACGGCCCAGACTCCTACGGGAGGCAGCAGTAGGGAATCTTCCGCAATGGACGAAAGTCTGACGGAGCAACGCCGCGTGTATGAAGAAGGTTTTCGGATCGTAAAGTACTGTTGTTAGAGAAGAACAAGGATAAGAGTAACTGCTNGTCCCTTGACGGTATCTAACCAGAAAGCCACGGCTAACTACGTGCCAGCAGCCGCGGTAATACGTAGGTGGCNAGCGTNGTCCGGATGGATTGGGCGTNAAGCGCGCGCAGGCGGTCTTTTAAGTCTNATGTGAAAGCCCCCGGCTGAACCGGGNNGGGTCATTGGAAACTGGAAGACTNGAGTGCNGAAGAGGAGAGTGGAATTCCACGTGTAGCGGTGAAATGCGTAGATATGTGGAGGAACACCAGTGGCGAAGGCGACTCTCTGGTCTGTNACTGACG CTGAGGCGCG AAAGCGTGGG
Listeria monocytogenes 07PF0776 strain 07PF0776
Listeria monocytogenes strain NCTC 10357
Listeria innocua strain ATCC 33090
Из таблицы следует, что данные Международного банка GeneBank [6] показывают высокую степень однородности нуклеотидной последовательности 16S rRNA изучаемого штамма с разновидностями рода Listeria (99 %).
Как видно из рис. 3, анализируемый штамм находится на одной филогенетической ветви с разновидностями рода Listeria.
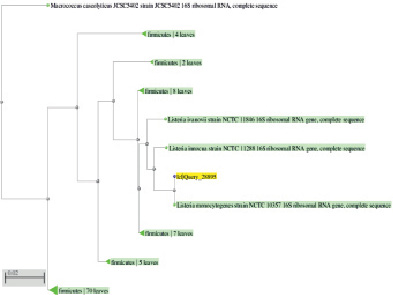
Рис. 3. Филогенетическое древо, построенное на основании фрагмента гена 16S rRNA
Определение патогенности листерий. Биопробу ставили на 3 белых мышах массой 16-18 г, которым подкожно вводили по 0,2 мл суточной бульонной культуры Listeria monocytogenes. На 3 сутки опытные животные пали. При бактериологическом исследовании патматериала от павших белых мышей чистая культура листерий высевалась из печени, сердца.
На 2 морских свинках ставили конъюнктивальную пробу введением в конъюнктивальный мешок по 0,05 мл суточной бульонной культуры Listeria monocytogenes. У морских свинок на 3 сутки развился кератоконъюнктивит и светобоязнь.
В результате проведенных исследований установлено, что эпизоотическая культура Listeria monocytogenes, полученая из патматериала от теленка, коровы, быка-производителя, обладала типичными культурально-морфологическими, биохимическими и антигенными свойствами и по результатам серологических исследований отнесена к 1-му серотипу. По биологическим свойствам эпизоотический изолят был идентичен эталонному музейному штамму. Методом генотипирования была установлена однородность нуклеотидной последовательности 16S rRNA изучаемого штамма с разновидностями рода Listeria (совпадение 99 %).
Таким образом, диагноз на листериоз был поставлен на основании клинико-эпизоотологических данных, характерных культуральных и морфологических свойств, тинкториальных свойств, биохимических свойств (отношение к белкам, углеводам, каталазной, лецитиназной активности и т.д.), молекулярно – генетических свойств (проведения генотипирования методом ПЦР), положительной реакции агглютинации с поливалентной и типовой листериозными сыворотками и отсутствием агглютинации в контроле с физраствором, а также в результате изучения биологических свойств с постановкой биопробы на лабораторных животных.
Во время изолированного содержания, при формировании новых групп в хозяйствующих субъектах или населенных пунктах необходимо проводить клиническое обследование животных и при необходимости (при выявлении признаков поражения нервной системы, абортов, повышенной температуры тела) бактериологические и серологические исследования на листериоз. Систематически проводить уничтожение грызунов, кровососущих насекомых и клещей. Вести строгий учет случаев абортов, мертворождения и падежа животных и направлять патологический материал на исследование в ветеринарную лабораторию.
Читайте также:


