Тест-система для выявления возбудителя чумы
Диагностические препараты, тест-системы, используемые для лабораторной диагностики чумы
Наименование препарата или тест-системы
Номер регистрационного удостоверения
Иммуноглобулины диагностические флуоресцирующие чумные адсорбированные лошадиные, лиофилизат для диагностических целей
ФКУЗ РосНИПЧИ "Микроб"
410005, г. Саратов, ул. Университетская, д. 46
Тел.: (8452) 26-21-31
Факс: (8452) 51-52-12
Иммуноглобулины диагностические чумные адсорбированные лошадиные для реакции агглютинации на стекле, лиофилизат для диагностических целей
Фаги диагностические чумные Л413C, Покровской (П), псевдотуберкулезный, лиофилизаты для приготовления раствора для диагностических целей
Сыворотка чумная антифаговая, лиофилизат для диагностических целей
Кровь гемолизированная, раствор для диагностических целей
Тест-система для выявления ДНК Yersinia pestis методом полимеразной цепной реакции (ГенПест)
Иммунохроматогра- фический экспресс-тест для серодиагностики чумы (ИХТ-F1 серодиагностика чумы)
142279, Московская область, Серпуховский район, п. Оболенск
Тел.: (4967) 36-00-09
Теп/факс: (4967) 36-00-20
Набор реагентов для иммунохроматогра- фического экспресс- выявления и идентификации возбудителя чумы (ИХ-тест Y. pestis):
Незарегистрированные и разрабатываемые препараты (используются лабораториями территориального и регионального уровней только после регистрации)
Набор реагентов для выявления ДНК Yersinia pestis методом полимеразной цепной реакции с гибри- дизационно-флуорес- центным учетом результатов в режиме реального времени (Ген Yersinia pestis индикация - РГФ)
ФКУЗ РосНИПЧИ "Микроб"
410005, г. Саратов, ул. Университетская, д. 46
Тел.: (8452) 26-21-31
Факс: (8452) 51-52-12
Набор реагентов для ускоренной идентификации штаммов Yersinia pestis методом мультилокусной полимеразной цепной реакции с гибридизационно-флуоресцентным учетом результатов в режиме реального времени (Ген Yersinia pestis идентификация - РГФ)
Ген Yersinia pestis - идентификация - РЭФ
Ген Yersinia pestis/ Francisella tularensis - РЭФ
Ген Yersinia pestis/ Francisella tularensis - РГФ
Набор для подготовки проб (выделения ДНК)
Диагностическая тест-система для выявления антител к чумному микробу
Тест-система диагностическая для выявления возбудителя чумы иммуно-ферментным методом
355035, г. Ставрополь, ул. Советская, 13-15
Тел./факс: (8652) 26-40-39
Тест-система с использованием частиц коллоидных металлов (золото, серебро) для обнаружения антигенов чумного микроба в дот-иммуноанализе
664047, г. Иркутск, ул. Трилиссера, 78
Тел./факс: (3952) 22-01-35 E-mail:
Иммунохроматогра- фическая тест-система для быстрой серодиагностики чумы (ИХТ-анти-LcrV серодиагностика)
142279, Московская область, Серпуховский район, п. Оболенск
Тел.: (4967) 36-00-09
Тел./факс: (4967) 36-00-20
Диагностикум чумной иммуноглобулиновый полимерный сухой для РАО
ФКУЗ Ростовский НИПЧИ
344007 г. Ростов-на-Дону, ул. М. Горького, 117,
Тел./факс: (863) 234-13-76
Диагностикум эритроцитарный чумной иммуноглобулиновый сухой
ФГУ "48 ЦНИИ МО РФ"
610000, г. Киров, Октябрьский пр., 119
Тел./факс: (8332) 38-15-27
Диагностикум эритроцитарный чумной антигенный сухой
Тест-система иммуноферментная моноклональная для обнаружения и идентификации капсульного антигена F1 возбудителя чумы
| > Антибактериальные препараты, используемые для определения чувствительности чумного микроба к антибиотикам |
| Содержание Методические указания МУК 4.2.2940-11 "Порядок организации и проведения лабораторной диагностики чумы для лабораторий. |
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
Изобретение относится к области ветеринарной вирусологии, в частности к тест-системе для обнаружения ДНК особо опасного возбудителя африканской чумы свиней (АЧС) в культуре инфицированных клеток и пробах патологических материалов от свиней, и может быть использовано при диагностике АЧС в научно-исследовательских учреждениях, региональных, областных ветеринарных лабораториях и на предприятиях биологической промышленности.
Известна тест-система (см. патент РФ №2360971, кл. C12Q 1/68, 2009 г.), включающая пластиковые флаконы и пробирки, термостабильный фермент Tag-полимеразу, ПЦР-смесь для постановки реакции со специфическими олигонуклеотидными праймерами, комплиментарными высококонсервативной области генома вируса АЧС района гена Р30, положительный и отрицательный контроли.
Также известна тест-система (см. патент РФ №2125089, кл. C12Q 1/68, 1999 г. - прототип), включающая пластиковые флаконы и пробирки, термостабильный фермент Tag-полимеразу, буфер для постановки реакции, смесь четырех дезоксинуклеотидтрифосфатов, положительный контроль - рекомбинантную плазмиду, содержащую фрагмент гена vp72 вируса африканской чумы свиней, синтетические олигонуклеотидные праймеры и зонд.
Недостатком прототипа является недостаточная степень специфичности и чувствительности тест-системы, а также длительность проведения диагностики, что не исключает вероятность технологических ошибок при лабораторных манипуляциях.
Техническим результатом является повышение степени специфичности и чувствительности тест-системы, а также сокращение времени проведения диагностики при снижении вероятности технологических ошибок во время лабораторных манипуляциях.
Технический результат достигается тем, что в тест-системе для обнаружения ДНК вируса африканской чумы свиней с помощью полимеразной цепной реакции в режиме реального времени, включающей пластиковые флаконы и пробирки, термостабильный фермент Tag-полимеразу, буфер для постановки реакции, смесь четырех дезоксинуклеотидтрифосфатов, положительный контроль - рекомбинантную плазмиду, содержащую фрагмент гена vp72 вируса африканской чумы свиней, синтетические олигонуклеотидные праймеры и зонд, согласно изобретению используют синтетические олигонуклеотидные праймеры и флуоресцирующий зонд, комплементарные консервативной области генома вируса африканской чумы свиней района гена vp72, имеющие следующий нуклеитидный состав:
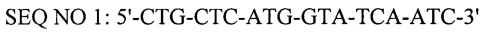
- прямой праймер,
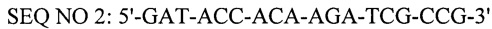
- обратный праймер,
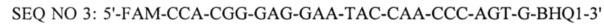
- флуоресцирующий зонд и взятые при соотношении 1:1:0,5, при этом BHQ1 - темновой гаситель флуоресценции присоединен к 3'-концевому нуклеотиду, а FAM - флуоресцентный краситель присоединен к нуклеотиду С, причем для постановка реакции используют 5-кратный буфер и в качестве отрицательного контроля используют дистиллированную воду.
Существенными признаками, отличающими заявляемое техническое решение от прототипа, являются:
- нуклеотидные последовательности праймеров и зонда;
- формат амплификационной смеси;
- состав амплификационой смеси, в которой используют два внутренних контроля проведения полимеразной цепной реакции.
Новизна заявляемой тест-системы заключается в том, что она позволяет в биологических образцах, в качестве которых используют по выбору: плазму, сыворотку крови, мазки со слизистых от латентно инфицированных и больных животных; патологический материал от павших животных, в инфицированных культурах клеток, а также в продуктах свиноводства и изделиях свиного происхождения, выявлять специфическую последовательность консервативного участка генома вируса африканской чумы свиней без использования дополнительных методов детекции ампликонов, тем самым сокращая процент технологических ошибок. Формат и состав амплификационной смеси сокращает трудоемкость и продолжительность анализа, а также позволяют осуществлять эффективную наработку фрагментов нуклеиновой кислоты вируса африканской чумы свиней, содержащих выбранные функционально значимые консервативные локусы гена-мишени вируса.
Также тест-система отличается тем, что в ее составе используют синтетические олигонуклеотидные конструкции:
(прямой праймер),
(обратный праймер),
(флуоресцирующий зонд), где BHQ1 означает присоединенный к 3'-концевому нуклеотиду темновой гаситель флуоресценции, a FAM - флуоресцентный краситель FAM, присоединенный к нуклеотиду С.
На основе синтетических олигонуклеотидных конструкций SEQ NO 1-3 готовят амплификационную смесь для проведения ПЦР в режиме реального времени; наличие в изучаемой пробе нуклеиновой кислоты искомого вируса определяют ростом сигнала флуоресценции красителя. Причем структура синтетических олигонуклеотидных конструкций обеспечивает связывание только с полностью комплементарными ДНК-мишенями, что обуславливает яркий флуоресцентный сигнал. Кроме того, физико-химические свойства олигонуклеотидных конструкций SEQ NO 1-3 препятствуют образованию между собой шпилек и дуплексов (высокоэнергетических внутренних структур), способствуют образованию необходимого количества продукта амплификации, а также подобраны с учетом одинаковой температуры отжига на ДНК-мишени (60-62°С). Для стабильной работы олигонуклеотидных конструкций в растворе тест-системы оптимизированы концентрация MgCl2 и самих конструкций, а также соотношение прямых, обратных праймеров и флуоресцентных зондов, количество циклов амплификации и их время на каждом этапе.
Сущность изобретения поясняется чертежом, где представлены графики из отчета работы прибора Rotor-Gene 6000 при использовании Real-time PCR:
на фиг. 1 представлен график канала FAM - искомая ДНК АЧС для отрицательного образца;
на фиг. 2 представлен график канала Су5 - внутренний контрольный образец специфики - ДНК свиньи - отрицательный образец;
на фиг. 3 представлен график канала HEX - внутренний контрольный образец выделения - синтетическая ДНК АЧС - отрицательный образец;
на фиг. 4 представлен график канала FAM - искомая ДНК АЧС для положительного образца;
на фиг. 5 представлен график канала Су5 - внутренний контрольный образец специфики - ДНК свиньи - положительный образец;
на фиг. 6 представлен график канала HEX - внутренний контрольный образец выделения - синтетическая ДНК АЧС - положительный образец;
на фиг. 7 представлен график канала FAM - искомая ДНК АЧС для сомнительного образца;
на фиг. 8 представлен график канала Су5 - внутренний контрольный образец специфики - ДНК свиньи - сомнительный образец;
на фиг. 9 представлен график канала HEX - внутренний контрольный образец выделения - синтетическая ДНК АЧС - сомнительный образец;
Сущность изобретения поясняется чертежом, где представлены графики из отчета работы прибора Rotor-Gene 6000 при использовании Real-time PCR:
на фиг. 1 представлен график канала FAM - искомая ДНК АЧС для отрицательного образца;
на фиг. 2 представлен график канала Су5 - внутренний контрольный образец специфики - ДНК свиньи - отрицательный образец;
на фиг. 3 представлен график канала HEX - внутренний контрольный образец выделения - синтетическая ДНК АЧС - отрицательный образец;
на фиг. 4 представлен график канала FAM - искомая ДНК АЧС для положительного образца;
на фиг. 5 представлен график канала Су5 - внутренний контрольный образец специфики - ДНК свиньи - положительный образец;
на фиг. 6 представлен график канала HEX - внутренний контрольный образец выделения - синтетическая ДНК АЧС - положительный образец;
на фиг. 7 представлен график канала FAM - искомая ДНК АЧС для сомнительного образца;
на фиг. 8 представлен график канала Су5 - внутренний контрольный образец специфики - ДНК свиньи - сомнительный образец;
на фиг. 9 представлен график канала HEX - внутренний контрольный образец выделения - синтетическая ДНК АЧС - сомнительный образец;
Примеры конкретного использования тест-системы
Тест-система снабжена пластиковыми флаконами и пробирками, термостабильным ферментом Tag-полимеразой, 5-кратным буфером для постановки реакции, смесью четырех дезоксинуклеотидтрифосфатов, рекомбинантной плазмидой, содержащей фрагмент гена vp72 вируса африканской чумы свиней в качестве положительнго контроля, синтетическими олигонуклеотидными праймерами и зондом комплементарные консервативной области генома вируса африканской чумы свиней района гена vp72, имеющие следующий нуклеитидный состав:
- прямой праймер,
- обратный праймер,
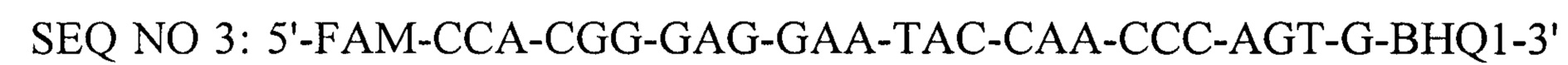
- флуоресцирующий зонд и взятые при соотношении 1:1:0,5 и отрицательным контролем в качестве которого используют дистиллированную воду.
Для проведения самой ПЦР с использованием тест-системы требуется:
Подготовить необходимое количество пробирок с реакционной смесью, включая три пробирки для стандартных образцов ДНК и отрицательного контрольного образца. При конструировании праймеров и зонда основными требованиями являются: степень гомологии (комплементарность) с выбранным участком гена; отсутствие самокоплементарных участков внутри олигонуклеотидов и комплементарности друг другу, чтобы не допускать возникновения устойчивых вторичных структур (димеров); близость значений температуры отжига праймеров.
Разработанные олигонуклеотиды имеют оптимальные размер (24-25 пл.) и GC состав (45,8 и 48%), температуру отжига праймеров 55°C, температуру отжига зонда до 72°C.
Состав реакционной смеси был подобран таким образом, чтобы концентрация ионов MgCl2 была в пределах 2,0 - 2,5 мМ, что обеспечивает оптимальную скорость и точность работы фермента Taq-полимеразы, концентрация дНТФ - не более 2,5 мМ, концентрация каждого праймера -1,5 пмоль/мкл, зонда - 0,75 пмоль/мкл и объем пробы - 10 мкл.
Пробирки с амплификационной смесью расставляют в соответствии с заранее подготовленным протоколом, где указаны номера анализируемых проб, а также пробирки положительного и отрицательного контролей. Если реакцию проводят на анализаторе Rotor Gene 6000/Q (Corbett Research), то пробирки могут быть промаркированы.
Добавлят во все пробирки индивидуальными наконечниками с аэрозольными фильтрами по 7 мкл:
а) в амплификационную пробирку для постановки отрицательного контроля
- отрицательный контрольный образец (ОКО) из комплекта тест-системы;
б) в пробирки исследуемых образцов - исследуемые образцы ДНК;
в) в амплификационную пробирку для постановки положительного контроля
- положительный контрольный образец (ПКО) из комплекта тест-системы.
Для снижения риска контаминации образцы следует добавлять в указанном порядке.
Пробирку, в которую был внесен образец, следует по возможности немедленно закрыть крышкой и центрифугировать в течение 15 секунд на плашечной центрифуге или микроцентрифуге-вортексе. Затем переносят пробирки в прибор и проводят амплификацию.
Проводят амплификацию по программе для амплификатора Rotor-Gene Q или Rotor-Gene 6000 (Corbett Research), указанной в Таблице 1.
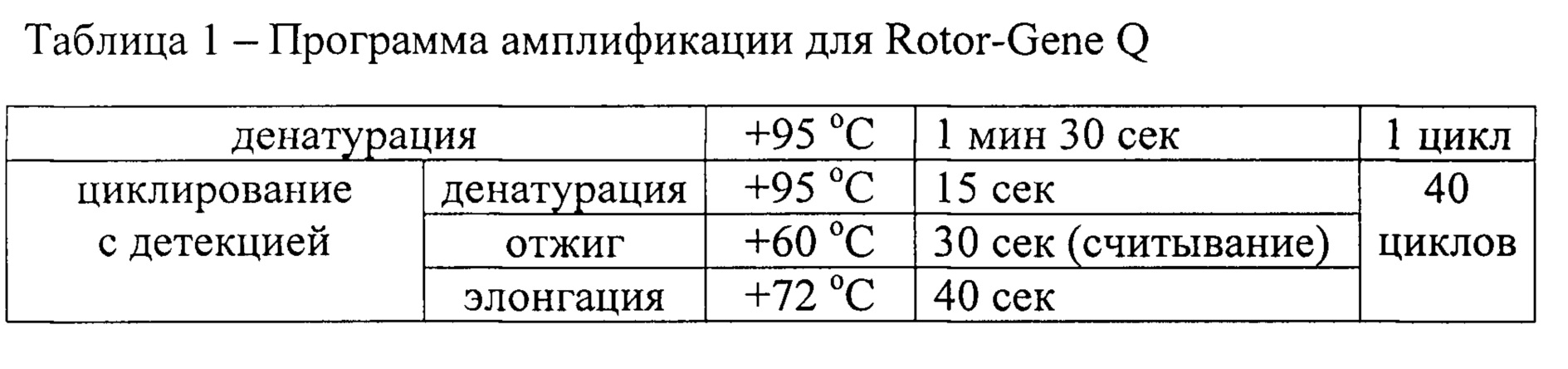
Детекция продуктов амплификации осуществляется прибором автоматически в каждом цикле амплификации. На основании этих данных управляющая программа строит кривые накопления флуоресцентного сигнала по каждому из заданных для образцов каналов.
Для работы с тест-системой используют каналы: FAM (специфический сигнал), HEX (сигнал внутреннего контроля), CY5 (сигнал экзогенного внутреннего контроля).
Оценка эффективности использования тест-системы осуществлялась по кривым накопления флуоресцентного сигнала по каждому из заданных для образцов каналов проводилась по графикам из отчета работы прибора Rotor-Gene 6000 при использовании Real-time PCR:
Для отрицательного образца
Фиг. 1. Канал FAM - искомая ДНК АЧС (фиолетовый цвет). Из исследуемых образцов не вышел. Регистрируется только сигнал контрольного образца (красный цвет).
Фиг. 2. Канал Су5 - внутренний контрольный образец специфики - ДНК АЧС (фиолетовый цвет) - выходят позже графика положительного контрольного образца (красный цвет), что говорит о незначительном ингибировании реакции.
Фиг. 3. Канал HEX - внутренний контрольный образец выделения - синтетическая ДНК АЧС (фиолетовый цвет). График экзогенного внутреннего контроля выделения и графики исследуемых образцов совпадают, что говорит, что реакция прошла успешно.
Для положительного образца
Фиг. 4. Канал FAM - искомая ДНК АЧС (синий цвет) - флуоресцентно сигнал начал накапливаться до 36 цикла, его можно считать положительным. Отрицательный контрольный образец не вышел - контаминации контроля нет.
Фиг. 5. Канал Су5 - внутренний контрольный образец специфики - ДНК АЧС (синий цвет) - накопление флуоресцентного сигнала достаточно, чтобы считать реакцию положительной. Черный график - отрицательный контрольный образец. Флуоресцирует благодаря наличию экзогенного контрольного образца, вносимого в пробирку на стадии выделения. Красный график - положительный контрольный образец.
Фиг. 6. Канал HEX - внутренний контрольный образец выделения - синтетическая ДНК АЧС - накопления флуоресцентного сигнала достаточно, чтобы считать реакцию положительной. Черный график - отрицательный контрольный образец. Флуоресцирует благодаря наличию экзогенного контрольного образца, вносимого в пробирку на стадии выделения. Красный график – положительный.
Для сомнительного образца
Фиг. 7. Канал FAM - искомая ДНК АЧС (синий цвет) - по графику видно, что и отрицательный контрольный образец, и исследуемый образец вышли до 36 цикла, это говорит о возможной контаминации.
Фиг. 8. Канал Су5 - внутренний контрольный образец специфики - ДНК АЧС (синий цвет) - накопления флуоресцентного сигнала достаточно, чтобы считать реакцию положительной. Фиолетовый график - отрицательный контрольный образец. Флуоресцирует благодаря наличию экзогенного контрольного образца, вносимого в пробирку на стадии выделения. Красный график - положительный контрольный образец.
Фиг. 9. Канал HEX - внутренний контрольный образец выделения - синтетическая ДНК АЧС - накопления флуоресцентного сигнала достаточно, чтобы считать реакцию положительной. Фиолетовый график - отрицательный контрольный образец. Флуоресцирует благодаря наличию экзогенного контрольного образца, вносимого в пробирку на стадии выделения. Красный график - положительный контрольный образец.
Пример 1. Для анализа методом ПЦР были взяты 2 пробы тканей селезенки от свиней, признанных больными африканской чумой свиней, на основании ПЦР-исследований набором производства ГНУ ВНИИВВиМ, г. Покров. В процессе ПЦР в пробах были получены кривые флуоресценции, пересекающие линию threshold, при отсутствии таковой в отрицательном контроле. Это свидетельствует о воспроизводимости результатов проведенных опытов.
Пример 2. Применение реакции амплификации для выявления ДНК вируса африканской чумы свиней с использованием разработанных специфических олигонуклеотидных праймеров и зонда, входящих в тест-систему.
Предложенная тест-система позволяет количественно выявлять на ранних стадиях высококонсервативную область гена VP72 вируса африканской чумы свиней. Применение олигонуклеотидного зонда позволяет повысить чувствительность и специфичность способа, исключить субъективность при оценке результатов. Использование предлагаемой модификации ПЦР позволяет значительно снизить возможность контаминации образцов, помещения, оборудования и реактивов, а также сократить сроки проведения анализа, что важно как для владельцев животных, так и для ветеринарных специалистов.
Предложенная тест-система апробирована с положительными результатами и регулярной воспроизводимостью этих результатов в 2016 году на 8 пробах тканей селезенки свиней, признанных больными африканской чумой свиней, на основании ПЦР-исследований набором производства ГНУ ВНИИВВиМ, г. Покров.
За звучной аббревиатурой ПЦР скрывается сложная и не слишком понятная для рядового пациента расшифровка — полимеразная цепная реакция. Что же такое ПЦР-диагностика, на чем она основана и почему в последнее время ее стали считать самой перспективной технологией в постановке диагнозов, касающихся инфекционных и вирусных заболеваний? Мы расскажем о преимуществах ПЦР-метода, его особенностях и этапах проведения.
ПЦР-диагностика: что это такое?
Диагностика методом ПЦР существует чуть более 30 лет. Значительно эволюционировав за это время, она зарекомендовала себя как один из наиболее точных способов выявления инфекций. В основе метода лежит принцип многократного увеличения микроскопических концентраций фрагментов ДНК возбудителя в биологической пробе пациента в искусственных условиях. В результате сложного процесса, называемого амплификацией, под воздействием ферментов и изменения температуры (от 50 до 95°С) из одной молекулы ДНК образуется две. При этом происходит копирование участка ДНК, который присутствует только у того вида патогенного микроорганизма, который интересует врача.
Цикл образования новой молекулы ДНК занимает всего около 3 минут, а тридцати-сорока циклов вполне достаточно, чтобы получить количество молекул, необходимое для достоверного визуального определения методом электрофореза.
Кроме амплификации, то есть простого увеличения числа копий молекулы ДНК, с помощью ПЦР можно производить и другие манипуляции с генетическим материалом, например, сращивать фрагменты ДНК, вводить мутации и т.д. Это позволяет использовать ПЦР не только для диагностики инфекционных и генетических заболеваний, но и для установления отцовства, клонирования и выделения новых генов.
ПЦР-диагностика проводится в специальных лабораториях с помощью амплификационного оборудования. На сегодня существует множество различных модификаций ПЦР, включая технологии с использованием не только ДНК, но и фрагментов рибонуклеиновой кислоты (РНК). В некоторых из них амплификация осуществляется при постоянной температуре, и для их проведения специальное оборудование не требуется.
Еще одна популярная модификация ПЦР — мультиплексная амплификация (МПА), которая позволяет проводить исследование сразу нескольких изучаемых фрагментов в одной пробирке. Это не только ускоряет и удешевляет проведение анализа, но и позволяет рассматривать одни фрагменты, получившиеся в результате реакции, в качестве положительных маркеров для других, что еще больше увеличивает точность исследования методом ПЦР.
В клинической медицине ПЦР-диагностика является одним из наиболее востребованных методов анализа в самых разных сферах:
- Прямое определение возбудителя инфекции. Некоторые традиционные методы, такие как иммуноферментный анализ (ИФА), выделяют только белки-маркеры, которые являются продуктом жизнедеятельности возбудителей инфекции, а потому только косвенно указывают на присутствие микроорганизмов. Наличие специфического участка в ДНК, выявленное с помощью ПЦР, безошибочно или почти безошибочно указывает на присутствие конкретной инфекции.
- Высокая специфичность метода . Она обусловлена тем, что в исследуемом материале выявляется фрагмент ДНК, характерный только для конкретного возбудителя инфекции. Специфичность исключает возможность ложных результатов анализа, тогда как в иммунологических методах исследований ошибки вполне вероятны из-за перекрестной реакции антигенов.
- Высокая чувствительность . При помощи ПЦР-диагностики можно выявить присутствие в организме даже единичных клеток вирусов или бактерий в тех случаях, когда обычными методами сделать это практически невозможно. ПРЦ определяет наличие всего 10–100 клеток в пробе, тогда как иммунологическими и микроскопическими тестами можно определить наличие инфекции при количестве клеток не менее 103–105.
- Универсальность . Сходство состава всех ДНК или РНК дает возможность применять универсальные методы лабораторных исследований, диагностируя сразу несколько возбудителей из одной биологической пробы.
- Скорость получения результатов . Поскольку для проведения ПЦР-диагностики не нужен посев и выделение культуры возбудителя, то и большого количества времени на нее не требуется. Весь цикл — от забора биоматериала до получения результатов — занимает 4–5 часов.
- Диагностика латентных инфекций . ПЦР-методом диагностируются трудно культивируемые и некультивируемые формы микроорганизмов, встречающиеся в тех случаях, когда заболевание протекает в скрытой форме.
Методом ПЦР можно выявлять возбудителей инфекции не только в организме человека, но и в почве, воде, продуктах питания.
Тем не менее не стоит думать, что ПЦР-диагностика не имеет недостатков. У нее есть свои ограничения, но их количество настолько незначительно, что не может отрицательно повлиять на популярность и эффективность метода:
- Вероятность амплификации ДНК не только живого, но и погибшего микроорганизма . При проведении ПЦР-диагностики для контроля эффективности лечения необходимо соблюдать определенные требования. В частности, проводить ПЦР нужно после определенного промежутка времени (1–2 месяца), за который происходит полное исчезновение возбудителя инфекции в организме.
- Возможность возникновения перекрестной реакции . Подбор фрагментов ДНК (праймеров) осуществляется на основе знаний о генетическом строении конкретного микроорганизма. Но теоретически такой же фрагмент может присутствовать и у других микроорганизмов, геном которых на сегодняшний день еще не расшифрован. Их присутствие в пробе может привести к ложноположительному результату анализа.
- Изменчивость микроорганизмов . Эта способность возбудителей к мутации иногда приводит к тому, что некоторые их штаммы становятся неуловимыми в процессе ПЦР-анализа.
Чтобы уменьшить риски, разработаны стандарты объемов испытаний тест-систем ПЦР-диагностики, включающие проверку на перекрестные реакции и тестирование всех известных штаммов конкретного возбудителя.
ПЦР-диагностика проводится в специальной лаборатории в несколько этапов.
- Забор биоматериала . Процедура, предшествующая непосредственному анализу, которая осуществляется в процедурном кабинете соответствующего профиля. Забор делается с помощью стерильного оборудования только в стерильные пробирки. Материалом для исследования могут быть:
- Эпителиальные соскобы со слизистых оболочек: из уретры, из цервикального канала, со слизистой дыхательных путей и зева, из конъюнктивы. Забор проводится с помощью специального ершика, при этом недопустимо попадание в материал следов крови.
- Моча . Собираются первые 50 г утренней мочи в стерильную емкость. Материал используется для диагностики мочеполовых инфекций.
- Мокрота . Используется для ПЦР-диагностики туберкулеза и респираторных форм микоплазмоза и хламидиоза. Мокроту собирают в стерильный флакон в количестве 15–20 мг.
- Кровь, сыворотка, плазма . С их помощью диагностируются гепатиты, герпес, ВИЧ-инфекция. Для анализа используется венозная кровь (1–1,5 мл), собранная у пациента натощак в стерильную пробирку. Хранить биоматериал можно не более суток при температуре 4°С. Замораживать кровь категорически запрещается.
- Биологические жидкости . К ним относятся слюна, сок простаты, околоплодная, плевральная, спинномозговая, суставная жидкости. Собираются при помощи пункции с использованием стерильного инструментария в количестве 0,1–1,5 мл в стерильные пробирки.
- Биоптаты , т.е. материалы, полученные путем биопсии. Обычно на анализ отправляют биоптаты двенадцатиперстной кишки или желудка, чтобы выявить хеликобактерную инфекцию. Объем материала 2–3 мм 3 .
- Хранение и транспортировка биоматериала . Хранить образцы можно при комнатной температуре не более 2 часов. Если необходимо длительное хранение, то пробы помещают в холодильник с температурой 2–8°С на срок не более одних суток. Допустимо хранение некоторых биоматериалов в течение двух недель в замороженном виде при температуре -20°С. Оттаивание и повторное замораживание проб запрещено. Транспортировка, если она необходима, должна проводиться в специальных термоконтейнерах или термосах с соблюдением всех правил хранения и перевозки биоматериалов.
- Выделение ДНК из образца . Способ выделения зависит от вида определяемого микроорганизма и от вида биологического образца. Если, например, анализируется соскоб эпителиальных клеток, используется так называемый метод твердофазной сорбции, заключающийся в добавлении в образец специального вещества, концентрации ДНК на сорбенте и его многократной отмывке буферным раствором.
- Проведение ПЦР . Некоторое количество образца из биологической пробы переносится в специальную микроцентрифужную пробирку. Туда же добавляется амплификационная смесь, имеющая сложный состав, в объеме 25 мл. Пробирки устанавливают в программируемый термостат, и автоматическом режиме проводится амплификация. Время ее проведения зависит от заданной программы и составляет 2–3 часа. Одновременно с опытными пробами проводятся контрольные — положительные , включающие в себя контрольный препарат ДНК исследуемого возбудителя, и отрицательные , не содержащие исследуемую ДНК. Количество циклов амплификации варьирует от 30 до 40, более 40 циклов проводить не рекомендуется, так как это способствует увеличению количества неспецифических продуктов в пробе.
- Регистрация результатов . Фрагмент ДНК, характерный для возбудителя инфекции, выделяют методом электрофореза в присутствии специального вещества — бромистого этидия. Его соединение с фрагментами ДНК дает светящиеся полосы при облучении ультрафиолетовым излучением. Образец помещают в камеру для электрофореза и в течение 35–40 минут проводят разделение продуктов амплификации. После этого образец просматривают в ультрафиолетовом свете — наличие оранжевой светящейся полосы свидетельствует о положительном результате.
- Интерпретация результатов исследования . Результат ПЦР-диагностики может быть либо положительным, либо отрицательным. Положительный результат говорит о том, что в организме человека обнаружены следы инфекции, причем именно в данный момент времени. Количественный результат ПЦР-анализа оценить может только врач, они индивидуальны для разных типов инфекций. На основании количественного результата можно сделать вывод о степени активности заболевания и определить характер лечения.
Цена ПЦР-диагностики зависит от того, на какую конкретно инфекцию пациент планирует проверяться, от вида анализируемого материала, методики тестирования — качественной или количественной. Цена за определение одной инфекции составляет от 200 до 800 рублей в разных клиниках. Кроме того, к стоимости анализа добавится и плата за забор биоматериала — около 400 рублей. Средняя стоимость ПЦР-диагностики разных видов приведена в таблице 1.
Таблица 1 . Примерные цены на анализы ПЦР в Москве
| Название анализа | Цена, руб. |
| Определение ДНК хламидия | 750 |
| Определение ДНК микоплазмы хоминис | 540 |
| Определение микоплазмы гениталиум | 350 |
| Определение ДНК уреаплазмы | 350 |
| Гонококк, определение ДНК | 350 |
| Определение ДНК герпеса (разные типы) | 350–600 |
| Определение ДНК кандиды | 570 |
| Вирус краснухи, определение РНК | 800 |
| Дифференцированное определение ДНК ВПЧ (разные типы) | 350–1900 [1] |
Читайте также:


