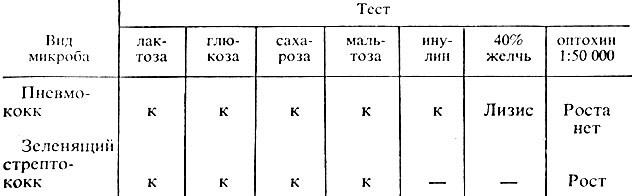
Выявление пневмококка при проведении быстрых тестов
Экспресс-тесты Бинакс выполнены на оригинальной тест-кассете в форме открывающейся книги. Позволяют проводить дифференциальную диагностику респираторных заболеваний. Образцы для анализа (в зависимости от вида теста): мазок из горла/аспират, моча/спинномозговая жидкость (ликвор), цельная кровь. Результат анализа через 5-15 минут.
Тесты Бинакс имеют регистрацию в США (FDA) и в странах ЕС (имеют CE марку), зарегистрированы РосЗдравнадзором.
Производитель: Alere Inc., США
Чувствительность: 97,7% (0,951 до 1,00, доверительный интервал 95%)
Специфичность: 100%
Совпадение: 99,0%
Информация для заказа: кат. № 851-000. Legionella Urinary Antigen EIA 96 Test Kit (96 определений).

Binax NOW Legionella
Экспресс-тест для определения антигена L.pneumophila (Легионеллёз) в моче.
Легионеллез более распространен, чем может показаться. Legionella pneumophila является одним из ведущих причин бактериальной внутрибольничной пневмонии. Тест для определения антигена легионелл в моче тест на легионеллёз Binax NOW® Legionella – один из наиболее широко известных быстрых тестов по моче, благодаря его чувствительности, специфичности и простоте использования.
Чувствительность: 95%
Специфичность: 95%
Информация для заказа: кат. № 852-000. Binax NOW Legionella (22 теста).

Binax NOW Streptococcus pneumoniae
Экспресс-тест для определения антигена Пневмококка в моче, спинномозговой жидкости (СМЖ).
Пневмококк (Streptococcus pneumoniae) является главной причиной пневмонии, приобретенной в обществе (community acquired pneumonia, CAP) и, согласно недавнему исследованию, может быть наиболее важным агентом в CAP неизвестной этиологии. Этот простой в использовании быстрый тест позволяет определять и назначать сфокусированную терапию в течение 4 часов, удовлетворяя нормативам Hospital Quality Initiative. Быстрое определение может приводить к решениям о сфокусированной терапии, улучшенным результатам лечения и уменьшению суммарных затрат на лечение. Поддерживается всемирными руководствами по внебольничной пневмонии.
Чувствительность: моча 86%, СМЖ 97% Специфичность: моча 94%, СМЖ 99%
Информация для заказа: кат. № 710-000. Binax NOW Streptococcus pneumoniae (22 теста).

Binax NOW Strep A
Экспресс-тест для определения антигена Streptococcus pyogenes группы A (Стрептококка А) по мазку из горла. Тест очень прост в использовании: всего 3 простых шага и 5 минут до считывания результата.
Чувствительность : 92% Специфичность : 100%
Информация для заказа: кат. № 735-025. Binax NOW Strep A (25 тестов).

 |
 |
 |
 |
 |