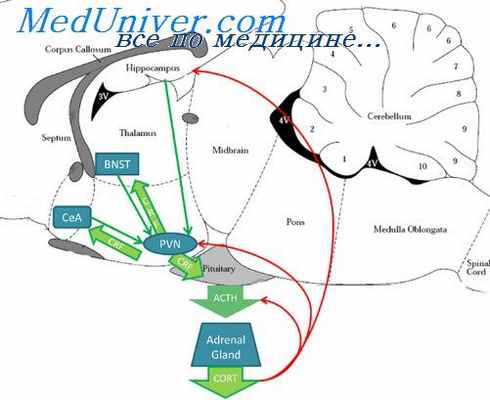
Аденогипофиз при стрессе. Морфология надпочечников при стрессе
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Аденогипофиз при стрессе. Морфология надпочечников при стрессе
В первые 1,5 ч масса железы и степень ее кровенаполнения увеличены. Строение паренхимы компактное. Отмечается увеличение объема ядер железистых клеток в 1,3— 1,5 раза. Процентное соотношение аденоцитов не изменено (хромофобные—51,2±2,0, ацидофильные—38,4±1,0, базофильные — 10,44:0,3), но размеры клеток увеличиваются, и в них определяется большое содержание РНК, мукополисахаридов, а в базофилах — и паральдегидфуксинофильных гранул.
Возрастает число вакуолизированных клеток. Коллоид промежуточной доли приобретает базофильный вид, размеры фолликулов уменьшены. К 8 ч увеличивается количество базофильных аденоцитов. Их цитоплазма повышенно вакуолизирована и дегранулирована, до 50—70% клеток утрачивает специфические гранулы, отмечаются явления цитолиза (последний легко определяется на препаратах, окрашенных с применением обычных гистологических методик).
Цитолиз в сочетании с полнокровием сосудов и прогрессирующим снижением нейросекреторного материала считают одним из показателей повышенной резорбции и интенсивного использования секрета гипоталамо-гипофизарной системы, а следовательно, активного ее функционирования. Цитоплазма ацидофильных аденоцитов к этому сроку сравнительно хорошо выполнена секреторными гранулами. В промежуточной доле фолликулы содержат небольшое количество вакуолизированного базофильного коллоида, слабо окрашивающегося при реакции на мукополисахариды.
В случаях смерти через одни или несколько суток появляется очаговая, преимущественно субкапсулярная, дискомплексация клеточных элементов; встречаются дву- и трехъядерные секреторные клетки с дегранулированной цитоплазмой и очаги пролиферации хромофобных аденоцитов. Эти изменения указывают на длительную функциональную активность аденогипофиза. К 10 сут на фоне повышенного кровенаполнения и других гемодинамических расстройств отмечают задержку выведения коллоида.
Большое количество его, вплоть до образования обширных кист и коллоидного отека стромы, обнаруживают в фолликулах промежуточной доли, а также в центре ячеек передней доли (масса гипофиза при этом увеличивается).
К 8 ч полнокровие паренхимы сохраняется. Увеличиваются очаги делипидизаций, снижается прозрачность коры, стираются границы между зонами, возрастает количество цитолизов. Ядра клеточных элементов увеличены, имеют гипертрофированные ядрышки. Все это указывает на сохранение функциональной активности коры надпочечников.
К концу первых суток выражены признаки гиперактивности органа. Увеличивается масса железы, наблюдается гипертрофия и гиперплазия коры надпочечников. Одновременно с этим происходит диффузное обеднение коры липидами, увеличивается число функционально-активных темных, бедных липидами, богатых РНК, аскорбиновой кислотой и щелочной фосфатазой клеток. В пучковой и сетчатой зонах местами имеется дискомплексация клеток, встречаются стазы, а кое-где лимфоидные инфильтраты.
При длительном стрессе наряду с сохраняющимися кое-где признаками гиперактивности развиваются изменения, характерные для острого истощения функции коры. Нарастает делипидизация гипертрофированных клеток, сопровождающаяся снижением в них РНК и активности ферментов. Появляются некробиотические изменения клеток. В капсуле и коре отмечают очаговую гиперплазию, обозначаемую как аденоматозные узлы. Эти изменения рассматривают как компенсаторно-приспособительные в условиях относительной функциональной недостаточности надпочечников.
Изменения со стороны хромаффинных клеток мозгового вещества также свидетельствуют о ранней реакции надпочечников в условиях стресса. Однако следует иметь в виду, что достоверные результаты получают при сроках вскрытия трупов до 6 ч после смерти. Помимо выраженных общих циркуляторных расстройств, в клетках отмечают прогрессивное снижение РНК, гранул аскорбиновой кислоты и адренохрома. В поздние сроки развиваются дистрофические и некробиотические изменения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Стресс и надпочечники
Надпочечники – это эндокринные железы, находящиеся поверх каждой почки, они состоят из двух слоёв: мозгового и коркового. Корковый слой синтезирует такие гормоны как: альдостерон и кортизол, а также небольшое количество тестостерона и эстрогена. В мозговом слое синтезируются гормоны: норадреналин, адреналин и катехоламины. У кортизола очень важная роль в организме, он регулирует скорость переработки белка, углеводов и жира. Этот гормон отвечает за адаптацию организма в стрессовой ситуации, он участвует в регулировке кровяного давления, отвечает за реакции иммунитета на внешние угрозы и воспаления.
Какая взаимосвязь между стрессом и надпочечниками при стрессовой ситуации?
При возникновении угрозы перед человеком, в его мозгу образуется сигнал тревоги, далее через цепочку: гипоталамус задействует гормон, влияющий на гипофиз и затем начинается стимуляция надпочечников, далее происходит выброс кортизола с адреналином в кровь. Адреналин отвечает за увеличение частоты сердцебиения, а кортизол поднимает уровень сахара в крови. Мозг лучше начинает использовать глюкозу, затем кортизол улучшает доступность веществ, ответственных за восстановление тканей. Гормон кортизол угнетает деятельность кишечника, активность пищеварительной и репродуктивной системы тоже снижается. По мере избавления от стрессовой ситуации, которую мозг считает угрозой, уровень гормонов приходит в норму, восстанавливается исходные значения сердцебиения, системы организма приходят в норму, артериальное давление стабилизируется.
Могут ли устать надпочечники?
При длительном присутствии в стрессовой ситуации надпочечники начинают истощаться, уровень вырабатываемого ими кортизола снижается, при таком низком уровне гормона, поддержание организма в здоровом состоянии становится невозможным. Существует ряд симптомов, характеризующих возможное наличие синдрома стресса надпочечников, такими симптомами могут являться:
- Постоянное чувство утомления
- Начинают выпадать волосы, ухудшение качества кожи
- Нарушение гормонального баланса
- Появление резистентности к инсулину
- Периодическое головокружение
- Снижение сексуальной активности
- Скачущее настроение
- Возникновение проблем со сном
В целях профилактики синдрома стресса надпочечников достаточно придерживаться некоторых правил:
- Соблюдать режим качественного сна
- Следить за питанием, рекомендуется иметь здоровый рацион
- Избегать стрессовых ситуаций
- Не злоупотреблять алкоголем
- Вести профилактику хронических заболеваний
- Заниматься физической активностью
При нахождении организма в длительных стрессовых ситуациях, связанных с тяжелой работой, нездоровым образом жизни или профессиональным спортом, человеку необходимо следить за уровнем кортизола в крови, особенно, если он испытывает какие-либо симптомы, присущие синдрому стресса надпочечников. От состояния этих желез напрямую будет зависеть качество и количество жизни человека.
Аденогипофиз при стрессе. Морфология надпочечников при стрессе
Изучена морфология гипофиза, надпочечников и щитовидной железы в 219 аутопсиях умерших хронических парентеральных опиатных наркоманов. ВИЧ-инфекция была исключена. Изменения эндокринных желез складывались из острых (полнокровие, отек, кровоизлияния, очаги некроза) и хронических (атрофия, склероз, макро-микроузелковая трансформация), прогрессирующих по мере увеличения длительности наркомании и соответствующих стадиям становления, компенсации и декомпенсации синдрома полиэндокринопатии. Ключевые слова: опиатная наркомания, морфология эндокринной системы.
При опиатной наркомании более половины больных погибает не от отравления наркотическими веществами, а от инфекционных и других заболеваний, развивающихся на фоне вторичного иммунодефицитного синдрома [3, 4, 6]. Патогенез иммунных нарушений связывают не только с токсическим или опосредованным специфическими опиоидными и опиоид-подобными рецепторами влиянием опиатов на клетки иммунной системы, но и с поражением нейроиммуномедиаторных систем головного мозга, синдромом полиэндокринопатии с нарушением нейроэндокринных регуляторных механизмов иммунной системы [1, 3, 4, 6, 8]. В немногочисленных исследованиях изменений органов эндокринной системы при опиатной наркомании описаны неспецифические острые и хронические изменения, причем ряд авторов объясняет их развитие влиянием инфекционных заболеваний, а не действием опиатов [1, 7].
Целью исследования явилось изучение морфологических изменений гипофиза, надпочечников и щитовидной железы при хронической парентеральной опиатной наркомании.
Материал исследования составили 219 аутопсийных наблюдений умерших опиатных наркоманов (213 мужчин и
6 женщин в возрасте 16-38 лет). Методом тонкослойной хроматографии во всех случаях выявляли в биопробах наличие опиатов. Группа сравнения состояла из 65 аутопсий умерших, страдавших хронической алкогольной интоксикацией или алкоголизмом (58 мужчин и 7 женщин в возрасте 21-42 лет), контрольная группа - из 20 аутопсий умерших от механических травм, не совместимых с жизнью, без заболеваний или экзогенных интоксикаций
(17 мужчин и 3 женщины в возрасте
16-35 лет). Исключали наблюдения с ВИЧ-инфекцией, острыми или активными хроническими вирусными гепатитами, циррозами печени, гематологическими и онкологическими заболеваниями. В зависимости от установленной длительности наркомании, с учетом данных литературы о стадийности развития иммунных нарушений [5], наблюдения основной группы были разделены на три подгруппы: с наркоманией, давностью менее 1 года, от 1-го до 2-х лет и более 2-х лет - до 10,5 лет. Инфицирование вирусами гепатитов В и С методом иммуноферментного анализа было выявлено в 88,6%, сочетание с хронической алкогольной интоксикацией - в 23,7% случаев. Причинами смерти больных опиатной наркоманией были острая наркотическая интоксикация (53%), пневмонии (12,8%), инфекционный эндокардит (10,9%), туберкулез (8,7%), септикопиемия (6,4%), травмы (5,9%), язвенная болезнь двенадцатиперстной кишки (1,4%), внутримозговое нетравматическое кровоизлияние (0,9%). Гипофиз, надпочечники и щитовидную железу изучали с помощью стандартных гистологического и морфометрического методов. Статистическую обработку результатов исследования проводили с помощью общепринятых методов вариационной статистики (пакет статистических программ «Statgraphix», версия «Stadia» и программа Statsoft Inc.99, USA).
Исследование показало, что изменения эндокринных желез складывались из острых, обусловленных особенностями танатогенеза при отравлении опиатами, сепсисе (острое полнокровие, отек, кровоизлияния, очаги некроза, нередко с развитием острой недостаточности гипофиза или надпочечников) и хронических, прогрессирующих по мере увеличения длительности наркомании (атрофия, склероз, компенсаторная узелковая трансформация).
В аденогипофизе по мере увеличения давности наркомании, особенно в сочетании с хронической алкогольной интоксикацией, было характерно уменьшение числа базофильных и эозинофильных аденоцитов с их узелковой пролиферацией, гипертрофией и вакуолизацией (особенно базофильных клеток), а также склероз стромы и стенок сосудов, уплотнение и обызвествление коллоида. Эти изменения указывают на хроническую гиперфункцию с исходом у части больных в истощение аденоцитов гипофиза и нарушением продукции его тропных гормонов.
В надпочечниках в 50,3% наблюдений развивались атрофия с делипоидизацией преимущественно пучковой зоны коры, в 65,3% - макро- и микроузелковая трансформация (нередко в сочетании с атрофией). При сочетании наркомании с хронической алкогольной интоксикацией частота узелковой трансформации достигала 92%. Такие изменения указывают на прогрессирующее истощение эндокриноцитов коры надпочечников, что может быть причиной развития хронического, а при стрессе любой природы - острого гипокортицизма. Известно, что даже скрытый хронический гипокортицизм ведет к нарушению функций иммунной системы с развитием, нередко, генерализованной персистирующей фолликулярной гиперплазией лимфоидной ткани [6].
В щитовидной железе узелковая трансформация обнаружена в 22,4% случаев. По данным аутопсий в Москве даже в старших возрастных группах этот показатель не превышает 32% [2]. В 48,6% наблюдений выявлялись зобные изменения (микро-макрофолликулярный коллоидный непролиферирующий зоб), в 28,6% - атрофия и склероз, в 1,7% - аутоиммунный тиреоидит, в 0,9% - аденомы. Зобные и, особенно, атрофические изменения щитовидной железы могут усиливать тяжесть иммунных нарушений.
Исследование также показало, что изменения органов эндокринной системы при опиатной наркомании, как и иммунный дефицит у таких больных, можно разделить на три стадии - становления, компенсации и декомпенсации полиэндокринопатии. Длительность стадий индивидуальна, зависит от многих факторов, но в целом выделение групп наблюдений с длительностью наркомании до 1 года (I стадия), более 1 и до 2-х лет (II стадия) и свыше 2-х лет, до 10,5 в проведенном исследовании (III стадия), оказалось адекватным для выявления их особенностей. I стадия отличается наиболее гетерогенными изменениями органов эндокринной системы. Характерны дисфункция гипофиза с нарушением продукции тропных гормонов; хронические изменения коры надпочечников и щитовидной железы или отсутствуют, или, реже, представлены атрофией и узелковой трансформацией (щитовидной железы - также зобными и аутоиммунными поражениями). II стадия отличается стереотипными изменениями органов эндокринной системы. Структурные изменения гипофиза выражены минимально, но чаще указывают на относительную компенсацию его функции с возможной гиперпродукцией ряда тропных гормонов. Преобладает атрофия коры надпочечников с ее узелковой трансформацией и выраженной делипоидизацией пучковой зоны, свидетельствующие в пользу ее истощения с развитием хронического гипокортицизма примерно в половине наблюдений (как следствие - усиление генерализованной фолликулярной гиперплазии лимфоидной ткани). В щитовидной железе преобладают умеренно выраженные зобные и, реже - атрофические изменения. III стадия также отличается стереотипностью изменений органов эндокринной системы: уменьшением числа хромофильных (главным образом, базофильных) аденоцитов гипофиза, склерозом стромы и стенок сосудов, обызвествлением коллоида, свидетельствующих о его истощении. В надпочечниках преобладают изменения, свойственные истощению их коры (атрофия, делипоидизация и дистрофия эндокриноцитов, узелковая трансформация), что может сопровождаться гипокортицизмом; частота зобных изменений щитовидной железы снижается, нарастает частота атрофических и склеротических процессов с узелковой трансформацией. Нельзя исключить, что часть наблюдений ее атрофии - результат перенесенного ранее аутоиммунного тиреоидита.
Стадийный характер поражения органов эндокринной систем при опиатной наркомании нарушается при ее сочетании с бактериальными инфекциями или хронической алкогольной интоксикацией, когда, независимо от ее длительности, развиваются изменения, свойственные III стадии.
Таким образом, морфологические изменения эндокринных желез (гипофиза, надпочечников и щитовидной железы) при хронической парентеральной опиатной наркомании складываются из острых (полнокровие, отек, кровоизлияния, очаги некроза) и хронических (атрофия, склероз, макро-микроузелковая трансформация). Хронические изменения прогрессируют по мере увеличения длительности наркомании и соответствуют стадиям становления, компенсации и декомпенсации синдрома полиэндокринопатии.
Автореферат и диссертация по ветеринарии (16.00.04) на тему: Влияние адаптогенов на морфофункциональное состояние аденогипофиза и коры надпочечников у быков при транспортном стрессе
Текст научной работы по ветеринарии, диссертация 1998 года, Толкачев, Игорь Сергеевич
Российская академия сельскохозяйственных наук Всероссийский научно-исследовательский ветеринарный институт патологии, фармакологии и терапии
ТОЛКАЧЕВ ИГОРЬ СЕРГЕЕВИЧ
Влияние адаптогенов на морфофункциональное состояние аденогипофиза и коры надпочечников у быков при
16.00.04 - ветеринарная фармакология с токсикологией 16.00.02 - патология, онкология и морфология животных
на соискание ученой степени кандидата биологических наук
Доктор ветеринарных наук, профессор С.М. Сулейманов Доктор ветеринарных наук М.Н. Аргунов
1.1. Актуальность темы. 4
1.2. Цель и задачи исследований. 5
1.3. Научная новизна. 6
1.4. Практическая значимость и внедрение. 6
1.5. Апробация работы и публикация. 7
2. Обзор литературы. 8
2.1. Стресс сельскохозяйственных животных. 8
2.2. Роль гипофиз-адреналовой системы в регуляции стресса. 16
2.3. Функциональная морфология аденогипофиза и коры надпочечника . 17
2.3.1. Аденогипофиз. 17
2.3.2. Кора надпочечников. 27
2.4. Профилактика стресса у сельскохозяйственных животных. 33
2.5. Заключение. 38
1. Собственные исследования. 39
3.1. Материал и методика исследований. 39
3.2.Морфофункциональная характеристика аденогипофиза и коры надпочечников у быков в различные сезоны года. 44
3.3. Клинико-морфологические изменения у телят после транспортировки . 53
3.4. Морфофункциональные изменения в аденогипофизе и коре надпочечников у быков при транспортном стрессе. 55
3.5. Влияние экстракта элеутерококка на морфофункциональное состояние аденогипофиза и коры надпочечников при транспортировке
3.6. Влияние фумаровой кислоты на морфофункциональное состояние аденогипофиза и коры надпочечников при транспортировке быков..75
3.7. Заключение. 86
3. Практические предложения. 91
4. Список использованной литературы. 92
1.1. Актуальность темы
Транспортировка животных - неизбежное технологическое звено промышленного скотоводства и является одним из самых тяжелых провокаторов напряжения организма, в результате которого потери в живой массе составляют от 2 до 20% в зависимости от сезона года, возраста, времени в пути и расстояния (A.C. Кашин, 1975; B.C. Бузлама с соавт., 1978; A.JI. Падучева, 1979; В.Н. Долгополов, 1981; А.И. Золотарев, 1988; O.A. Сапожкова, 1990; B.C. Бузлама, 1995; МИ. Редкий, 1997; О. Weiher et al., 1972; Н. Volker et al., 1973; G.H. Srensen, 1985; H. Jasukouchi et al., 1995).
Важную роль в адаптации животных к неблагоприятным факторам транспортировки играют гормоны гипофиз-адреналовой системы, которые оказывают влияние на многие виды обмена веществ и принимают участие в регуляции общей неспецифической резистентности организма. При этом, в органах эндокринной системы животных после транспортировки возникают различные функциональные нарушения в деятельности всех звеньев эндокринной системы в том числе гипофизе и надпочечниках, которые раньше других органов реагируют на изменение внутренней среды организма (С.И. Плященко с соавт., 1987; Ф.З. Меерсон с соавт., 1988; Б.Я. Рыжавский, 1989; П.М. Торгун, 1997 и др.).
Требования интенсификации промышленного животноводства не позволяют полностью избежать нежелательного влияния неблагоприятных воздействий технологическим путем. Встала острая проблема сочетания эволюционно обусловленных физиологических возможностей высокопродуктивных с современными методами ведения отрасли (B.C. Бузлама, 1976; И.И. Брехман, 1979; В. Гаськов, 1980; В. Бекенев, 1982; Л.С. Кузнецов,
3. Изучение морфофунациональных изменений в аденогипофизе и коре надпочечников у быков при транспортном стрессе;
4. Определение влияния экстракта элеутерококка на морфофункциональное состояние аденогипофиза и коры надпочечников при транспортировке быков;
5. Выяснения влияния фумаровой кислоты на морфофункциональное состояние аденогипофиза и коры надпочечников при транспортировке быков.
1.3. Научная новизна
В работе впервые дана подробная морфологическая, гистохимическая и электронно-микроскопическая характеристика клеток аденогипофиза и коры надпочечников у быков в различные периоды года при транспортном стрессе и его профилактике адаптогеннами - экстрактом элеутерококка и фумаровой кислотой. Выявлены изменения соотношения основных типов клеток в передней доле гипофиза и признаки деструктивных изменений коры надпочечников у стрессированных быков. Морфологически обоснована целесообразность применения экстракта элеутерококка и фумаровой кислоты быкам перед транспортировкой.
1.4. Практическая значимость и внедрение
Выявленные морфологические, гистохимические и электронно-микроскопические особенности аденогипофиза и коры надпочечников у быков при транспортном стрессе и его предупреждении адаптогенами создают теоретическую базу для разработки комплексных мероприятий по применению антистрессовых препаратов при транспортировке животных. Полученные данные могут быть использованы при составлении методических руководств по
применению адаптогенов в животноводстве и в учебном процессе на биологических и ветеринарных факультетах высших учебных заведений, для написания соответствующих разделов учебных пособий по гистологии и патанатомии.
1.5. Апробация работы и публикация
По результатам исследований опубликовано 13 работ.
Основные положения, выносимые на защиту:
функциональная морфология аденогипофиза и коры надпочечников у быков при транспортном стрессе;
Влияние экстракта элеутерококка на морфофункциональное состояние аденогипофиза и коры надпочечников у быков при предупреждении транспортного стресса;
Влияние фумаровой кислоты на морфофункциональное состояние аденогипофиза и коры надпочечников у быков при предупреждении транспортного стресса.
2. ОБЗОР ЛИТЕРАТУРЫ
2.1. Стресс сельскохозяйственных животных
Существование условий интенсификации жизни человека и животных на современном этапе характеризуется снижением физической активности, неизбежными моментами экстремальных условий, информационными нагрузками, социальными конфликтами, различным уровнем резистентности млекопитающих (П.К. Анохин, 1965; Е.В. Голомолзина, 1975; B.C. БузламаД976; М. Ковальчикова с соавт., 1978; Ю.П. Фомичев с соавт.,1979; К.В. Судаков, 1981 Е.И. Соколов с соавт.,1983; Е.А. Юматов с соавт., 1984; A.M. Клочков с соавт., 1994).
Развивающееся при стрессе напряжение защитно-приспособигельных систем организма животных приводит к потере продуктивности и заболеваниям (М.И. Немченко, 1974; В.В. Митюшин, 1979; К.В. Судаков с соавт., 1991).
Классическая теория стресса Г. Селье (1936; 1950) строится на основе следующих основных пунктах:
5. Причиной стресса любого происхождения или напряжения организма являются разнообразные действующие на организм повреждающие факторы - стрессоры.
6. Стресс - это есть неспецифическая реакция организма, которая при воздействии различных стрессоров проявляется однотипно путем активации ведущего эндокринного механизма: системы гипоталамус - передняя доля гипофиза - кора надпочечников
7. В развитии общего адаптационного синдрома (ОАС) выделяют 3 стадии: тревоги, резистентности и истощения, последовательно сменяющие друг друга.
систем организма. Саморегуляция функциональных систем в этих условиях стремится удержать полезные для организма приспособительные результаты в рамках, обеспечивающих нормальное течение метаболических процессов. При длительных и непрерывных конфликтных ситуациях на фоне все нарастающих генерализованных нисходящих влияний симпатической нервной системы происходит «прорыв» механизмов саморегуляции генетически или индивидуально ослабленных функциональных систем. При этом нарушаются механизмы саморегуляции деятельности сердца, иммунитет и устойчивость слизистых желудочно-кишечного тракта и легких, в результате чего возникают различные заболевания.
Напряжение организма, или стресс-реакция является необходимым звеном адаптации, но в безвыходных ситуациях, когда действующий на организм фактор силен или слишком сложен, приспособительная реакция оказывается неосуществимой. Адекватная функциональная система и системный структурный «след» в ней не формируются (Ф.З. Меерсон с соавт., 1988), в результате чего начальные нарушения гомеастаза сохраняются, а стимулируемая ими стресс-реакция достигает высокой интенсивности и длительности, что приводит к снижению резистентности организма.
Интенсивные промышленные технологии скотоводства на современном этапе, основанные на концентрации животных и специализации предприятий предусматривают транспортировку большого поголовья скота в откормочные хозяйства и на мясокомбинаты.
В последнее время 30% животных подвергаются перегону, 26% перевозится по железной дороге и 44% транспортируется автомобилями (Ю.П. Фомичев с соавт., 1981).
На мясокомбинаты автотранспортом доставляют 16-18% животных, водным путём 2-3%, железнодорожными перевозками 30% поголовья, а 50-55% перегоняют (Ю.П. Лисицын, 1972).
Перегруппировка, погрузка, смена привычной обстановки, теснота, физические воздействия, напряжение организма, выгрузка и смена условий кормления и содержания вызывают у животных психическое возбуждение, повышение рефлекторной чувствительности, учащение пульса и дыхания или в целом состояние стресса.
Проблема стресса в сельскохозяйственном животноводстве и ее аспектам придается большое значение (Е.М. Пяткин, 1966; В.Р. Зельнер, 1970; Ю.П Фомичев с соавт., 1974; G.Steinbach, 1973; В.Е, Чумаченко, 1982), факторам, вызывающим стрессы (Г.В. Домрачев, 1959; Р.Я. Трубка, 1973; Г.В Бурксер, 1974; Е.В. Голомолзина, 1975; А.С. Кашин, 1973, 1975; Б.Г. Георгиев, 1978; Т.К. Городецкая, 1979; С.И. Плященко с соавт., 1980; Н.А. Уразаев с соавт., 1981; С.М. Сулейманов, 1986; В. Algers et al., 1978; J. Hodges et al, 1978) и механизмам их развития (Р. Фитко с соавт., 1975;Б.М. Анохин, 1980; П.М. Митрофанов, 1981; В.М. Данилевский с соавт., 1983; Е. Kolb, 1979).
Транспортный и технологический стресс является одним из наиболее тяжелых (С.И. Плященко с соавт., 1987). Психофизиологическая и физическая нагрузки в период транспортировки нарушают гомеостаз организма в целом и как следствие приводят к значительным сдвигам в его обменных процессах. Снижение резистентности организма способствует изменение морфологического состава крови после транспортировки (JT.A. Пастухова, 1981).
Под воздействием стресс-факторов снижается бактерицидная и лизоцимная активность, уменьшается содержание макрофагов в крови, что снижает защитно-приспособительные возможности организма (З.М. Путова, 1975; Р.Г. Мустакимов, 1977; Л.И. Коваленко, 1982; А.Г. Шахов с соавт., 1980; B.C. Бузлама с соавт., 1984).
После воздействия стресс-факторов в крови увеличивается на 20% количество лейкоцитов, на 140% - нейтрофилов, на 10% - глюкозы, в то же время уменьшается содержание на 50% эозинофилов и на 20% лимфоцитов, что
указывает на снижение адаптационных способностей организма и расположенности его к различным заболеваниям (М.Н. Феклистов, 1984).
В фазе тревоги при напряжении организма происходит «аварийная» мобилизация энергетических ресурсов (углеводы, липиды) в форме глюкозы и свободных жирных кислот, которые должны обеспечить восстановление нормального состояния (Г.Г. Гацко, 1977; М. Ковальчикова с соавт., 1978). В результате транспортировки откормочного молодняка крупного рогатого скота снижается уровень глюкозы, витамина А, фосфора, магния, кальция и других минеральных веществ в крови отмечал В. Hironaka (1972).
По другим данным, перевозка племенных быков (К. Kreisten, 1976), бычков и кастратов (Ю.П. Фомичев с соавт., 1981) сопровождалось повышением уровня глюкозы в крови.
На фоне снижения уровня резистентности организма под действием условно-патогенной микрофлоры начинается заболевание животных бронхопневмонией (А.Г. Шахов с соавт., 1980; СМ. Сулейманов, 1986, 1988).
Большое значение в возникновении бронхопневмонии придается колебаниям зоогигиенических параметров (температура среды, влажность, вентиляция) как стресс-факгорам (G.R Stensen, 1985).
При высокой концентрации (плотности) животных на промышленных комплексах после транспортировки как факторы стресса выступают вирусные и бактериальные агенты (Д.Я. Бирюков, 1974; П.М. Митрофанов, 1981).
В результате транспортировки у животных снижается аппетит,. Замедляется рост, учащаются случаи респираторных заболеваний и болезней желудочно-кишечного тракта. Синдром всех стрессовых признаков называется транспортной лихорадкой, и она не прекращается одновременно с прекращением транспортировки, а продолжается еще несколько десятков часов (Р. Фитко с соавт., 1975). Сила транспортного стресса зависит от продолжительности транспортировки, транспортных средств и индивидуальной чувствительности животных (Д.А. Устинов, 1976).
Падеж свиней при перевозке на мясокомбинаты в Англии составляет 13000 голов (0,1%) и имеет взаимосвязь с температурой окружающей среды (W. Allen, 1977).
Смертность свиней в 1970 году при транспортировке в ФРГ превысила 1%, причем кормление перед транспортировкой вело к повышению падежа (J. Lohr, 1970).
Р. Фитько с соавт. (1975) и L. Mehrkens (1970) отмечали, что наибольший падеж (6,63%) свиней происходил при перевозке их на расстояние от 5-50км, причем смертность по причине сердечной деятельности достигала 0,3-3% наблюдалась при длительной транспортировке.
По данным R. Roscol et al., (1970) за деа десятилетия в США ущерб от транспортировки крупного рогатого скота в результате падежа и травматических повреждений составили 2 млн. долларов.
По данным Д.А. Устинова (1976) при перевозке крупного рогатого скота но железной дороге травматизм достигает 49,3%, а на автотранспорте - 41,1%. A.B. Высоцкий (1981) отмечает, что при автомобильной транспортировке крупного рогатого скота травмируется от 10 до 27% от перевозимого поголовья, при этом бракуется до 2,7% мышечной ткани.
Кроме травматизма и падежа экономический ущерб увеличивается из-за потери живой массы тела животных, которые в зависимости от условий транспортировки крупного рогатого скота составляют от 3,9 до 19,7%, а у свиней - от 0,69 до 10,6% (О. Weiher et al., 1972).
Ю.П. Лисицын (1972) отмечает увеличение потерь от транспортировки с декабря по март и с мая по июль, причем у скота откормленного на жоме они меньше, чем откормленного на барде.
При перевозке автотранспортом телят в течение 2-11 часов потери массы тела составляли 2-6% Н. Volker et al., (1973), причем они были максимальны на 55 километровом расстоянии. При перевозке специализированным
автотранспортом на 100 км телят 14-45 дневного возраста потери в живой массе составили от 2,0 до 3,6 кг на голову (Ю.П. Фомичев с соавт., 1974).
По данным А.Ф. Шевхужева с соавт. (1992) адаптационные качества телок трех линий симментальской породы различны. Проведенный эксперимент с перевозкой 127 чистопородных телок железнодорожным, а затем автомобильным транспортом показал, что кроме транспортного стресса, за счет которого произошло снижение живой массы, они испытали технологические стрессы от смены условий кормления и содержания. Благодаря различным адаптационным качествам быстрее восстановили живую массу и дали больше прироста телки линии Флорина 374 ЦС-199, общий прирост составил 21,3 кг при среднесуточном в 231 г, в то же время у телок линии Альрума 49 КС-7 среднесуточный прирост был в 3, а у телок линии Радониса 838 в 4 раза меньше.
По данным Е.К. Голенкевича (1972) транспортировка на мясокомбинат на расстояние в 50 км вызвала потерю 6% живого веса быков, тогда как быки, которым вводили транквилизатор дексаметазон (4 мг/100 кг) потеряли 3% массы тела и выход мяса у них на 2,2% был выше по сравнению с контролем.
Прямую зависимость между концентрацией кортикостероидов и аденокотртикотропным гормоном в крови обнаружил Е.К. Голенкевич (1972) и предположил участие гипофиза в регуляции обменных процессов в организме телят.
По П.В. Макрушину (1985) большой экономический ущерб приносят транспортные стрессы, особенно при неправильной организации перевозок: высокой скорос
Влияние адаптогенов на морфофункциональное состояние аденогипофиза и коры надпочечников у быков при транспортном стрессе

СОДЕРЖАНИЕ
1. Введение
1.1. Актуальность темы
1.2. Цель и задачи исследований
1.3. Научная новизна
1.4. Практическая значимость и внедрение
1.5. Апробация работы и публикация
2. Обзор литературы
2.1. Стресс сельскохозяйственных животных
2.2. Роль гипофиз-адреналовой системы в регуляции стресса
2.3. Функциональная морфология аденогипофиза и коры надпочечника
2.3.1. Аденогипофиз
2.3.2. Кора надпочечников
2.4. Профилактика стресса у сельскохозяйственных животных
2.5. Заключение
1. Собственные исследования
3.1. Материал и методика исследований
3.2.Морфофункциональная характеристика аденогипофиза и коры надпочечников у быков в различные сезоны года
3.3. Клинико-морфологические изменения у телят после транспортировки
3.4. Морфофункциональные изменения в аденогипофизе и коре надпочечников у быков при транспортном стрессе
3.5. Влияние экстракта элеутерококка на морфофункциональное состояние аденогипофиза и коры надпочечников при транспортировке быков
3.6. Влияние фумаровой кислоты на морфофункциональное состояние аденогипофиза и коры надпочечников при транспортировке быков
3.7. Заключение
2. Выводы
3. Практические предложения
4. Список использованной литературы
1. ВВЕДЕНИЕ
1.1. Актуальность темы
Транспортировка животных - неизбежное технологическое звено промышленного скотоводства и является одним из самых тяжелых провокаторов напряжения организма, в результате которого потери в живой массе составляют от 2 до 20% в зависимости от сезона года, возраста, времени в пути и расстояния (A.C. Кашин, 1975; B.C. Бузлама с соавт., 1978; А.Л. Падучева, 1979; В.Н. Долгополов, 1981; А.И. Золотарев, 1988; O.A. Сапожкова, 1990; B.C. Бузлама, 1995; М.И. Редкий, 1997; О. Weiher et al., 1972; H. Volker et a. 1973; G.H. Srensen, 1985; H. Jasukouchi et al., 1995).
Важную роль в адаптации животных к неблагоприятным факторам транспортировки играют гормоны гипофиз-адреналовой системы, которые оказывают влияние на многие виды обмена веществ и принимают участие в регуляции общей неспецифической резистентности организма. При этом, в органах эндокринной системы животных после транспортировки возникают различные функциональные нарушения в деятельности всех звеньев эндокринной системы в том числе гипофизе и надпочечниках, которые раньше других органов реагируют на изменение внутренней среды организма (С.И. Плященко с соавт., 1987; Ф.З. Меерсон с соавт., 1988; Б.Я. Рыжавский, 1989; П.М. Торгуй, 1997 и др.).
Требования интенсификации промышленного животноводства не позволяют полностью избежать нежелательного влияния неблагоприятных воздействий технологическим путем. Встала острая проблема сочетания эволюционно обусловленных физиологических возможностей высокопродуктивных с современными методами ведения отрасли (B.C. Бузлама, 1976; И.И. Брехман, 1979; В. Гаськов, 1980; В. Бекенев, 1982; Л.С. Кузнецов,
наблюдений прирост массы у каждого подсвинка, получавшего фумаровую кислоту, составил 17,1 кг, среднесуточный прирост 362,7 г, в контрольной группе - 15,5 кг и 330,6 г соответственно. Дополнительный прирост при даче фумаровой кислоты составил 28,8 кг.
Фумаровая кислота является эффективным средством для профилактики постстрессовых пневмоний сельскохозяйственных животных (B.C. Бузлама с соавт., 1984) и отрицательных последствий технологического стресса при выращивании свиней (JI.C. Кузнецов, 1989;О.Н. Мистюкова, 1986; B.C. Бузлама с соавт., 1987). Фумаровая кислота увеличивает энергетические возможности организма при стрессе и нормализует его антиоксидантный статус (B.C. Бузлама с соавт., 1985; Т.Е. Рогачева, 1986), препятствует угнетению синтеза нуклеиновых кислот (О.Н. Мистюкова, 1986; A. Tshierschrvitz, 1980), оказывает нормализирующее влияние на структуру клеток печени и почек мышей (К. Kuroda et al., 1982), тормозит образование язв желудка у крыс (К. Kuroda et al., 1977), увеличивает содержание белка в скелетных мышцах и повышает активность аланин- и аспартатаминотрансфераз, сукцинойдегидрогеназы (А. Tschierschrvits, 1980).
Исследования по изучению влияния адаптогенов на функциональную морфологию аденогипофиза и коры надпочечника крупного рогатого скота единичны. Так, С.М. Сулейманов (1982) установил, что при повышении уровня резистентности телят элеутерококком улучшается структурная организация эндокринных органов.
Однако до настоящего времени в доступной литературе отсутствуют сведения относительно влияния фумаровой кислоты и элеутерококка на функциональную морфологию аденогипофиза и коры надпочечника откормочных быков при транспортном стрессе.
Обратите внимание, представленные выше научные тексты размещены для ознакомления и получены посредством распознавания оригинальных текстов диссертаций (OCR). В связи с чем, в них могут содержаться ошибки, связанные с несовершенством алгоритмов распознавания. В PDF файлах диссертаций, которые мы доставляем, подобных ошибок нет.
Читайте также:
