Активация противоопухолевого иммунитета.
Добавил пользователь Alex Обновлено: 27.01.2026
Иммунотерапия, вопреки расхожему мнению, - один из самых старых методов лечения злокачественных опухолей, ему уже более 100 лет. Первое лекарственное лечение, которое описано в медицинской литературе, было сделано в конце 19 века, когда впервые для лечения злокачественной опухоли предложили использовать один из методов – токсин Coley, который мы бы сегодня отнесли к иммунотерапии.
За 100 лет истории изучения иммунной системы, наше представление о самой работе этого органа существенно изменялись. Изначально ученые предполагали, что иммунная система - это такая система, которая должна нас защищать от внутренних и внешних врагов, используя все силы и возможности, которые есть у нее в арсенале. Это три отдельных звена - неспецифическое звено, гуморальный иммунитет и клеточный иммунитет, которые вместе обеспечивают защиту организма, как три богатыря в русских сказках. Такое представление бытовало довольно долго, однако, чем больше изучали иммунную систему, тем больше понимали, что это значительно более сложно устроенная система, там очень много механизмов.

Компоненты иммунной системы:
- Эффекторы (специфические и неспецифические) - те клетки, которые непосредственно выполняют роль защиты, которые должны убить опухолевые клетки. Их можно сравнить с солдатами. Как у солдат есть армия, сепцназ, милиция, так и у иммунной системы есть более и менее специализированные клетки, но их главная задача - уничтожать врага, в том числе - опухолевые клетки.
- Регуляторы – клетки-«чиновники», которые определяют, кому работать, что делать, как и когда. С работой этих регуляторных механизмов связаны последние успехи и прорывы онкоиммунологии. Мы научились влиять на регуляторы и давать возможность иммунной системе работать так, как она должна.
- Антиген-презентирующие клетки - своего рода учителя, которые обучают иммунную систему и обеспечивают активность специфических эффекторов, которые наиболее узко направлены. Эти клетки указывают иммунной системе, против кого бороться, показывают, кто друг, а кто враг. Эти клетки очень важны, именно потому, что они обеспечивают такое распознавание.
Почему иммунная система не срабатывает при злокачественной опухоли?
Во-первых - опухоль может маскироваться от иммунной системы. На ней могут быть слабые антигены, это те молекулы, которые иммунная система может распознать, тот маркер, на основании которого система решает хорошая это клетка или плохая, убить ее или поддержать.
Опухолевая клетка учится защищаться от антигенов, иммунная система может их плохо распознавать. К сожалению, часто в опухолевой клетке используются те сам антигены, которые есть во всех других тканях, иммунная система в норме приучена не реагировать на них. Соответственно не будет противоопухолевого иммунного ответа.
То есть опухоль использует некоторые элементы маскировки, как бы предъявляет иммунной системе фальшивый паспорт, что она «своя».
Безусловно, есть связанная с опухолевыми процессами иммунная супрессия, чтобы расти, опухоль должна подавить иммунную систему. У опухоли есть регуляторные вещества, которые она секретирует в кровь, которыми она отображает стоп сигнал на поверхности клетки. Иммунная система, даже если видит опухолевые клетки, то клетки-«солдаты», которые должны убить опухоль, могут прийти к ней и получить сигнал, что этого делать не надо.
Методы иммунотерапии
- Вакцинотерапия
С помощью вакцинотерапии мы можем обучить иммунную систему бороться с опухолевыми клетками. Как правило, это происходит «в пробирке», вне организма, т.е. вне влияния подавляющих действий опухоли. Мы можем обучить иммунные клетки больного распознавать опухоль или ее отдельные части. Потом эти обученные клетки возвращаются в организм и работают: они активируют имунную систему и нацеливают ее на опухоль. - Цитокины
Другой метод – цитокины, своего рода стимуляторы, допинг для иммунной системы. Если мы введем цитокины, мы можем ускорить и улучшить функции иммунной системы. Однако мы не всегда знаем, какая функция будет усилена. Если в организме есть противоопухолевый иммунный ответ, мы его активируем. Проблема истощения иммунных клеток решится, они получат силы, чтобы реализовать противоопухолевый иммунный ответ. Если же иммунная система, наоборот, защищает опухоль от организма, дает ей расти, то мы можем усилить эту функцию. - Антитела
Мы можем заменить часть функций иммунной системы, использовать антитела - такие молекулы, которые распознают конкретный белок, и даже часть белка, на опухолевой клетке. Таким образом иммунная система получает своего рода маркер. По антителу она может найти опухолевую клетку и уничтожить ее. Это один из первых методов иммунотерапии который дал прогресс в этой области. Благодаря ему появилось понятие таргетной терапии. На сегодняшний день в онкологии используется множество моноклональных антител, это современные препараты такие как Мабтера, Герцептин, которые успешно применяются при раке молочной железы. К сожалению, ограничение этого метода - именно целенаправленность. Опухоль меняется в процессе своего развития. Ее клетки могут научиться обходится без мишени или объяснить иммунной системе, что их не надо атаковать. - Эффекторные клетки
Другая замена функций иммунной системы – использование искусственно созданных или специально выращенных эффекторных клеток. Они запрограммированы уничтожать определенную опухоль. В организме они могут найти и обезвредить опухолевые клетки. Но этот метод, как и антитела, очень узко направлен. Кроме того, не всегда удается длительно сохранять такие клетки у пациента. - Ингибиторы сигнальных молекул
Наибольший успех, которого мы сегодня достигли, связан с применением ингибиторов сигнальных молекул. Это молекулы, которые останавливают стоп-сигнал в иммунной системе. Когда опухолевые клетки пытаются защититься с помощью активации таких стоп-сигналов, мы их можем отключить. Иммунная система продолжит атаковать опухолевую клетку, невзирая на то, какие сигналы она получает.
Этот метод позволил нам достигнуть значительного прогресса в лечении меланомы кожи, рака легкого, почечно-клеточного рака и других.
Опухоли головы, шеи, лимфопролиферативные заболевания, рак молочной железы, колоректальный рак - современная иммунотерапия без моноклональных антител в этих опухолях практически немыслима.
Новые методы терапии тоже входят в широкую клиническую практику. Активно изучаются различные методы вакцинотерапии, методы замещения функций иммунной системы, это генетически модифицированные эффекторные клетки. Таким образом на сегодняшний день иммунотерапия стала неотъемлемым компонентом комплексного лечения злокачественных опухолей.
Практически любой метод лечения при злокачественном процессе, так или иначе, затрагивает иммунную систему. И дает возможность иммунной системе сработать и вызвать длительный, продолжительный иммунный ответ. Сегодня вопрос излечения, даже на распространенной стадии процесса - это уже не фантастика а реальность, которой возможно удастся достичь очень скоро. Безусловно, наибольшую эффективность мы можем получить, когда комбинируем различные методы терапии.

На диаграмме «Взаимодействия различных методов противоопухолевого лечения» представлены возможные комбинации отдельных методов терапии, при этом зеленым отмечены комбинации с доказанной эффективностью, а красным – сочетания методов, изучающихся в настоящее время.
Мы знаем, что модуляторы иммунологического синапса и цитокины хорошо сочетаются и с химиотерапией, и с хирургическим лечением. Мы активно используем лучевую терапию как один из компонентов иммунотерапевтического подхода к лечению. Мы используем различные ингибиторы тирозинкиназ, которые также работают для иммунной системы. Мы используем адоптивную клиническую терапию, то есть заместительную иммунотерапию.
Иммунотерапия на сегодняшний день это один из основных методов системной терапии злокачественных опухолей. Комплексный подход и индивидуализация лечения в дальнейшем обеспечит еще большую эффективность этого вида терапии.
Новик Алексей Викторович, кандидат медицинских наук, ведущий научный сотрудник отдела онкоиммунологии НИИ онкологии им. Н.Н.Петрова
Противорецидивная реабилитация больных злокачественными опухолями
СТОИМОСТЬ ПРОТИВОРЕЦИДИВНОЙ РЕАБИЛИТАЦИИ БОЛЬНЫХ ЗЛОКАЧЕСТВЕННЫМИ ОПУХОЛЯМИ определяется индивидуально и зависит от объёма реабилитационных мероприятий.
Противорецидивная реабилитация - это совокупность патогенетически обоснованных лечебно-диагностических мероприятий, направленных на предупреждение рецидива злокачественных опухолей у онкобольных с так называемым психогенным анамнезом, которые завершили стандартное комбинированное лечение злокачественных опухолей (хирургия, лучевая терапия, химиотерапия). Психогенный анамнез - это наличие значимых стрессовых событий в жизни человека (смерть близкого человека, развод, частые семейные конфликты, смена места жительства и работы, появление инвалида в семье и др.), которые предшествовали постановке диагноза рака (в среднем за 1,5 года до постановки диагноза) и явились причиной хронического стрессового состояния с развитием психоэмоциональных нарушений (тревожных, депрессивных расстройств и др.).
Противорецидивная реабилитация онкобольных с психогенным анамнезом основана на научных данных о феномене зависимости противоопухолевого иммунитета от состояния высшей нервной деятельности (психики) и концепции психогенного канцерогенеза, т.е. возможности развития рака на фоне хронического психоэмоционального стресса.
Противоопухолевый иммунитет организма обеспечивается за счёт деятельности специальных клеток иммунной системы (цитотоксических Т-лимфоцитов - CD8 Т-клетки и клеток-киллеров - NK-клетки), которые уничтожают раковые клетки, прикрепляясь к их оболочке, образуя в ней многочисленные дырки (поры) диаметром 5-20 нм, словно наноперфоратором, и ввводя внутрь клетки белок перфорин, который полностью разрушает (лизирует) раковую клетку. Иммунные аттаки и уничтожение раковых клеток цитотоксическими Т-лимфоцитами можно посмотреть на уникальном видео (с 1:45 мин. по 2:55 мин.), которое представлено Американским обществом клеточной биологии (the American Society for Cell Biology). На видео показано, как цитотоксические Т-лимфоциты (окрашенные зелёным цветом), прикрепляясь к раковым клеткам (окрашенные красным цветом), "впрыскивают" внутрь раковой клетки цитолитический белок перфорин, что приводит к яркой красной вспышке всей раковой клетки (словно подлили бензина в огонь) с последующим быстрым уменьшением её размеров и распадом. Так осуществляется противоопухолевый иммунный надзор в организме с уничтожением раковых клеток, ежедневное появление которых является обычным фоновым процессом. Однако под влиянием хронического психоэмоционального стресса с развитием тревожно-депрессивных расстройств противоопухолевая активность цитотоксических Т-лимфоцитов и клеток-киллеров значительно снижается, что приводит к накоплению раковых клеток в организме и способствует развитию злокачественных опухолей, а также появлению прогрессии или рецидива рака.
Цитотоксические Т-лимфоциты и клетки-киллеры атакуют раковую клетку
Противоопухолевый иммунитет участвует также в процессе заживления каких-либо повреждений в организме и это имеет непосредственное отношение к появлению злокачественных опухолей. Так, в зоне повреждения (раны) противоопухолевый иммунитет временно "выключается" под влиянием сигналов блокировки со стороны тканевых стволовых клеток (которые идентичны раковым клеткам!), чтобы заживить повреждение (рану) ( рисунок 1 ). В противном случае активный противоопухолевый иммунитет уничтожил бы тканевые стволовые клетки и заживление никогда не наступило. После завершения заживления, теперь уже клетки противоопухолевого иммунитета берут под свой контроль деятельность тканевых стволовых клеток ( рисунок 2 ). Так происходит в нормальных условиях. Однако, при возникновении тревожно-депрессивных расстройств в результате хронического стресса, в организме постоянно образуется и поддерживается огромное количество зон микроповреждений под влиянием стрессовых гормонов и нарушений вегетативной регуляции (гиперсимпатикотонии). В такой ситуации противоопухолевый иммунитет "выключается" системно и длительно, чтобы обеспечить полное заживление, но оно никак не наступает из-за постоянного поддержания старых и появления новых зон микроповреждений. Более того, в зоне наибольших микроповреждений и постоянного воспаления часть тканевых стволовых клеток из-за повреждений ДНК трансформируется в так называемые раковые стволовые клетки, которые, собственно, дают начало росту раковой опухоли ( рисунок 3 ).
При этом, клетки-киллеры (NK-клетки), которые призваны природой уничтожать раковые клетки, начинают выделять вещества, которые наоборот поддерживают раковый процесс, превращаясь в своеобразные "клетки-предатели". Таким образом, на фоне хронического стресса противоопухолевый иммунитет не только подавляется, но одновременно извращается! Это имеет крайне важное значение при использовании методов иммунотерапии рака, указывая на особую опасность их применения без предварительного устранения извращённых противоопухолевых реакций иммунной системы, обусловленных иммунодепрессивным влиянием хронического стресса. В этой связи противорецидивная реабилитация онкобольных с психогенным анамнезом состоит из 2-х строго последовательных этапов: I этап - психокоррекция, II этап - иммунокоррекция.
I этап - психокоррекция. Целью данного этапа является точная диагностика и эффективное лечение психоэмоциональных нарушений у больных злокачественными опухолями. Комплексная диагностика психоэмоциональных расстройств и оценка эффективности лечения предполагает проведение обязательного психометрического исследования, в том числе дистанционно. Для эффективного лечения психоэмоциональных расстройств у онкобольных используются лекарственные препараты и гипносуггестивная психотерапия в виде специально разработанной и модифицированной методики гипнотерапии боевого стресса. Гипнотерапия направлена на устранение эмоциональной стрессовой памяти и комплекса патологических рефлексов пережитых стрессов, формирование стрессоустойчивости онкобольных, чего достичь лекарственными средствами практически невозможно. Методика гипнотерапии предусматривает также обучение онкобольных технике аутогипноза для самостоятельного пролонгирования лечебного эффекта без участия врача. До начала психокоррекции и после неё проводится оценка состояния активности противоопухолевого иммунитета с использованием кожной противоопухолевой пробы для принятия решения о переходе к следующему этапу противорецидивной реабилитации - иммунокоррекции.
II этап - иммунокоррекция. Целью данного этапа является активация специфического противоопухолевого иммунитета и формирование иммунологической памяти. Иммунокоррекция проводится в двух вариантах - экстракорпоральная и трансдермальная.
1. Экстракорпоральная иммунотерапия (селективная аутогемотерапия), когда собственные клетки иммунной системы (цитотоксические Т-лимфоциты и NK-клетки) приобретают вне организма, т.е. экстракорпорально, чрезвычайную противоопухолевую активность, становясь своеобразным "противоопухолевым иммунным спецназом". Этапы экстракорпоральной иммунотерапии больных злокачественными опухолями представлены на рисунке.
2. Трансдермальная иммунотерапия, при которой клетки "противоопухолевого иммунного спецназа" получают специфические сигналы, направленые на уничтожение злокачественных опухолевых клеток в организме. Это достигается путём нанесения раствора опухолеассоциированных антигенов на скарифицированную кожу под стерильным пластырем, как показано на фото. В результате аппликации на повреждённую кожу опухолеассоциированных антигенов последние посылают специфические иммунные сигналы действия клеткам "противоопухолевого иммунного спецназа", вызывая мощный системный противоопухолевый иммунный ответ. За открытие этого ключевого механизма чрескожной системной активации противоопухолевого иммунитета американскому учёному профессору Ральфу Штайнману в 2011 году была присуждена Нобелевская премия по физиологии и медицине (информация здесь). Процедура трансдермальной иммунотерапии представлена на рисунке.
Такая двойная активация противоопухолевого иммунитета приводит к целенаправленным специфическим иммунным атакам в отношении злокачественных опухолевых клеток, их ликвидации, а также формирует иммунологическую память для более эффективного противоопухолевого иммунного ответа в случае повторного появления в организме злокачественных опухолевых клеток.
Активация противоопухолевого иммунитета.
Активация противоопухолевого иммунитета.
Эффективная индукция специфического противоопухолевого иммунитета достигается при выполнении ряда условий.
1. В опухолевой клетке должен быть экспрессирован соответствующий антиген, способный к процессингу и представлению в виде комплекса с молекулами гистосовместимости данного больного.
2. В репертуаре Т-клеток должны присутствовать клоны, несущие рецепторы, специфичные к комплексу молекулы МНС данного реципиента с пептидом антигена опухолевой клетки.
3. Для индукции цитотоксического ответа должен быть обеспечен достаточный уровень костимуляции, который достигается вовлечением в ответ других типов клеток — Т-хелперов CD4+ первого типа и дендритных клеток.

Костимуляция обеспечивается как на уровне контактных взаимодействий между клеточными типами, участвующими в иммунном ответе, так и на уровне продукции цитокинов, необходимых для его развития. На эффективность иммунного ответа оказывают влияние и другие факторы, такие как продукция опухолевыми клетками супрессорных цитокинов и локальные эффекты опухолевой стромы. В связи с фенотипической и генетической нестабильностью опухолевые клетки могут одвергаться селекции и избегать иммунной деструкции посредством снижения экпрессии молекул МНС класса I либо снижения иммуногенности вследствие утраты экспрессии антигена.
Дополнительный уровень сложности в управлении взаимодействием между иммунной системой и опухолью создается вариабельностью процессинга опухолевых антигенов как в клетках различных гистологических типов, так и в клетках, находящихся в различных акти-вационных состояниях. Процессинг эпитопов опухолевых антигенов, распознаваемых в контексте молекул МНС класса I, зависит от расщепления белковых молекул протеасомой — каталитическим комплексом, состоящим из нескольких субъединиц. В зависимости от композиции этих каталитических субъединиц имеет место различный процессинг некоторых белков. Существуют различия между иммунопро-теасомой, экспрессированнои в лимфоидных органах или клетках, хронически подвергающихся воздействию IFNg в очаге воспаления, и стандартной протеасомой, характерной для большинства клеток. Хотя оба вида протеасом являются каталитически эффективными, они показывают различную степень предпочтения при разрезании молекул белков, в результате чего некоторые эпитопы не могут быть эффективно процессированы тем или другим типом фермента. Это наблюдение может быть очень важным для иммунотерапии рака, поскольку пептиды или минигенные вакцины, позволяющие обойти необходимость расщепления протеасомой, могут быть наиболее эффективными для лечения.
Эти обстоятельства диктуют ограничения в индукции эффективного противоопухолевого иммунитета. В частности, опухолеассоциированные антигены, как мишени для направленной иммунотерапии, обладают тем преимуществом, что они выражены у большинства пациентов с определенным видом рака. Однако Т-клетки показывают низкую или промежуточную способность к взаимодействию с ними из-за механизмов толерантности к «своему» и делеции внутри тимуса ауторе активных клонов.
С другой стороны, экспрессии специфических антигенов на опухолевых клетках оказывается недостаточно для развития эффективного иммунного ответа в связи с неспособностью опухолевых клеток обеспечить достаточный уровень кос-тимуляции. В отсутствие костимуляторного сигнала Т-клетки впадают в состояние анергии и начинают конкурировать с эффектор-ными клетками, способными к выполнению иммуных функций.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Чекпойнты в борьбе против рака
Нобелевская премия по физиологии и медицине вручена американцу Джеймсу Эллисону (James P. Allison) и японцу Тасуки Хондзё (Tasuku Honjo). Жюри Каролинского института в Стокгольме присудило награду этим ученым за открытие контрольных точек иммунного ответа, способных останавливать развитие иммунной реакции организма на раковую опухоль, и за разработку принципиально новых противораковых препаратов. Что же представляют собой эти «контрольные точки» и почему они важны в борьбе с онкозаболеваниями? Разъясняет кандидат биологических наук, доцент Александр Борисович Сагакянц, руководитель лаборатории иммунофенотипирования опухолей Ростовского научно-исследовательского онкологического института.

Не секрет, что проблема поиска эффективных способов диагностики и лечения, а также профилактики онкологических заболеваний является одной из самых актуальных проблем современного общества, объединяющей усилия представителей как фундаментальной, так прикладной науки. Население нашей планеты стареет, а вместе с этим увеличивается и число онкологических больных.
Идея о том, что развитие опухоли имеет тесную, связь с особенностями работы иммунной системы организма человека не нова – фактически с момента появления иммунологии как отдельной отрасли человеческого знания (конец XIX начало XX вв.) появляются теоретические и практические предпосылки будущей онкоиммунологии, развитие которой привело к открытию и антигенов опухолей и раскрытию механизмов противоопухолевого иммунитета. Своеобразным венцом развития онкоиммунологии и, в частности, иммунотерапии опухолей явилось появление таргетных препаратов, обладающих высокой специфичностью и эффективностью по отношению к мишени – опухолевым клеткам.
Известно, что различные компоненты совместно функционирующих звеньев иммунной системы (врожденного и адаптивного иммунитета) обуславливают удаление большинства чужеродных веществ – антигенов, которые чаще всего ассоциируются с инфекционными агентами. Эти чужеродные вещества вызывают активацию (включение) иммунного ответа в виде появления и размножения специфических цитотоксических Т-лимфоцитов и образования столь же специфических по отношению к антигену антител (иммуноглобулинов).
Следует отметить, что иммунитет должен не только уничтожать «чужих» – он не должен повреждать собственные здоровые клетки организма. Иммунитет должен, во-первых, давать симметричный ответ, а во-вторых, уметь вовремя остановиться. Таким образом, баланс между стимулирующими и ингибирующими механизмами позволяет иммунной системе давать отпор болезни, не повреждая здоровые ткани.
Несмотря на достаточно хорошо изученные, но, в ряде случаев не столь однозначные особенности реализации противоопухолевого иммунитета, было показано, что опухоль, являясь гетерогенным, сложным, эволюционирующим образованием обладает рядом механизмов, вызывающих торможение работы иммунной системы, что способствует ее росту и прогрессированию.
Один из белков, который служит тормозом для Т-клеток и является своеобразной мишенью для опухолевых клеток, называется CTLA-4 – он локализован на наружной мембране Т-лимфоцита, его активация приводит к снижению активности клеточного иммунитета. Эту молекулу стали активно изучать в 90-е годы, но обычно его рассматривали как средство противодействия с другими заболеваниями - с аутоиммунными расстройствами, при которых активация CTLA-4 приводила к торможению иммунного ответа по отношению к собственным тканям, что и давало желаемый эффект.

Джеймс Эллисон (James P. Allison), который, работая в Калифорнийском университете в Беркли, задумался о другом аспекте использования данной молекулы. Известно, что раковые клетки часто выигрывают от того, что иммунитет слишком вяло на них реагирует. Что, если CTLA-4, наоборот, отключить – поможет ли это активировать противоопухолевый иммунный ответ? Первые такие эксперименты Эллисон и его коллеги поставили в конце 1994–начале 1995 года, и результаты оказались весьма впечатляющими. Поначалу фармацевтические компании не проявили особого интереса, но Эллисон с коллегами продолжили работать, и в XXI веке стало ясно, что один из самых перспективных направлений создания новых лекарственных препаратов. В 2010 году клинические исследования показали, что, подавляя CTLA-4, можно избавить больного от меланомы; были положительные результаты и с другими разновидностями рака.

Тасуку Хондзё (Tasuku Honjo), открыл в 1992 году белок PD-1 – другой известный белок, который также находится на Т-клетках и управляет их активностью. Хондзё и его коллеги по Киотскому университету показали, что PD-1 действует подобно CTLA-4, то есть «успокаивает» Т-лимфоциты, однако делает это по другому механизму. Показано, что на опухолевых клетках появляется молекула-лиганд для данного рецептора (PDL-1), наличие которой вызывает ингибирование противоопухолевого иммунного ответа. Когда в опытах с онкобольными животными у них отключали PD-1, иммунитет начинал активно бороться с опухолями. Так же, как в случае с CTLA-4, несколько клинических исследований, выполненных в начале 2010-х годов, показали эффективность такого метода против нескольких разных типов рака. Лечению через PD-1 поддавались даже метастатические опухоли.
Молекулы подобные PD-1 и CTLA-4 называют иммунными чекпойнтами, иммунными «проверочными» точками. В обоих описанных подходах, разработанных лауреатами Нобелевской премии 2018 г. в качестве лекарственных препаратов используются особые белки – моноклональные антитела высокоспецифичные по отношению к CTLA-4 и PD-1. Присоединение этих препаратов к указанным мишеням и вызывает описанные эффекты.
Можно сказать, что терапевтические методы, которые основаны на управлении иммунными чекпойнтами, без преувеличения открыли новую главу в онкологии. Побочные эффекты у такого способа лечения есть, и связаны они с риском аутоиммунной реакции, однако метод сам по себе достаточно нов, особенно если сравнивать его с классическими подходами к лечению онкологических болезней - химио- и радиотерапией.
В Ростовском научно-исследовательском онкологическом институте (ФГБУ «РНИОИ» Минздрава России) проводятся активные исследования, направленные на раскрытие вклада отдельных элементов врожденного и адаптивного иммунитета в механизмы борьбы организма с опухолевыми клетками. Показано, что инфильтрирующие опухоль и соседние ткани клетки иммунной системы сложным образом вовлечены не только в борьбу, но, при определенных условиях, способны обуславливать рост и метастазирование опухоли.

Одним из направлений, развивающихся в институте, является изучение фенотипических характеристик и биологических свойств особой популяции клеток опухолей – опухолевых стволовых клеток, обуславливающих высокую устойчивость к современным химио- и радиотерапевтическим методам лечения, участвующих в процессах метастазирования опухолей. Несмотря на 20-летнюю историю их изучения, многие вопросы, связанные с их биологией, остаются спорными и нерешенными. Выделение этих клеток, создание на их основе модельных систем, позволит глубже изучить их свойства и, вероятно, разработать новые подходы к диагностике и терапии ряда онкологических заболеваний.

Отдельной задачей проводимых исследований является оценка влияния как традиционных, так и инновационных подходов лечения опухолей на организм человека по показаниям функциональной активности клеток иммунной системы, оценка влияния терапии на различные системы органов по биохимическим и иным показателям. Это, несомненно, является важным аспектом, так как проводимое лечение оказывает влияние не только на опухоль, но и на здоровые ткани и органы человека, что может иметь нежелательные, побочные эффекты. Коллектив Ростовского НИИ онкологии ищет способы оценки таких осложнений, своевременного их предотвращения и повышения адресного воздействия препаратов на клетки опухоли.

В Ростовском онкоинституте ряд работ проводится на экспериментальных животных, для чего на базе Испытательного лабораторного центра создан виварий, позволяющий работать в особых условиях, в том числе с иммунодефицитными животными, которые дают возможность получить модельные системы по изучению отдельных типов опухолей. Кроме того, работы осуществляются и на культуре опухолевых клеток, что позволяет проводить исследования на качественно новом уровне.


Использование комплекса молекулярно-генетических, биохимических, иммунологических и функциональных подходов к исследованию позволяет получать новые, интересные результаты, раскрывающие некоторые закономерности роста и развития опухоли, ее поведении в различных условиях, что позволит разработать более совершенные подходы к лечению данного недуга.
В институте запланированы и проводятся научно-исследовательские работы, направленные на изучение закономерностей экспрессии важнейших генов и их продуктов – антигенов в опухолях как при их развитии, так и при использовании современных подходов лечения онкологических заболеваний, в том числе, направленных на иммунные чекпойнты (CTLA-4 и PD-1), за открытие которых и была присуждена Нобелевская премия 2018 г.
Иммунотерапия при онкологии
Иммунотерапия – это новое слово в лечении онкологических заболеваний. В ее основе лежит более детальное понимание взаимодействия организма и опухоли.
В последние несколько лет в лечении онкологии происходит революция, где на помощь традиционной химиотерапии приходит более узконаправленное и эффективное лечение.
Если коротко проследить эволюцию лекарственной терапии злокачественных опухолей, то химиотерапия – это воздействие специальными цитостатическими препаратами на клетки опухоли. Эти препараты поражают в первую очередь клетки, которые быстро делятся. Отсюда прямое следствие, что поражаются не только опухолевые, но и здоровые ткани. Но химиотерапия универсальна и может быть назначена практически при любой опухоли на всех этапах лечения. Следующим ключевым этапом было появление таргетной терапии, которая избирательно воздействует на сигнальные пути межклеточных взаимодействий. Таргетная терапия бьет в определенную мишень, но опухолевые клетки со временем приобретают возможность находить новые пути для своего развития. Возможности применения таргетной терапии ограничены наличием этих мишеней, что в большинстве случаев удается выяснить при проведении иммуногистохимического исследования. Примером таргетной терапии является добавление трастузумаба пациентам с Her-позитивным раком молочной железы.
Лечение рака иммунотерапией
Сравнительно недавно (первый препарат вошел в широкую клиническую практику в 2013 г.) появился принципиальный вид лечения. Дело в том, что в организме каждого человека происходит постоянная борьба иммунной системы с опухолевыми клетками, и во многом появление злокачественной опухоли связано с дефектом иммунной системы. Используя специальные механизмы внутреннего контроля опухолевые клетки приобретают способность «ускользать» от иммунной системы.
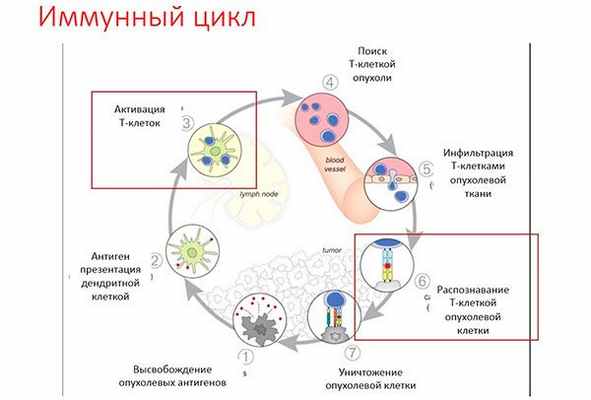
Ответ иммунной системы на опухоль представляет собой цепь реакций, где дефект одного звеньев блокирует весь цикл. В целом этот цикл можно описать так:
Множество опухолевых клеток уничтожается еще до появления клинических признаков рака, а некоторые опухоли находятся в состоянии равновесия с иммунной системой до тех пор, пока какое–либо событие не изменит баланс в ту или иную сторону. Однако опухолевые клетки адаптируются и меняются путем своего естественного развития, чтобы ускользнуть от иммунного ответа.
Сегодня мы можем воздействовать на как минимум 2 звена, запуская этот цикл заново:
- Анти–CTLA4 (Ипилимумаб) блокирует рецептор на мембране Т-лимфоцитов, который выключает активацию иммунитета. В нашем организме все сбалансировано, и если иммуная система будет «слишком активна», то начнет атаковать нормальные клетки организма – так возникают аутоиммунные заболевания. Данный препарат блокирует механизм «блокирования» иммунной системы, позволяя ей «раскрутить» противоопухолевый иммунитет и увеличить количество Т-лимфоцитов, которые будут атаковать опухоль.
- Ингибиторы контрольных точек. Это моноклональное антитело, блокирующее рецепторы клеточной гибели PD1 (пембролизумаб, ниволумаб) и их лиганды PD-L1 (атезолизумаб, дурвалумаб). Активация рецепторов PD1 специальным лигандом, который находится на поверхности опухолевых клеток, запускает механизм клеточной гибели клеток иммунной системы. Этот механизм предусмотрен в норме для соблюдения баланса иммунитета, но используется опухолевыми клетками для «ускользания». Препараты этой группы блокируют этот механизм, позволяя иммунной системе снова видеть и атаковать опухолевые клетки.
Данная терапия сегодня активно изучается и используется в лечении метастатической меланомы, немелкоклеточного рака легких, рака мочевого пузыря, колоректального рака, лимфомы Ходжкина, карциномы Меркеля, рака головы и шеи, печени и некоторых других опухолях в определенных обстоятельствах.
Но, к сожалению, пока она работает лишь в ограниченном числе случаев - 10-30%.
Но в большинстве случаев (более 70%) по тем или иным причинам иммунный ответ не реализуется. В настоящее время ведется множество исследований, направленных на моделирование иммунного ответа.
Одной из отличительных особенностей является то, что если на иммунотерапию возникает ответ, то он часто может быть очень длительным.
На фоне иммунотерапии также возникает токсичность, в том числе и серьезная. Она имеет другой профиль, нежели чем при стандартной химиотерапии. Связаны эти побочные действия с аутоиммунными реакциями на фоне «гиперактивного» иммунитета. Среди них отмечают:
- и витилиго
- энтероколит
- гепатит
- тиреоидит
- пневмонит
- гипофизит
- увеит
- надпочечниковую недостаточность
- нефрит
- артрит и дерматомиозит , аутоиммунный диабет
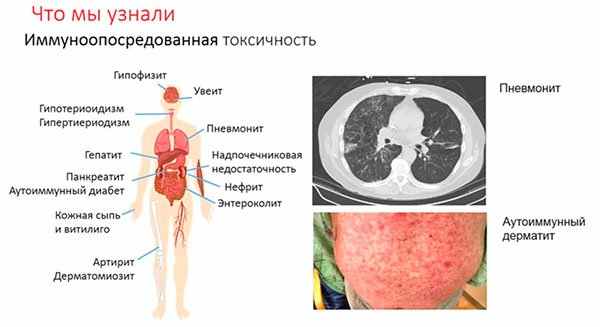
Очень важно, чтобы проведение этой терапии осуществлялось врачами-онкологами, имеющими опыт как проведения данной терапии, так и выявления на ранней стадии этих осложнений и их лечения. Раннее распознавание осложнений позволяет провести эффективное лечение коротким курсом глюкокортикостероидов, однако ряд побочных эффектов может длиться постоянно и требовать заместительной терапии (например, при аутоиммунном поражении щитовидной железы).
Что вы получите от иммунотерапии в клинике Рассвет
В клинике Рассвет проводятся все виды противоопухолевого лечения, в том числе и иммуноонкологичекими препаратами. Наличие у нас врачей практически всех специальностей позволяет привлекать их для решения сложных случаев и совместно обеспечивать лучший контроль над побочными действиями.
Читайте также:
