Анатомия фатерова сосочка. Хирургическая анатомия сфинктера Одди.
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
Дивертикулы редко появляются в желудке, но в двенадцатиперстной кишке присутствуют у 25% людей. Большая часть дуоденальных дивертикулов одиночные и расположены в нисходящей части двенадцатиперстной кишки, прилегая или включая в себя ампулы фатерова сосочка (периампулярно). В остальной части тонкого кишечника (тощей кишке и подвздошной кишке) дивертикулы выявляются у более 5% пациентов, чаще всего встречаются в тощей кишке пациентов с расстройствами кишечной моторики. Меккелев дивертикул Меккелев дивертикул Дивертикул Меккеля является истинным дивертикулом; это наиболее распространенная врожденная аномалия желудочно-кишечного тракта, встречающаяся примерно у 2% населения. Он вызван неполной облитерацией. Прочитайте дополнительные сведения Большинство дивертикулов желудка и тонкой кишки бессимптомны и обнаруживаются случайно. Осложнения дивертикулов включают кровотечение Желудочно-кишечные кровотечения, обзор [Overview of GI Bleeding] Кровотечение в желудочно-кишечном тракте может развиваться на любом уровне – от ротовой полости до ануса, протекать в явной и скрытой форме. Клинические проявления зависят от локализации источника. Прочитайте дополнительные сведения , перфорацию Острая перфорация желудочно-кишечного тракта Перфорация может происходить на любом уровне желудочно-кишечного тракта; при этом содержимое желудка или кишечника поступает в полость брюшины. Причины различны. Клинические симптомы развиваются. Прочитайте дополнительные сведения
Дивертикулы желудка
Дивертикулы желудка обычно обнаруживаются случайно при эндоскопических исследованиях или визуализациях (например, в исследованиях верхних отделов желудочно-кишечного тракта с барием, КТ с контрастированием). Преобладающее местоположение –проксимальная часть желудка вдоль большой кривизны. Размер дивертикулов колеблется от 1 до 3 см в диаметре. Дивертикулы желудка образованы выпячиванием слизистой оболочки желудка через мышечный слой, но при этом не сквозь всю стенку желудка (возможно, из-за толщины мышечных слоев), поэтому они называются интрамуральными, или частичными дивертикулами.
Дивертикулы желудка обычно бессимптомны, но некоторые пациенты сообщают о неясном ощущении тяжести в желудке и диспепсии. Такие осложнения, как кровотечение, перфорация и рак, не являются типичными.
Для бессимптомных дивертикулов не требуется специфического лечения; ведение данного заболевания зависит от тяжести симптомов. В некоторых исследованиях сообщалось, что использование ингибиторов протонной помпы в течение нескольких недель может облегчить диспепсию. Однако другие данные свидетельствуют о невосприимчивости симптомов к ингибиторам протонной помпы или H2-блокаторам.
Дивертикул двенадцатиперстной кишки
Дивертикулы двенадцатиперстной кишки могут быть
Внепросветными (выступающими за стенку двенадцатиперстной кишки)
Внутрипросветными (выступающими в просвет двенадцатиперстной кишки)
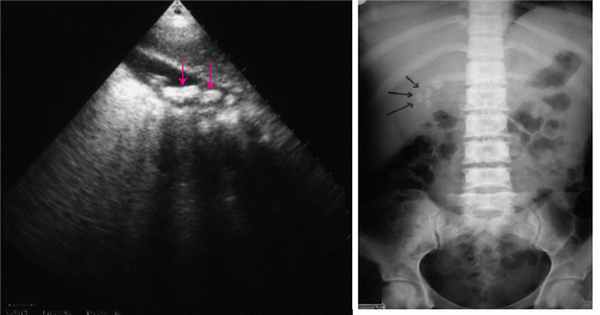
Внепросветные дивертикулы двенадцатиперстной кишки часто встречаются и наблюдаются примерно у 25% пациентов > 50 лет, проходящих эндоскопическую ретроградную холангиопанкреатографию Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) Визуальные методы исследования позволяют точно диагностировать патологию билиарного тракта и важны для определения очаговых повреждений печени (например, абсцесс, опухоль). Они ограничены в. Прочитайте дополнительные сведения ; они являются периампуллярными у трех четвертей этих пациентов. Дивертикул, возникающий в пределах 2–3 см от ампулы, называется юкстапапиллярным. Пациенты бессимптомны или жалуются на неспицифические абдоминальные симптомы.
Осложнения внепросветных дивертикулов включают кровотечение Желудочно-кишечные кровотечения, обзор [Overview of GI Bleeding] Кровотечение в желудочно-кишечном тракте может развиваться на любом уровне – от ротовой полости до ануса, протекать в явной и скрытой форме. Клинические проявления зависят от локализации источника. Прочитайте дополнительные сведения , дивертикулит Дивертикулит толстого отдела кишечника Дивертикулит – воспаление дивертикула с инфекцией или без нее, которое может приводить к развитию флегмоны стенки кишечника, перитониту, перфорации, образованию фистулы или абсцессу. Основной. Прочитайте дополнительные сведения . При множественных дивертикулах могут возникать диарея и мальабсорбция из-за избыточного бактериального роста Избыточный бактериальный рост в тонком кишечнике (SIBO) Небольшой избыточный бактериальный рост в тонком кишечнике может быть следствием изменений анатомии кишечника или нарушений моторики желудочно-кишечного тракта, а также недостатка секреции желудком. Прочитайте дополнительные сведения . Непроходимость двенадцатиперстной кишки встречается крайне редко. Юкстапапиллярные дивертикулы могут вызывать такие осложнения, как холангит, рецидивирующий панкреатит, холедохолитиаз (даже после холецистэктомии) и дисфункцию сфинктера Одди.
Внутрипросветные дивертикулы, напоминающие по форме ветровой конус, являются дивертикулами, полностью находящимися в просвете. Встречаются они редко и вызваны аномалиями развития, которые приводят к возникновению перемычки через весь просвет кишки. Со временем перистальтические сокращения втягивают перемычку и стенку кишечника, к которой она прикреплена, в просвет кишки. Инвагинальная стенка кишки тогда представляет собой внутрипросветный мешочек, или дивертикул. Внутрипросветные дивертикулы обычно встречаются во второй доле двенадцатиперстной кишки, большинство из них расположено вблизи фатеровой ампулы. Они могут дистально располагаться по всей кишке или только в некоторой ее части, размер их может составлять до четверти размера всей двенадцатиперстной кишки. Часто в дивертикуле несимметрично относительно его центра присутствует вторая ножка. Они обычно бессимптомны, но у некоторых пациентов развивается неполная дуоденальная обструкция, перфорация или кровотечение.
Дивертикулы тощей и подвздошной кишок
Эти дивертикулы тонкой кишки встречаются примерно в 5% случаев и могут возникать в тощей кишке (80%), подвздошной кишке (15%) или обеих (5%). Они обычно множественные и их размеры колеблются от нескольких миллиметров в диаметре до 10 см в длину. Дивертикулы тонкой кишки не имеют истинной мышечной стенки и обычно расположены по линии прикрепления брыжейки. Эти дивертикулы могут быть вызваны нарушениями моторики кишечника.
Многие пациенты бессимптомны или сообщают о неспецифических симптомах, таких как периодическая боль в животе, быстрое насыщение, вздутие живота, громкие кишечные шумы и периодическая диарея. Осложнения включают кровотечение, дивертикулит и перфорацию. У некоторых пациентов может развиться избыточный бактериальный рост с последующей мальабсорбцией или заворот тонкого кишечника, что может привести к непроходимости.
Дивертикулы тонкой кишки обычно диагностируют с помощью энтероскопии (антероградным или ретроградным способом), рентгенографии пассажа бария, КТ-энтерографии, МРТ-энтерографии или капсульной эндоскопии.
Для пациентов с отсутствием симптоматики обычно рекомендуется консервативное лечение. При избыточном бактериальном росте назначают антибиотики. Пациентам с перфорацией или дивертикулитом может потребоваться хирургическая операция. При хронической кишечной псевдообструкции операции обычно избегают.
Основные положения
Дивертикулы редко возникают в желудке, однако часто в двенадцатиперстной кишке и тонком кишечнике.
Большинство дивертикулов протекают бессимптомно и выявляются случайно.
Осложнения включают кровотечение, перфорацию и мальабсорбцию в результате избыточного бактериального роста.
Бессимптомные дивертикулы не требуют лечения.
Следует с осторожностью рекомендовать хирургическое вмешательство пациентам с дивертикулами и неспецифическими симптомами нарушений в работе желудочно-кишечного тракта (например, диспепсией).
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Автореферат и диссертация по медицине (14.00.02) на тему: Хирургическая анатомия сосудисто-нервного компонента большого дуоденального сосочка
Оглавление диссертации Александров, Тимофей Игоревич :: 2006 :: Новосибирск
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ.
1.1. Кровоснабжение и иннервация большого дуоденального сосочка.
1.2. Классическая эндоскопическая папиллосфинктеротомия.
1.3. Полукруглая папиллотомия по P. Schweizer (2000).
1.4. Причины патологическою состояния большою дуоденального сосочка.
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ.
2.1. Общие сведения.
2.2. Анатомические методы исследования.
ГЛАВА 3. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ.
3.1. Сосудисто-нервный компонент большого дуоденального сосочка.
3.1.1. Артериальное обеспечение большого дуоденального сосочка.
3.1.2. Венозный отток от большого дуоденального сосочка.
3.1.3 Иннервация большого дуоденального сосочка.
3.1.4 Гистологические исследования большого дуоденального сосочка.
3.2 Классическая папиллосфинктеротомия.
3.3. Полукруглый доступ по P. Schweizer.
3.4. Состояние при патологии желчевыделительной системы.~.
ГЛАВА 4. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ.
Введение диссертации по теме "Анатомия человека", Александров, Тимофей Игоревич, автореферат
Операция лишь тогда может рассматриваться как действительное приобретение для науки, когда теория этой операции обоснована опыта.ми, анатомо-физиологическими и патологоанатомическими исследованиями»
За последние десятилетия потребность в эффективном оперативном вмешательстве на большом дуоденальном сосочке не снизилась, в то время как осложнения, вызванные данной процедурой, вынуждают специалистов снижать оперативную активность. Анализ отечественных и зарубежных источников литературы показал, что проблеме патологических состояний большого дуоденального сосочка уделяется самое пристальной внимание. Однако, оперативные вмешательства на большом дуоденальном сосочке (типичная папиллосфинктеротомия, чрезпузырная папиллосфинктеротомия, ультразвуковая папиллосфинктеротомия и т.д.) нередко приводят к неудовлетворительным функциональным результатам. Осложнения возникают как во время процедуры, так и в отдаленном послеоперационном периоде. Процент осложнений, возникающих в раннем послеоперационном периоде, составляет 10 %, летальность - 1,5 %, поздние осложнения - 5,2-26 % (А.Л. Андреев, 2003). Из всего числа осложнений кровотечение составляет 73,7 %, ретродуоденальная перфорация - 15,8 %, другие причины - 0,5 % (Б.С. Брискин, 2003).
Различные варианты оперативного лечения стеноза большого дуоденального сосочка базируются на механической теории, в основе которой лежит принцип наименьшей травматизации главного протока поджелудочной железы и стенки двенадцатиперстной кишки (В.И. Малярчук с соавт., 2004г.). Хирургические методы лечения стеноза большого дуоденального сосочка имеют ряд общих недостатков: 1 - при рассечении сосочка не учитывается тип впадения протоковой системы; 2 -недооцениваются физиологические особенности области большого дуоденального сосочка (строение сфинктерно-клапанного аппарата); 3 -недооцениваются особенности кровоснабжения большого дуоденального сосочка.
В научных публикациях имеется достаточно информации по различным вариантам кровоснабжения поджелудочной железы (Г.Е. Островерхое, Ю.М. Бомаш, Д.Н. Лубоцкий, В.В. Кованов, Н.С. Шадриной, А.В. Смирнова, С.А. Аганезова). Между тем в работах перечисленных авторов описание сосудов участвующих в кровоснабжении большого дуоденального сосочка сводится к мелким прямым артериальным ветвям, отходящим от артериальных дуг головки поджелудочной железы.
В доступной нам литературе было найдено не более десяти работ, посвященных более детальному описанию кровоснабжения большого дуоденального сосочка. Однако при анализе данных результатов отмечается отсутствие топографии сосудисто-нервного компонента, разногласия в описании количества сосудов, взаимосвязи артериальных и венозных сосудов, точек выхода сосудов по отношению к устью большого дуоденального сосочка. Попытка найти точки пересечения литературных данных не увенчалась успехом. Таким образом, однозначно трактовать причину возникновения послеоперационных кровотечений, после папиллосфинктеротомии, не представляется возможным.
Необходимо отметить, что имеется практически полная информация о типах впадения общего желчного протока и протоков поджелудочной железы, сфинктерно-клапанного аппарата большого дуоденального сосочка. Между тем нет четкого представления об артериально-венозной системе данной области. Повреждения сосудистой системы большого дуоденального сосочка приводят к тяжелым осложнениям, требующим поиска новых вариантов хирургических вмешательств и разработки иных оперативных доступов.
Цель нашего исследования состояла в изучении сосудистого и нервного компонента большого дуоденального сосочка и выявлении тяжести их повреждений при различных способах папиллосфинктеротомии.
В соответствии с целью настоящего исследования были сформулированы следующие задачи:
1. Изучить топографию сосудисто-нервного компонента большого дуоденального сосочка.
2. Изучить повреждения сосудисто-нервного компонента большого дуоденального сосочка при выполнении типичного доступа классической папиллосфинктеротомии.
3. Изучить повреждения сосудисто-нервного компонента большого дуоденального сосочка при полукруглой папиллотомии по методу, предложенному P. Schweizer с соавт. (2000).
4. Изучить состояние сосудистой системы большого дуоденального сосочка при патологии желчевыделительной системы.
Научная новизна работы. Впервые сопоставлены анатомические, гистологические и патологоанатомические представления о сосудисто-нервном компоненте большого дуоденального сосочка. Выявлены особенности кровоснабжения всех отделов большого дуоденального сосочка. Установлена степень повреждения сосудисто-нервного компонента Фатерова сосочка при выполнении принципиально различных вариантах папиллосфинктеротомии. Описаны диаметры сосудов, повреждаемых при папиллосфинктеротомии, и их месторасположение, что позволяет прогнозировать характер кровотечения. Выполнено сопоставление патологоанатомической картины сосудистой системы большого дуоденального сосочка при патологии желчевыделительной системы и оперативном вмешательстве.
Практическая значимость. Сведения о топографии сосудисто-нервной системы большого дуоденального сосочка, полученные в настоящем исследовании, представляют значительный интерес не только для анатомов, гистологов, но и для хирургов, занимающихся оперативными вмешательствами в области большого дуоденального сосочка.
Внедрение результатов. Полученные результаты определяют практические рекомендации врачам хирургического профиля (хирургии, эндоскопии, гастроэнтерологии); являются основанием для разработки и обоснования щадящих методик оперативных пособий при стенозе большого дуоденального сосочка. В форме рекомендации результаты исследования внедрены в учебный процесс на кафедре нормальной анатомии и оперативной хирургии Сибирского государственного медицинского университета. А также используются в практической деятельности врачами эндоскопистами Городской больницы № 3 и клиник Сибирского государственного медицинского университета, г. Томск.
Результаты исследований доложены на Всероссийской научной конференции, посвященной столетию со дня рождения профессора А.Н. Максименкова в Санкт-Петербурге (2006), Международном конгрессе молодых ученых «Науки о человеке» (2006). По результатам исследований опубликовано 4 статьи.
Положения, выносимые на защиту:
1. Не смотря на обособленность мышечного и сфинктерно-клапанного аппарата большого дуоденального сосочка от мускулатуры стенки двенадцатиперстной кишки, сосудисто-нервный компонент этих структур является общим.
2. При выполнении типичной папиллосфинктеротомии с рассечением ампулы более 10 мм хирургическая манипуляция может сопровождаться обильным кровотечением из артерий и вен ампулярного сплетения и прямых сосудов двенадцатиперстной кишки. При рассечении ампулы большого дуоденального сосочка более 20 мм возможно повреждение задних дуг (артериальной и венозной) головки поджелудочной железы.
3. При выполнении оперативного доступа, предложенного P. Schweizcr (2000), повреждение ампулярного сплетения и (или) сосочковых сосудов может спровоцировать ишемию довольно большого сектора дуоденальной части большого дуоденального сосочка.
4. Патологические изменения стенки ампулы большого дуоденального сосочка и сфинктерно-клапанного аппарата не влияют на топографию экстраорганного сосудисто-нервного компонента большого дуоденального сосочка.
Анатомия Фатерова сосочка. Хирургическая анатомия сфинктера Одди
Фатеров сосочек имеет овальную форму, проецируется в просвет двенадцатиперстной кишки на ее задневнутренней стенке, иногда вблизи среднего сегмента нисходящей части двенадцатиперстной кишки. Реже он может располагаться дистальнее, ближе к нижней горизонтальной части двенадцатиперстной кишки. Обычно расстояние от пилорического отдела до большого дуоденального сосочка составляет 10 см. Он может располагаться ближе к привратнику, если общий желчный проток впадает в проксимальную половину нисходящей части двенадцатиперстной кишки. Еще реже дуоденальный сосочек открывается в начальную часть двенадцатиперстной кишки. У пациентов с язвой двенадцатиперстной кишки или постбульбарной язвой, пенетрирующей в поджелудочную железу, в результате фиброзного стягивания двенадцатиперстной кишки дуоденальный сосочек может находиться в опасной близости к пилорическому отделу, о чем необходимо помнить во время резекции желудка.
Дуоденальный сосочек сверху покрыт слизистой оболочкой двенадцатиперстной кишки, а его просвет выстлан слизистой общего желчного протока. Две слизистые оболочки встречаются в устье сосочка. По своей верхней границе дуоденальный сосочек обычно частично покрыт поперечной складкой, что создает впечатление карниза. Реже под сосочком находится вертикальная складка слизистой двенадцатиперстной кишки, которая, вместе с ранее упоминавшейся поперечной складкой, образует букву «Т». Общий желчный проток впадает в верхнюю часть дуоденального сосочка, а панкреатический проток — с внутренней его стороны, в направлении на 4, 5 или 6 часов.
Более чем в 60% случаев дуоденальный сосочек обнаружить легко: он может быть увеличен в размерах и выпячиваться в просвет двенадцатиперстной кишки, на его присутствие могут также указывать напряжение или наличие складок, расположенных в виде буквы «Т». Благодаря наличию фиброзных и мышечных волокон его можно обнаружить пальпаторно по более плотной консистенции. При отсутствии указанных факторов или в случаях, когда он полностью покрыт складками слизистой, большой дуоденальный сосочек найти нелегко. Чтобы обнаружить большой дуоденальный сосочек, в нисходящей части двенадцатиперстной кишки делают продольный разрез. Его начинают от середины нисходящей части и продолжают в дистальном направлении, где дуоденальный сосочек обычно и обнаруживается.
В изуальный осмотр следует дополнить пальпацией, проводя палец заднемедиально вдоль нисходящей части двенадцатиперстной кишки. Часто можно прощупать маленький овальный холмик, более плотный, чем складки двенадцатиперстной кишки. При ревизии необходимо избегать чрезмерного растяжения двенадцатиперстной кишки, так как при этом деформируются и разглаживаются ее складки. Поперечная складка, присутствующая в некоторых случаях, формирует как бы козырек над сосочком, который может полностью закрыть и спрятать его. Если желчный пузырь не удален, а дуоденальный сосочек обнаружить не удалось, его можно идентифицировать, осторожно сжав желчный пузырь, что вызовет видимое истечение желчи через сосочек. Если желчный пузырь прежде был удален, есть другая возможность: нужно ввести изотонический раствор, катетер или расширитель через пузырный проток или супрадуоденальное холедохотомическое отверстие. Наличие перипапиллярного дивертикула двенадцатиперстной кишки может создать дополнительные трудности при обнаружении большого дуоденального сосочка. Сосочек легко опознать эндоскопически, и опытный эндоскопист может быстро катетеризировать ампулу и выполнить папиллотомию.
Хирургическая анатомия сфинктера Одди.
В настоящее время общепринятым является описание сфинктера Oddi, сделанное Boyden (2—5). Boyden описал четыре группы мышечных волокон:
1. Верхний сфинктер общего желчного протока.
2. Нижний сфинктер общего желчного протока.
3. Сфинктер панкреатического протока.
4. Сфинктер большого дуоденального сосочка. Волокна верхнего сфинктера обнаруживаются не всегда, а волокна нижнего сфинктера не все являются циркулярными.
Мышечные волокна сфинктера панкреатического протока присутствуют лишь в 20% случаев и редко бывают циркулярными. Boyden утверждает, что сфинктер Oddi эмбриологически и функционально отличается от мышечных волокон двенадцатиперстной кишки. Некоторые авторы придерживаются мнения, что существует взаимосвязь. Ведущая к функциональному взаимодействию между мышечными волокнами сфинктера Oddi и такими же волокнами в двенадцатиперстной кишке. Строение сфинктера может быть различным в зависимости от способа соединения общего желчного протока с панкреатическим протоком. Здесь также есть пучки продольных волокон, которые связывают оба протока, они, в свою очередь, связаны с мышечными волокнами двенадцатиперстной кишки. В сфинктере есть другие волокна, названные усиливающими, идущие из мышечных волокон собственно двенадцатиперстной кишки к продольным волокнам.
Кинематохолангиографические, манометрические и электромиографические исследования подтверждают синхронную работу мышечных волокон сфинктера Oddi и двенадцатиперстной кишки. Расслабление сфинктера Oddi и соседней мускулатуры двенадцатиперстной кишки наступает синхронно; сокращение также происходит в одно и то же время. Было установлено, что сфинктер Oddi открывается сверху вниз, а закрывается снизу вверх. Эти циклы — сокращения-расслабления-сокращения — инициируются присутствием пищи в двенадцатиперстной кишке, впрыскиванием холецистокинина или прохождением дуоденальной перистальтической волны через зону сфинктера. Эта последовательность известна как двенадцатиперстно-сфинктерный синергизм.
Диагностика опухолей большого сосочка двенадцатиперстной кишки
Для цитирования: Орлова М.В., Ким В.А., Быстровская Е.В. Диагностика опухолей большого сосочка двенадцатиперстной кишки // Эффективная фармакотерапия. 2020. Т. 16. № 30. С. 74–80.
- Аннотация
- Статья
- Ссылки
- Английский вариант
С развитием эндоскопических малоинвазивных методов лечения в диагностическом алгоритме обследования пациентов с новообразованиями большого сосочка двенадцатиперстной кишки наибольшую актуальность приобретает эндоскопическая ультрасонография. Оценка точного размера новообразования, вовлечения в патологический процесс стенки двенадцатиперстной кишки, общего желчного и главного панкреатического протоков, паренхимы поджелудочной железы крайне важна для определения дальнейшей тактики ведения пациентов. Внедрение дополнительных методик, таких как контрастное усиление (CH-EUS), тонкоигольная пункция (EUS-FNA), способствует улучшению верификации опухолей.
- КЛЮЧЕВЫЕ СЛОВА: двенадцатиперстная кишка, опухоли, эндоскопическая ультрасонография, метастазы в печени, болезнь Реклингхаузена, нейрофиброматоз
С развитием эндоскопических малоинвазивных методов лечения в диагностическом алгоритме обследования пациентов с новообразованиями большого сосочка двенадцатиперстной кишки наибольшую актуальность приобретает эндоскопическая ультрасонография. Оценка точного размера новообразования, вовлечения в патологический процесс стенки двенадцатиперстной кишки, общего желчного и главного панкреатического протоков, паренхимы поджелудочной железы крайне важна для определения дальнейшей тактики ведения пациентов. Внедрение дополнительных методик, таких как контрастное усиление (CH-EUS), тонкоигольная пункция (EUS-FNA), способствует улучшению верификации опухолей.
Таблица 2. Анализ исследований данных диагностической точности эндосонографии в T-стадировании опухолей БСДК
Большой сосочек двенадцатиперстной кишки (БСДК) – сложная анатомическая структура, представляющая область контакта терминального отдела общего желчного протока, главного панкреатического протока и непосредственно стенки двенадцатиперстной кишки [1]. Этим объясняется разнообразие доброкачественных и злокачественных опухолей БСДК по морфологическому строению [2, 3]. Самым распространенным считается кишечный тип, за ним следует протоковый тип опухоли [4]. Возможны и редкие находки, такие как нейроэндокринные неоплазии или мезенхимальные опухоли [5].
Ампулярная аденокарцинома развивается в последовательности «аденома – карцинома», как и при колоректальном раке. Скорость малигнизации аденом БСДК достаточно медленная, и, по статистике, только 5% прогрессируют до аденокарциномы.
По данным ряда исследователей, риск развития рака БСДК увеличивается при взаимодействии канцерогенов с панкреатическим соком в области сосочка. Кроме того, длительное хроническое воспаление относится к факторам, повышающим риск малигнизации [10].
На момент выявления ампулярного новообразования до 50% ворсинчатых аденом уже содержат фокус аденокарциномы [11]. Ампулярные злокачественные опухоли нередко обнаруживаются на ранних стадиях заболевания, поскольку манифестируют механической желтухой [12]. При агрессивном течении опухоль метастазирует в лимфатические узлы и дает отдаленные метастазы. Пациентам с новообразованием БСДК должна проводиться колоноскопия с целью исключения новообразований толстой кишки, а также ее вторичного метастатического поражения, выявляемого в трети случаев [13]. В десятилетнем исследовании только у восьми (5%) из 163 пациентов с ампулярной аденокарциномой были выявлены метастазы в печени [14].
Нейроэндокринные опухоли (НЭО) двенадцатиперстной кишки встречаются крайне редко – 5% всех карциноидов ЖКТ [15]. НЭО в проекции БСДК отмечаются менее чем в 0,3% случаев [16]. В группу риска входят пациенты с болезнью Реклингхаузена (нейрофиброматоз 1-го типа) – наследственным заболеванием, предрасполагающим к возникновению множественных опухолей. В отличие от пациентов с карциноидами тощей и подвздошной кишки пациенты с нейроэндокринной неоплазией БСДК чаще не имеют характерных для карциноидного синдрома клинических проявлений [17].
Гастроинтестинальная стромальная опухоль (ГИСО) в 60–70% случаев диагностируется в желудке и лишь в 4% – двенадцатиперстной кишке. В литературе описано всего 11 клинических случаев ГИСО БСДК [18]. Для дифференциальной диагностики ГИСО и лейомиомы может быть использована тонкоигольная пункция под контролем эндосонографии либо эндоскопическая резекция как метод расширенной биопсии с последующей гистологической и иммуногистохимической оценкой материала [19].
Методы диагностики и лечения
Диагностический спектр, позволяющий выявить заболевание и установить стадию, включает эндоскопические и лучевые методы. Однако даже комплексная диагностика не всегда позволяет точно определить злокачественное поражение БСДК. При наличии у пациента рака БСДК ключевым моментом является стадирование по TNM-критериям. При стадии Т1 новообразование не затрагивает мышечный дуоденальный слой и ограничено лишь ампулой БСДК. При стадии Т2 опухоль прорастает в мышечный слой ДПК, при стадиях Т3 и Т4 новообразование захватывает стенки двенадцатиперстной кишки, паренхиму поджелудочной железы [20] (табл. 1).
Анатомическое расположение и малый размер ампулярных опухолей определяют сложность их диагностики. Заподозрить заболевание позволяют такие признаки, как дилатация общего желчного протока и/или главного панкреатического протока [21]. Уровень онкомаркера CA19-9 не является специфичным признаком и, по данным ряда исследований, повышен лишь у 63% пациентов с аденокарциномой БСДК [12].
Для диагностики и стадирования ампулярной опухоли используются дуоденоскопия, трансабдоминальное ультразвуковое сканирование брюшной полости, мультиспиральная компьютерная томография (МСКТ) с внутривенным контрастированием, магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ) и эндоскопическая ультрасонография.
Необходимо отметить, что размер опухоли не является критерием малигнизации. В исследованиях были проанализированы морфологические характеристики новообразований БСДК у 450 пациентов. Средний размер аденокарциномы составил 2,0 см, аденомы – 2,9 см [1, 12, 22]. Тем не менее исследователи предположили, что размер опухоли имеет значение для прогнозирования злокачественности. Согласно результатам исследования, размер более 3,0 см подтвержден в 28% случаев аденокарцином и только в 12% случаев аденомы [14]. Показатели частоты обнаружения опухолей БСДК при ультразвуковом исследовании брюшной полости варьируются от 12 до 27% [22, 23].
Описана точность МСКТ при диагностике ампулярных опухолей. В исследовании P. Skordilis и соавт., опубликованном в 2002 г., только четыре (20%) из 20 ампулярных опухолей были обнаружены при проведении МСКТ с применением среза толщиной 10 мм [24].
По мере совершенствования метода компьютерной томографии результаты диагностики новообразований БСДК значительно улучшились. В 2009 г. E.L.A. Artifon и соавт. использовали толщину среза 5 мм, что позволило обнаружить 100% ампулярных опухолей из всех исследуемых. При этом чувствительность метода составила 74%. Кроме того, ученые отметили роль компьютерной томографии в выявлении метастатического поражения, которое чаще поражает региональные лимфатические узлы, печень, брюшину, кости и легкие. Как показали данные систематического обзора исследований (учитывались опухоли БСДК размером более 12,3 мм), при Т- и N-стадировании чувствительность МСКТ варьируется от 15 до 92% [22].
C.H. Chen и соавт. предположили, что МРТ имеет преимущество перед МСКТ в отношении T-стадирования. Так, частота выявления ампулярной опухоли составила 53% при МРТ и 26% при МСКТ. Правда, в этом исследовании средний размер опухоли БСДК не указывался [25]. К преимуществам МРТ можно отнести ее неинвазивность. Данный метод можно использовать у пациентов после оперативных вмешательств на желудке. К недостаткам метода относится то, что ампула БСДК – это возможное слепое пятно для МРТ из-за его небольшого размера [21]. Кроме того, метод не позволяет проводить прямой осмотр области сосочка и щипцовую биопсию [26].
В литературе описано немного исследований эффективности диагностической лапароскопии в выявлении опухолей ампулы БСДК. E. Beenen и соавт. провели диагностическую лапароскопию 67 пациентам с ампулярными опухолями. У шести (9%) были обнаружены отдаленные метастазы, ранее не выявленные при компьютерной томографии, что впоследствии изменило тактику ведения данных пациентов [27].
Диагностический спектр при подозрении на новообразование БСДК включает эндоскопическую ретроградную холангиопанкреатографию (ЭРХПГ). Метод позволяет визуализировать ампулу БСДК, провести браш-биопсию, выполнить холангиографию с последующей установкой стента для билиарной декомпрессии, если это необходимо и технически осуществимо. Щипцовая биопсия ампулярных аденокарцином имеет высокий уровень ложноотрицательных результатов, диапазон информативности – 25–50% [28].
По мнению T.C. Tran и соавт., эндоскопическая щеточная биопсия является лучшей альтернативой щипцовой биопсии для получения цитологических образцов ампулярных поражений. Диагностическая точность данного метода достигает 70% [29].
В исследовании с участием 35 пациентов биопсия под контролем ЭУС показала точность диагностики ампулярной опухоли, близкую к 90% [22].
ЭРХПГ может быть дополнена внутрипротоковым ультразвуковым исследованием (IDUS), что значительно улучшает диагностику. Исследование осуществляется с помощью ультразвукового катетера диаметром 2 мм, проведенного через стандартный канал эндоскопа непосредственно в желчный или панкреатический проток. Высокое качество получаемого изображения определяет его полезность для оценки патологических изменений стенки протоков. IDUS точно визуализирует анатомию сосочка и является единственным методом, надежно дифференцирующим сфинктер Одди от остальной части сосочка [30]. Данный метод безопасен. Японские ученые зафиксировали один случай легкого панкреатита после 40 проведенных внутрипротоковых эндоскопических исследований [31]. В 33 исследованиях при использовании ЭРХПГ и IDUS злокачественное поражение БДСК было подтверждено у 88% пациентов [32]. Однако данная методика требует специального оборудования и не доступна в большинстве учреждений.
В настоящее время эндоскопическая ультрасонография признана эффективным способом визуализации области БСДК. Эндосонография играет существенную роль в предоперационной оценке новообразования с локальным поражением ампулы БСДК, поскольку позволяет определить степень местной опухолевой инвазии в стенку ДПК или паренхиму поджелудочной железы, что необходимо для предоперационного стадирования и определения дальнейшей тактики хирургического лечения. Это особенно актуально, поскольку при обнаружении доброкачественных новообразований либо новообразований с высокой степенью дисплазии предпочтительна эндоскопическая папиллэктомия. Уже в 1992 г. ЭУС была признана исследованием, необходимым на этапе предоперационной подготовки пациентов для определения возможности локальной резекции новообразования из-за ее способности точно диагностировать аденому БСДК [33]. Результаты ЭУС в 95% соответствуют окончательному диагнозу, выставленному на основании результатов гистологического исследования [34].
При выполнении эндоскопической ультрасонографии эхоэндоскоп располагается в нисходящем отделе ДПК, что позволяет детально оценить дистальные отделы общего желчного и главного панкреатического протоков, структурность БСДК, слои стенки двенадцатиперстной кишки, мышечный слой непосредственно сфинктера Одди, подслизистый и слизистый слои ампулы БСДК. С помощью данного метода можно установить нарушение дифференцировки слоев, распространение новообразования на протоковую систему, мышечный слой стенки двенадцатиперстной кишки, паренхиму поджелудочной железы. Необходимо отметить, что при распространении опухолевой инфильтрации на поджелудочную железу не всегда можно определить первичный очаг: в пределах ампулы БСДК (дистальнее от места слияния общего желчного протока и главного панкреатического протока) или периампулярно – в непосредственной близости от БСДК, то есть из поджелудочной железы, двенадцатиперстной кишки, дистального общего желчного протока.
C.H. Chen и соавт. сравнивали ЭУС с трансабдоминальным УЗИ и компьютерной томографией. ЭУС признана наиболее эффективным методом локальной оценки рака БСДК [25].
W. Ridtitid и соавт. провели ретроспективный анализ исследований за 15-летний период с участием 113 пациентов с поражением ампулы двенадцатиперстной кишки, которым выполнялась эндосонография в качестве предоперационной оценки. Согласно результатам, ЭУС превосходила трансабдоминальное ультразвуковое исследование, компьютерную томографию и МРТ при T-стадировании ампулярных поражений. Наибольшая точность ЭУС отмечалась при выявлении заболевания на стадии T1 (98%). При определении поражений на стадиях T2, T3 и T4 диагностическая точность ЭУС снизилась до 78, 80 и 78% соответственно [35].
J.J. Rejeski и соавт. было отобрано 50 пациентов с новообразованиями БСДК размером менее 2,5 см, которым в предоперационном периоде проводилась эндосонография с целью выбора дальнейшей тактики ведения. По результатам исследования, ЭУС оказалась высокочувствительным методом (97%), в связи с чем ее рекомендовано проводить всем пациентам с подозрением на опухоль БСДК [24].
Согласно систематическому обзору англоязычных статей 2013 г., связанных с диагностикой и лечением рака БСДК, суммарная чувствительность/специфичность ЭУС для диагностики опухоли на стадии T1 составила 77/78%. Общая точность в определении Т-стадии находилась в диапазоне 63–82%, N-стадии – 60–81% [22].
В таблице 2 представлены результаты 15 исследований, включавших 557 пациентов с опухолью БСДК [31, 35–48]. Всем пациентам в качестве предоперационной диагностики проводилась эндосонография. Данные сопоставлялись с результатами гистологического исследования после оперативного лечения пациентов с опухолью БСДК. Суммарная общая точность диагностики Т-стадии находилась в диапазоне 62–92% [19].
Как показал анализ, основной проблемой, требующей уточнения, является дифференциация между T1- и T2-стадиями опухоли, что также подтверждается в обзорной статье K. Ito и соавт. [3]. Кроме того, исследователи отметили большее число ошибок в постановке диагноза у пациентов с билиарным стентом [23].
В настоящее время при верификации опухолей БСДК немаловажное значение в диагностическом алгоритме имеет тонкоигольная пункция. Как уже отмечалось, для постановки окончательного диагноза иногда недостаточно инструментальных и визуальных методов диагностики, а щипцовая биопсия дает в большинстве случаев ложноотрицательный результат. Конечно, тонкоигольная пункция тоже не является решающим методом диагностики, однако в случаях, когда новообразование подозрительно в отношении нейроэндокринной или гастроинтестинальной опухоли, данный метод может сыграть решающую диагностическую роль и подвести клиницистов к правильному решению вопроса о выборе метода лечения пациента [49, 50].
На текущий момент в мировой литературе количество статей по данной тематике ограниченно. Однако T. Ogura и соавт. сообщили о 100%-ной точности EUS-FNA при диагностике внутриампулярных опухолей БСДК [50]. По данным D. Kim и соавт., при диагностике первичных ампулярных новообразований диагностическая точность метода составляет 88,8%, чувствительность – 82,4%, специфичность – 100% [51].
Таким образом, диагностическая точность щипцовой и щеточной биопсии уступает таковой тонкоигольной пункции под контролем эндосонографии. Обращает на себя внимание и тот факт, что количество осложнений при данном методе менее 0,5% [52]. Дополнительные методики, такие как контрастное усиление (CH-EUS), улучшают диагностическую точность ЭУС, а также влияют на выбор оптимального места для проведения тонкоигольной пункции. Исследования в этой области продолжаются [53].
В исследовании V. Patel и соавт. участвовали пациенты с новообразованиями БСДК малых размеров. Показано, что новообразования размером менее 6,5 мм труднодоступны для визуализации глубины инвазии. При размере опухоли от 0,5 до 1 см чувствительность эндосонографии достигает 63%, специфичность – 88%. При большем размере новообразования специфичность повышается до 95% и более [54].
Критерии отбора пациентов для папиллэктомии остаются спорными (размер новообразования менее 2–3 см, отсутствие эндоскопических признаков злокачественности, новообразование ограничено подслизистой оболочкой, отсутствие поражения желчного и/или панкреатического протоков, отсутствие внутрибрюшной лимфаденопатии) [13, 54]. Частота связанных с процедурой осложнений, таких как кровотечение и послеоперационный панкреатит, относительно высока. Желтуха, большой размер новообразования, а также расширение желчного протока служат предикторами злокачественности аденомы БСДК [55]. При наличии очага аденокарциномы в новообразовании БСДК операцией выбора является панкреатодуоденальная резекция. Таким образом, вопрос идентификации злокачественности опухолей небольших размеров (до 1 см) остается открытым [56].
Панкреатодуоденальная резекция, или операция Whipple, – метод выбора лечения при злокачественных новообразованиях в ампулярной области или ДПК с вовлечением области БСДК. Однако вопрос лечения доброкачественных ампулярных поражений данным методом остается спорным.
Согласно базе данных SEER, только у 40% пациентов с диагностированной ампулярной аденокарциномой отсутствуют противопоказания для хирургического лечения из-за большого количества сопутствующих заболеваний в силу пожилого возраста. Поэтому значение имеет выбор альтернативного, менее инвазивного эндоскопического лечения. Этим методом является папиллэктомия [57]. Она показана пациентам с доброкачественным поражением [13] либо пациентам, требующим паллиативного вмешательства, если радикальная резекция невозможна по жизненным показаниям [28]. Оценка глубины инвазии опухоли играет первостепенную роль при планировании оптимального хирургического лечения пациентов с новообразованиями БСДК и периампулярной области. Эндосонография панкреатобилиарной зоны признана ведущим методом, позволяющим наиболее точно определить распространение опухоли БСДК.
Анатомия поджелудочной железы
ПЖ — непарный железистый орган, расположенный в забрюшинном пространстве на уровне 1—11 поясничных позвонков. Длина железы в среднем составляет 18—22 см, средняя масса — 80-100 г. В ней различают 3 анатомических отдела: головку, тело и хвост. Головка ПЖ прилежит к ДПК, а хвост расположен в воротах селезёнки. Толщина железы в различных отделах составляет 1,5—3см. Передняя и нижняя поверхности тела ПЖ покрыты брюшиной. ПЖ имеет тонкую соединительнотканную капсулу и слабо выраженные соединительнотканные перегородки. Кпереди от ПЖ располагаются желудок и начальный отдел ДП К. Головка ПЖ лежит в подковообразном изгибе ДПК.
Позади головки ПЖ проходят нижняя полая и воротная вены, правые почечные артерия и вена, общий жёлчный проток. К задней поверхности тела прилежит аорта и селезеночная вена, а позади хвоста находятся левая почка со своими артерией и веной и левый надпочечник (см. рис. 1-2).
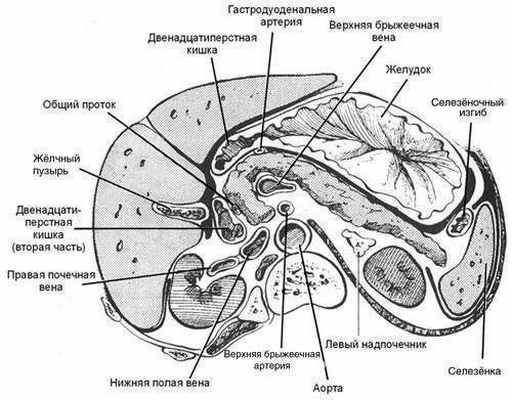
Рис. 1-2. Топографическая анатомия поджелудочной железы. На рисунке схематически представлено изображение поперечного среза верхних отделов брюшной полости
Главный (вирсунгов) проток ПЖ образуется путём слияния дольковых протоков и проходит в толще органа от хвоста до головки, ближе к задней поверхности. Диаметр ГПП у взрослого человека составляет 1—2 мм в области хвоста и тела и 3—4 мм в области головки, где ГПП в 60% случаев сливается с добавочным (санториниевым) протоком (см. рис. 1-3).
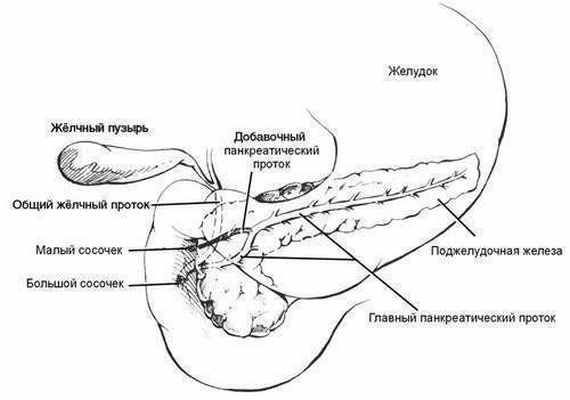
Рис. 1-3. Строение поджелудочной железы. Показана анатомическая взаимосвязь общего жёлчного протока и протоков поджелудочной железы
Проток ПЖ сливается с общим жёлчным протоком, образуя печён очно-поджелудочную ампулу, и открывается в ДПК на вершине её большою (фатерова) сосочка. В 20—25% случаев протоки впадают в ДПК раздельно, что зависит от различных вариантов развития протоковой системы (см. рис. 1-4). Так, в 10% случаев происходит атрофия терминального отдела вирсунгова протока и ПЖ дренируется через санториниев проток — такой вариант развития называют расщеплённой ПЖ (pancreas division) и относят к аномалиям развития органа. Длина ГПП составляет 18—20 см.
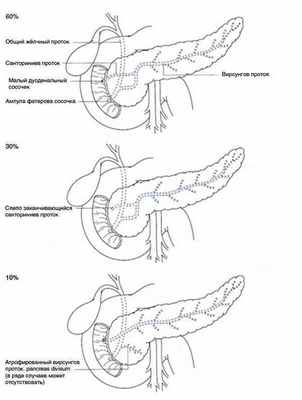
Рис. 1-4. Анатомическая конфигурация внутрипанкреатической протоковой системы. Показано примерное процентное соотношение каждого из возможных вариантов развития
Интрамуральные отделы обшего жёлчного протока и протока ПЖ, а также печёночно-поджелудочная ампула окружены гладкомышечными волокнами, формирующими сфинктер Одди, регулирующий порционное поступление жёлчи и сока ПЖ в ДПК. Местоположение фатерова соска вариабельно, но чаще всего он расположен в 12—14 см от привратника. Сфинктер Одди имеет довольно сложное строение и формально не является общим для обоих протоков (см. рис. 1-5).
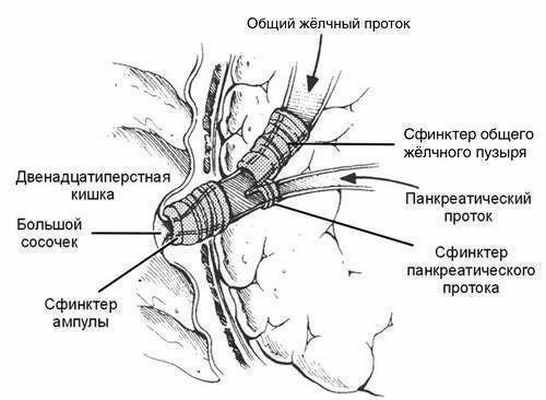
• Собственный сфинктер общего жёлчного протока (сфинктер Вестфаля), расположенный на границе со сфинктером основания сосочка.
Что касается особенностей структуры самих гладкомышечные образований сфинктера Одди, то в целом они идентичны другим гладкомышечным клеткам во всех внутренних органах.
Как видно из рисунка, сфинктер функционирует так, что не только отделяет общий жёлчный проток и ГПП от просвета ДПК, но и на большом протяжении разделяет вышеуказанные протоки друг от друга.
Сфинктерный аппарат системы жёлчеотделения и протоков ПЖ выполняет комплексные функции, с одной стороны, обеспечивая рациональное расходование жёлчи и панкреатического сока путём ограничения потока жёлчи и панкреатических соков в ДПК между приёмами пищи, и, с другой стороны, предотвращая обратный ток жёлчи и кишечного содержимого в жёлчные протоки и ГПП и облегчая (способствуя) наполнение жёлчного пузыря. Эти функции обусловлены и способностью сфинктера создавать высокий градиент давления между системой протоков и ДПК. Сфинктер Одди способствует подъёму давления в общем жёлчном протоке, благодаря чему эта величина различается на разных уровнях жёлчного протока — от 4 до 10 мм рт.ст.
Данные функции, в первую очередь, выполняют расположенный в общем жёлчном протоке, перед ампулой, сфинктер Вестфаля (т. sphincter ductus choledochi) и сфинктер печёночно-поджелудочной ампулы, работающие во взаимосвязи со сфинктером панкреатического протока. Кроме того, сфинктерный аппарат большого сосочка ДПК отвечает за регуляцию давления в полости ДПК.
Вместе с тем мышечные образования сфинктера Одди работают и как мощный насос, обеспечивая интенсивное поступление жёлчи и секрета ПЖ в полость ДПК в процессе пищеварения.
Моторная активность сфинктерного аппарата фатерова соска находится под контролем сложных нейро-гуморальных механизмов. К медиаторам, регулирующим деятельность сфинктера, относят энкефалины и эндорфины, субстанцию Р, оксид азота, вазоактивный интестиналъный полипептид (ВИП), нейропептид Y, холецистокинин (ХК) и кальцитонин-связанный пептид.
Таким образом, отдельные части сфинктера Одди предотвращают рефлюкс содержимого ДПК в вирсунгов проток и жёлчные протоки, жёлчи в ГПП, панкреатического секрета — в систему жёлчных протоков. Измерение давления с помощью микроканюляции протоков свидетельствует о более высоком давлении в протоке ПЖ по сравнению с давлением в общем жёлчном протоке. Имеет ли эта разница давлений какое-либо физиологическое значение, доподлинно до сих пор не известно.
Головка ПЖ получает кровоснабжение через печёночную артерию (a. hepatica), переднюю и заднюю поджелудочно-двенадцатиперстные артерии. Перешеек и тело ПЖ снабжаются вариантно отходящими ветвями общей печёночной и желудочно-двенадцатиперстной артерий, а также правой желудочно-сальниковой артерией. В области перешейка иногда лежит вариантно отходящая от общей печёночной, верхней брыжеечной, чревной, селезёночной или желудочно-двенадцатиперстной артерии так называемая тыльная поджелудочная артерия. Располагаясь на границе тела и головки ПЖ, она служит анастомотическим пограничным ориентиром. Тело ПЖ получает кровь из селезёночной артерии через крупную ветвь — большую поджелудочную артерию Гаплера. Она может отходить одним или двумя-гремя стволами, широко анастомозирующими друг с другом и с другими артериями.
В результате соединения поджелудочной артерии в области тела и хвоста ПЖ образуется два внутриорганных анастомоза, расположенных вдоль нижнего и верхнего краёв органа. Вместе с артериальными дугами головки эти анастомозирующие ветви образуют замкнутый пери-панкреатический артериальный круг, отдающий по передней и задней поверхности ПЖ на всём своём протяжении ветви, анастомозируюшие между собой. Таким образом, артериальная система паренхимы ПЖ представляет собой трёхмерную внутриорганную сеть широко анастомозируюших между собой сосудов.
Венозный отток осуществляют одноимённые венозные сосуды, идущие параллельно артериям. Вся кровь, оттекающая от ПЖ, поступает в воротную вену и далее в печень. Лимфатический отток от ПЖ происходит через лимфатические узлы, расположенные по ходу кровеносных сосудов (парапилорические, панкреатодуоденальные лимфатические узлы и лимфатические узлы ворот селезёнки).
ПЖ относится к «чемпионам» по объёму кровотока на 100 г ткани: натощак кровоток составляет 50—180 мл/мин на 100 г ткани, а при стимулированной секреции — до 400 мл/мин на 100 г ткани. Немаяоважной особенностью кровоснабжения ПЖ считают высокую диффузионную проницаемость кровеносных сосудов: в покое она составляет 0,1—0,3 мл/ мин на 100 г ткани ПЖ; при функциональной гиперемии она возрастает до 1,5—20 мл/мин на 100 г. Приведённые данные свидетельствуют о высоких потребностях железы в кровоснабжении и, следовательно, в пластических материалах, энергии и кислороде, а также в элиминации метаболитов.
Поджелудочная железа имеет симпатическую и парасимпатическую иннервацию — из чревного сплетения и блуждающих нервов. Вегетативная иннервация включает эфферентные (двигательные) и афферентные (чувствительные) нервные волокна. Центр симпатической иннервации находится в сегментах спинного мозга Тh5—Th9, затем в составе симпатических нервов аксоны нейронов направляются к чревному сплетению и ПЖ. Эти нервы иннервируют интрапанкреатические кровеносные сосуды и нервные узлы, а также несут волокна болевой чувствительности.
Парасимпатическую иннервацию осуществляет блуждающий нерв. ПЖ также получает иннервацию от нейронов метасимпатической нервной системы. Наконец, ПЖ содержит ряд нервных волокон, контролирующих кровеносные сосуды, ацинарные и островковые клетки — эти нервные волокна оплетают ацинусы железы, располагаются вокруг сосудистой сети и вокруг островков Лангерганса. Главными нейромедиаторами, ответственными за экзокринную функцию ПЖ, служат ацетилхолин, ВИП, гастрин-рилизинг пептид и др. Объединение нервной и гуморальной регуляции составляет систему контроля над деятельностью ПЖ. Таким образом, нейроны в ПЖ вовлечены в процесс контроля за эндокринными и экзокринными функциями органа.
Иннервация жёлчевыводящей системы, ПЖ и ДПК имеет общее происхождение, что предопределяет тесную взаимосвязь их функционирования. Жёлчевыводящая система также получает иннервацию от нервных симпатических и парасимпатических структур. Волокна симпатических нервов, направляясь от симпатического ствола, через внутренностные нервы входят в звёздчатый узел, где встречаются с волокнами блуждающего нерва. Кроме того, жёлчные пути иннервирует и правый диафрагмальный нерв.
Нервные волокна симпатического и парасимпатического происхождения обнаруживаются также непосредственно в области сфинктерного аппарата жёлчного пузыря и протоковой системы жёлчевыводящих путей. В жёлчном пузыре, пузырном протоке и общем жёлчном протоке имеются нервные сплегения и ганглии, подобные таковым в ДПК.
Многочисленные нервные волокна залегают в мышечном слое, вокруг кровеносных сосудов и в слизистой оболочке системы жёлчеотделения. Сплетения жёлчевыводящей системы и ПЖ тесно связаны с автономной нервной системой ДПК, ее сплетениями, что имеет существенное значение в координации деятельности этих органов и остальной части желудочно-кишечного тракта (ЖКТ).
Читайте также:
- Кисты челюстей. Фолликулярная киста челюсти.
- Стирание зубов. Сошлифование зубов. Откол зуба. Эрозия зубов.
- Сперматогенез при криодеструкции простаты. Андрогенная активность при деструкции простаты
- Значение пола и наследственности в метаболизме лекарств. Метаболизм лекарств
- Регуляция сперматогенеза. Созревание сперматозоидов
